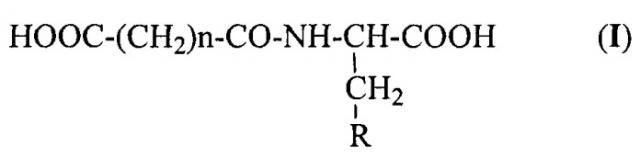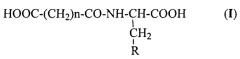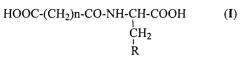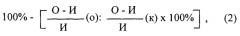Способы получения n-ацильных производных аминокислот (варианты)
Иллюстрации
Показать всеНастоящее изобретение относится к новым способам получения (вариантам) N-ацильным производным аминокислот общей формулы (I) или их солей, с использованием ангидридов глутаровой или янтарной кислот. Преимущества заявленных способов заключаются в простоте их проведения, упрощении выделения целевого продукта и высокий выход конечных продуктов. 2 н.п. ф-лы, 27 табл.
где n равно 2 или 3; и
R представляет
Реферат
Настоящее изобретение относится к области биоорганической химии и касается новых способов синтеза N-ацильных производных аминокислот и их фармацевтически приемлемых солей, используемых в качестве противоаллергических, противовоспалительных и гиполипидемических средств.
Предшествующий уровень техники
Как известно, в настоящее время аллергические заболевания и нарушения липидного обмена весьма распространены вследствие плохой экологической обстановки, изменения структуры питания и образа жизни населения. Поэтому проблема создания лекарственных средств для борьбы с этими патологиями, а также с воспалительными процессами, как правило, сопровождающими аллергию, продолжает оставаться актуальной.
В этом отношении особый интерес представляют соединения, включающие остатки веществ природного происхождения, так как для них можно прогнозировать более низкую токсичность и частоту побочных эффектов.
В публикации международной заявки WO 99/01103 описано противоаллергическое и гиполипидемическое действие N-ацильных производных биогенных аминов, например, γ-глутамилгистамина, и его ближайшего аналога глутарилгистамина, которые наиболее близки по структуре и действию к заявляемым соединениям. В статье Кржечковская В.В., Желтухина Г.А., Небольсин В.Е. и др. Изучение антианафилактической активности и механизмов действия γ-L-глутамилгистамина. // Патогенез, 2003, Т.1, №2, c. 60-64, показано, что γ-глутамилгистамин обладает выраженной антианафилактической активностью при использовании различных видов животных и способов введения. Полученные результаты свидетельствуют о том, что в тучных клетках животных под действием γ-глутамилгистамина достоверно снижается содержание гистамина и его антиген-стимулированная секреция. В тесте по исследованию влияния глутарилгистамина на выраженность антиген-индуцированного бронхоспазма было показано снижение величины бронхоспазма более чем на 50% по сравнению с контролем. Данный эффект проявлялся как при пероральном, так и интратрахеальном способе его введения в низкой дозе - 50 мкг/кг. Глутарилгистамин обладает способностью снижать проявления пассивной кожной анафилаксии от 34 до 42% и, таким образом, превосходит по эффективности супрастин, но уступает кларитину. В WO 99/01103 показано, что при введении животным глутарилгистамина в дозах 50 и 500 мкг/кг было продемонстрировано достоверное снижение интенсивности гиперчувствительности замедленного типа. Кроме того, глутарилгистамин в дозах 50 и 500 мкг/кг обладал также некоторой антихолестеринмимической активностью, снижая содержание общего холестерина по сравнению с животными с атерогенной нагрузкой на 5-7%.
Недостатком глутарилгистамина является его сравнительно высокая стоимость и малая доступность исходного сырья для его получения - гистамина. Кроме того, указанное вещество недостаточно эффективно в вышеперечисленных тестах.
С целью расширения арсенала технических средств и создания более эффективного и доступного противоаллергического, противовоспалительного и гиполипидемического средства, авторами изобретения были выявлены некоторые специфические N-ацильные производные аминокислот общей формулы (I), раскрытой в публикации международной заявки WO 99/01103, но конкретно в ней не описанные, не полученные и не охарактеризованные.
Так, под общую формулу (I) вышеуказанной международной заявки подпадают соединения настоящего изобретения Nα-сукцинил-L-триптофан (II), Nα-глутарил-L-триптофан (III), Nα-глутарил-L-гистидин (IV) и Nα-сукцинил-L-гистидин (V). Однако в указанной публикации не приведены ни конкретные структурные формулы данных соединений, ни какие-либо физико-химические характеристики, а также не описаны способы их получения. В публикации международной заявки WO 03/072124 приведены формулы Nα-глутарил-L-триптофана (II), Nα-глутарил-L-гистидина (IV) и Nα-сукцинил-L-гистидина (V), но не описан способ их синтеза и не приведены их физико-химические константы.
Одно из соединений глутарилгистидин упоминается только в виде метилового эфира по С-концу His [Glt-His(OMe)] в патенте США 3963691, в качестве промежуточного соединения в синтезе пептида Glt-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-poly-Lys.
Соединение сукцинилгистидин упоминается в публикации международной заявки WO 93/04690. В этой публикации указано, что добавление свободного имидазола или сукцинилгистидина ускоряет взаимодействие карнозина с дигидроксиацетоном. Методики синтеза сукцинилгистидина и его физико-химические константы не приведены.
Структурная формула сукцинилтриптофана упоминается в заявке США 2005079515. В указанной публикации ни методики синтеза сукцинилтриптофана, ни его физико-химические константы не приведены.
Получение Nα-глутарил-L-гистамина описано в публикации международной заявки WO 99/01103 и представляет собой N-ацилирование биогенного амина глутаровым ангидридом в среде безводного N,N-диметилформамида. Кроме того, в публикации Гершкович А.А., Киберев В.К. // Химический синтез пептидов. / Киев: Наукова думка, 1992, 360, описан способ ацилирования аминокислот в водно-органической, сильно щелочной среде.
В Sorm F., Pravda Z., Proteins and amino acids. X. Synthesis of two peptide analogs. // Chemicke Listy pro Vedu a Prumysl., 1951, V.45, p.423-425, описан способ синтеза сукцинилтирозина этилового эфира в смеси воды и этилацетата при соотношении (1:1) исходя из хлоргидрата этилового эфира тирозина и глутарового ангидрида в присутствии NaHCO3 для поддержания слабощелочного pH.
Однако ацилирование ангидридами дикарбоновых кислот свободного гистидина в литературе не описано.
Целью настоящего изобретения являются новые способы синтеза эффективных N-ацильных производных аминокислот, обладающих противоаллергическим, противовоспалительным и гиполипидемическим действием в низких дозах и не проявляющих побочных эффектов.
Авторами изобретения разработан простой и препаративный способ синтеза соединений общей формулы (I), заключающийся в том, что ангидрид глутаровой или янтарной кислоты в виде твердого вещества прибавляют к водному раствору аминокислоты в отсутствие неорганического и органического основания с получением целевого продукта с достаточно высоким выходом 55-60%.
Авторами изобретения также разработан еще один способ синтеза соединений общей формулы (I), в том числе N-ацильных производных гистидина, включающий проведение реакции в двухфазной системе, состоящей из водного раствора гистидина и раствора ангидрида в подходящем органическом растворителе при использовании избытка ацилирующего агента.
Краткое описание изобретения
Настоящее изобретение также относится к способу получения N-ацильных производных аминокислот общей формулы I
где n равно 2 или 3; и
R представляет
и их солей, включающему прибавление ангидрида глутаровой или янтарной кислоты в виде твердого вещества к водному раствору аминокислоты общей формулы:
или ее соли, где
R представляет
и необязательно, превращение целевого продукта в его соль.
Настоящее изобретение также относится к способу получения N-ацильных производных аминокислот общей формулы I
где n равно 2 или 3; и
R представляет
и их солей, включающему проведение реакции в двухфазной системе с ангидридом глутаровой или янтарной кислоты в несмешивающемся с водой органическом растворителе с водным раствором аминокислоты общей формулы:
или ее соли, где
R представляет
и, необязательно, превращение целевого продукта в его соль.
Детальное описание изобретения
Предпочтительные соединения общей формулы I представлены в таблице 1.
| Таблица 1 | |||
| Соединение | № соединения | R | n |
| Nα-сукцинил-L-триптофан | II | (Ind) | 2 |
| Nα-глутарил-L-триптофан | III | Ind | 3 |
| Nα-глутарил-L-гистидин | IV | (Im) | 3 |
| Nα-сукцинил-L-гистидин | V | Im | 2 |
Синтез соединений общей формулы I может быть осуществлен двумя способами. Первый способ заключается в постепенном добавлении к водному раствору аминокислоты общей формулы
или ее соли, где
R представляет
глутарового или янтарного ангидрида в виде твердого вещества, с последующим выделением целевого продукта ионообменной хроматографией, предпочтительно пропусканием реакционной смеси через колонку с катионитом и последующей кристаллизацией из водного раствора. Полученные кристаллы целевого продукта промывают подходящим растворителем, предпочтительно метанолом. Главное преимущество заявляемого способа состоит в отсутствии щелочи в водном растворе аминокислоты, что препятствует инактивации ангидрида дикарбоновой кислоты в результате гидролиза. Кроме того, остаток имидазола в составе молекулы аминокислоты может осуществлять кислотно-основный аутокатализ реакции ацилирования аминогруппы аминокислоты. Достаточно высокие выходы (55-60%) при использовании заявляемого способа достигаются, в частности, благодаря постепенному прибавлению ангидрида дикарбоновой кислоты, взятого в избытке, и интенсивному перемешиванию реакционной массы.
Соединения общей формулы I также могут быть получены альтернативным способом в двухфазной системе, включающим добавление ангидрида глутаровой или янтарной кислоты в несмешивающемся с водой органическом растворителе к водному раствору аминокислоты общей формулы:
или ее соли, где
R представляет
Данный способ позволяет использовать избыток ацилирующего агента, достичь полного ацилирования α-аминогруппы аминокислоты и выхода целевого продукта около 70%. Для поддержания необходимого pH вместо неорганической щелочи используют органическое основание - пиридин, который не гидролизует ангидрид, и, кроме того, как известно, является катализатором ацилирования. Использование пиридина позволяет избежать загрязнения конечного продукта неорганическими солями, которые вместе с продуктом реакции остаются в водном слое. Использованные подходы позволяют упростить отделение целевого продукта от непрореагировавших ангидрида и соответствующей аминокислоты и выделять целевой продукт простой кристаллизацией.
Предпочтительными несмешивающимися с водой органическими растворителями являются бутанол, этилацетат, хлороформ.
Предпочтительными растворителями, используемыми для кристаллизации целевого продукта, являются водноспиртовые смеси, в частности вода-этанол.
Соединения общей формулы I могут быть также получены в виде фармацевтически приемлемых солей с гидроксидом натрия, гидроксидом калия, карбонатом магния, гидроксидом лития, карбонатом кальция рутинными способами, широко описанными в литературе.
Соединения общей формулы I обладают противоаллергической, противовоспалительной и гиполипидемической активностью и могут быть использованы для лечения аллергических, анафилактических, в том числе сопровождающихся воспалением заболеваний, а также нарушениями липидного обмена.
В частности, соединения настоящего изобретения могут быть использованы для лечения следующих аллергических заболеваний: бронхиальной астмы, аллергического ринита, поллинозов, сезонного ринита, круглогодичного ринита, атопического дерматита, псориаза, крапивницы, аллергических (в том числе анафилактических) реакций на укусы насекомых и лекарственные препараты, холодовой аллергии, аллергического конъюктивита, хронических обструктивных заболеваний легких, а именно хронического обструктивного бронхита, эмфиземы, облитерирующего бронхита, муковисцидоза, а также заболеваний, связанных с нарушениями липидного обмена, таких как атеросклероз, ожирение, ишемическая болезнь сердца и головного мозга, инфаркт миокарда, инсульт.
Соединения настоящего изобретения вводятся в эффективном количестве, которое обеспечивает желаемый терапевтический результат.
Для лечения аллергических заболеваний, включающих бронхиальную астму, аллергический ринит, поллинозы, сезонный ринит, круглогодичный ринит, атопический дерматит, псориаз, крапивницу, аллергические (в том числе анафилактические) реакции на укусы насекомых и лекарственные препараты, холодовую аллергию, аллергический конъюктивит, хронические обструктивные заболевания легких, а именно хронический обструктивный бронхит, эмфизему, облитерирующий бронхит, муковисцидоз, а также заболеваний, связанных с нарушениями липидного обмена, таких как атеросклероз, ожирение, ишемическая болезнь сердца и головного мозга, инфаркт миокарда, инсульта соединения общей формулы I могут быть введены перорально, местно, парентерально, интраназально, ингаляционно и ректально в виде стандартных лекарственных форм, содержащих нетоксичные фармацевтически приемлемые носители. Используемый в настоящем описании термин «парентеральное введение» означает подкожные, внутривенные, внутримышечные или внутригрудные инъекции или вливания.
Соединения настоящего изобретения могут быть введены пациенту в дозах, составляющих от 0,01 до 10 мг/кг веса тела в день, предпочтительно в дозах от 0,05 до 5 мг/кг один или более раз в день.
При этом следует отметить, что конкретная доза для каждого конкретного пациента будет зависеть от многих факторов, включая активность данного используемого соединения, возраст, вес тела, пол, общее состояние здоровья и режим питания пациента, время и способ введения лекарственного средства, скорость его выведения из организма, конкретно используемую комбинацию лекарственных средств, а также тяжесть заболевания у данного индивида, подвергаемого лечению.
Детальное описание соединений настоящего изобретения, их получения и исследования фармакологической активности представлено в нижеследующих примерах, предназначенных для иллюстрации предпочтительных вариантов изобретения и не ограничивающими его объем.
Примеры синтеза N-ацильных производных аминокислот общей формулы (I)
Индивидуальность полученных соединений проверялась методом ТСХ на пластинках "Kieselgel 60 F254" "Merck" (Германия) в системах: метанол (1), хлороформ-метанол-аммиак (4:3:1) (2).
Хроматограммы проявляли хлортолидиновым реактивом, нингидрином, йодом по свечению в УФ-свете.
Углы оптического вращения измеряли на поляриметре "Perkin Elmer 341" (Швеция).
1Н-ЯМР регистрировали на приборе "AMX-400 Bruker" (Германия).
Температуру плавления определяли на приборе "Boetius" (Германия).
Аналитическую ВЭЖХ поводили на приборе "System Gold" ("Beckman", США): скорость элюции 0,25 мл/мин, детекция при 214 нм в условиях: колонка Ultrasphere ODS "Beckman", 2×250 мм, 5 мкм, элюция 0,1%-ной TFA, скорость элюирования 0,25 мл/мин (1); скорость элюции 1 мл/мин, детекция при 220 нм, колонка Luna-5 "Phenomenex", C18, 250×4,6 мм, элюция 25% ацетонитрила в 0,05 М фосфатном буфере (pH 3,0) (2).
Пример 1
N α -Глутарил-L-гистидин (IV)
Методика А
К раствору 103,4 г (0,67 моль) гистидина в 400 мл воды добавляют 83,7 г (0,73 моль) глутарового ангидрида. Суспензию перемешивают 1 час, образующийся раствор упаривают до объема 150 мл, оставляют в холодильнике на 16 часов. Выпавший осадок отфильтровывают, промывают 150 мл метанола и сушат. Очистку проводят ионообменной хроматографией на смоле Пьюролайт в Н+ форме, элюируя водой. Фракции, содержащие целевой продукт, объединяют, упаривают до начала выпадения осадка и оставляют на 16 часов при +4°C. Выпавший осадок отфильтровывают, промывают 200 мл метанола и сушат до постоянного веса. Выход 98,8 г (55%). Rf 0,55 (1), 0,37 (2). Тпл = 222-224°С. [α]D 20+15, 95° (C 0,53, вода). [М+Н]+ 270,1. 1H-ЯМР спектр (D2O), δ, м.д.: 1,60-1,80 (м, 2Н, β-CH2-Glt), 2,10-2,25 (м, 4Н, α,γ-CH2-Glt), 2,90-3,25 (м, 2Н, β-CH2-His), 4,40-4,50 (м, 1Н, α-CH-His), 7,15 (с, 1Н, CH-4-Im), 8,50 (с, 1Н, CH-2-Im). Найдено, %: C 49,18; H 5,91; N 15,42. C11H15N3O5. Вычислено, %: C 49,07; H 5,62; N 15,61.
Методика Б
К суспензии 0,3 г (1,93 ммоль) гистидина в 5 мл воды при интенсивном перемешивании добавляют 0,44 г (3,86 ммоль) глутарового ангидрида, растворенного в 2,5 мл этилацетата. Перемешивают 2 часа, пиридином доводят рН до 7 и перемешивают еще 1 час. Этилацетатный и водный слой разделяют. Водный слой дважды промывают эфиром, эфирный слой отбрасывают. Воду удаляют в вакууме, остаток растворяют в минимальном количестве воды и добавляют этанол до начала выпадения белого осадка, оставляют при +4°C на 20 ч. Осадок отделяют фильтрованием, сушат в вакууме. Выход 0,36 г (70%). Rf 0,56 (1), 0,35 (2). Тпл = 219-221°С. [α]D 20 = +15,71° (C 0,56, вода). [М+Н]+ 270,1. 1H-ЯМР спектр (D2O), δ, м.д.: 1,40-1,55 (м, 2Н, β-CH2-Glt), 1,90-2,0 (м, 4H, α, γ-CH2-Glt), 2,7-3,0 (м, 2H, β-CH2-His), 4,20-4,30 (м, 1H, α-CH-His), 6,95 (c, 1H, 4-CH-Im), 8,30 (c, 1H, 2-CH-Im). ВЭЖХ в условиях: (1) - индивидуальный пик, время удерживания 14,55 мин. Найдено, %: C 49,07; H 5,65; N 15,65. C11H15N3O5. Вычислено, %: C 49,07; H 5,62; N 15,61.
Пример 2
N α -Сукцинил-L-гистидин (V)
Синтез проводили в соответствии с методикой А, приведенной для соединения IV.
Выход 0,08 г (57%).
Rf 0,44 (1), 0,25 (2).
Тпл = 179-181°С.
[α]D 20 = +30,71° (C 0,56, вода).
[М]+ 255,2.
1H-ЯМР спектр (D2O), δ, м.д.: 2,15-2,30 (м, 4Н, (CH2)2-Suc), 2,75-2,95 (м, 2H, β-CH2-His), 4,25 (уш.с, 1H, α-CH-His), 6,95 (c, 1H, 4-CH-Jm), 8,25 (c, 1H, 2-CH-Jm).
Найдено %: C 47,09; H 5,04; N 16,40. C10H13N3O5. Вычислено %: C 47,06; H 5,13; N 16,46.
Синтез проводили в соответствии с методикой Б, приведенной для соединения IV.
Выход 0,101 г (67%).
Rf 0,45 (1), 0,27 (2).
Тпл = 178-180°С.
[α]D 20 = +30,8° (C 0,57, вода).
ВЭЖХ в условиях (1) - индивидуальный пик, время удерживания 7,54 мин.
Найдено %: C 47,15; H 5,2; N 16,50. C10H13N3O5. Вычислено %: C 47,06; H 5,13; N 16,46.
Пример 3
N α -Глутарилтриптофан (III)
К суспензии 1,0 г (4,9 ммоль) триптофана в 7 мл воды прибавляют по каплям раствор 1 N NaOH (4,9 ммоль). К полученному раствору добавляют раствор 0,56 г (4,9 мммоль) глутарового ангидрида в 3 мл этилацетата. Реакционную смесь перемешивают в течение 3 часов при комнатной температуре в атмосфере аргона в темноте, оставляют на 16 часов при +4°. Растворитель из реакционной смеси удаляют в вакууме. Полученный маслообразный остаток растворяют в 30 мл воды при перемешивании, охлаждают до 0°, добавляют раствор 1 N HCl до pH 4. Продукт экстрагируют этилацетатом (3×25 мл). Объединенный этилацетатный экстракт охлаждают до 0°, промывают водой (4×25 мл) до pH 7, раствором 5% HCl (5 мл), водой (4×25 мл) до pH 7, сушат над безводным Na2SO4 в течение 1 часа. Осадок Na2SO4 отфильтровывают, промывают этилацетатом, растворитель удаляют в вакууме. Получают сероватый твердый остаток, который сушат в вакууме.
Выход 1,0 г (70%).
Rf 0,54 (1).
Тпл = 150-152°С.
[α]D 20 = +8,20° (C 0,5, метанол).
1H-ЯМР спектр (CD3OD), δ, м.д.: 1,75-1,84 (м, 2Н, β-CH2-Glt), 2,15-2,30 (м, 4Н, α,γ-CH2-Glt), 3,30-3,40 (м, 2Н, β-CH2-Trp), 3,80-3,90 (м, 1Н, α-CH-Trp), 6,97 (т, J=7 Гц, 1H, CH-6-Ind), 7,06 (т, J=7 Гц, 1Н, CH-7-Ind), 7,15 (д, J=7 Гц, 1H, CH-2-Ind), 7,33 (д, J=7 Гц, 1H, CH-5-Ind), 7,55 (д, J=7 Гц, 1Н, CH-8-Ind).
ВЭЖХ в условиях: (2) - индивидуальный пик, время удерживания 6,77 мин.
Найдено, %: С 60,07; H 5,65; N 8,75. C16H18N2O5 Вычислено, %: С 60,37; H 5,7; N 8,8.
Пример 4
N α -Сукцинил-L-триптофан (II)
Синтез проводили в соответствии с методикой, приведенной для соединения III.
Выход 100,5 мг (67%).
Rf 0,63 (1).
[α]D 20 = +21,05° (C 0,6, вода).
1H-ЯМР спектр (DMSO-d6), δ, м.д.: 2,33-2,41 (м, 4Н, α,β-CH2-Suc), 2,93-3,01 (м, 1Н, β-CH2-Trp), 3,10-3,16 (м, 1Н, β-CH2-Trp), 4,39-4,47 (м, 1Н, α-CH-Trp), 6,93-7,06 (м, 2H, CH-6,7-Ind), 7,11 (д, J 2,2 Гц, 1H, CH-2-Ind), 7,30-7,32 (м, 1H, CH-5-Ind), 7,44-7,47 (м, 1Н, CH-8-Ind). [М]+ 304,3.
ВЭЖХ в условиях: (2) - индивидуальный пик, время удерживания 6,35 мин.
Найдено, %: С 59,07; H 5,65; N 9,35. C15H16N2O5 Вычислено, %: С 59,21; H 5,3; N 9,21.
Пример 5
Мононатриевая соль N α -глутарил-L-гистидина (IV)
К раствору 1,0 г (3,7 ммоль) Nα-глутарил-L-гистидина в 15 мл воды при перемешивании и охлаждении до +5°С прибавляют раствор 0,15 г (3,7 ммоль) NaOH в 20 мл воды. Раствор перемешивают 30 мин, растворитель удаляют в вакууме. К маслообразному остатку порциями добавляют бензол, растворитель удаляют в вакууме. Твердый остаток сушат над гранулированной щелочью.
Выход 1,07 г (99,7%).
Тпл = 208-210°С.
[α]D 20 = +16,27° (C 0,58, вода).
Найдено, %: C 45,25; H 5,51; N 14,52. C11H15N3O5Na. Вычислено, %: C 45,21; H 5,17; N 14,38.
Пример 6
Мононатриевая соль N α -сукцинил-L-гистидина (V)
Синтез проводили в соответствии с методикой, приведенной для мононатриевой соли Nα-глутарил-L-гистидина (IV) (пример 5).
Выход 1,06 г (97,0%).
[α]D 20 = +40,21° (C 0,48, вода).
Найдено, %: C 43,25; H 4,51; N 15,52. C10H13N3O5Na. Вычислено, %: C 43,17; H 4,71; N 15,10.
Пример 7
Мононатриевая соль N α -сукцинил-L-триптофана (II)
Синтез проводили в соответствии с методикой, приведенной для мононатриевой соли Nα-глутарил-L-гистидина (IV) (пример 5).
Выход 0,21 г (98,0%).
Тпл = 147-150°С.
[α]D 20 = +22,02° (C 0,39, вода).
Найдено, %: C 55,25; H 4,51; N 8,32. C15H16N2O5Na. Вычислено, %: C 55,05; H 4,93; N 8,56.
ВЭЖХ в условиях: (2) - индивидуальный пик, время удерживания 6,56 мин.
Пример 8
Мононатриевая соль N α -глутарил-L-триптофана (III)
Синтез проводили в соответствии с методикой, приведенной для мононатриевой соли Nα-глутарил-L-гистидина (IV) (пример 5).
Выход 0,11 г (99,0%).
Тпл = 128-130°С.
[α]D 20 = +22,06° (C 0,34, метанол).
Найдено, %: C 56,15; H 5,21; N 8,22. C16H18N2O5Na. Вычислено, %: C 56,30; H 5,32; N 8,21.
ВЭЖХ в условиях: (2) - индивидуальный пик, время удерживания 6,96 мин.
Пример 9
Динатриевая соль N α -глутарил-L-гистидина (IV)
К раствору 1,0 г (3,7 ммоль) Nα-глутарил-L-гистидина в 15 мл воды при перемешивании и охлаждении до +5°С прибавляют раствор 0,3 г (7,44 ммоль) NaOH в 15 мл воды. Раствор перемешивают 30 мин, растворитель удаляют в вакууме. К маслообразному остатку порциями добавляют бензол, растворитель удаляют в вакууме. Твердый остаток сушат над гранулированной щелочью.
Выход 1,15 г (99,0%).
[α]D 20 = +11,92° (C 0,57, вода).
Найдено, %: C 41,25; H 4,51; N 13,52. C11H15N3O5Na2. Вычислено, %: C 41,91; H 4,80; N 13,3.
Пример 10
Динатриевая соль N α -сукцинил-L-гистидина (V)
Синтез проводили в соответствии с методикой, приведенной для динатриевой соли Nα-глутарил-L-гистидина (IV) (пример 9).
Выход 1,16 г (99,0%).
Тпл = 124-128°С.
[α]D 20 = +20,06° (C 0,67, вода).
Найдено, %: C 39,55; H 4,31; N 13,52. C10H13N3O5Na2. Вычислено, %: C 39,88; H 4,35; N 13,95.
Пример 11
Динатриевая соль N α -сукцинил-L-триптофана (II)
Синтез проводили в соответствии с методикой, приведенной для динатриевой соли Nα-глутарил-L-гистидина (IV) (пример 9).
Выход 0,56 г (97,7%).
Найдено, %: C 51,35; H 4,31; N 8,22. C15H16N2O5Na2. Вычислено, %: C 51,43; H 4,60; N 8,0.
Пример 12
Динатриевая соль N α -глутарил-L-триптофана (III)
Синтез проводили в соответствии с методикой, приведенной для динатриевой соли Nα-глутарил-L-гистидина (IV) (пример 9).
Выход 0,56 г (98,5%).
Найдено, %: C 52,55; H 4,71; N 7,52. C16H18N2O5Na2. Вычислено, %: C 52,75; H 4,98; N 7,69.
Тесты на биологическую активность
Пример 13
Влияние соединений общей формулы I на аллергические реакции немедленного типа (тест индуцированной овальбумином (ОА) дегрануляции базофилов крови иммунизированной морской свинки in vitro)
Выделение лейкоцитов из крови морской свинки осуществляли по методу Фримеля (Иммунологические методы./Под ред. Г.Фримеля/ - М.: Медицина, 1987, стр.222 в нашей модификации).
Для постановки теста использовали морских свинок обоего пола массой 600-800 г. Животных иммунизировали однократно смесью овальбумина 10 мкг и 100 мг гидроокиси алюминия на животное по Andersson (Anderson P., Antigen-induced bronchial anaphulaxis in actively sensitized geinea-pigs. // Allergy, 1980, Vol. 35, p. 63-71).
Под эфирным наркозом из сердца морской свинки отбирали 15 мл крови. Для выделения базофилов в составе лейкоцитарной взвеси использовали двойное осаждение клеток - посредством ЭДТА и с помощью цитратсодержащей осаждающей жидкости.
Кровь смешивали с 5% раствором ЭДТА·Na2 2H2O ("Sigma") в соотношении 9:1 и через 30 мин мягко центрифугировали (12 мин при 80 g). Надосадочную жидкость собирали и центрифугировали 15 мин при 500 g.
К оставшимся клеткам крови добавляли цитратсодержащую осаждающую жидкость (3) в пропорции 3:10 (термостатируется при 37°С в течение 30 мин). Обогащенную лейкоцитами надосадочную фракцию центрифугировали 7 мин при 100 g. К осадку лейкоцитов добавляли 0,85% раствор NaCl, и концентрацию клеток доводили до 30×103/мкл.
Постановка теста дегрануляции базофилов in vitr o [Справочник по клиническим лабораторным методам исследования./Под ред. Е.А.Кост/ - М.: Медицина, 1975, стр. 130].
Для постановки теста в центрифужную пробирку (используется по 3 пробирки на каждую пробу) помещали 300 мкл клеточной взвеси, затем добавляли 300 мкл солевого раствора исследуемого соединения (или солевого раствора в контроле спонтанной и максимальной дегрануляции) и преинкубировали при 37°С в течение 15 мин, затем добавляли по 300 мкл 1% солевого раствора ОА в каждую пробирку (в контроль спонтанной дегрануляции добавляли солевой раствор в таком же количестве) и еще раз преинкубировали при 37°С в течение 10 мин. Рабочая концентрация лейкоцитов составляет при этом 104/мкл. Из каждой пробирки отбирали пробы (100 мкл) в отдельные пробирки для оценки полной дегрануляции базофилов, а к оставшимся клеткам добавляли охлажденный солевой раствор (по 5 мл в каждую пробирку) для остановки реакции дегрануляции, затем центрифугировали 7 мин при 100 g, а из осадка готовили препараты для микроскопирования. Фиксацию и окраску препаратов проводили по методу Seder et al. (Seder R.A. et al., Mouse splenic and bone marrow cell populations that express high - affinity Fcε receptors and produce interleukin-4 are highly enriched in basophils. // Proc. Natl. Acad. USA, 1991, V.88, p.2835-2839).
Для выявления специфической зернистости базофилов использовали краситель 0,5% альциановый синий (рН 1,0), ядра докрашивали сафранином (0,1% раствор в 1% уксусной кислоте). Препараты использовали для оценки суммарного торможения дегрануляции
Торможение суммарной дегрануляции (ТГ) (%) рассчитывали по формуле
, где
mах - % дегранулированных базофилов при максимальной дегрануляции (ОА),
спонт. - % дегранулированных базофилов при спонтанной дегрануляции (контроль),
экспер. - % дегранулированных базофилов после воздействия исследуемого соединения.
Оценка полной дегрануляции базофилов
Отобранные после постановки теста дегрануляции базофилов пробы (по 100 мкл) помещали в пробирки с красителем (0,5% альциановый синий, рН 1,0) в соотношении 1:1. Окрашивание производили при комнатной температуре не менее 50 мин. Подсчет количества окрашенных базофилов проводили с использованием камеры Фукса-Розенталя. Торможение полной дегрануляции (ТПД) базофилов рассчитывали по формуле:
ТПД(%) = 1-[(М ср (к)- М ср (эксп.)]/[М ср (к) - М ср (ОА)] × 100, где
М ср (к) - среднее (по 3-м пробам) количество базофилов в тесте спонтанной дегрануляции;
М ср (ОА) - среднее (по 3-м пробам) количество базофилов в тесте максимальной антиген-индуцированной дегрануляции;
М ср (эксп) - среднее (по 3-м пробам) количество базофилов в тесте дегрануляции после инкубации с исследуемым соединением.
| Таблица 2 Торможение ОА-индуцированной дегрануляции базофилов крови иммунизированных морских свинок in vitro под воздействием соединений общей формулы I | |||
| № опыта п/п | Группы | Торможение полной дегрануляции (ТПД), (%) | Количество полностью дегранулированных базофилов, (%) |
| 1. | Контроль 1 (спонтанная дегрануляция) | 100 | 0 |
| 2. | Овальбумин 1%(max дегрануляция) | 0 | 35,2±0,8 |
| 3. | Соединение IV(10-3 М) | 99,2±11,2 | 2,6±2,6* |
| 4. | Соединение IV(10-4 М) | 99,5±12,0 | 2,9±1,6* |
| 5. | Соединение IV(10-5 М) | 113,5±2,7 | 0 |
| 6. | Соединение IV(10-6 М) | 90,0±1,8 | 3,9±0,6 |
| 7. | Соединение IV(10-7 М) | 76,7±1,5 | 9,1±0,8 |
| 8. | Глутарилгистамин(10-3 М) | 9,3±5,5 | 31,6±6,33 |
| 9. | Глутарилгистамин(10-4 М) | 24,1±1,1 | 25,3±3,38 |
| 10. | Глутарилгистамин(10-5 М) | 0 | 29,8±6,73 |
| 11. | Контроль 2 | 100 | 0 |
| 12. | Овальбумин 1%(max дегрануляция) | 0 | 38,9±8,43 |
| 13. | Соединение V(10-3 М) | 10,6±7,6 | 35,3±7,29 |
| 14. | Соединение V(10-4 М) | 18,9±11,8 | 31,2±6,8 |
| 15. | Соединение V(10-5 М) | 44,0±11,27 | 24,6±10,38 |
| 16. | Гидрокортизон(10-3 М) | 71,0±1,6 | 10,0±0,7 |
| 17. | Гидрокортизон(10-4 М) | 48,0±0,8 | 17,3±0,9 |
| 18. | Гидрокортизон(10-5 М) | 40,0±0,6 | 20,0±1,3 |
| (* - Р < 0,001) |
Данные таблицы 2 показывают, что по сравнению с глутарилгистамином соединение (IV) оказывает выраженное антианафилактическое действие, проявляющееся практически 100% торможением дегрануляции в тесте полной ОА-индуцированной дегрануляции базофилов крови активно иммунизированных морских свинок (реакция анафилаксии in vitro в безкальциевой среде). Значительный антианафилактический эффект соединения IV проявляется и в уменьшении количества дегранулированных клеток, особенно выраженном в концентрации 10-5 М (отсутствие дегранулированных клеток).
Пример 14
Изучение влияния соединений общей формулы I на системную анафилаксию in vivo
Использовали модель бронхоспазма у ненаркотизированных активно сенсибилизированных морских свинок с аэрозольным воздействием овальбумина в качестве антигена (Ковалева В.Л. "Методические указания по изучению бронхолитических, муколитических и противовоспалительных средств".//Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, Москва, 2000, с. 242-250).
Морских свинок сенсибилизировали овальбумином по методу Andersson (Anderson P., Antigen-induced bronchial anaphulaxis in actively sensitized geinea-pigs.//Allergy, 1980, Vol.35, p. 63-71) и через 1-2 месяца после сенсибилизации индуцировали бронхоспазм аэрозольным введением разрешающей дозы овальбумина (3 мг/кг в 1 мл физраствора).
В опытных группах морским свинкам в течение трех дней внутрижелудочно с помощью зонда вводили исследуемые соединения в дозах 10 мкг/кг, 50 мкг/кг и 150 мкг/кг. В другой серии экспериментов исследуемые соединения в дозе 50 мкг/кг (в 1 мл физраствора) вводили ингаляционно (с помощью небулайзера) также в течение трех дней 1 раз в сутки. Контрольной группе вводили физраствор. Через 1 час после последнего введения веществ ингалировали с помощью небулайзера овальбумин и оценивали длительность (в секундах) и интенсивность бронхоспастической реакции животных.
| Таблица 3 Торможение системной анафилактической реакции морских свинок при ингаляционном введении соединения IV в дозе 50 мкг/кг | ||
| Группы | Длительность острой фазы, сек | Длительность подострой фазы, сек |
| Контроль 1(физраствор) | 180±6 | 650±34 |
| Соединение IV50 мкг/кг | 0 | 400±25 |
| Таблица 4 Торможение системной анафилактической реакции морских свинок при внутрижелудочном введении соединения IV в дозах 10 и 150 мкг/кг (М±m) | ||
| Группы | Длительность острой фазы, сек | Общее время реакции, сек |
| Контроль 2(физраствор) | 296,7±104,6 | 628,3±80,6 |
| Соединение IV10 мкг/кг | 68,0±54,7* | 428,0±75,0 |
| Соединение IV150 мкг/кг | 72,0±42,1* | 337,0±78,5* |
| * - Р < 0,001 |
Результаты экспериментов, представленные в таблицах 3 и 4, показывают, что соединение IV при внутрижелудочном введении в дозах 10 и 150 мкг/кг и ингаляционном введении в дозе 50 мкг/кг проявило антианафилактическую активность. Ингаляционное введение вещества в дозе 50 мкг/кг блокировало развитие острой фазы бронхоконстрикторной реакции, которая, вызывая удушье, является причиной гибели животных. При внутрижелудочном введении соединения IV в дозах 10 мкг/кг и 150 мкг/кг был, выявлен значительный протективный эффект в отношении антиген-индуцированного бронхоспазма.
Таким образом, соединение IV проявляет значительный протективный эффект в отношении системной анафилактической реакции in vivo.
Пример 15
Противоаллергическое действие соединений общей формулы I на модели аллергического ринита у морских свинок
Использована модель аллергического ринита у морских свинок.
Морских свинок иммунизировали по определенной схеме в течение 1,5-2-х месяцев (Hutson P.A., Church M.K. et al., 1988): вначале животных иммунизировали внутрибрюшинным введением овальбумина в дозе 10 мг/кг с 7-дневным интервалом (дважды), затем свинкам ингалировали с помощью небулайзерной техники (Pari) раствор овальбумина в возрастающей концентрации, начиная с 0,1% до 1% с интервалом в 4 дня между ингаляциями. Последнюю дозу овальбумина вводили в назальные ходы с помощью микропипетки. Через 24 часа после последнего введения овальбумина производили забор назального смыва (через систему специальных трубочек) и изменения в слизистой носа оценивали с помощью комплекса методов: гистологических и цитологических. Исследуемые соединения (0,1% раствор) вводили ежедневно в виде ингаляций с помощью небулайзерной техники в течение 6 дней, на 6-й день введения вызывали провокацию антигеном (ОА). Назальный смыв получали через сутки после провокации.
| Таблица 5 Влияние соединения IV на цитоз (абсолютное количество клеток в 1 мкл) в назальном смыве | |||
| Группа | Интактный контроль | Модель + провокация (ринит) | Соединение IV(0,1% р-р) |
| N | 6 | 7 | 7 |
| Цитоз | 18,0±2,10 | 67,2±6,47** | 43,7±6,65 ° * |
| * - отличие от интактного контроля; ° - отличие от модели(° - Р<0,05; * - Р<0,01; ** - Р<0,001) |
| Таблица 6 Влияние соединения IV на показатели цитограммы (%) назального смыва морских свинок | |||
| ГруппаСубпопуляция | Интактный контрольn=6 | Модель(ринит)n=7 | Соединение IV(0,1% р-р)n=7 |
| Макрофаги | 21,8±1,64 | 12,7*±1,57 | 14,6*±1,27 |
| Лимфоциты | 4,7±0,88 | 6,1±1,42 | 5,7±1,54 |
| Нейтрофилы | 0,3±0,21 | 3,3*±0,80 | 7,8**°±1,35 |
| Эозинофилы | 7,0±2,45 | 47,9***±5,37 | 6,9°°°±1,32 |
| Эпителиоциты | 66,2±3,09 | 27,1***±5,01 | 63,6°°°±3,02 |
| * - отличие от интактного контроля; ° - отличие от модели (ринит)(° - Р<0,05; **, °° - Р<0,01; ***, °°° - Р<0,001) |
| Таблица 7 Влияние соединения IV на абсолютное количество клеточных субпопуляций назального смыва морских свинок (в 1 мкл) | |||
| ГруппаСубпопуляция | Интактный контрольn=6 | Модель(ринит)n=7 | Соединение IV(0,1% р-р)n=7 |
| Макрофаги | 6,2±1,29 | 7,9±1,88 | 6,1±0,75 |
| Лимфоциты | 0,9±0,24 | 4,1*±1,16 | 3,2*±52 |
| Нейтрофилы | 0,03±0,021 | 2,1±0,67 | 3,1±1,02 |
| Эозинофилы | 1,2±0,46 | 26,5***±4,47 | 3,2°°±0,97 |
| Эпителиоциты | 11,8±1,4 | 11,3±2,10 | 26,3**°°±4,31 |
| Примечание: * - отличие от интактного контроля; ° - отличие от модели(* - P<0,05; **,°° - Р<0,01; *** -Р<0,001) |
Из данных таблиц 5-7 следует, что в условиях моделирования аллергического ринита соединение IV значительно подавляет эозинофильное воспаление. Это подтверждается снижением до нормы абсолютного и относительного количества эозинофилов, а также существенным снижением цитоза в назальном смыве.
Пример 16
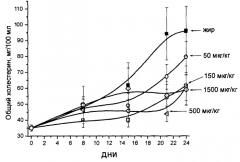
Противоаллергическ