Способ калориметрического определения сорбции веществ из растворов
Иллюстрации
Показать всеИзобретение относится к химии дисперсных систем и поверхностных явлений и может быть использовано для получения изотерм сорбции индивидуальных веществ из растворов с применением калориметра с изотермической оболочкой. Способ калориметрического определения сорбции веществ из растворов характеризуется применением многоампульного калориметра переменной температуры с изотермической оболочкой и автоматизированной схемой измерения температуры и тепловой калибровки, с калориметрической ячейкой, в центре которой расположен цилиндрический стакан с плотно вставляемым в него калориметрическим сосудом со съемной кассетой на двенадцать ампул и заключается во взвешивании двенадцати навесок сорбента, запаивании их в стеклянные ампулы, закреплении ампулы в кассете, установлении кассеты в калориметрический сосуд, затем в калориметрический сосуд вносят раствор сорбируемого вещества-орбтива, герметично закрывают калориметрический сосуд, устанавливают его в калориметрическую ячейку, термостатируют при заданной температуре до установления теплового равновесия, затем включают автоматизированную схему измерения температуры и тепловой калибровки калориметра переменной температуры для непрерывного фиксирования температуры в калориметрической ячейке, проводят тепловую калибровку калориметра, последовательно разбивают ампулы с сорбентом, смешивая каждую порцию сорбента с раствором сорбтива, при этом автоматически происходит запись изменения температуры в ходе химической реакции, добавление следующей порции сорбента проводят после выравнивания температуры в калориметрической ячейке, после выравнивания температуры в калориметрической ячейке вследствие поглощения сорбента из двенадцатой ампулы и окончания калориметрического опыта строят кривую изменения температуры калориметрического опыта, по ней определяют изменение температуры в калориметрическом сосуде при калибровке и при добавлении каждой порции сорбента, используя специальный алгоритм обработки результатов измерений, рассчитывают тепловой эффект реакции сорбции (Qc) для каждой порции сорбента по математическому уравнению. Технический результат - разработка способа калориметрического определения сорбции веществ из растворов, позволяющего получить одновременно энергетические характеристики поглощения вещества, тип сорбционного взаимодействия, время достижения равновесия сорбции и предельные сорбционные емкости сорбента по данному веществу с высокой точностью и селективностью. 3 ил.
Реферат
Изобретение относится к химии дисперсных систем и поверхностных явлений и может быть использовано для получения изотерм сорбции индивидуальных веществ из растворов с применением калориметра с изотермической оболочкой.
Техническая задача изобретения заключается в разработке способа калориметрического определения сорбции веществ из растворов, позволяющего получить одновременно энергетические характеристики поглощения вещества, тип сорбционного взаимодействия, время достижения равновесия сорбции и предельные сорбционные емкости сорбента по данному веществу с высокой точностью и селективностью.
Для решения поставленной технической задачи предложен способ калориметрического определения сорбции веществ из растворов, характеризующийся тем, что он предусматривает применение многоампульного калориметра переменной температуры с изотермической оболочкой и автоматизированной схемой измерения температуры и тепловой калибровки, с калориметрической ячейкой, в центре которой расположен цилиндрический стакан с плотно вставляемым в него калориметрическим сосудом со съемной кассетой на двенадцать ампул, и заключающийся в том, что взвешивают двенадцать навесок сорбента, запаивают их в стеклянные ампулы, закрепляют ампулы в кассете, устанавливают кассету в калориметрический сосуд, затем в калориметрический сосуд вносят раствор сорбируемого вещества-сорбтива, герметично закрывают калориметрический сосуд, устанавливают его в калориметрическую ячейку, термостатируют при заданной температуре до установления теплового равновесия, затем включают автоматизированную схему измерения температуры и тепловой калибровки калориметра переменной температуры для непрерывного фиксирования температуры в калориметрической ячейке, проводят тепловую калибровку калориметра, последовательно разбивают ампулы с сорбентом, смешивая каждую порцию сорбента с раствором сорбтива, при этом автоматически происходит запись изменения температуры в ходе химической реакции, добавление следующей порции сорбента проводят после выравнивания температуры в калориметрической ячейке, после выравнивания температуры в калориметрической ячейке вследствие поглощения сорбента из двенадцатой ампулы и окончания калориметрического опыта строят кривую изменения температуры калориметрического опыта, по ней определяют изменение температуры в калориметрическом сосуде при калибровке и при добавлении каждой порции сорбента, используя специальный алгоритм обработки результатов измерений, рассчитывают тепловой эффект реакции сорбции (Qc) для каждой порции сорбента по уравнению
Qc=Qэ-(Qг+Qн+Qхол+Qp),
где Qг - тепловой эффект сопутствующего процесса сольватации, Qн - набухания, Qp - разбавления, Qхол - теплота разбиения ампулы, Qэ - тепловой эффект, определяемый экспериментально, рассчитывается по уравнению
Qэ=IUτн(ΔT1/ΔT),
где I - заданная при тепловой калибровке сила тока, U - заданное при тепловой калибровке напряжение, τн - время тепловой калибровки, ΔT1 - изменение температуры в ходе химической реакции, протекающей при калориметрическом опыте, ΔT - изменение температуры в ходе тепловой калибровки, тепловые эффекты сопутствующих процессов - Qг, Qн, Qp - измеряют в отдельных опытах при условиях, идентичных основному калориметрическому опыту, например для определения Qн калориметрический сосуд заполняют точно измеренным объемом растворителя без сорбтива, в ампулу запаивают 0,1±0,0001 г сорбента и измеряют изменение температуры в данном опыте, затем рассчитывают тепловые эффекты сопутствующего процесса по последнему уравнению, при этом Qхол и систематическую погрешность калориметрического опыта определяют в «холостых» опытах, для чего в калориметрический сосуд наливают дистиллированную воду, запаивают пустые ампулы и проводят измерения температурного хода «холостого» опыта, рассчитывают тепловой эффект сорбции (Qc), вычитая тепловые эффекты сопутствующих процессов из измеренных тепловых эффектов сорбции и затем молярную энтальпию сорбции (ΔсН) по уравнению ΔсН=Qc/ν, где ν - количество сорбированного вещества, которое определяют из разницы концентраций сорбтива в каждой предыдущей () и последующей точке () по уравнению ν=()V, где V - объем раствора сорбтива, затем строят изотерму сорбции в координатах ΔсН=f(ν), проводят анализ вида изотермы, по горизонтальному участку оценивают сорбционную емкость сорбента, по форме изотермы - характер взаимодействия.
Технический результат заключается в высокой точности и селективности определения энергетической характеристики поглощения вещества - энтальпии сорбции, с одновременной оценкой типа сорбционного взаимодействия, предельной сорбционной емкости сорбента по данному веществу и времени достижения сорбционного равновесия по времени выравнивания температуры в опыте.
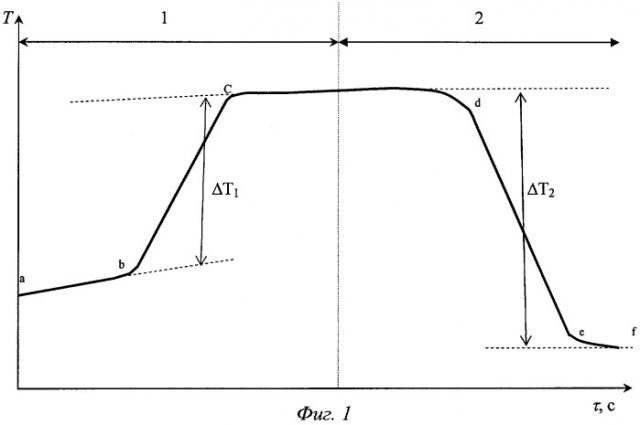
На фиг.1 представлено изменение температуры в калориметрической ячейке в ходе опыта.
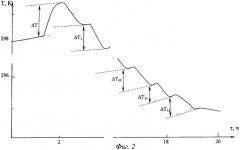
На фиг.2 представлены изменения температуры в калориметрической ячейке при калибровке и сорбции никеля (II) на амфолите АМФ.
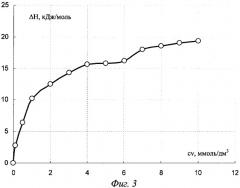
На фиг.3 показана изотерма сорбции ионов никеля (II) из водного раствора на амфолите АМФ.
Способ калориметрического определения сорбции веществ из растворов реализуют следующим образом.
Двенадцать стеклянных ампул взвешивают последовательно на аналитических весах с точностью ±0,0001 г, в каждую вносят около 0,1 г сорбента и заполненные ампулы повторно взвешивают с точностью ±0,0001 г, затем все ампулы герметично запаивают. Запаянные ампулы закрепляют с помощью держателей по кругу в кассете, которая располагается на крышке калориметрического сосуда. В калориметрический сосуд калиброванной пипеткой вносят 50±0,005 см3 раствора с концентрацией сорбтива 0,1 моль/дм3 или другой концентрацией, выбираемой для каждого сорбента и сорбтива индивидуально и близкой к концентрации максимальной сорбции. Герметично закрывают калориметрический сосуд крышкой, помещают в гнездо калориметрической ячейки, закрывают ячейку, устанавливают устройство для разбивания ампул в начальное положение и проводят термостатирование до установления теплового равновесия в калориметрической ячейке. После этого включают автоматизированную схему измерения температуры и тепловой калибровки калориметра переменной температуры для непрерывного фиксирования температуры в калориметрической ячейке, проводят тепловую калибровку калориметра, последовательно разбивают ампулы с сорбентом, смешивая каждую порцию сорбента с раствором сорбтива, при этом автоматически происходит запись изменения температуры в ходе химической реакции, добавление следующей порции сорбента проводят после выравнивания температуры в калориметрической ячейке, после выравнивания температуры в калориметрической ячейке вследствие поглощения сорбента из двенадцатой ампулы заканчивают калориметрический опыт. По результатам опыта строят кривую изменения температуры в калориметрической ячейке в координатах Т=f(τ) (фиг.1), которая отражает температурный ход тепловой калибровки калориметра (кривая 1) и температурный ход сорбции (кривая 2). Базовую прямую линию ab строят не менее чем из 100 измерений, что происходит примерно за 25 с измерений. Включают нагреватель, расположенный внутри калориметрического сосуда, проводят калибровку калориметра и получают линию подъема температуры bс, после прекращения подъема температуры ожидают выхода на базовую линию cd и разбивают первую ампулу с сорбентом. Если сорбция сопровождается эндотермическим тепловым эффектом, то наблюдают падение температуры, аналогично фиг.1. Линия de характеризует снижение температуры в результате сорбционного процесса с последующим выходом на базовую линию eƒ. Выдерживание линейной базовой линии eƒ проводят не менее 30 минут, чтобы убедиться в установлении химического и теплового равновесия. Последовательно разбивают последующие ампулы с навесками сорбента, проводят измерения и построения линий, аналогичных deƒ.
После окончания опыта и построения температурного хода калориметрического опыта графически определяют изменение температуры калориметрической системы при калибровке (ΔТ) и изменение температуры в ходе каждого опыта (ΔТ1) и рассчитывают тепловой эффект сорбции (, Дж) каждой навеской сорбента по формуле
где I - заданная при тепловой калибровке сила тока, A; U - заданное при тепловой калибровке напряжение, В; τн - время тепловой калибровки, с. Тепловое значение калориметра (IUτн/ΔT) определяли как среднеарифметическое между 4-6 опытами.
Измеренный тепловой эффект включает тепловые эффекты сопутствующих процессов: сольватации (Qг), набухания (Qн), разбавления (Qp), их измеряют в отдельных опытах при условиях, идентичных основному калориметрическому опыту. Для определения теплоты сольватации (Qг) калориметрической сосуд заполняют 50±0,01 см3 раствора сорбтива, в ампулу запаивают 0,1±0,0001 г дистиллированной воды и измеряют изменение температуры в данном опыте, затем рассчитывают тепловой эффект процесса по уравнению (1). Для определения теплоты набухания (Qp) в калориметрический сосуд вносят 50±0,01 см3 дистиллированной воды, в ампулу запаивают 0,1±0,0001 г сорбента и измеряют изменение температуры в данном опыте, затем рассчитывают тепловой эффект по уравнению (1). Теплоту разбиения ампулы
(Qхол) и систематическую погрешность калориметрического опыта определяют в «холостых» опытах, для этого в калориметрический сосуд наливают дистиллированную воду, запаивают пустые ампулы и проводят измерения температурного хода «холостого» опыта и расчет по уравнению (1). Тепловой эффект сорбции рассчитывают, вычитая тепловые эффекты сопутствующих процессов из измеренных тепловых эффектов по уравнению
Рассчитывают количество сорбированного вещества после добавления каждой порции сорбтива (ν1, моль), которое определяют из условия материального баланса по разнице концентраций сорбтива в каждой предыдущей () и последующей точке () по уравнению
где V - объем раствора сорбтива. После этого рассчитывают молярную энтальпию сорбции (ΔсНi) по формуле
,
Определенные таким образом энтальпии сорбции оформляют в виде изотермы сорбции.
Способ калориметрического определения сорбции веществ из растворов поясняется следующим примером.
Пример. Способ калориметрического определения сорбции веществ из растворов поясняется на примере изотермы сорбции ионов никеля из раствора, содержащего нитрат никеля на аминофосфорнокислом амфолите АМФ (фиг.2, 3).
Двенадцать стеклянных ампул взвешивают последовательно на аналитических весах с точностью ±0,0001 г, в каждую вносят около 0,1 г АМФ и заполненные ампулы повторно взвешивают с точностью ±0,0001 г, затем все ампулы герметично запаивают. Запаянные ампулы закрепляют в последовательности, соответствующей массам сорбента, с помощью держателей по кругу в кассету, которая располагается на крышке калориметрического сосуда. В калориметрический сосуд калиброванной пипеткой вносят 50±0,005 см3 раствора нитрата никеля (II) с концентрацией ионов никеля (II) 0,1 моль/дм3. Герметично закрывают калориметрический сосуд крышкой, помещают в гнездо калориметрической ячейки, закрывают ячейку, устанавливают устройство для разбивания ампул над первой ампулой и проводят термостатирование до установления теплового равновесия в калориметрической ячейке. После этого включают автоматизированную схему измерения температуры и тепловой калибровки и начинают непрерывную запись изменения температуры во времени. После формирования базовой линии из 100 измерений, что происходит за 25 секунд, включают электрический нагреватель, вмонтированный в калориметрический сосуд, задают калибровочное количество теплоты, равное 1 кДж, и записывают ход повышения температуры в калориметрической ячейке. Выжидают 10 минут для установления теплового равновесия в ячейке и проводят собственно сорбционный опыт. Для этого разбивают начальную ампулу, перемешивают первую навеску АМФ с раствором нитрата никеля (II), происходит поглощение некоторого количества ионов никеля (II), сопровождающееся снижением температуры в калориметрической ячейке, фиксируемое измерительной схемой калориметра. Выжидают 10 минут для установления теплового равновесия в ячейке и разбивают вторую ампулу, таким образом продолжают проводить опыт до двенадцатой ампулы. После установления теплового равновесия в ячейке заканчивают запись изменения температуры калориметрического опыта и строят кривую фиг.2.
После окончания опыта и построения температурного хода калориметрического опыта графически определяют изменение температуры калориметрической системы при калибровке (ΔT) и изменение температуры в ходе каждого смешения первой порции АМФ с раствором нитрата никеля (II) (ΔТ1), второй и последующей вплоть до двенадцатой ампулы (ΔТ12), рассчитывают тепловой эффект сорбции первой навеской АМФ (Q1, Дж) и всех последующих до (Q12, Дж) по формуле
где I - заданная при тепловой калибровке сила тока, A; U - заданное при тепловой калибровке напряжение, В; τн - время тепловой калибровки, с.
Проводят учет тепловых эффектов сопутствующих процессов, измеренных в отдельных опытах, рассчитывают количество поглощенных ионов никеля (II) v1, моль каждой навеской сорбента АМФ из условия материального баланса по разнице между исходной и равновесной концентрациями сорбтива в растворе в каждой предыдущей и последующей точке по уравнению (2). Молярную энтальпию сорбции (ΔcHi) в каждой точке изотермы сорбции рассчитывают по формуле
Определенные таким образом энтальпии сорбции оформляют в виде изотермы сорбции (фиг.3) в координатах ΔН=f(cv), где cv концентрация ионов никеля (II) в исходном растворе и растворах после сорбции каждой навеской АМФ.
Как следует из фиг.3, вид изотермы сорбции соотвествует поглощению веществ на активных центрах со сменой природы сорбционных центров при концентрации никеля (II) в области 4,5 ммоль/дм3, максимальная концентрация насыщения близка концентрации исходного раствора 0,1 моль/дм3 при сорбции на 1,2 г АМФ. Кроме того, в каждой точке изотермы сорбции графически определяется энтальпия сорбции.
Как следует из описания и приведенного примера, использование способа калориметрического определения сорбции веществ из растворов позволяет: обеспечить высокую точность и селективность определения сорбции, фиксирование времени достижения равновесия сорбции по времени окончания изменения темпеартуры в калориметрической ячейке, кроме того, одновременно определелить максимальное количество поглощенного вещества и энеретические характеристики сорбции, а также исключить временные затраты на ожидание достижения равновесия (иногда это время достигает 24 часов), на анализ равновесных растворов в опытах способом переменных концентраций.
Аналоги не обнаружены.
Способ калориметрического определения сорбции веществ из растворов характеризуется тем, что предусматривает применение многоампульного калориметра переменной температуры с изотермической оболочкой и автоматизированной схемой измерения температуры и тепловой калибровки, с калориметрической ячейкой, в центре которой расположен цилиндрический стакан с плотно вставляемым в него калориметрическим сосудом со съемной кассетой на двенадцать ампул и заключается в том, что взвешивают двенадцать навесок сорбента, запаивают их в стеклянные ампулы, закрепляют ампулы в кассете, устанавливают кассету в калориметрический сосуд, затем в калориметрический сосуд вносят раствор сорбируемого вещества-сорбтива, герметично закрывают калориметрический сосуд, устанавливают его в калориметрическую ячейку, термостатируют при заданной температуре до установления теплового равновесия, затем включают автоматизированную схему измерения температуры и тепловой калибровки калориметра переменной температуры для непрерывного фиксирования температуры в калориметрической ячейке, проводят тепловую калибровку калориметра, последовательно разбивают ампулы с сорбентом, смешивая каждую порцию сорбента с раствором сорбтива, при этом автоматически происходит запись изменения температуры в ходе химической реакции, добавление следующей порции сорбента проводят после выравнивания температуры в калориметрической ячейке, после выравнивания температуры в калориметрической ячейке вследствие поглощения сорбента из двенадцатой ампулы и окончания калориметрического опыта строят кривую изменения температуры калориметрического опыта, по ней определяют изменение температуры в калориметрическом сосуде при калибровке и при добавлении каждой порции сорбента, используя специальный алгоритм обработки результатов измерений, рассчитывают тепловой эффект реакции сорбции (Qc) для каждой порции сорбента по уравнениюQс=Qэ-(Qг+Qн+Qхол+QP),где Qг - тепловой эффект сопутствующего процесса сольватации, Qн - набухания, Qp - разбавления, Qхол - теплота разбиения ампулы, Qэ - тепловой эффект определяемый экспериментально, рассчитывается по уравнениюQэ=IUτн(ΔТ1/ΔТ),где I - заданная при тепловой калибровке сила тока, U - заданное при тепловой калибровке напряжение, τн - время тепловой калибровки, ΔT1 - изменение температуры в ходе химической реакции, протекающей при калориметрическом опыте, ΔT - изменение температуры в ходе тепловой калибровки, тепловые эффекты сопутствующих процессов - Qг, Qн, Qp - измеряют в отдельных опытах при условиях идентичных основному калориметрическому опыту, например, для определения Qн калориметрический сосуд заполняют точно измеренным объемом растворителя без сорбтива, в ампулу запаивают 0,1±0,0001 г сорбента и измеряют изменение температуры в данном опыте, затем рассчитывают тепловые эффекты сопутствующего процесса по последнему уравнению, при этом Qхол и систематическую погрешность калориметрического опыта определяют в «холостых» опытах, для чего в калориметрический сосуд наливают дистиллированную воду, запаивают пустые ампулы и проводят измерения температурного хода «холостого» опыта, рассчитывают тепловой эффект сорбции (Qc.) вычитая тепловые эффекты сопутствующих процессов из измеренных тепловых эффектов сорбции и затем молярную энтальпию сорбции (ΔсН) по уравнению ΔcH=Qc/v, где v - количество сорбированного вещества, которое определяют из разницы концентраций сорбтива в каждой предыдущей и последующей точке по уравнению v=()V, где V - объем раствора сорбтива, затем строят изотерму сорбции в координатах ΔcH=f(v), проводят анализ вида изотермы, по горизонтальному участку оценивают сорбционную емкость сорбента, по форме изотермы характер взаимодействия.