6, 6-бициклические кольцевые замещенные гетеробициклические ингибиторы протеинкиназ
Иллюстрации
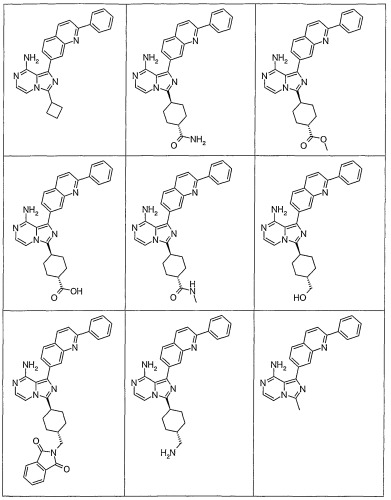
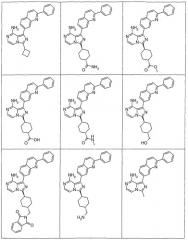
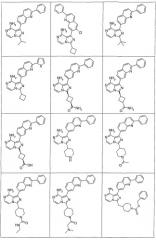
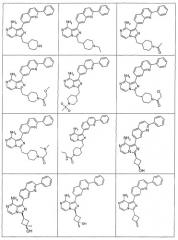
Показать всеИзобретение относится к соединениям общей формулы I или их фармацевтически приемлемым солям,где X1 - СН; X2 - N или СН; Q1 представляет собой
,
где Х11 - СН или С-галоген; Х12 - СН, С-галоген или С-СF3; Х13 - СН; Х14 - С-Е11, и Е11 представляет собой С0-10алкил или С0-10алкокси; X15 - СН или N; X16 - N или N+-O-; G1 - фенил или 5-6-членое ненасыщенное кольцо, содержащее один гетероатом N или S; R1 - С0-10алкил, циклоС3-10алкил или пиперидинил, любой из которых необязательно замещен 1-2 независимыми заместителями G11, или R1 представляет собой фенил; G11 выбирают из: OR21, где R21 представляет собой С0-10алкил; -оксо; -циклоС3-8алкила; -С0-10алкила, необязательно замещенного группой N(С0-10алкил)(С0-10алкил), в которой С0-10алкил необязательно замещен группой N(C0-10алкил)С(O)C0-10алкил; группой OR2221, где R2221 - C0-10алкил; группой N(C0-10алкил)С(O)C0-10алкил; группой N(C0-10алкил)SO2(C0-10алкил); группой N(C0-10алкил)С(O)N(C0-10алкил)(C0-10алкил); группой N(C0-10алкил)С(=O)R3331, где R3331 - С1-10алкоксиС1-10алкил или тетрагидрофуранил; -N(R21)R31, где R21 и R31 независимо представляют собой C0-10алкил, необязательно замещенный тиофенилом, морфолинилом, фуранилом; циклоС3-8алкил; С1-10алкоксиС1-10алкил; тетрагидропиранил; пиперидилC0-10алкил; или пиперидил, необязательно замещенный C0-10алкилом; или R21 и R31, необязательно, взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное кольцо, необязательно замещенное одним или более независимыми заместителями G1111 и необязательно включающее один или более гетероатомов, отличных от азота, к которому присоединены R21 и R31; где G1111 - C0-10алкил, необязательно замещенный группой OR77, где R77 - C0-10алкил, или G1111 представляет собой С1-10алкоксиС1-10алкил, пиримидинил, пиразинил, имидазолилметил; -C(O)N(R21)R31, где R21 и R31 независимо представляют собой C0-10алкил; -С(O)O(C0-10алкил); -С(O)C0-10алкила, необязательно замещенного N(C0-10алкил)(С0-10алкил) или галогеном; -гетероциклилC0-10алкила, где гетероциклил представляет собой 4-6-членное насыщенное кольцо, содержащее 1 или 2 гетероатома, независимо выбранных из N, О или S, необязательно замещенный заместителем, выбранным из: 1) OR2221, где R2221 - пиримидинил или C0-10алкил; 2) C(O)OR2221, где R2221 - C0-10алкил или фенил-C0-10алкил; 3) С(O)C0-10алкила, необязательно замещенного N(C0-10алкил)(С0-10алкил) или С1-10алкоксиС1-10алкил; 4) С(O)N(C0-10алкил)(C0-10алкил); 5) S(O)2C0-10алкил; 6) SO2N(C0-10алкил)(C0-10алкил); 7) -NR222R3331, где R2221 и R3331, взятые вместе с атомом азота, к которому они присоединены, образуют пирролидинил; или G11 представляет собой С, который взятый вместе с углеродом, к которому он присоединен, образует С=С двойную связь, которая замещена R5 и G111, где R5 и G111 - водороды. Изобретение относится также конкретно к цис-3-[8-амино-1-(2-фенилхинолин-7-ил)-имидазо[1,5-а]пиразин-3-ил]-1-метил-циклобутанолу или его фармацевтически приемлемой соли. Указанные соединения и их фармацевтически приемлемые соли применимы при лечении состояний, которые опосредованы активностью IGF-1R протеинкиназы, в частности, ангиогенеза, проницаемости сосудов, иммунного ответа, апоптоза клеток, роста опухолей или воспаления. Изобретение относится также к фармацевтической композиции. 3 н. и 11 з.п. ф-лы, 3 табл.
Реферат
По данной заявке испрашивается приоритет согласно заявке США No. 60/559250, поданной 2 апреля 2004 г.
Предпосылки создания изобретения
Настоящее изобретение направлено на новые гетеробициклические соединения, их соли и содержащие их композиции. В частности, настоящее изобретение направлено на новые гетеробициклические соединения, которые ингибируют активность тирозинкиназных ферментов у животных, включая человека, для лечения и/или профилактики различных заболеваний и состояний, таких как рак.
Протеинтирозинкиназы (PTK) представляют собой ферменты, которые катализируют фосфорилирование специфических тирозиновых остатков в различных клеточных белках, участвующих в регуляции клеточной пролиферации, активации или дифференциации (Schlessinger and Ullrich, 1992, Neuron 9:383-391). Было показано, что аномальная, избыточная или неконтролируемая активность PTK приводит к неконтролируемому клеточному росту и наблюдается при таких заболеваниях, как доброкачественные и злокачественные пролиферативные нарушения, а также при заболеваниях, возникающих в результате неадекватной активации иммунной системы (например, аутоиммунных нарушениях), отторжении аллотрансплантата и болезни трансплантат против хозяина. Кроме того, специфичные для эндотелиальных клеток рецепторы PTK, такие как KDR и Tie-2, опосредуют ангиогенный процесс и, таким образом, участвуют в поддержании развития раковых и других заболеваний с вовлечением неадекватной васкуляризации (например, диабетической ретинопатии, хороидальной неоваскуляризации из-за возрастной дегенерации желтого пятна, псориаза, артрита, ретролентальной фиброплазии, детских гемангиом).
Тирозинкиназы могут быть рецепторного типа (содержащие внеклеточный, трансмембранный и внутриклеточный домены) или нерецепторного типа (являясь полностью внутриклеточными). Рецепторные тирозинкиназы (RTK) включают большое семейство трансмембранных рецепторов с, по меньшей мере, девятнадцатью отдельными подсемействами RTK, обладающими различной биологической активностью. Семейство RTK включает рецепторы, которые являются ключевыми для роста и дифференциации множества типов клеток (Yarden and Ullrich, Ann. Rev. Biochem. 57:433-478, 1988; Ullrich and Schlessinger, Cell 61:243-254, 1990). Присущая RTK функция активируется после связывания лиганда, что приводит к фосфорилированию рецептора и многочисленных клеточных субстратов и впоследствии ведет к множеству клеточных ответов (Ullrich & Schlessinge, 1990, Cell 61:203-212). Таким образом, опосредуемое RTK проведение сигнала инициируется внеклеточным взаимодействием со специфическим фактором роста (лигандом), обычно сопровождающимся димеризацией рецептора, стимуляцией присущей ему протеинтирозинкиназной активности и трансфосфорилированием рецептора. Таким путем создаются сайты связывания для молекул проведения внутриклеточного сигнала и это ведет к образованию комплексов с рядом цитоплазматических игнальных молекул, что облегчает соответствующий клеточный ответ, такой как клеточное деление, дифференциация, метаболическое действие и изменения во внеклеточном микроокружении (Schlessinger and Ullrich, 1992, Neuron 9:1-20).
Злокачественные клетки связаны с утратой контроля над одним или более элементами клеточного цикла. Эти элементы варьируют от рецепторов клеточной поверхности до регуляторов транскрипции и трансляции, включая инсулинподобные факторы роста, инсулиноподобный фактор роста-I (IGF-I), инсулиноподобный фактор роста-II (IGF-II) (M.J. Ellis, “The Insulin-Like Growth Factor Network and Breast cancer”, Breast Cancer, Molecular Genetics, Pathogenesis and Therapeutics, Humana Press 1999). Система факторов роста инсулина состоит из семейств лигандов, белков, связывающих инсулиновые факторы роста, и рецепторов.
Основная физиологическая роль системы IGF-I заключается в стимуляции нормального роста и регенерации. Гиперэкспрессия IGF-1R (тип 1 рецептора инсулинподобного фактора роста) может инициировать митогенез и вызывать зависимую от лиганда неопластическую трансформацию. Более того, IGF-1R играет важную роль в установлении и поддержании злокачественного фенотипа.
IGF-1R существует в виде гетеродимера с несколькими дисульфидными мостиками. Тирозинкиназный каталитический сайт и сайт связывания АТФ локализованы на цитоплазматической части бета-субъединицы. В отличие от рецептора эпидермального фактора роста (EGF) не было обнаружено мутантных онкогенных форм IGF-1R. Однако было показано, что ряд онкогенов влияет на экспрессию IGF-1 и IGF-1R. Была обнаружена корреляция между снижением экспрессии IGF-1R и резистентностью к трансформации. Экспозиция клеток с антисмысловой мРНК по отношению к РНК IGF-1R предотвращает рост нескольких линий опухолевых клеток человека в полутвердом агаре.
Апоптоз представляет собой повсеместный физиологический процесс, используемый для уничтожения поврежденных или нежелательных клеток в многоклеточных организмах. Полагают, что нарушение регуляции апоптоза вовлечено в патогенез многих заболеваний человека. Было показано участие недостаточности апоптотической гибели клеток в различных формах рака, а также аутоиммунных нарушениях. Напротив, усиленный апоптоз связан с множеством заболеваний, включающих утрату клеток, таких как нейродегенеративные нарушения и СПИД. В результате регуляторы апоптоза стали важным объектом терапии. В настоящее время установлено, что основным способом выживания опухоли является ускользание от апоптоза. IGF-1R блокирует продвижение в апоптоз как in vivo, так и in vitro. Было показано, что снижение уровня IGF-1R ниже уровня дикого типа вызывает апоптоз опухолевых клеток in vivo. Разрушение IGF-1R способно вызывать апоптоз, но эта способность, по-видимому, снижена в нормальных, неопухолевых клетках.
Было показано участие неадекватно высокой протеинкиназной активности во многих заболеваниях из-за аномальной клеточной функции. Это могло быть следствием либо прямой, либо непрямой недостаточности адекватных контрольных механизмов киназы, связанных с мутацией, гиперэкспрессией или неадекватной активацией фермента; или гипер-, или гипопродукцией цитокинов или факторов роста, участвующих в проведении сигналов в положение апстрим или даунстрим относительно киназы. Во всех таких случаях можно ожидать благоприятного действия селективного ингибирования действия киназы.
IGF-1R представляет собой трансмембранную RTK, которая связывает преимущественно IGF-1, а также IGF-II и инсулин с низкой аффинностью. Связывание IGF-1 со своим рецептором приводит к олигомеризации рецептора, активации тирозинкиназы, межмолекулярному аутофосфорилированию рецептора и фосфорилированию клеточных субстратов (основными субстратами являются IRS1 и Shc). Активированный лигандом IGF-1R вызывает митогенную активность в нормальных клетках и играет важную роль в аномальном росте.
Путь IGF-1 в развитии опухоли у человека играет важную роль: 1) гиперэкспрессия IGF-1R часто обнаруживается в различных опухолях (молочной железы, ободочной кишки, легкого, саркоме) и часто связана с агрессивным фенотипом. 2) Высокая концентрация циркулирующего IGF-1 существенно коррелирует с риском рака предстательной железы, легкого и молочной железы. Более того, IGF-1R необходим для установления и поддержания трансформированного фенотипа in vitro и in vivo (Baserga R. Exp. Cell. Res., 1999, 253, 1-6). Киназная активность IGF-1R существенна для трансформирующей активности ряда онкогенов: EGFR, PDGFR, SV40 T антигена, активированных Ras, Raf и v-Src. Экспрессия IGF-1R в нормальных фибробластах индуцирует неопластические фенотипы, которые затем могут образовывать опухоли in vivo. Экспрессия IGF-1R играет важную роль в росте независимом от заякоревания. Было также показано, что IGF-1R защищает клетки от индуцированного химиотерапией, облучением и цитокинами апоптоза. Напротив, было показано, что ингибирование эндогенного IGF-1R доминантно негативным IGF-1R, образованием тройной спирали или антисмысловым экспрессионным вектором подавляет трансформирующую активность in vitro и опухолевый рост на животных моделях.
Было обнаружено, что многие тирозинкиназы либо RTK, либо нерецепторные тирозинкиназы участвуют в путях клеточной сигнализации, вовлеченных в различные нарушения, включая рак, псориаз, фиброз, атеросклероз, рестеноз, аутоиммунное заболевание, аллергию, астму, отторжение трансплантата, воспаление, тромбоз, заболевания нервной системы и другие гиперпролиферативные нарушения или гипериммунные ответы. Желательно обеспечить новыми ингибиторами киназ, участвующих в опосредовании или поддержании патологических состояний, для лечения таких заболеваний.
Таким образом, желательно выявление эффективных низкомолекулярных соединений, которые специфично ингибируют проведение сигнала и клеточную пролиферацию путем модуляции активности рецепторных и нерецепторных тирозин- и серин/треонинкиназ для регуляции и модуляции аномальных или неадекватных клеточной пролиферации, дифференциации или метаболизма. В частности, полезно выявить способы и соединения, которые специфически ингибируют функцию тирозинкиназы, необходимую для процессов ангиогенеза или для образования сосудистой сверхпроницаемости, ведущей к отеку, асцитам, излияниям, экссудатам, макромолекулярной экстравазии из сосудов, отложению матрикса и связанным с ними нарушениям.
Было установлено, что ингибиторы протеинтирозинкиназ пригодны в качестве селективных ингибиторов роста раковых клеток млекопитающих. Например, недавно управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США был одобрен Gleevec™ (известный также как иматиниба мезилат или STI571), 2-фенилпиримидиновый ингибитор тирозинкиназы, который ингибирует киназную активность продукта слитого гена BCR-ABL, для лечения CML. Указанное соединение, кроме ингибирования киназы BCR-ABL, ингибирует также киназу KIT и рецепторную киназу PDGF, хотя не эффективно в отношении всех мутантных изоформ киназы KIT. В недавних клинических исследованиях по применению Gleevec™ для лечения пациентов GIST, заболевания, при котором киназа KIT участвует в трансформации клеток, у многих пациентов было выявлено значительное клиническое улучшение. Другие киназные ингибиторы обнаруживают даже более высокую селективность. Например, 4-анилинохиназолиновое соединение Tarceva™ ингибирует с высокой эффективностью только рецепторную киназу EGF, хотя оно может ингибировать проведение сигнала других рецепторных киназ, возможно, благодаря гетеродимеризации таких рецепторов с рецептором EGF.
В свете важности PTK для контроля, регуляции и модуляции клеточной пролиферации, а также заболеваний и нарушений, связанных с аномальной клеточной пролиферацией, было предпринято много попыток выявить низкомолекулярные ингибиторы тирозинкиназ. В качестве тирозинкиназных ингибиторов в целом были описаны бис-, моноциклические, бициклические или гетероциклические арильные соединения (международная патентная публикация No. WO 92/20642) и производные виниленазаиндола (международная патентная публикация No. WO 94/14808). В качестве соединений для использования в качестве ингибиторов тирозинкиназ для применения при лечении рака были описаны стирильные соединения (патент США No. 5217999), замещенные стирилом пиридильные соединения (патент США No. 5302606), некоторые производные хиназолина (заявка EP No. 0566266 A1; Expert Opin. Ther. Pat. (1998), 8(4):475-478), селеноиндолы и селениды (международная патентная публикация WO 94/03427), трициклические полигидроксильные соединения (международная патентная публикация WO 92/21660) и соединения бензилфосфоновой кислоты (международная патентная публикация WO 91/15495). В качестве ингибиторов ангиогенеза и проницаемости сосудов были описаны анилиноциннолины (PCT WO 97/34876) и соединения-производные хиназолина (международная патентная публикация WO 97/22596; международная патентная публикация WO 97/42187). В качестве ингибиторов отдельных изоформ PKC, серин/треониновой киназы, функция проведения сигнала которой связана с нарушенной проницаемостью сосудов при связанных с VEGF заболеваниях, были описаны бис(индолилмалеимидные) соединения (международные патентные публикации № WO 97/40830 и WO 97/40831).
В международных патентных публикациях № WO 03/018021 и WO 03/018022 описаны пиримидины для лечения связанных с IGF-1R нарушений, в международных патентных публикациях № WO 02/102804 и WO 02/102805 описаны циклолигнаны и циклолигнаны в качестве ингибиторов IGF-1R, в международной патентной публикации WO 02/092599 описаны пирролопиримидины для лечения заболевания, которое отвечает на ингибирование тирозинкиназы IGF-1R, в международной патентной публикации WO 01/72751 описаны пирролопиримидины в качестве тирозинкиназных ингибиторов. В международной патентной публикации WO 00/71129 описаны пирролотриазиновые ингибиторы киназ. В международной патентной публикации WO 97/28161 описаны пирроло[2,3-d]пиримидины и их применение в качестве тирозинкиназных ингибиторов.
Parrizas et al. описывают тирфостины, обладающие ингибирующей активностью in vitro и in vivo в отношении IGF-1R (Endocrinology, 138:1427-1433 (1997)), и в международной патентной публикации WO 00/35455 описаны гетероариларильные производные мочевины в качестве ингибиторов IGF-1R. В международной патентной публикации WO 03/048133 описаны пиримидиновые производные в качестве модуляторов IGF-1R. В международной патентной публикации WO 03/024967 описаны химические соединения с ингибирующим действием в отношении киназных белков. В международной патентной публикации WO 03/068265 описаны способы и композиции для лечения гиперпролиферативных состояний. В международной патентной публикации WO 00/17203 описаны пирролопиримидины в качестве ингибиторов протеинкиназ. В японской патентной публикации No. JP 07/133280 описывается соединение цефема, его получение и противомикробная композиция. A. Albert et al., Journal of the Chemical Society, 11:1540-1547 (1970) описывают исследования птеридина и птеридинов, не замещенных в положении 4, синтез из пиразинов через 3,4-дигидроптеридина. A. Albert et al., Chem. Biol. Pteridines Proc. Int. Symp., 4th, 4:1-5 (1969) описывают синтез птеридинов (незамещенных в положении 4) из пиразинов через 3-4-дигидроптеридины.
IGF-1R выполняет важные функции в клеточном делении, развитии и метаболизме и в своем активированном состоянии играет роль в онкогенезе и подавлении апоптоза. Известно, что IGF-1R гиперэкспрессируется в ряде раковых клеточных линий (гиперэкспрессия IGF-1R связана с акромегалией и раком предстательной железы). Напротив, было показано, что сниженная экспрессия IGF-1R приводит к ингибированию онкогенеза и повышению апоптоза опухолевых клеток.
Хотя описанные выше противораковые соединения внесли существенный вклад в данную область, имеется постоянная потребность в данной области в улучшении противораковых фармацевтических агентов с большей селективностью или эффективностью, сниженной токсичностью или с меньшими побочными эффектами.
Краткое описание изобретения
Настоящее изобретение относится к соединению формулы I:
или его фармацевтически приемлемой соли. Соединения формулы I ингибируют фермент IGF-1R и полезны для лечения и/или профилактики гиперпролиферативных заболеваний, таких как рак, воспаление, псориаз, аллергия/астма, заболевания и состояния иммунной системы, заболевания и состояния центральной нервной системы.
Подробное описание изобретения
Настоящее изобретение относится к соединению формулы I
или его фармацевтически приемлемой соли, где:
X1 и X2, каждый независимо представляет собой N или C-(E1)aa;
X5 представляет собой N, C-(E1)aa или N-(E1)aa;
X3, X4, X6 и X7, каждый независимо представляет собой N или C;
где, по меньшей мере, один из X3, X4, X5, X6 и X7 независимо представляет собой N или N-(E1)aa;
Q1 представляет собой
X11, X12, X13, X14, X15 и X16, каждый независимо представляет собой N, C-(E11)bb или N+-O-;
где, по меньшей мере, один из Xl1, X12, X13, X14, X15 и X16 представляет собой N или N+-O-;
R1 отсутствует, представляет собой C0-10алкил, циклоC3-10алкил, бициклоC5-10алкил, арил, гетероарил, аралкил, гетероаралкил, гетероциклил, гетеробициклоC5-10алкил, спироалкил или гетероспироалкил, любой из которых необязательно замещен одним или более независимыми заместителями G11;
E1, E11, G1 и G41, каждый независимо представляет собой галоген, -CF3, -OCF3, -OR2, -NR2R3(R2a)j1, -C(=O)R2, -CO2R2,
-CONR2R3, -NO2, -CN, -S(O)j1R2, -SO2NR2R3, -NR2C(=O)R3,
-NR2C(=O)OR3, -NR2C(=O)NR3R2a, -NR2S(O)j1R3, -C(=S)OR2, -C(=O)SR2,
-NR2C(=NR3)NR2aR3a, -NR2C(=NR3)OR2a, -NR2C(=NR3)SR2a, -OC(=O)OR2,
-OC(=O)NR2R3, -OC(=O)SR2, -SC(=O)OR2, -SC(=O)NR2R3, C0-10алкил,
C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил,
C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил,
C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил,
C1-10алкилтиоC2-10алкинил, циклоC3-8алкил, циклоC3-8алкенил,
циклоC3-8алкилC1-10алкил, циклоC3-8алкенилC1-10алкил,
циклоC3-8алкилC2-10алкенил, циклоC3-8алкенилC2-10алкенил,
циклоC3-8алкилC2-10алкинил, циклоC3-8алкенилC2-10алкинил,
гетероциклил-C0-10алкил, гетероциклил-C2-10алкенил или
гетероциклил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR222, -NR222R333(R222a)j1a,
-C(=O)R222, -CO2R222, -C(=O)NR222R333, -NO2, -CN, -S(=O)j1aR222,
-SO2NR222R333, -NR222C(=O)R333, -NR222C(=O)OR333, -NR222C(=O)NR333R222a,
-NR222S(O)j1aR333, -C(=S)OR222, -C(=O)SR222, -NR222C(=NR333)NR222aR333a,
-NR222C(=NR333)OR222a, -NR222C(=NR333)SR222a, -OC(=O)OR222,
-OC(=O)NR222R333, -OC(=O)SR222, -SC(=O)OR222 или -SC(=O)NR222R333;
или El, E11 или G1 необязательно представляют собой -(W1)n-(Y1)m-R4;
или El, E11, G1 или G41 необязательно независимо представляют собой арил-C0-10алкил, арил-C2-10алкенил, арил-C2-10алкинил, гетарил-C0-10алкил, гетарил-C2-10алкенил или гетарил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, -CF3, -OCF3,
-OR222, -NR222R333(R222a)j2a, -C(O)R222, -CO2R222, -C(=O)NR222R333, -NO2,
-CN, -S(O)j2aR222, -SO2NR222R333, -NR222C(=O)R333, -NR222C(=O)OR333,
-NR222C(=O)NR333R222a, -NR222S(O)j2aR333, -C(=S)OR222, -C(=O)SR222,
-NR222C(=NR333)NR222aR333a, -NR222C(=NR333)OR222a, -NR222C(=NR333)SR222a,
-OC(=O)OR222, -OC(=O)NR222R333, -OC(=O)SR222, -SC(=O)OR222 или
-SC(=O)NR222R333;
G11 представляет собой галоген, оксо, -CF3, -OCF3, -OR21,
-NR21R31(R2a1)j4, -C(O)R21, -CO2R21, -C(=O)NR21R31, -NO2, -CN,
-S(O)j4R21, -SO2NR21R31, -NR21C(=O)R31, -NR21C(=O)OR31,
-NR21C(=O)NR31R2a1, -NR21S(O)j4R31, -C(=S)OR21, -C(=O)SR21,
-NR21C(=NR31)NR2a1R3a1, -NR21C(=NR31)OR2a1, -NR21C(=NR31)SR2a1,
-OC(=O)OR21, -OC(=O)NR21R31, -OC(=O)SR21, -SC(=O)OR21,
-SC(=O)NR21R31, -P(O)OR21OR31, C1-10алкилиден, C0-10алкил,
C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил,
C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил,
C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил,
C1-10алкилтиоC2-10алкинил, циклоC3-8алкил, циклоC3-8алкенил,
циклоC3-8алкилC1-10алкил, циклоC3-8алкенилC1-10алкил,
циклоC3-8алкилC2-10алкенил, циклоC3-8алкенилC2-10алкенил,
циклоC3-8алкилC2-10алкинил, циклоC3-8алкенилC2-10алкинил,
гетероциклил-C0-10алкил, гетероциклил-C2-10алкенил или
гетероциклил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, оксо, -CF3, -OCF3, -OR2221, -NR2221R3331(R222a1)j4a,
-C(O)R2221, -CO2R2221, -C(=O)NR2221R3331, -NO2, -CN, -S(O)j4aR2221,
-SO2NR2221R3331, -NR2221C(=O)R3331, -NR2221C(=O)OR3331,
-NR2221C(=O)NR3331R222a1, -NR2221S(O)j4aR3331, -C(=S)OR2221, -C(=O)SR2221,
-NR2221C(=NR3331)NR222a1R333a1, -NR2221C(=NR3331)OR222a1,
-NR2221C(=NR3331)SR222a1, -OC(=O)OR2221, -OC(=O)NR2221R3331,
-OC(=O)SR2221, -SC(=O)OR2221, -P(O)OR2221OR3331 или -SC(=O)NR2221R3331;
или G11 представляет собой арил-C0-10алкил,
арил-C2-10алкенил, арил-C2-10алкинил, гетарил-C0-10алкил,
гетарил-C2-10алкенил или гетарил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена,
-CF3, -OCF3, -OR2221, -NR2221R3331(R222a1)j5a, -C(O)R2221, -CO2R2221,
-C(=O)NR2221R3331, -NO2, -CN, -S(O)j5aR2221, -SO2NR2221R3331,
-NR2221C(=O)R3331, -NR2221C(=O)OR3331, -NR2221C(=O)NR3331R222a1,
-NR2221S(O)j5aR3331, -C(=S)OR2221, -C(=O)SR2221,
-NR2221C(=NR3331)NR222a1R333a1, -NR2221C(=NR3331)OR222a1,
-NR2221C(=NR3331)SR222a1, -OC(=O)OR2221, -OC(=O)NR2221R3331,
-OC(=O)SR2221, -SC(=O)OR2221 , -P(O)OR2221OR3331 или -SC(=O)NR2221R3331;
или G11 представляет собой C, взятый вместе с углеродом, к которому он присоединен, с образованием C=C двойной связи, которая замещена R5 и G111;
R2, R2a, R3, R3a, R222, R222a, R333, R333a, R21, p2al, R31, R3a1, R2221, R222a1, R3331 и R333a1, каждый независимо представляет собой C0-10алкил, C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил,
C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил,
C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил,
C1-10алкилтиоC2-10алкинил, циклоC3-8алкил, циклоC3-8алкенил,
циклоC3-8алкилC1-10алкил, циклоC3-8алкенилC1-10алкил,
циклоC3-8алкилC2-10алкенил, циклоC3-8алкенилC2-10алкенил,
циклоC3-8алкилC2-10алкинил, циклоC3-8алкенилC2-10алкинил,
гетероциклил-C0-10алкил, гетероциклил-C2-10алкенил,
гетероциклил-C2-10алкинил, арил-C0-10алкил, арил-C2-10алкенил или
арил-C2-10алкинил, гетарил-C0-10алкил, гетарил-C2-10алкенил или
гетарил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями G111;
или в случае -NR2R3(R2a)j1, или -NR222R333(R222a)j1a, или -NR222R333(R222a)j2a, или -NR21R31(R2a1)j4, или -NR2221R3331(R222a1)j4a, или -NR2221R3331(R222a1)j5a, тогда R2 и R3, или R222 и R333, или R2221 и R3331, соответственно, необязательно, взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями G1111, и где указанное кольцо необязательно включает один или более гетероатомов, отличных от азота, к которому присоединены R2 и R3, или R222 и R333, или R2221 и R3331;
W1 и Y1, каждый независимо представляет собой -O-, -NR7-,
-S(O)j7-, -CR5R6-, -N(C(O)OR7)-, -N(C(O)R7)-, -N(SO2R7)-, -CH2O-,
-CH2S-, -CH2N(R7)-, -CH(NR7)-, -CH2N(C(O)R7)-, -CH2N(C(O)OR7)-,
-CH2N(SO2R7)-, -CH(NHR7)-, -CH(NHC(O)R7)-, -CH(NHSO2R7)-,
-CH(NHC(O)OR7)-, -CH(OC(O)R7)-, -CH(OC(O)NHR7)-, -CH=CH-, -C≡C-,
-C(=NOR7)-, -C(O)-, -CH(OR7)-, -C(O)N(R7)-, -N(R7)C(O)-,
-N(R7)S(O)-, -N(R7)S(O)2- -OC(O)N(R7)-, -N(R7)C(O)N(R8)-,
-NR7C(O)O-, -S(O)N(R7)-, -S(O)2N(R7)-, -N(C(O)R7)S(O)-,
-N(C(O)R7)S(O)2-, -N(R7)S(O)N(R8)-, -N(R7)S(O)2N(R8)-,
-C(O)N(R7)C(O)-, -S(O)N(R7)C(O)-, -S(O)2N(R7)C(O)-, -OS(O)N(R7)-,
-OS(O)2N(R7)-, -N(R7)S(O)O-, -N(R7)S(O)2O-, -N(R7)S(O)C(O)-,
-N(R7)S(O)2C(O)-, -SON(C(O)R7)-, -SO2N(C(O)R7)-, -N(R7)SON(R8)-,
-N(R7)SO2N(R8)-, -C(O)O-, -N(R7)P(OR8)O-, -N(R7)P(OR8)-,
-N(R7)P(O)(OR8)O-, -N(R7)P(O)(OR8)-, -N(C(O)R7)P(OR8)O-,
-N(C(O)R7)P(OR8)-, -N(C(O)R7)P(O)(OR8)O-, -N(C(O)R7)P(OR8)-,
-CH(R7)S(O)-, -CH(R7)S(O)2-, -CH(R7)N(C(O)OR8)-,
-CH(R7)N(C(O)R8)-, -CH(R7)N(SO2R8)-, -CH(R7)O-, -CH(R7)S-,
-CH(R7)N(R8)-, -CH(R7)N(C(O)R8)-, -CH(R7)N(C(O)OR8)-,
-CH(R7)N(SO2R8)-, -CH(R7)C(=NOR8)-, -CH(R7)C(O)-, -CH(R7)CH(OR8)-,
-CH(R7)C(O)N(R8)-, -CH(R7)N(R8)C(O)-, -CH(R7)N(R8)S(O)-,
-CH(R7)N(R8)S(O)2-, -CH(R7)OC(O)N(R8)-, -CH(R7)N(R8)C(O)N(R7a)-,
-CH(R7)NR8C(O)O-, -CH(R7)S(O)N(R8)-, -CH(R7)S(O)2N(R8)-,
-CH(R7)N(C(O)R8)S(O)-, -CH(R7)N(C(O)R8)S(O)-,
-CH(R7)N(R8)S(O)N(R7a)-, -CH(R7)N(R8)S(O)2N(R7a)-,
-CH(R7)C(O)N(R8)C(O)-, -CH(R7)S(O)N(R8)C(O)-,
-CH(R7)S(O)2N(R8)C(O)-, -CH(R7)OS(O)N(R8)-,
-CH(R7)OS(O)2N(R8)-, -CH(R7)N(R8)S(O)O-, -CH(R7)N(R8)S(O)2O-,
-CH(R7)N(R8)S(O)C(O)-, -CH(R7)N(R8)S(O)2C(O)-,
-CH(R7)SON(C(O)R8)-, -CH(R7)SO2N(C(O)R8)-, -CH(R7)N(R8)SON(R7a)-,
-CH(R7)N(R8)SO2N(R7a)-, -CH(R7)C(O)O-, -CH(R7)N(R8)P(OR7a)O-,
-CH(R7)N(R8)P(OR7a)-, -CH(R7)N(R8)P(O)(OR7a)O-,
-CH(R7)N(R8)P(O)(OR7a)-, CH(R7)N(C(O)R8)P(OR7a)O-,
-CH(R7)N(C(O)R8)P(OR7a)-, -CH(R7)N(C(O)R8)P(O)(OR7a)O- или
-CH(R7)N(C(O)R8)p(OR7a)-;
R5, R6, G111 и G1111, каждый независимо представляет собой C0-10алкил, C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил,
C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил,
C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил,
C1-10алкилтиоC2-10алкинил, циклоC3-8алкил, циклоC3-8алкенил,
циклоC3-8алкилC1-10алкил, циклоC3-8алкенилC1-10алкил,
циклоC3-8алкилC2-10алкенил, циклоC3-8алкенилC2-10алкенил,
циклоC3-8алкилC2-10алкинил, циклоC3-8алкенилC2-10алкинил,
гетероциклил-C0-10алкил, гетероциклил-C2-10алкенил,
гетероциклил-C2-10алкинил, арил-C0-10алкил, арил-C2-10алкенил,
арил-C2-10алкинил, гетарил-C0-10алкил, гетарил-C2-10алкенил или
гетарил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена,
-CF3, -OCF3, -OR77, -NR77R87, -C(O)R77, -CO2R77, -C(O)NR77R87, -NO2,
-CN, -S(O)j5aR77, -SO2NR77R87, -NR77C(=O)R87, -NR77C(=O)OR87,
-NR77C(=O)NR78R87, -NR77S(O)j5aR87, -C(=S)OR77, -C(=O)SR77,
-NR77C(=NR87)NR78R88, -NR77C(=NR87)OR78, -NR77C(=NR87)SR78,
-OC(=O)OR77, -OC(=O)NR77R87, -OC(=O)SR77, -SC(=O)OR77 , -P(O)OR77OR87
или -SC(=O)NR77R87;
или R5 с R6, необязательно взятые вместе с атомом углерода, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями R69, и где указанное кольцо необязательно включает один или более гетероатомов;
R7, R7a и R8, каждый независимо представляет собой ацил, C0-10алкил, C2-10алкенил, арил, гетероарил, гетероциклил или циклоC3-10алкил, любой из которых необязательно замещен одним или более независимыми заместителями G111;
R4 представляет собой C0-10алкил, C2-10алкенил, C2-10алкинил, арил, гетероарил, циклоC3-10алкил, гетероциклил, циклоC3-8алкенил или гетероциклоалкенил, любой из которых необязательно замещен одним или более независимыми заместителями G41;
R69 представляет собой галоген, -OR78, -SH, -NR78R88, -CO2R78,
-C(=O)NR78R88, -NO2, -CN, -S(O)j8R78, -SO2NR78R88, C0-10алкил,
C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил,
C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил,
C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил,
C1-10алкилтиоC2-10алкинил, циклоC3-8алкил, циклоC3-8алкенил,
циклоC3-8алкилC1-10алкил, циклоC3-8алкенилC1-10алкил,
циклоC3-8алкилC2-10алкенил, циклоC3-8алкенилC2-10алкенил,
циклоC3-8алкилC2-10алкинил, циклоC3-8алкенилC2-10алкинил,
гетероциклил-C0-10алкил, гетероциклил-C2-10алкенил или
гетероциклил-C2-10алкинил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -OR778, -SO2NR778R888 или -NR778R888;
или R69 представляет собой арил-C0-10алкил,
арил-C2-10алкенил, арил-C2-10алкинил, гетарил-C0-10алкил,
гетарил-C2-10алкенил, гетарил-C2-10алкинил,
моно(C1-6алкил)аминоC1-6алкил,
ди(C1-6алкил)аминоC1-6алкил, моно(арил)аминоC1-6алкил,
ди(арил)аминоC1-6алкил или -N(C1-6алкил)-C1-6алкил-арил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро, -OR778,
C1-10алкила, C2-10алкенила, C2-10алкинила, галогенC1-10алкила,
галогенC2-10алкенила, галогенC2-10алкинила, -COOH,
C1-4алкоксикарбонила, -C(=O)NR778R888, -SO2NR778R888 или -NR778R888;
или в случае -NR78R88, R78 и R88, необязательно взятые вместе с атомом азота, к которому они присоединены, образуют 3-10-членное насыщенное или ненасыщенное кольцо, где указанное кольцо необязательно замещено одним или более независимыми заместителями, выбранными из галогена, циано, гидрокси, нитро, C1-10алкокси, -SO2NR778R888 или -NR778R888, и где указанное кольцо необязательно включает один или более гетероатомов, отличных от азота, к которому присоединены R78 и R88;
R77, R78, R87, R88, R778 и R888, каждый независимо представляет собой C0-10алкил, C2-10алкенил, C2-10алкинил, C1-10алкоксиC1-10алкил,
C1-10алкоксиC2-10алкенил, C1-10алкоксиC2-10алкинил,
C1-10алкилтиоC1-10алкил, C1-10алкилтиоC2-10алкенил,
C1-10алкилтиоC2-10алкинил, циклоC3-8алкил, циклоC3-8алкенил,
циклоC3-8алкилC1-10алкил, циклоC3-8алкенилC1-10алкил,
циклоC3-8алкилC2-10алкенил, циклоC3-8алкенилC2-10алкенил,
циклоC3-8алкилC2-10алкинил, циклоC3-8алкенилC2-10алкинил,
гетероциклил-C0-10алкил, гетероциклил-C2-10алкенил,
гетероциклил-C2-10алкинил, C1-10алкилкарбонил,
C2-10алкенилкарбонил,
C2-10алкинилкарбонил, C1-10алкоксикарбонил,
C1-10алкоксикарбонилC1-10алкил, моноC1-6алкиламинокарбонил,
диC1-6алкиламинокарбонил, моно(арил)аминокарбонил,
ди(арил)аминокарбонил или C1-10алкил(арил)аминокарбонил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, гидрокси, нитро,
C1-10алкокси, -SO2N(C0-4алкил)(C0-4алкила) или
-N(C0-4алкил)(C0-4алкила);
или R77, R78, R87, R88, R778 и R888, каждый независимо представляет собой арил-C0-10алкил, арил-C2-10алкенил,
арил-C2-10алкинил, гетарил-C0-10алкил, гетарил-C2-10алкенил,
гетарил-C2-10алкинил, моно(C1-6алкил)аминоC1-6алкил,
ди(C1-6алкил)аминоC1-6алкил, моно(арил)аминоC1-6алкил,
ди(арил)аминоC1-6алкил или -N(C1-6алкил)-C1-6алкил-арил, любой из которых необязательно замещен одним или более независимыми заместителями, выбранными из галогена, циано, нитро,
-O-(C0-4алкила), C1-10алкила C2-10алкенила, C2-10алкинила,
галогенC1-10алкила, галогенC2-10алкенила, галогенC2-10алкинила,
-COOH, C1-4алкоксикарбонила, -CON(C0-4алкил)(C0-10алкила),
-SO2N(C0-4алкил)(C0-10алкила) или -N(C0-4алкил)(C0-10алкила);
n, m, j1, j1a, j2a, j4, j4a, j5a, j7 и j8, каждый независимо равен 0, 1 или 2; и
aa и bb, каждый независимо равен 0 или 1.
В одном аспекте настоящего изобретения соединение представлено формулой I или его фармацевтически приемлемой солью, где X3 представляет собой N; X1, X2 и X5 представляют собой C-(E1)aa; X4, X6 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
Во втором аспекте настоящего изобретения соединение представлено формулой I или его фармацевтически приемлемой солью, где X4 представляет собой N; X1, X2 и X5 представляют собой C-(E1)aa; и X3, X6 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В третьем аспекте настоящего изобретения соединение представлено формулой I или его солью, где X5 представляет собой N-(E1)aa; X1 и X2 представляют собой C-(E1)aa; X3, X4, X6 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В четвертом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X6 представляет собой N; X1, X2 и X5 представляют собой C-(E1)aa; X3, X4 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В пятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X7 представляет собой N; X1, X2 и X5 представляют собой C-(E1)aa; X3, X4 и X6 представляют собой C; и другие переменные описаны выше для формулы I.
В шестом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X1 и X3 представляют собой N; X2 и X5 представляют собой C-(E1)aa; X4, X6 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В седьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X1 и X4 представляют собой N; X2 и X5 представляют собой C-(E1)aa; X3, X6 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В восьмом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X1 представляет собой N; X5 представляет собой N-(E1)aa; X2 представляет собой C-(E1)aa; X3, X4, X6 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В девятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X1 и X6 представляют собой N; X2 и X5 представляют собой C-(E1)aa; X3, X4 и X7 представляют собой C; и другие переменные описаны выше для формулы I.
В десятом аспекте настоящего изобретения соединение представлено формулой I или его солью, где X1 и X7 представляют собой N; X