Способ ингибирования пролиферации гепатоцитов, способ ингибирования клеточной адгезии гепатоцитов и способ ингибирования биологической активности angptl4 в гепатоцитах или предшественниках гепатоцитов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению антагонистов ангиопоэтинподобного белка-4 (ANGPTL4), и может быть использовано в медицине. В качестве антагониста ANGPTL4 используют анти-ANGPTL4-антитело. Изобретение позволяет получить антагонист ANGPTL4, способный ингибировать пролиферацию и клеточную адгезию гепатоцитов, а также ингибирующий биологическую активность ANGPTL4 в гепатоцитах или предшественниках гепатоцитов. 3 н. и 1 з.п. ф-лы, 20 ил., 1 табл.
Реферат
Родственная заявка
Настоящая заявка притязает на приоритет согласно статье 119(e) на основании предварительной заявки на выдачу патента США с регистрационным №60/589875, поданной 20 июля 2004, описание которой включено в данную заявку в полном объеме.
Область техники, к которой относится изобретение
Изобретение относится к ангиопоэтинподобному белку 4 (ANGPTL4). Изобретение относится к композициям и способам применения ANGPTL4 и его агонистов и антагонистов для диагностики и лечения заболеваний или расстройств.
Уровень техники
Ангиопоэтинподобный белок 4 (ANGPTL4) является представителем семейства секретируемых белков ангиопоэтинов. Консервативные области семейства ангиопоэтинов включают биспиральный домен и C-концевой фибриногенподобный (FBN-подобный) домен. См., например, Kim et al., Biochem. J. 346: 603-610 (2000). Другие представители семейства включают ангиопоэтин 1, ангиопоэтин 2 и ангиопоэтин 3. Ангиопоэтин 1, ангиопоэтин 2 и ангиопоэтин 3/ангиопоэтин 4 связываются с рецептором Tie2. См., например, Davis et al., Cell 87, 1161-1169 (1996); Maisonpierre et al., Science 277, 55-60 (1997); Valenzuela et al, Proc. Natl. Acad. Sci. USA 96, 1904-1909 (1999) и патенты США №5521073, 5650490 и 5814464. Ангиопоэтины 1 и 4, по-видимому, являются агонистами рецептора Tie2, тогда как ангиопоэтины 2 и 3, по-видимому, являются антагонистами (а может быть, агонистами) рецептора Tie2. См., например, Folkman & D'Amore, Cell, 87: 1153-1155 (1996); Suri et al., Cell, 87: 1171-1180 (1996); Masionpierre et al., Science 277: 55-60 (1997) и Ward & Dumont, Seminars in Cell and Developmental Biology, 13: 19-27 (2002). Рецептор Tie2 относится к семейству специфичных для эндотелиальных клеток тирозинкиназных рецепторов, которые также включают сиротский рецептор Tie1. Обнаружено, что другой представитель семейства, ангиопоэтинподобный белок 3, связывается с интегрином αvβ3. См., например, заявку на выдачу патента США 2003/0215451 и Camenisch et al., J. Biol. Chem., 277 (19): 17281-17290 (2002).
ANGPTL4 известен под другими терминами. Например, ANGPTL4 также известен как фибриноген печени/ангиопоэтин-родственный белок (HFARP) (Kim et al., Biochem. J. 346:603-610 (2000)), PPARγ-ангиопоэтин-родственный белок (PGAR) (Yoon, et al., Mol. Cell Biol., 20: 5343-5349 (2000)) и индуцируемый голоданием адипозный фактор (FIAF) (Kerten et al., J. Biol. Chem., 275: 28488-28493 (2000)).
Исследования in vitro и in vivo и характеристики ANGPTL4 могут обеспечить полезную идентификацию и открытие терапевтических средств и/или лекарственных средств, применимых для профилактики, улучшения состояния или корректировки заболеваний или дисфункций, связанных с активностью и/или экспрессией ANGPTL4. Например, подтверждено, что исследования на культурах ткани и генно-инженерных мышах представляют собой полезные средства для функционального анализа биологических процессов, имеющих отношение к заболеванию человека, включая иммунологию, злокачественные опухоли, нейробиологию, сердечно-сосудистую биологию, ожирение и многие другие. Существует необходимость в раскрытии и понимании многих биологических функций ANGPTL4. Изобретение обращено к указанным и других потребностям, которые будут очевидны при рассмотрении следующего описания.
Сущность изобретения
Изобретение относится к ангиопоэтинподобному белку 4 (ANGPTL4). Изобретение относится к применению ANGPTL4 или его подпоследовательности, или его агониста или антагониста для лечения состояний или заболеваний, характеризуемых аномальной экспрессией или активностью ANGPTL4, и/или состояний или заболеваний, в которые вовлечены экспрессия и/или активность ANGPTL4.
Предлагаются способы модулирования пролиферации гепатоцитов посредством ANGPTL4 или его агонистов или антагонистов. В некоторых вариантах способы включают в себя индукцию пролиферации гепатоцитов. Например, способ включает в себя введение эффективного количества ANGPTL4 или агониста ANGPTL4 в популяцию гепатоцитов или предшественников гепатоцитов, индуцируя таким образом пролиферацию. В одном аспекте стадия введения включает в себя введение нуклеиновой кислоты, которая кодирует ANGPTL4. Альтернативно или дополнительно может быть введено эффективное количество средства, которое индуцирует продукцию ANGPTL4 в гепатоците или предшественнике гепатоцита, чтобы стимулировать пролиферацию. ANGPTL4 или агонисты ANGPTL4 можно применять для лечения дисфункции, заболеваний и повреждения печени с помощью введения эффективного количества ANGPTL4 или агониста. В одном аспекте ANGPTL4 обеспечивается нуклеиновой кислотой, кодирующей ANGPTL4. В одном варианте изобретения агонистом ANGPTL4 является агонист рецептора αvβ5.
Также предлагаются способы ингибирования пролиферации гепатоцитов. В некоторых вариантах способ включает в себя введение эффективного количества композиции, содержащей антагонист ANGPTL4, в популяцию гепатоцитов или предшественников гепатоцитов. В одном аспекте антагонистом ANGPTL4 является средство, которое ингибирует продукцию белка ANGPTL4, например, антисмысловая молекула или молекула рибозима. В одном аспекте антагонистом ANGPTL4 является анти-ANGPTL4-антитело. В другом аспекте антагонистом ANGPTL4 является антагонистическое анти-αvβ5-антитело. В одном варианте антагонистом ANGPTL4 является ANGPTL4-миРНК. Антагонисты ANGPTL4 могут быть использованы для лечения, например, рака печени или нежелательной гипертрофии печени посредством введения эффективного количества антагониста ANGPTL4 в гепатоциты.
Также предлагаются способы модулирования клеточной адгезии гепатоцитов. В некоторых вариантах способы включают в себя индукцию клеточной адгезии гепатоцитов посредством введения эффективного количества композиции, содержащей ANGPTL4 или агонист ANGPTL4, в популяцию гепатоцитов. В других вариантах способы включают в себя ингибирование клеточной адгезии гепатоцитов посредством введения эффективного количества композиции, содержащей антагонист ANGPTL4, в популяцию гепатоцитов с ингибированием при этом клеточной адгезии гепатоцитов.
Кроме модулирования пролиферации и клеточной адгезии гепатоцитов, которые вовлечены в гомеостаз липидов, ANGPTL4 модулирует уровни триглицеридов и холестерина в сыворотке и стимулирует пролиферацию преадипоцитов, которые также вовлечены в гомеостаз липидов. Изобретение относится к способам модулирования ряда различных аспектов гомеостаза липидов. Например, способы согласно изобретению заключаются в стимуляции пролиферации преадипоцитов посредством введения эффективного количества композиции, содержащей ANGPTL4 или агонист ANGPTL4, в популяцию преадипоцитов, индуцируя таким образом пролиферацию преадипоцитов. Также предлагаются способы ингибирования пролиферации преадипоцитов. Например, способы включают в себя введение эффективного количества композиции, содержащей антагонист ANGPTL4, в популяцию преадипоцитов. Также включены способы модулирования клеточной миграции преадипоцитов. Например, способы согласно изобретению включают в себя индукцию клеточной миграции преадипоцитов посредством введения эффективного количества ANGPTL4 или агониста ANGPTL4 в популяцию преадипоцитов. Также предлагаются способы ингибирования клеточной миграции преадипоцитов, которые заключаются, например, во введении эффективного количества антагониста ANGPTL4 в популяцию преадипоцитов с ингибированием при этом клеточной миграции.
Также в изобретении предлагаются способы модулирования уровней триглицеридов или холестерина в сыворотке у субъекта. Например, способы заключаются во введении эффективного количества композиции, содержащей ANGPTL4, или агонист ANGPTL4, или антагонист ANGPTL4 субъекту, модулируя таким образом уровни триглицеридов и/или холестерина в сыворотке у субъекта. В одном варианте вводят ANGPTL4 или антагонист ANGPTL4, который приводит к накоплению триглицеридов и/или холестерина в сыворотке субъекта по сравнению с контролем. В другом варианте субъекту вводят эффективное количество антагониста ANGPTL4, снижая таким образом уровень в сыворотке субъекта по меньшей мере одного из следующих компонентов: триглицеридов, свободных жирных кислот и/или холестерина. В некоторых вариантах изобретения контролем является сыворотка субъекта до лечения или сыворотка субъекта, не подвергаемого лечению или меньше подвергаемого лечению, и т.д.
ANGPTL4 и модулятор ANGPTL4 (его агонист или антагонист) можно использовать для лечения расстройств гомеостаза липидов посредством введения эффективного количества молекулы субъекту. См. «расстройство гомеостаза липидов» в разделе «Определения» в данном описании. Например, способ включает в себя введение субъекту композиции, содержащей антагонист ANGPTL4 в количестве, эффективном для лечения гиперлипидемии.
Также предлагаются способы лечения ожирения и/или уменьшения массы тела субъекта. Например, способ включает в себя введение субъекту эффективного количества модулятора ANGPTL4, осуществляя таким образом лечение ожирения и/или уменьшение массы тела субъекта по сравнению с отсутствием лечения или лечением с помощью контроля. В одном варианте у субъекта снижают ожирение (жир). Таким образом, также можно лечить состояния, связанные с ожирением, например, сердечно-сосудистые заболевания, диабет и т.д.
В некоторых вариантах изобретение осуществляют на клетках, например, гепатоцитах, преадипоцитах, у субъекта. Обычно субъектом является человек.
ANGPTL4 согласно изобретению включает полноразмерный белок, а также биологически активные молекулы, например, остатки, соответствующие N-концу, N-концевому биспиральному домену, C-концу, C-концевому фибриногенподобному домену, или аминокислотную подпоследовательность ANGPTL4 (1-183), ANGPTL4 (23-183), ANGPTL4 (от 1 до примерно 162), ANGPTL4 (примерно 162-406), ANGPTL4 (23-406) или ANGPTL4 (184-406) человеческого ANGPTL4 и/или аминокислотную подпоследовательность mANGPTL4 (1-183), mANGPTL4 (23-183), mANGPTL4 (от 1 до примерно 165), mANGPTL4(от 23 до примерно 165), mANGPTL4 (23-410) или mANGPTL4 (184-410) мышиного ANGPTL4. Другие подпоследовательности также включают без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406 и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4. Агонисты ANGPTL4 включают молекулы, которые активируют ANGPTL4 или создают активности ANGPTL4, например, активные полипептиды, малые молекулы (синтетические аналоги) и молекулы, которые увеличивают активность или экспрессию ANGPTL4. Агонисты ANGPTL4 также включают агонисты αvβ5.
Антагонистами ANGPTL4 согласно изобретению являются молекулы, которые ингибируют или уменьшают активность ANGPTL4. Ингибитор ANGPTL4 может включать вещество с низкой молекулярной массой, полинуклеотид, антисмысловые молекулы, аптамеры РНК, рибозимы против ANGPTL4 или полипептидов его рецептора, полипептид, антагонистические варианты ANGPTL4, изолированный белок, рекомбинантный белок, антитело или его конъюгаты или слитые белки, которые ингибируют активность ANGPTL4 прямо или опосредованно. В некоторых вариантах осуществления изобретения антагонистическим ANGPTL4-антителом является антитело, которое ингибирует или уменьшает активность ANGPTL4 в результате связывания со специфичной подпоследовательностью или областью белка ANGPTL4, например, N-концом, N-концевым биспиральным доменом, C-концом, C-концевым фибриногенподобным доменом или аминокислотной подпоследовательностью ANGPTL4 (1-183), ANGPTL4 (23-183), ANGPTL4 (от 1 до примерно 162), ANGPTL4 (примерно 162-406), ANGPTL4 (23-406) или ANGPTL4 (184-406) человеческого ANGPTL4 и/или аминокислотной подпоследовательностью mANGPTL4 (1-183), mANGPTL4 (23-183), mANGPTL4 (от 1 до примерно 165), mANGPTL4 (от 23 до примерно 165), mANGPTL4 (23-410) или mANGPTL4 (184-410) мышиного ANGPTL4. Другие подпоследовательности также включают без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406 и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4. В некоторых вариантах осуществления изобретения антагонист ANGPTL4 включает анти-αvβ5-антитело, например, антагонистическое анти-αvβ5-антитело. В некоторых вариантах антитела согласно изобретению являются гуманизированными антителами. В некоторых вариантах осуществления изобретения антагонистом ANGPTL4 является молекула миРНК. В одном варианте молекулой миРНК является молекула ANGPTL4-миРНК, при этом мишенью молекулы является последовательность ДНК (например, GTGGCCAAGCCTGCCCGAAGA) (SEQ ID NO: 3) нуклеиновой кислоты, кодирующей ANGPTL4. Иммуноадгезин ANGPTL4 содержит, по меньшей мере, связывающую рецептор область ANGPTL4, слитую с последовательностью иммуноглобулина. В некоторых вариантах ANGPTL4, агонист или антагонист находится в сочетании с носителем, например, фармацевтически приемлемым носителем.
Описаны трансгенные и нокаутированные по ANGPTL4 животные и также предлагаются применения указанных трансгенных животных. Изобретение также относится к изолированной клетке, полученной из трансгенного животного, отличного от человека, геном которого содержит нарушение гена, который кодирует ANGPTL4. В некоторых вариантах изолированной клеткой является мышиная клетка (например, эмбриональная стволовая клетка).
Нарушения в мутантном гене ANGPTL4 привели к фенотипическим наблюдениям, связанным с различными патологическими состояниями или дисфункциями, включая сердечно-сосудистые, эндотелиальные или ангиогенные расстройства, включая атеросклероз; расстройства, связанные с аномальным метаболизмом, включая расстройства гомеостаза липидов; или иммунологические и воспалительные расстройства. Способы согласно изобретению включают лечение сердечно-сосудистого, эндотелиального или ангиогенного расстройства; расстройства, связанного с аномальным метаболизмом, иммунологического расстройства; расстройства гомеостаза липидов или онкологического заболевания, связанного с нарушением гена, который кодирует ANGPTL4, или связанного с активностью ANGPTL4, посредством введения субъекту эффективного количества ANGPTL4, агониста или антагониста ANGPTL4, таким образом осуществляя эффективное лечение указанного расстройства или заболевания.
Также предлагаются способы идентификации фенотипа, связанного с нарушением гена, который кодирует ANGPTL4. Например, способ включает в себя (a) измерение физиологического признака трансгенного животного, отличного от человека, геном которого содержит нарушение гена, который кодирует ANGPTL4; и (b) сравнение измеренного физиологического признака с признаком животного дикого типа соответствующего пола. Фенотип, возникающий в результате нарушения гена, идентифицируют в виде физиологического признака трансгенного животного, отличного от человека, который отличается от физиологического признака животного дикого типа. Трансгенное животное, отличное от человека, может быть гомозиготным или гетерозиготным в отношении нарушения гена, который кодирует ANGPTL4.
Также предлагаются способы идентификации средства, которое модулирует фенотип, связанный с нарушением гена, который экспрессирует ANGPTL4. Например, способ включает в себя (a) измерение физиологического признака трансгенного животного, отличного от человека, геном которого содержит нарушение гена, который кодирует ANGPTL4; и (b) сравнение измеренного физиологического признака (a) с признаком животного дикого типа соответствующего пола. Фенотип, возникающий в результате нарушения гена у трансгенного животного, отличного от человека, является физиологическим признаком трансгенного животного, отличного от человека, который отличается от физиологического признака животного дикого типа. Тестируемое средство вводят трансгенному животному, отличному от человека (a); и определяют, модулирует ли тестируемое соединение идентифицированный фенотип, связанный с нарушением гена. Тестируемое средство, которое модулирует фенотип, является средством, которое модулирует такой фенотип.
В некоторых вариантах фенотип, связанный с нарушением гена ANGPTL4, или фенотип, проявляемый трансгенным животным, отличным от человека, по сравнению с однопометными животными дикого типа соответствующего пола, представляет собой, по меньшей мере, один из следующих фенотипов, но не ограничен указанным; например, сердечно-сосудистое, эндотелиальное или ангиогенное расстройство; иммунологическое расстройство; расстройство гомеостаза липидов или расстройство, связанное с аномальным метаболизмом.
Также предлагаются способы идентификации средства, которое модулирует физиологический признак, связанный с нарушением гена, который кодирует ANGPTL4.
В некоторых вариантах способ включает в себя (a) измерение физиологического признака, проявляемого трансгенным животным, отличным от человека, геном которого содержит нарушение гена, который кодирует ANGPTL4; и (b) сравнение измеренного физиологического признака согласно (a) с физиологическим признаком животного дикого типа соответствующего пола. Физиологический признак, проявляемый трансгенным животным, отличным от человека, который отличается от физиологического признака, проявляемого животным дикого типа, идентифицируют как физиологический признак, связанный с нарушением гена. Тестируемое средство вводят трансгенному животному, отличному от человека (a), и определяют, модулируется ли физиологический признак, связанный с нарушением гена. Тестируемое средство, которое модулирует физиологический признак, является средством, которое модулирует такой признак.
В некоторых вариантах трансгенное животное, отличное от человека, проявляет, по меньшей мере, один из следующих физиологических признаков по сравнению с однопометными животными дикого типа соответствующего пола, например, модулирование средних уровней холестерина в сыворотке, модулирование средних уровней триглицеридов в сыворотке, модулирование в тесте толерантности к глюкозе, модулирование гомеостаза глюкозы, пониженный средний уровень глюкозы в сыворотке; повышенный средний уровень инсулина в сыворотке; пониженный средний уровень инсулина в сыворотке; повышенный средний уровень IgM в сыворотке и повышенное абсолютное количество нейтрофилов, повышенное среднее процентное содержание жира в организме; пониженная масса тела и длина, пониженная общая масса ткани и безжировая компонента массы тела, пониженная общая жировая масса, задержка роста с пониженной массой тела и длиной и/или пониженное среднее процентное содержание общего жира в организме, общей массы ткани. В одном варианте модулирование средних уровней холестерина в сыворотке представляет собой пониженный средний уровень холестерина в сыворотке. В одном варианте модулирование среднего уровня триглицеридов в сыворотке представляет собой снижение среднего уровня триглицеридов в сыворотке. В другом варианте модулирование в тесте толерантности к глюкозе представляет собой повышенную толерантность к глюкозе.
Предлагаются способы идентификации средства, которое улучшает состояние при сердечно-сосудистом, эндотелиальном или ангиогенном расстройстве; иммунологическом расстройстве; онкологическом заболевании; расстройстве метаболизма липидов; или аномальном метаболическом расстройстве, связанном с нарушением гена, который кодирует ANGPTL4. Например, способ включает в себя (a) введение тестируемого средства трансгенному животному, отличному от человека, имеющему нарушение в гене ANGPTL4; и (b) определение того, улучшает ли тестируемое средство состояние при сердечно-сосудистом, эндотелиальном или ангиогенном расстройстве; иммунологическом расстройстве; онкологическом заболевании; расстройстве метаболизма липидов; или метаболическом расстройстве, связанном с нарушением гена у трансгенного животного, отличного от человека.
Изобретение относится к способам оценки терапевтического средства, способного влиять на состояние, связанное с нарушением гена, который кодирует ANGPTL4. Например, способ включает в себя (a) измерение физиологического признака трансгенного животного, отличного от человека, геном которого содержит нарушение гена, который кодирует ANGPTL4; (b) сравнение измеренного физиологического признака согласно (a) с физиологическим признаком животного дикого типа соответствующего пола; (c) введение тестируемого средства трансгенному животному, отличному от человека, согласно (a); и (d) оценку влияния тестируемого средства на идентифицированное состояние, связанное с нарушением гена, у трансгенного животного, отличного от человека. Физиологический признак трансгенного животного, отличного от человека, который отличается от физиологического признака животного дикого типа, идентифицируют как состояние, возникающее в результате нарушения гена, у трансгенного животного, отличного от человека. Например, состояние представляет собой сердечно-сосудистое, эндотелиальное или ангиогенное расстройство; иммунологическое расстройство; онкологическое заболевание; расстройство гомеостаза липидов или метаболическое расстройство.
Также предлагаются способы идентификации средства, которое модулирует экспрессию ANGPTL4. Например, способ включает в себя (a) осуществление контакта тестируемого средства с клеткой-хозяином, экспрессирующей ANGPTL4; и (b) определение того, модулирует ли тестируемое средство экспрессию ANGPTL4 клеткой-хозяином.
Средство, идентифицированное любым из указанных выше способов, также включено в изобретение. В одном варианте средство является агонистом. В другом варианте средство является антагонистом ANGPTL4. Средства, которые являются терапевтическими средствами, также включены в изобретение наряду с фармацевтической композицией, содержащей терапевтическое средство.
В различных способах согласно изобретению молекула согласно изобретению, например ANGPTL4, агонист или антагонист ANGPTL4, средство и т.д., могут быть введены субъекту с помощью системы для системной доставки. В одном аспекте система для системной доставки содержит препарат клеток, содержащий клетки млекопитающих (например, клетки CHO), экспрессирующие рекомбинантную форму данного средства. В другом аспекте система для системной доставки может содержать препарат замедленного высвобождения, включающий в себя очищенное средство и полимерный матрикс. В некоторых вариантах молекулу вводят субъекту с использованием фармацевтически приемлемого носителя. Альтернативно молекулу согласно изобретению можно вводить с помощью вектора для целенаправленной доставки генов в ткани (например, в адипоциты, печень и т.д.), содержащего нуклеиновую кислоту, кодирующую молекулу. Можно использовать хорошо разработанные вирусные и невирусные векторы для генной терапии в качестве вектора для целенаправленной доставки генов в ткани в изобретении.
Краткое описание фигур
Фиг.1 иллюстрирует последовательность нуклеиновой кислоты ANGPTL4 человека (SEQ ID NO: 1).
Фиг.2 иллюстрирует аминокислотную последовательность ANGPTL4 человека (SEQ ID NO: 2), полученную на основе кодирующей последовательности SEQ ID NO: 1, показанной на фиг.1.
На фиг.3 панель A иллюстрирует очищенный рекомбинантный ANGPTL4 мыши (23-410) при разделении с помощью электрофореза в SDS-полиакриламидном геле (SDS-ПААГ) (4-20%) в присутствии (10 мМ) или в отсутствие дитиотреитола (DTT). На фиг.3 панель B иллюстрирует hANGPTL4 дикого типа (дорожка 1) и вариант hANGPTL4 (дорожка 2), после разделения в SDS-геле и выявления с помощью Вестерн-блоттинга, где вариант hANGPTL4 имеет замену R162G и R164E.
Фиг.4 схематично иллюстрирует, что ANGPTL4 индуцирует клеточную адгезию гепатоцитов человека.
Фиг.5 схематично иллюстрирует, что ANGPTL4 индуцирует пролиферацию гепатоцитов.
На фиг.6 панели A и B схематично иллюстрируют, что внеклеточный ANGPTL4 индуцирует висцеральную пролиферацию первичных преадипоцитов человека (панель A) и подкожную пролиферацию преадипоцитов (панель B).
Фиг.7 схематично показывает, что ANGPTL4 (23-406) и химерные формы IgG-ANGPTL4 человека связываются с подкожными первичными адипоцитами человека по данным анализа FACS.
На фиг.8 панели A, B и C иллюстрируют, что ANGPTL4 индуцирует клеточную миграцию первичных подкожных преадипоцитов человека. Панели A и B иллюстрируют индукцию ANGPTL4 клеточной миграции первичных преадипоцитов в течение ночи (панель A) и в течение 7 часов (панель B). Панель C схематично иллюстрирует миграцию первичных преадипоцитов под влиянием ANGPTL4 в течение 7 часов, где (1) без добавления сыворотки, (2) с 10% фетальной сыворотки теленка (FCS), (3) с PDGF-BB и (4) с mANGPTL4.
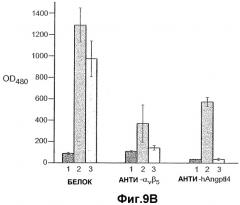
На фиг.9 панели A, B, C, D и E иллюстрируют связывание ANGPTL4 с интегрином αvβ5. Панель A иллюстрирует адгезию клеток 293-1953 (αvβ5) с планшетом, покрытым либо mANGPTL4, либо витронектином в концентрации, указанной внизу в (мкг/мл), где БСА используют в качестве контроля. Панель B иллюстрирует, что анти-αvβ5-антитело и анти-hANGPTL4-антитело удаляют активность ANGPTL4 в клеточной адгезии, где (1) означает БСА, (2) означает вибронектин и (3) означает mANGPTL4. Панель C иллюстрирует связывание белка (mANGPTL4, hANGPTL4-Nконец или hANGPTL4-Cконец) при использовании указанного количества с планшетами, покрытыми αvβ5. Панель D иллюстрирует ингибирование связывания белка (mANGPTL4, hANGPTL4-Nконец или hANGPTL4-Cконец) с планшетами, покрытыми αvβ5, с использованием анти-hANGPTL4, где в качестве контролей использовали контрольное антитело против белка критической для синдрома Дауна области 1 (Dscr), 5G7 или среду. Панель E иллюстрирует связывание ANGPTL4 и αvβ5, где (1) означает планшет, покрытый hANGPTL4-Cконец, (2) означает планшет, покрытый hANGPTL4-Cконец и инкубированный с анти-hANGPTL4, (3) означает планшет, покрытый hANGPTL4-Cконец и инкубированный с анти-Dscr, (4) означает планшет, покрытый витронектином, и (5) означает планшет, покрытый БСА перед добавлением αvβ5.
Фиг.10 иллюстрирует уровни триглицеридов у мышей при инъекции в хвостовую вену ANGPTL4 и вариантов ANGPTL4, где (1) означает Ad-GFP, (2) означает Ad-Gd, (3) означает ANGPTL4(1-406), (4) означает ANGPTL4(1-183), (5) означает ANGPTL4 (184-406), (6) означает вариант ANGPTL4 R1162G и R164E, (7) означает ANGPTL4 (1-408) и (8) означает контроль.
Подробное описание
Определения
Перед подробным описанием изобретения следует понять, что данное изобретение не ограничено конкретными композициями или биологическими системами, которые, конечно, могут варьировать. Также следует понимать, что терминология, используемая в данном описании, предназначена только для целей описания конкретных вариантов и не предназначена для ограничения. В используемом в данном описании и прилагаемой формуле изобретения смысле формы единственного числа включают множественные объекты, если содержание ясно не диктует иное. Таким образом, например, ссылка на «молекулу» необязательно включает комбинацию двух или более таких молекул, и т.п. Если не оговорено особо, подразумевается, что все научные и технические термины имеют такое же значение, которое обычно используют в области, к которой они относятся. В целях изобретения ниже определены следующие термины.
Термин «ANGPTL4» или «Angptl4» относится к ангиопоэтинподобному полипептиду или белку 4 вместе с его встречающимися в природе аллельными, секретируемыми и процессированными формами. Например, ANGPTL4 человека является белком из 406 аминокислот, тогда как мышиный ANGPTL4 является белком, состоящим из 410 аминокислот.Термин «ANGPTL4» также используют для указания фрагментов (например, подпоследовательностей, укороченных форм и т.д.) полипептида, содержащих, например, N-концевой фрагмент, биспиральный домен, C-концевой фрагмент, фибриногенподобный домен, аминокислоты 1-183, 23-183, от 1 до примерно 162, от 23 до примерно 162, 23-406, 184-406, примерно 162-406 или 23-184 ангиопоэтинподобного белка 4 человека и аминокислоты 1-183, 23-183, от 1 до примерно 165, от 23 до примерно 165, 23-410 или 184-410 мышиного ангиопоэтинподобного белка 4. Другие фрагменты включают без ограничения, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-406, 60-406, 80-406, 100-406, 120-406, 140-406, и 160-406 hANGPTL4 и, например, 40-183, 60-183, 80-183, 100-183, 120-183, 140-183, 40-410, 60-410, 80-410, 100-410, 120-410, 140-410 и 160-410 mANGPTL4. Ссылка на любые такие формы ANGPTL4 также может быть указана в заявке, например, в виде «ANGPTL4 (23-406)», «ANGPTL4 (184-406)», «ANGPTL4 (23-183)», «mANGPTL4 (23-410)», «mANGPTL4 (184-410)» и т.д., где m указывает мышиную последовательность. Положения аминокислот для фрагмента нативного ANGPTL4 пронумерованы, как указано в нативной последовательности ANGPTL4. Например, положение аминокислоты 22(Ser) во фрагменте ANGPTL4 также является положением 22(Ser) в нативном ANGPTL4 человека, например, см. фиг.2. Как правило, фрагмент нативного ANGPTL4 обладает биологической активностью.
Полипептид с «нативной последовательностью» включает полипептид, имеющий такую же аминокислотную последовательность, как и полипептид, полученный из природного источника. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность встречающегося в природе полипептида любого млекопитающего. Такой полипептид с нативной последовательностью можно выделить из природного источника и можно получить способами рекомбинации или синтеза. Термин полипептид с «нативной последовательностью» специально охватывает встречающиеся в природе укороченные или секретируемые формы полипептида (например, последовательность внеклеточного домена), встречающиеся в природе вариантные формы (например, альтернативно сплайсируемые формы) и встречающиеся в природе аллельные варианты полипептида.
«Вариант» полипептида означает биологически активный полипептид, имеющий, по меньшей мере, примерно 80% идентичность аминокислотной последовательности с соответствующим полипептидом с нативной последовательностью или его фрагментом. Такие варианты включают, например, полипептиды, в которых один или несколько аминокислотных остатков добавлены или делетированы на N- и/или C-конце полипептида. Обычно вариант будет обладать, по меньшей мере, примерно 80% идентичностью аминокислотной последовательности или, по меньшей мере, примерно 90% идентичностью аминокислотной последовательности, или, по меньшей мере, примерно 95% или большей идентичностью аминокислотной последовательности с полипептидом с нативной последовательностью или его фрагментом.
Термин «вариант ANGPTL4» в используемом в данном описании смысле относится к варианту, который описан выше, и/или ANGPTL4, который содержит одну или несколько аминокислотных мутаций в нативной последовательности ANGPTL4. Необязательно одна или несколько аминокислотных мутаций включают аминокислотную замену(ы). ANGPTL4 и его варианты для применения в изобретении могут быть получены множеством способов, хорошо известных в данной области. Варианты аминокислотной последовательности ANGPTL4 могут быть получены в результате мутаций в ДНК ANGPTL4. Такие варианты включают, например, делеции, инсерции или замены остатков в аминокислотной последовательности ANGPTL4, например в аминокислотной последовательности человека, кодируемой нуклеиновой кислотой, депонированной в ATCC под номером депозита 209284, или показанной на фиг.2. Может быть осуществлена любая комбинация делеции, инсерции и замены, чтобы добиться конечной конструкции, обладающей требуемой активностью. Мутации, которые будут получены в ДНК, кодирующей вариант, не должны выводить последовательность из рамки считывания и предпочтительно не будут создавать комплементарные области, которые могут создавать вторичную структуру мРНК. EP 75444A.
Варианты ANGPTL4 необязательно получают сайт-специфичным мутагенезом нуклеотидов в ДНК, кодирующей нативный ANGPTL4, или способами фагового дисплея, получая таким образом ДНК, кодирующую вариант, и после этого экспрессируя ДНК в культуре рекомбинантных клеток.
В то время как сайт введения изменения аминокислотной последовательности определяют предварительно, мутация как таковая необязательно должна быть определена предварительно. Например, чтобы оптимизировать эффективность мутации в данном сайте, может быть проведен случайный мутагенез в кодоне-мишени или области-мишени и экспрессированные варианты ANGPTL4 подвергнуты скринингу в отношении оптимальной комбинации требуемой активности. Способы получения мутаций в виде замен в предварительно определяемых сайтах ДНК, имеющей известную последовательность, хорошо известны, например, такие как сайт-специфичный мутагенез. Получение вариантов ANGPTL4, описанных в данной публикации, можно осуществить с помощью способов фагового дисплея, таких как способы, описанные в публикации PCT WO 00/63380.
После отбора такого клона область мутантного белка может быть извлечена и помещена в соответствующий вектор для продукции белка, как правило, экспрессирующий вектор такого типа, который может быть использован для трансформации подходящего хозяина.
Делеции аминокислотной последовательности обычно находятся в пределах примерно от 1 до 30 остатков, необязательно от 1 до 10 остатков, необязательно от 1 до 5 или менее и обычно являются непрерывными.
Инсерции аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце от одного остатка до полипептидов по существу неограниченной длины, а также инсерции внутри последовательности одного или множества аминокислотных остатков. Инсерции внутри последовательности (т.е. инсерции в нативной последовательности ANGPTL4) могут быть в пределах, как правило, примерно от 1 до 10 остатков, необязательно от 1 до 5, или необязательно от 1 до 3. Пример концевой инсерции включает слияние сигнальной последовательности, либо гетерологичной, либо гомологичной по отношению к клетке-хозяину, с N-концом, чтобы облегчить секрецию из рекомбинантных хозяев.
Дополнительными вариантами ANGPTL4 являются такие варианты, в которых, по меньшей мере, один аминокислотный остаток в нативном ANGPTL4 был удален, а другой остаток встроен на его место. В одном варианте осуществления изобретения вариант ANGPTL4 содержит замену в положении 162 и/или 164 ANGPTL4 или замену в положении 169 mANGPTL4. Такие замены могут быть осуществлены в соответствии с заменами, показанными в таблице. Варианты ANGPTL4 также могут содержать неприродные аминокислоты, которые описаны в данной публикации.
Аминокислоты могут быть сгруппированы в соответствии со сходствами в свойствах их боковых цепей (в A. L. Lehninger, Biochemistry, second ed., pp.73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M)
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (C), Tyr (Y), Asn (N), Gln (Q)
(3) кислотные: Asp (D), Glu (E)
(4) основные: Lys (K), Arg (R), His (H)
Альтернативно встречающиеся в природе остатки могут быть разделены на группы на основе общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
«Встречающиеся в природе аминокислотные остатки» (т.е. аминокислотные остатки, кодируемые генетическим кодом) могут быть выбраны из группы, состоящей из аланина (Ala); аргинина (Arg); аспарагина (Asn); аспарагиновой кислоты (Asp); цистеина (Cys); глутамина (Gln); глутаминовой кислоты (Glu); глицина (Gly); гистидина (His); изолейцина (Ile); лейцина (Leu); лизина (Lys); метионина (Met); фенилаланина (Phe); пролина (Pro); серина (Ser); треонина (Thr); триптофана (Trp); тирозина (Tyr) и валина (Val). «Не встречающийся в природе аминокислотный остаток» относится к другому остатку, отличному от встречающихся в природе аминокислотных остатков, перечисленных выше, который способен ковалентно связывать соседний аминокислотный остаток(ки) в полипептидной цепи. Примеры не встречающихся в природе аминокислотных остатков включают, например, норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как остатки, описанные в Ellman et al. Meth. Enzym. 202:301-336 (1991), и публикации заявок на выдачу патентов США 2003/0108885 и 2003/0082575. Коротко, указанные способы включают активацию супрессорной тРНК не встречающимся в природе аминокислотным остатком с последующей транскрипцией и трансляцией РНК in vitro или in vivo. См., например, публикации заявок на выдачу патентов США 2003/0108885 и 2003/0082575; Noren et al. Science 244: 182 (1989); и Ellman et al., выше.
«Идентичность аминокислотных последовательностей в процентах (%)» в данном описании определяют как процентное содержание аминокислотных остатков в исследуемой последовательности, которые идентичны аминокислотным остаткам в выбранной последовательности после выравнивания последовательностей и введения при необходимости пробелов, чтобы достичь максимального процента идентичности последовательностей, и без учета каких-либо консервативных замен в качестве части идентичности последовательностей. Выравнивание в целях определения идентичности аминокислотных последовательностей в процентах можно осуществить различными способами, котор