Модуляторы рецепторов прогестерона
Иллюстрации
Показать всеНастоящее изобретение относится к стероидам с (11β)-[4-(аза-арил)фенильным] заместителем, модулирующим рецепторы прогестерона, или его фармацевтически приемлемой соли и/или гидратированной форме, и/или его пролекарству. Соединения проявляют смешанный профиль активности агониста PR и антагониста PR, что делает их пригодными для контрацепции и лечения гинекологических расстройств. 6 н. и 24 з.п. ф-лы, 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области контрацепции, гормонзамещающей терапии (HRT) и терапии гинекологических расстройств, а также к вспомогательной терапии при раке и других заболеваниях.
Рассматриваемое изобретение предусматривает новые стероиды, модулирующие рецепторы прогестерона, которые имеют как агонистические, так и антагонистические модулирующие активности по отношению к рецептору прогестерона, к способам их получения, и к их использованию при терапии.
Уровень техники
Внутриклеточные рецепторы представляют собой класс структурно родственных белков, вовлеченных в регуляцию транскрипции гена. Стероидные рецепторы представляют собой подмножество этих рецепторов, включающие в себя рецептор прогестеронов (PR), рецептор андрогенов (AR), рецептор эстрогенов (ER), рецептор глюкокортикоидов (GR) и рецептор минералокортикоидов (MR). Регуляция гена требует внутриклеточного рецептора и соответствующего лиганда, который обладает способностью к селективному связыванию с рецептором таким способом, который влияет на транскрипцию гена.
Модуляторы рецепторов прогестерона (прогестагены и антипрогестагены), как известно, играют важную роль в здоровье женщин. Природный лиганд PR представляет собой стероидный гормон прогестерон, но получены синтетические соединения, которые также могут служить в качестве лигандов (см., например, Jones et al. патент США №5688810).
В настоящее время прогестагены широко используются для гормональной контрацепции и при HRT. Другие важные клинические применения прогестагенов представляют собой лечение гинекологических расстройств (например, эндометриоза, дисменореи, дисфункционального маточного кровотечения, острого предменструального синдрома), рака груди, «приливов» и аффективных расстройств, и прогестероновую поддержку во время IVF (при экстракорпоральном оплодотворении). В дополнение к этому они применяются в сочетании с другими гормонами и/или другими видами терапии, включая, но, не ограничиваясь этим, химиотерапевтические агенты, такие как цитотоксические и цитостатические агенты, иммунологические модификаторы, такие как интерфероны и интерлейкины, гормоны роста или другие цитокины, гормональную терапию, при хирургии и радиационной терапии.
Современные стероидные прогестагены, как показано, являются совершенно безопасными и хорошо переносятся. Иногда, однако, сообщается о побочных воздействиях (например, о повышенной чувствительности груди, головных болях, депрессии и увеличении веса), связанных с этими стероидными прогестагенами, которые используют индивидуально, либо в сочетании с эстрогенными соединениями. В дополнение к этому стероидные лиганды для одного рецептора часто демонстрируют перекрестную реакционную способность с другими стероидными рецепторами. Множество прогестагенов также связываются, например, с рецептором андрогенов, в то время как многие антипрогестагены имеют сродство к рецептору глюкокортикоидов.
Антипрогестагены в сочетании с прогестагенами являются также пригодными для использования в режимах контрацепции и замещения гормонов, как описано, например, в международных заявках WO 99/25360 и WO 97/49407. По этой причине было бы полезным обнаружение соединений, которые имеют как прогестагенные, так и антипрогестагенные свойства в одной молекуле.
Международная заявка WO 99/45022 описывает 20-кето-11β-арилстероиды, которые имеют либо антагонистическую, либо агонистическую активность по отношению к рецепторам прогестерона. Среди множества соединений, описанных в международной заявке WO 99/45022, три или четыре соединения имеют активность как антагониста, так и агониста прогестерона. Ни одно из этих соединений не имеет заместителя в положении 16; в положении 17α они имеют ацетилокси, ацетилоксиметильный или метоксиметильный заместитель.
Соединения, описанные в EP 349481, содержат 4-[(3-пиридил)фенильный] заместитель в положении 11(и не имеют заместителя в положении 16; ни одно из этих соединений не обладает циклопропилкарбонильным или циклопропенилкарбонильным заместителем в положении 17, или спироциклоалканоновым или спироциклоалкеноновым заместителем в положении 17. Соединения EP 349481 имеют только антипрогестагенные свойства.
В настоящем изобретении неожиданно обнаружено, что новые стероидные соединения с (11β)-[4-(аза-арил)фенильным] заместителем, в сочетании с разнообразными заместителями в положениях 16 и 17, демонстрируют смешанный профиль активности агониста PR и антагониста PR (далее упоминаемый как смешанный P/AP профиль) в одном соединении. Эти соединения являются особенно пригодными для контрацепции, HRT и при лечении гинекологических расстройств.
Cook et al., (Life Sciences 52 (1993), 155-162) описывают возможность того, что стероид, который имеет антипрогестагенный профиль, с ацетилокси-заместителем в положении 17α, может быть превращен в соединение со смешанным профилем, если убрать этот заместитель, в то время как введение заместителя в положение 16α превращает соединение в полный агонист. Неожиданно оказалось, что это не относится к новым соединениям, описанным в рассматриваемом изобретении, которые имеют однородные смешанные профили при различных сочетаниях (включая водород) заместителей в положениях 16α и 17α.
Подробное описание изобретения
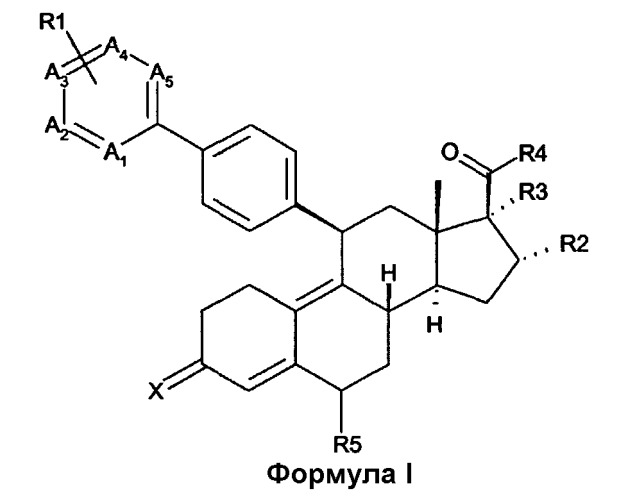
Объектом настоящего изобретения является соединение структурной формулы I
где
X представляет собой O, NOH, NO(1-4C)алкил, NO(1-4C)ацил;
A1-A5 представляют собой C, замещенный R1, или N, при условии, что, по меньшей мере, один, но не более чем три из A1-A5 представляют собой N; или
один или два из A1, A2 и A5 представляют собой N, а остальные представляют собой C, замещенный R1, и A3 и A4 вместе представляют собой конденсированное бензольное кольцо или конденсированное пяти- или шестичленное азотсодержащее ароматическое кольцо, оба необязательно являются замещенными одним или несколькими атомами галогенов и/или (1-4C)алкилом;
каждый R1 независимо выбирается из H, галогена, (1-4C)алкила и (1-4C)алкокси; R2 представляет собой H, (1-4C)алкил или (1-6C)алкенил, оба необязательно являются замещенными (6-10C)арильной группой, которая является необязательно замещенной одним или несколькими атомами галогенов и/или (1-4C)алкилом; и R3 представляет собой H или (1-4C)алкил, необязательно замещенный одним или несколькими атомами галогенов; и
R4 представляет собой циклопропил или циклопропенил, оба необязательно являются замещенными одним или несколькими атомами галогенов и/или (1-4C)алкилом; или
R2 вместе с R3 образуют 3-, 4-, 5- или 6-членное карбоциклическое кольцо; и
R4 представляет собой циклопропил или циклопропенил, оба необязательно являются замещенными одним или несколькими атомами галогенов и/или (1-4C)алкилом; или
R2 представляет собой H или (1-4C)алкил; и
R3 вместе с R4 образуют 5-, 6- или 7-членное насыщенное или ненасыщенное карбоциклическое кольцо;
R5 представляет собой H или(1-4C)алкил;
или его фармацевтически приемлемую соль и/или гидратированную форму, и/или его пролекарство.
В одном из вариантов осуществления A1-A5 представляют собой C, замещенный R1, или N, при условии, что, по меньшей мере, один, но не более чем три из A1-A5 представляют собой N.
В другом варианте осуществления один или два из A1, A2 и A5 представляют собой N, а остальные представляют собой C, замещенный R1, и A3 и A4 вместе представляют собой конденсированное бензольное кольцо или конденсированное азотсодержащее кольцо, оба необязательно являются замещенными атомом галогена и/или (1-4C)алкилом.
В одном из вариантов осуществления R2 представляет собой H, (1-4C)алкил или (1-6C)алкенил, оба необязательно являются замещенными (6-10C)арильной группой, которая является необязательно замещенной одним или несколькими атомами галогенов и/или (1-4C)алкилом; и R3 представляет собой H или (1-4C)алкил, необязательно замещенный одним или несколькими атомами галогенов; и R4 представляет собой циклопропил или циклопропенил, оба необязательно являются замещенными одним или несколькими атомами галогенов и/или (1-4C)алкилом.
В другом варианте осуществления R2 вместе с R3 образуют 3-, 4-, 5- или 6-членное карбоциклическое кольцо; и R4 представляет собой циклопропил или циклопропенил, оба необязательно являются замещенными одним или несколькими атомами галогенов и/или (1-4C)алкилом.
Еще в одном варианте осуществления R2 представляет собой H или (1-4C)алкил; и R3 вместе с R4 образуют 5-, 6-или 7-членное насыщенное или ненасыщенное карбоциклическое кольцо.
В конкретном варианте осуществления X представляет собой O.
В другом конкретном варианте осуществления R4 представляет собой циклопропил.
Еще в одном конкретном варианте осуществления A1, A3, A4 и A5 представляют собой C, замещенный R1, и A2 представляет собой N.
В одном из вариантов осуществления R2 представляет собой H, (1-4C)алкил или (1-4C)алкенил.
В конкретном варианте осуществления X представляет собой O, A1, A3, A4 и A5 представляют собой C, замещенный R1, и A2 представляет собой N; R2 представляет собой H, (1-4C)алкил или (1-4C)алкенил; и R3 представляет собой H или (1-4C)алкил, необязательно замещенный одним или несколькими атомами галогенов; и R4 представляет собой циклопропил; или
R2 вместе с R3 образуют 3-, 4-, 5- или 6-членное карбоциклическое кольцо; и
R4 представляет собой циклопропил.
В отдельном варианте осуществления X представляет собой O, A1, A3, A4 и A5 представляют собой C; A2 представляет собой N; R1 представляет собой H; R2 представляет собой метил; R3 представляет собой H; R4 представляет собой циклопропил; и R5 представляет собой H.
В другом отдельном варианте осуществления X представляет собой O, A1, A3, A4 и A5 представляют собой C; A2 представляет собой N; R1 представляет собой H; R2 представляет собой этенил; R3 представляет собой H; R4 представляет собой циклопропил; и R5 представляет собой H.
Соединения рассматриваемого изобретения предназначены для использования в терапии.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение согласно изобретению и фармацевтически приемлемый носитель. В одном из вариантов осуществления фармацевтическая композиция предназначена для контрацепции. В другом варианте осуществления фармацевтическая композиция предназначена для гормон-замещающей терапии. Еще в одном варианте осуществления фармацевтическая композиция предназначена для лечения гинекологического расстройства.
Рассматриваемое изобретение, кроме того, относится к применению соединения согласно изобретению для получения лекарственного средства. В одном из вариантов осуществления применение соединения согласно изобретению предусматривает получение контрацептива. В другом варианте осуществления применение соединения согласно изобретению предусматривает получение лекарственного средства для гормон-замещающей терапии или для лечения гинекологического расстройства.
Объектом настоящего изобретения, кроме того, является способ контрацепции, включающий в себя введение фармацевтически эффективного количества соединения по рассматриваемому изобретению субъекту, нуждающемуся в этом.
Объектом настоящего изобретения, кроме того, является способ лечения гинекологического расстройства, включающий в себя введение фармацевтически эффективного количества соединения согласно изобретению субъекту, нуждающемуся в этом.
Соединения формулы I, где X представляет собой NOH, NO(алкил) или NO(ацил), получают из соединения формулы I, где X представляет собой O, посредством обработки H2NOH, H2NO(алкилом) или H2NO(ацилом), или солями этих аминов.
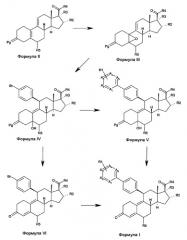
Как изображено на схеме 1, соединения формулы I, где X представляет собой O (формула I на схеме 1), получают из соединений формулы II. На этой схеме Pg представляет собой соответствующую защитную группу карбонильной функциональной группы в положении 3 стероидов. Несколько защитных групп, известных в данной области, описываются в "Protective Groups In Organic Synthesis" by Greene T.W. and Wuts P.G.M. (John Wiley & Sons, New York). Соответствующие типы защитных групп представляют собой кетали, в частности, циклические кетали, такие как 1,3-диоксоланы, являются пригодными для использования. Карбонильная группа в положении 17 стероида используется как таковая, в этой последовательности реакций, или маскируется в форме синтетического эквивалента, такого как гидроксиметильная группа (которая позже при синтезе окисляется обратно до карбонила). Другая возможность представляет собой защиту карбонила посредством защитной группы, такой как кеталь.
Соединения формулы II окисляются до эпоксида формулы III с использованием различных способов, известных в данной области, таких как обработка с помощью перекиси водорода в присутствии трифторацетофенона. Обработка такого эпоксида с помощью бромида (4-бромфенил)магния в присутствии соответствующей соли Cu(I), такой как хлорид меди(I), дает соединения формулы IV. Соединения формулы IV преобразуются в соединения формулы V с использованием реакций перекрестного связывания, опосредуемых палладием, таких как реакции Сузуки, Штиле или Негиши. Удаление защитной группы соединений формулы V с использованием способов, известных в данной области, таких как, в случае кеталей, водный раствор кислоты, дает соединения формулы I. Такие способы снятия защиты могут применяться к соединениям формулы IV, с получением соединений формулы VI. Последние соединения могут преобразовываться в соединения формулы I с использованием реакций перекрестного связывания, опосредуемых палладием.
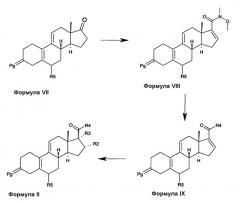
Соединения формулы II, в которых R4 представляет собой циклопропил или циклопропенил, получают из соединений формулы VII, как изображено на схеме 2. Соединения формулы VII описаны в литературе (например, van den Heuvel, M.J. and Groen, M.B. Rec. Trav. Chim. Pays-Bas, 112, 107 (1993), EP289073, EP277676, DE3617883, EP549041, EP 582338). Соединения формулы VII преобразуются в енолтрифлаты с использованием основания и трифлатирующего реагента. Пример пригодного для использования сочетания реагентов представляет собой литий гексаметилдисилазан, в качестве основания, с последующим добавлением N-фенил-бис(трифторметансульфонимида), в качестве трифлатирующего агента. Полученные енолтрифлаты преобразуются в соединения формулы VIII, с использованием опосредуемого палладием карбонилирования в присутствии N,O-диметилгидроксиламина. Обработка соединений формулы VIII циклопропилом - реагентом Гриньяра, циклопропиллитиатом, циклопропенилом - реагентом Гриньяра, или циклопропениллитиатом, дает соединения формулы IX. Обработка последних соединений с помощью соединения R2-литиата или R2-реагента Гриньяра в присутствии соответствующей соли Cu(I), с последующим гашением водой, дает соединения формулы II, где R3 представляет собой H; альтернативно, гашение алкилирующим реагентом, таким как метилйодид, или что-либо подобное, дает соединения формулы II, где R3 представляет собой алкил.
Соединения формулы II, где R3 вместе с R4 образуют 5-членное карбоциклическое кольцо, могут быть получены с использованием способа, описанного в патенте США №5084450. Как правило, соединения формулы II, где R3 вместе с R4 образуют 5-, 6-или 7-членное карбоциклическое кольцо, могут быть получены из соединений формулы VII, с использованием способа, описанного Mash, E.A. et al. в J. Org. Chem. 55, 2045 (1990). В этой публикации способ применяется для преобразования кетона в 6-членное спиросоединение. Этот способ может быть распространен на 5- или 7-членные спиросоединения посредством использования простого 4-йодбутил трет-бутилдиметилсилилового эфира или простого 6-йодгексил трет-бутилдиметилсилилового эфира вместо простого 5-йодпентил трет-бутилдиметилсилилового эфира, применяемого в публикации для получения 6-членного спиросоединения.
Схема 1
Схема 2
Соединение в соответствии с настоящим изобретением представляет собой соединение, как определено выше, в формуле I, его соль, его гидрат и/или его пролекарство.
В тех случаях, когда соединение по настоящему изобретению содержит атом азота соответствующей основности, соединение может использоваться в виде свободного основания или в виде фармацевтически приемлемой соли.
Термин фармацевтически приемлемая соль представляет собой такие соли, которые являются, в рамках медицинского суждения, пригодными для использования в контакте с тканями человека и/или животных без излишней токсичности, раздражения, аллергической реакции и тому подобного, и являются совместимыми с разумным отношением выгода/риск. Фармацевтически приемлемые соли хорошо известны в данной области.
Они могут быть получены во время конечного выделения и очистки соединений по настоящему изобретению, или отдельно, посредством взаимодействия функциональной группы свободного основания с соответствующей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой, например, как аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное.
Пролекарства представляют собой соединения, которые быстро преобразуются in vivo в исходное соединение указанной выше формулы, например, посредством гидролиза в желудке и/или в крови, метаболизма в печени или других процессов, известных специалисту в данной области. Например, специалисты в данной области обнаружат, что соединения формулы I, где X представляет собой H2, как можно ожидать, должны метаболизироваться до аналогичных соединений, где X представляет собой O, которые демонстрируют активность in vitro, даже если пролекарства, где X представляет собой H2, не проявляет ее.
Термины, используемые при определении соединений по настоящему изобретению в соответствии с формулой I, имеют следующие значения:
- (1-4C)алкил представляет собой разветвленную или неразветвленную алкильную группу, имеющую 1-4 атома углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил или трет-бутил;
- (1-4C)алкокси обозначает (1-4C)алкилокси, где (1-4C)алкил имеет такое же значение, как определено выше;
- (1-6C)алкенил представляет собой разветвленную или неразветвленную алкенильную группу, имеющую 1-6 атомов углерода, такую как этенил, 1-метилэтенил, 2-пропенил, 2-бутенил, и тому подобное;
- (6-10)арил представляет собой карбоциклическую ароматическую группу, имеющую 6-10 атомов углерода, такую как фенил, 1-нафтил или 2-нафтил;
- (1-4C)ацил представляет собой алкилкарбонильную группу, имеющую 1-4 атома углерода, такую как формил, ацетил или пропионил;
- аза-арил обозначает моноциклическую или бициклическую ароматическую кольцевую систему, в которой, по меньшей мере, одно из колец содержит, по меньшей мере, один атом азота в кольце. Примеры включают в себя, но не ограничиваясь этим, пиридил, пирмидинил, хинолинил, нафтиридил и тому подобное;
- карбоциклический, когда рассматривается в контексте кольца, означает, что все атомы, составляющие кольцо, представляют собой атомы углерода;
- спироциклоалкан представляет собой заместитель, состоящий из алкандиильной группы, у которой два конечных атома присоединены к одному и тому же атому (углероду), таким образом, образуя систему спирокольца;
- спироциклоалкен представляет собой заместитель, состоящий из алкендиильной группы, у которой два конечных атома присоединены к одному и тому же атому (углероду), таким образом, образуя систему спирокольца;
- приставки (1-4C), (2-4C) и тому подобное имеют обычное значение, ограничивая значение указанной группы до таких групп с 1-4, 2-4, и тому подобное, атомами углерода;
- галоген относится к фтору, хлору, брому и йоду;
- спироциклоалканон представляет собой спироциклоалкановое кольцо, где один из атомов углерода образует карбонильную группу;
- спироциклоалкенон представляет собой спироциклоалкеновое кольцо, где один из атомов углерода образует карбонильную группу.
Сродство и эффективность к рецепторам соединений прогестагенов в соответствии с настоящим изобретением делает их пригодными для использования при контроле фертильности и воспроизводства, например, при контрацепции женщин, и, кроме того, для HRT женщин, лечения гинекологических расстройств, в качестве компонентов мужской контрацепции и в методах диагностики, концентрирующихся на количестве и/или расположении рецепторов прогестерона в различных тканях. Для последней цели может быть предпочтительным получение изотопно-меченных вариантов соединений в соответствии с настоящим изобретением.
Соединения по настоящему изобретению могут, кроме того, быть полезны для использования при лечении эндометриоза, менорагии, менометрорагии, дисменореи, прыщей, фиброидов, остеопороза, а также других нарушений костей, восстановления костей после переломов, саркопении, дряхлости, старения кожи, женской сексуальной дисфункции, постменапаузальных симптомов, атеросклероза, апластической анемии, липодистрофии, побочных воздействий химиотерапии, опухолей (расположенных, например, в груди, яичниках или матке) и других.
Соединения по настоящему изобретению могут вводиться в сочетании с эстрогенами, андрогенами, прогестагенами, антипрогестагенами и другими соответствующими соединениями, такими как фолиевая кислота, витамины, минералы, и тому подобное.
Способы определения связывания рецепторов, а также анализы in vitro и in vivo для определения биологической активности соединений, хорошо известны. Как правило, экспрессированный рецептор (или его функциональная часть) обрабатывается соединением по настоящему изобретению, и измеряется связывание, или стимулирование, или ингибирование функциональной реакции.
Для измерения функциональной реакции, выделенная ДНК, кодирующая ген рецептора прогестерона, предпочтительно, рецептора человека, экспрессируется в соответствующие клетки-хозяева. Такая клетка может представлять собой клетку яичника китайского хомячка (CHO), но и другие клетки также являются пригодными для использования. Предпочтительно, клетки берутся у млекопитающих. Способы конструирования рекомбинантных линий клеток, экспрессирующих рецептор прогестерона, хорошо известны в данной области (Sambrook et al.., Molecular Cloning: а Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, последнее издание). Экспрессия рецептора поддерживается посредством экспрессии ДНК, кодирующей желаемый белок.
Методики сайт-ориентированного мутагенеза, лигирования дополнительных последовательностей, PCR и конструирование соответствующих систем экспрессии, все являются на сегодняшний день хорошо известными в данной области. Части ДНК, кодирующие желаемый белок, или вся она, может конструироваться синтетически с использованием стандартных твердофазных методик, предпочтительно, для включения сайтов рестрикции, для простоты лигирования. Соответствующие элементы контроля транскрипции и трансляции включенной кодирующей последовательности могут обеспечиваться посредством кодирующих последовательностей ДНК. Как хорошо известно, в настоящее время доступны системы экспрессии, которые являются совместимыми с большим разнообразием хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, клетки растений, клетки насекомых, клетки млекопитающих, клетки птиц и тому подобное.
Клетки, экспрессирующие рецептор, затем приводятся в контакт с соединением по настоящему изобретению для наблюдения связывания или стимулирования или ингибирования функциональной реакции.
Альтернативно, выделенный цитозоль, содержащий экспрессированный рецептор, может использоваться для измерения связывания соединения по настоящему изобретению.
Для измерения связывания могут использоваться радиоактивно- или флуоресцентно-меченное соединение. В качестве соединения сравнения могут использоваться нативный гормон или другие соединения, связывающие рецептор. В качестве альтернативы также может использоваться анализ конкурентного связывания. Другой анализ включает в себя скрининг соединений по настоящему изобретению, смешанных агонистов/антагонистов рецептора прогестерона, посредством определения регуляции медиируемого рецептором природного целевого гена мРНК, то есть генов, регулируемых посредством рецептора, путем связывания рецептора в промоторной области гена. Уровни мРНК целевого гена будут уменьшаться или увеличиваться, в зависимости от ингибиторного или стимулирующего воздействия соединения по настоящему изобретению при связывании рецептора.
В дополнение к прямому измерению уровней мРНК в экспонированных клетках, могут использоваться клетки, которые, в дополнение к трансфекции ДНК, кодирующей рецептор, трансфицируются также второй ДНК, кодирующей репортерный ген, экспрессия которого реагирует на связывания рецептора по отношению к чувствительным элементам в промоторе конкретного репортерного гена. Такие чувствительные элементы могут представлять собой классические гормон-чувствительные элементы, хорошо известные в данной области и описанные, например, в Beato, M, Chalepakis, G, Schauer, M, Slater, EP J. Steroid Biochem. 5 (1989) 737-47, или могут конструироваться таким образом, что они связаны с новыми чувствительными элементами. Как правило, экспрессия репортерного гена может контролироваться посредством любого чувствительного элемента, реагирующего на связывание рецептора прогестерона. Пригодные для использования репортерные гены представляют собой, например, LacZ, щелочную фосфатазу, люциферазу светлячков и зеленый флуоресцентный белок.
Для выбора соединений по рассматриваемому изобретению со смешанным модулирующим воздействием на рецептор прогестерона, исследование в агонистическом режиме должно приводить к собственной активности в пределах примерно между 15% и примерно 85% от максимальной активности, когда (16α)-16-этил-21-гидрокси-19-норпрегн-4-ен-3,20-дион используется в качестве сравнения. Кроме того, эта максимальная агонистическая активность должна достигаться при концентрации 10-6 или менее, а предпочтительно при концентрации 10-8 или менее.
В антагонистическом режиме исследование должно приводить к собственной активности в пределах примерно между 85% и примерно 15% от максимальной активности, когда в качестве сравнения используется (6β,11β,17β)-11-[4-(диметиламино)фенил]-4',5'-дигидро-6-метилспиро[эстра-4,9-диен-17,2'(3'H)-фуран]-3-он.
Дополнительный критерий представляет собой значение IC50, которое должно быть<10-6 M, предпочтительно<10-8 M. Специалистам в данной области будет понятно, что соединения по настоящему изобретению со смешанным профилем P/AP понимаются как имеющие профиль в пределах от сочетания минимальной собственной агонистической активности примерно от 15% и максимальной собственной антагонистической активности примерно 85% до сочетания максимальной собственной агонистической активности примерно 85% и минимальной собственной антагонистической активности примерно 15%. Специалисты в данной области также заметят, что из-за биологической вариации при анализе не всегда является необходимым случай, когда собственная агонистическая активность и собственная антагонистическая активность доходят точно до 100%.
Кроме того, специалист в данной области заметит, что желаемые значения EC50 и IC50 зависят от соединения по настоящему изобретению, которое исследуется. Например, соединение с EC50, которая меньше, чем 10-6 M, как правило, рассматривается как кандидат для выбора лекарственного средства. Предпочтительно, это значение меньше, чем 10-8 M. Однако соединение, которое имеет более высокие EC50 и/или IC50, но имеет соответствующую селективность (или сочетание агонистической и антагонистической селективности) по отношению к конкретному рецептору, по-прежнему может являться кандидатом для выбора лекарственного средства.
В основном любой анализ трансактивирования на клетках млекопитающих (на линии клеток или на первичной культуре), который может давать информацию о возможном активировании рецептора, может использоваться для целей выбора сильнодействующих и пригодных для использования лигандов. Дополнительная ценность использования нескольких систем клеток, с клетками, которые происходят от различных органов, будет заключаться в том, что получается информация о потенциальной специфичности лигандов к тканям. Без ограничения, примеры клеток, часто используемых для этой цели, представляют собой, наряду с клетками CHO, например, клетки T47D, клетки MCF7, клетки ECC-1, клетки HeLa, первичные культуры эндометриальных клеток и питуитарные клетки.
Соответствующие способы введения для соединений по рассматриваемому изобретению (называемые также активным ингредиентом) представляют собой пероральное, ректальное, назальное, местное (включая трансдермальное, буккальное и сублингвальное), вагинальное или парентеральное (включая подкожное, внутримышечное, внутривенное и чрескожное) введение или введение посредством импланта. В конкретном варианте осуществления соединения могут вводиться перорально. Конкретная доза и режим введения активного ингредиента или его фармацевтической композиции обязательно будут зависеть от терапевтического воздействия, которое должно достигаться (например, при контрацепции, HRT, эндометриозе), и может изменяться вместе с конкретным соединением, способом введения и возрастом и состоянием индивидуального субъекта, которому должно вводиться лекарственное средство.
Как правило, парентеральное введение требует более низких дозировок, чем другие способы введения, которые сильнее зависят от поглощения. Однако дозировка для людей желательно составляет 0,0001-25 мг на кг массы тела. Желаемая доза может быть представлена как одна доза или множество суб-доз, вводимых в соответствующих интервалах в течение дня, или, в случае пациентов женского пола, в виде доз, которые должны вводиться при соответствующих (дневных) интервалах в течение менструального цикла.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение в соответствии с формулой I, в смеси с фармацевтически приемлемыми вспомогательными веществами и, необязательно, с другими терапевтическими агентами. Вспомогательные вещества должны быть "приемлемыми" в смысле совместимости с другими ингредиентами композиции и не быть вредными для тех, кто их принимает.
Фармацевтические композиции включают в себя композиции, пригодные для перорального, ректального, назального, местного (включая трансдермальное, буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и чрескожное) введения или введение посредством импланта. Композиции могут быть получены с помощью способов, известных в области фармации, например, с использованием таких способов, как те, которые описаны в Gennaro et al., Remington's Pharmaceutical Sciences (18th ed, Mack Publishing company, 1990, см., в частности, Part 8: Pharmaceutical Preparations and Their Manufacture).
Такие способы включают в себя стадию объединения активного ингредиента с любым вспомогательным агентом. Вспомогательный агент (агенты), называемый также вспомогательным ингредиентом (ингредиентами), включает в себя агенты, обычные в данной области (Gennaro, выше), такие как носители, наполнители, связующие вещества, разбавители, разрыхлители, смазочные материалы, красители, ароматизирующие агенты, антиоксиданты и смачивающие агенты.
Фармацевтические композиции, пригодные для перорального введения, могут быть представлены как отдельные единичные дозированные формы, такие как пилюли, таблетки, драже или капсулы, или в виде порошка или гранул, или в виде раствора или суспензии. Активный ингредиент может также быть представлен в виде болюса или пасты. Композиции могут быть, кроме того, переработаны в суппозитории или клизмы для ректального введения.
Кроме того, настоящее изобретение включает в себя фармацевтическую композицию, как описано выше, в сочетании с упаковочным материалом, включая инструкции по использованию композиции, для ее использования, как описано выше.
Для парентерального введения пригодные для использования композиции включают в себя водную и неводную стерильную инъекцию. Композиции могут быть представлены в однодозовых или многодозовых контейнерах, например, в герметичных флаконах и ампулах, и могут храниться в полученном сушкой замораживанием (лиофилизированным) состоянии, требующим только добавления стерильного жидкого носителя, например воды, перед использованием. Композиции или препараты, пригодные для введения посредством назальной ингаляции, включают в себя мелкодисперсные пыли или туманы, которые могут генерироваться посредством аэрозолей высокого давления с отмеряемой дозой, небулизаторов или инсуфляторов.
Соединения по настоящему изобретению могут также вводиться в форме устройств, состоящих из сердцевины из активного материала, окруженной мембраной, регулирующей скорость высвобождения. Такие импланты могут применяться подкожно или локально и будут высвобождать активный ингредиент приблизительно с постоянной скоростью в течение относительно больших периодов времени, например, от недель до лет. Способы получения имплантируемых фармацевтических устройств как таковых известны в данной области, например, как описано в EP 303306.
Соединения по настоящему изобретению могут также вводиться в форме вагинального кольца, такого, как описано, например, в EP 876815.
Соединения по настоящему изобретению могут быть получены посредством различных способов, известных в области органической химии в целом. Более конкретно, могут использоваться способы синтеза, как иллюстрируется в предыдущих и следующих далее схемах и примерах. В схемах и примерах используются следующие сокращения:
ТГФ: тетрагидрофуран
ДМФ: N,N-диметилформамид
NaHCO3: бикарбонат натрия
NH4Cl: хлорид аммония
Na2S2O3: тиосульфат натрия
SiO2: двуокись кремния (силикагель)
Na2SO4: сульфат натрия
MgSO4: сульфат магния
ЖХ-МС: жидкостная хроматография/масс-спектрометрия
ВЭЖХ: высокоэффективная жидкостная хроматография
ЯМР: ядерный магнитный резонанс
M: молярный
В дальнейшем настоящее изобретение описывается в следующих далее примерах, которые ни в коем случае не предназначены для ограничения рамок настоящего изобретения в соответствии с формулой изобретения.
Примеры
Пример 1
Получение (11β,16α,17β)-17-циклопропилкарбонил-16-метил-11-[4-(3-пиридинил)фенил]эстра-4,9-диен-3-она
a. Циклический 1,2-этандиилацеталь 17-[[(трифторметил)сульфонил]окси]эстра-5(10),9(11),16-триен-3-она
Литий гексаметилдисилазан (1M в ТГФ, 478 мл, 478 ммоль) добавляют к ТГФ (1 л) и охлаждают до -40°C в атмосфере азота. Раствор циклического 3-(1,2-этандиилацеталя) эстра-5(10),9(11)-диен-3,17-диона (50 г, 159 ммоль) в сухом ТГФ (500 мл) добавляют по каплям, в то время как температуру реакции медленно увеличивают до -15°C. После перемешивания в течение 30 минут при -15°C добавляют в виде загрузки N-фенил-бис(трифторметансульфонимид) (62,5 г, 175 ммоль) и реакционную смесь перемешивают в течение 3 часов при 0°C. Насыщенный водный раствор NaHCO3 добавляют по каплям (экзотермически), а затем воду. Органический слой отделяют и водный слой экстрагируют три раза этилацетатом. Объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4) и выпаривают досуха. Сырой продукт очищают с помощью колоночной хроматографии (SiO2, гептан/этилацетат, 4/1), с получением циклического 1,2-этандиилацеталя 17-[[(трифторметил)сульфонил]окси]эстра-5(10),9(11),16-триен-3-она (90,1 г, 159 ммоль, выход 100%, по-прежнему содержит некоторое количество растворителя). 1H ЯМР (400 МГц, CDCl3): (0,91 (с, 3H), 1,20-2,55 (м, 16H), 3,98 (с, 4H), 5,52 (м, 1H), 5,59 (м, 1H).
b. N-метокси-N-метил-3,3-[1,2-этандиилбис(окси)]оксо-эстра-5(10),9(11),16-триен-17-карбоксамид
Триэтиламин (221 мл, 1,59 моль), трифенилфосфин (6,67 г, 25 ммоль) и N,O-диметилгидроксиламин·HCl (82,2 г, 843 ммоль) добавляют к раствору циклического 1,2-этандиилацеталя 17-[[(трифторметил)сульфонил]окси]эстра-5(1