Производные 4-(сульфанилпиримидин-4-илметил)морфолина в качестве лигандов gaba-рецептора для лечения тревожности, депрессии и эпилепсии
Иллюстрации
Показать всеНастоящее изобретение относится к соединению формулы I
в которой Х представляет собой -S- или -NH-; R1 представляет собой С1-12алкил, С1-12алкенил, фенилС1-12алкил, фенилС2-12алкенил или фенил-O-C1-12алкил и где указанные фенильные группы являются необязательно замещенными одним или двумя заместителями, выбранными из группы, состоящей из низшего С1-7алкила, C1-7алкокси и галогенС1-7алкила; R2 представляет собой водород, низший С1-7алкил или С3-6циклоалкил; R3/R4 вместе с N-атомом, к которому они присоединены, образуют неароматическую 5-, 6-членную гетероциклическую кольцевую систему, которая необязательно содержит в дополнение к N-атому один дополнительный гетероатом, выбранный из группы, состоящей из О или N, и где кольцевая система является необязательно замещенной группой низший С1-7алкил, низший С1-7алкокси, -NR2, -CONR2; или R3/R4 вместе с N-атомом, к которому они присоединены, могут образовывать гетероциклическую кольцевую систему, которая содержит по меньшей мере два кольца и которая необязательно содержит один или два дополнительных гетероатома, выбранных из группы, состоящей из N и О; R представляет собой водород или низший С1-7алкил; R5 представляет собой водород или низший С1-7алкил; или фармацевтически приемлемым аддитивным солям с кислотой этого соединения. Изобретение также относится к лекарственному средству. 2 н. и 14 з.п. ф-лы, 3 табл.
Реферат
Настоящее изобретение относится к соединениям формулы
где
Х представляет собой -S- или -NH-;
R1 представляет собой алкил, алкенил, арилалкил, арилалкенил или арил-O-алкил, где указанные арильные группы являются необязательно замещенными одним или более заместителем, выбранным из группы, состоящей из низшего алкила, низшего алкокси, галогена или низшего галогеналкила;
R2 представляет собой водород, низший алкил или циклоалкил;
R3/R4 вместе с N-атомом, к которому они присоединены, образуют неароматическую 5-, 6- или 7-членную кольцевую систему, которая необязательно содержит в дополнение к N-атому один дополнительный гетероатом, выбранный из группы, состоящей из О, S и N, и где кольцевая система является необязательно замещенной группой гидрокси, низший алкил, низший алкокси, -NR2, -CONR2, -СО - низший алкил или бензил; или R3/R4 вместе с N-атомом, к которому они присоединены, образует гетероциклическую кольцевую систему, которая содержит по меньшей мере два кольца, необязательно содержащих один или два дополнительных гетероатома, выбранных из группы, состоящей из N и О;
R5 представляет собой водород или низший алкил;
R представляет собой водород или низший алкил;
и к их фармацевтически приемлемым аддитивным солям с кислотами (солям - продуктам присоединения кислоты).
Соединения формулы I и их соли обладают ценными фармацевтическими свойствами. Было обнаружено, что эти соединения обладают активностью в отношении рецепторов GABAB.
γ-Аминомасляная кислота (GABA - сокр. от англ. γ-aminobutyric acid), наиболее распространенный ингибирующий нейротрансмиттер, активирует как ионотропные рецепторы GАВАA/C, так и метаботропные рецепторы GАВАB (Hill, Bowery, Nature, 290, 149-152, 1981). GАВАB-рецепторы, которые присутствуют во многих областях головного мозга млекопитающих на пресинаптических окончаниях и постсинаптических нейронах, участвуют в процессе тонкой настройки ингибирующей синаптической трансмиссии. Пресинаптические GАВАB-рецепторы посредством модулирования активируемых при высоком потенциале Са2+ каналов (P/Q- и N-типа) ингибируют высвобождение многих нейротрансмиттеров. Постсинаптические GАВАB-рецепторы активируют сопряженные с G-белком каналы, впускающие ионы K+(GIRK), и регулируют аденилилциклазу (Bilhnton et al., Trends Neurosci., 24, 277-282, 2001; Bowery et al., Pharmacol. Rev.54, 247-264, 2002). Поскольку GABAB-рецепторы со стратегической точки зрения расположены таким образом, чтобы модулировать активность различных нейротрансмиттерных систем, лиганды GABAA-рецептора могут найти возможное применение в качестве лекарственных средств для лечения тревожности, депрессии, эпилепсии, шизофрении и когнитивных нарушений и расстройств (Vacher, Bettler, Curr. Drug Target, CNS Neurol. Disord. 2, 248-259, 2003; Bettler et al., Physiol Rev. 84, 835-867, 2004).
Нативные GАВАB-рецепторы представляют собой гетеромерные структуры, состоящие из двух типов субъединиц, а именно из субъединиц GABABR1 и GАВАBR2 (Kaupmann et al., Nature, 386, 239-246, 1997; Nature, 396, 683-687, 1998). Структура GABAeR1 и R2 свидетельствует о том, что они относятся к семейству рецепторов, сопряженных G-белком (GPCR - сокр. от англ. G-protein coupled receptor - рецептор, сопряженный с G-белком), называемому третьим семейством. Другие члены третьего семейства рецепторов, сопряженных с G-белком, включают метаботропные глутаматные (mGlu1-8), кальций-чувствительные рецепторы сошниково-носового (якобсонова органа), рецепторы феромонов и предполагаемые рецепторы вкусовых веществ (Pin et al., Pharmaco. Ther. 98, 325-354, 2003). Третье семейство рецепторов (включая GABAB-рецепторы) характеризуется наличием двух четко разделяемых топологических доменов: исключительно протяженного внеклеточного домена с концевой аминогруппой (ATD, 500-600 аминокислот), который содержит модуль-ловушку (сайт связывания, по форме напоминающий лист венериной мухоловки) для агонистического связывания (ортостерический сайт) (Galvez et al., J. Biol. Chem., 275, 41166-41174, 2000) и 7 трансмембранных (ТМ) спиральных сегментов плюс внутриклеточный домен с концевой карбоксильной группой, которые связаны с активацией рецептора и сопряжением с G-белком. Механизм активации рецептора посредством агониста в GАВАBR1R2-гетеродимере является единственным в своем роде для рецепторов типа GPCR. В гетеродимере только субъединицы GABABR1 связываются с GABA, в то время как GABABR2 ответственны за сопряжение и активацию G-белка (Havlickova et al., Mol. Pharmacol. 62, 343-350, 2002; Kniazefiet al., J. Neurosci., 22, 7352-7361. 2002).
В статье Schuler et al., Neuron, 31, 47-58, 2001 показано, что у мышей с нокаутом GABABR1 спонтанно проявляются эпилептические припадки и гипералгезия (повышенная болевая чувствительность). У таких нокаут-мышей отсутствуют все биохимические и электрофизиологические GABAB-отклики. Интересно, что мыши с нокаутом GABABR1 более тревожны согласно двум системам оценки тревожности, а именно по данным теста в камере с чередующимся циклами освещение-темнота (уменьшенная продолжительность освещения) и по данным лестничного теста (изменение наклона и величины ступеней). Эти результаты свидетельствуют о явном ухудшении модельной пассивной реакции избегания, что указывает на ухудшение запоминания. Мыши с нокаутом GABABR1 также характеризуются увеличением гиперлокомоции и гиперактивности в новой среде. Ген GABABR1 картируется с хромосомой 6р21,3, которая относится к HLA классу I, области, взаимосвязанной с шизофренией, эпилепсией и дислексией (неспособностью к чтению) (Peters et al., Neurogenetics, 2, 47-54, 1998). В статье Mondabon et al., Am. J. Med. Genet 122B/1, 134, 2003 сообщается о некоторой слабой ассоциации Ala20Val полиморфизма гена GABABR1 с шизофренией. Кроме того, в статье Gassmann et al., J. Neurosci. 24, 6086-6097, 2004 показано, что мыши с нокаутом САВАBR2 страдают от спонтанных припадков, повышенной болевой чувствительности, гиперлокомоторной активности и тяжелых нарушений памяти по сравнению с мышами с нокаутом GABABR1. Следовательно, гетеромерные GABABR1R2-рецепторы ответственны за эти фенотипы.
Баклофен (лиоресал θ,β-хлорфенил GABA), селективный агонист рецептора GАВАB с EC50=210 нМ для нативного рецептора, является единственным лигандом, который используется с 1972 года в клинических исследованиях, проводимых при мышечной спастичности и ригидности скелетной мускулатуры у пациентов с травмой спинного мозга, рассеянным склерозом, боковым амиотрофическим склерозом, корковым (церебральным) параличом. Значительная часть доклинических и клинических исследований, проводимых с использованием баклофена и агонистов рецептора
GАВАB, используется при лечении невропатической боли и пристрастия к наркотикам, связанного с кокаином и никотином (Misgeld et al., Prog. Neurobiol. 46, 423-462, 1995; Enna et al., Life Sci, 62, 1525-1530, 1998; McCarson, Enna, Neuropharmacology, 38, 1767-1773, 1999; Brebner et al., Neuropharmacology, 38, 1797-1804, 1999; Paterson et al., Psychopharmacology, 172, 179-186, 2004). У пациентов с паническими расстройствами баклофен, как показано, является в значительной степени эффективным для снижения количества приступов паники и симптомов тревожности при оценке по шкале оценки тревожности Гамильтона (Hamilton), по шкале оценки тревожности Зунга (Zung) и по дополнительной шкале оценки нервозности Katz-R (Breslow et al., Am. J. Psychiatry, 146, 353-356, 1989). При исследовании небольшой группы бывших военнослужащих с хроническими, связанными с участием в боевых действиях стрессорными расстройствами (PTSD), было обнаружено, что баклофен является эффективным и хорошо переносимым лекарственным средством. Это средство приводит к значительному улучшениям в отношении общих симптомов стрессорных расстройств (PTSD), главным образом, в отношении замкнутого поведения, оцепенения и безразличия и симптомов перевозбуждения, а также к снижению сопутствующих тревожности и депрессивности (Drake et al., Ann. Pharmacother. 37, 1177-1181, 2003). Согласно доклиническим исследованиям баклофен способен полностью изменять в противоположном направлении уменьшение ингибирования опережающего импульса (PPI) акустического старт-рефлекса, индуцированного дизоцилпином (dizocilpine), но не апоморфином, при исследовании PPI-модели психоза на крысах (Bortolato et al., Psychopharmacology, 171, 322-330, 2004). Следовательно, агонисты рецептора GАВАB обладают потенциалом для проведения фармакологической терапии психических расстройств. К сожалению, у баклофена имеется ряд побочных нежелательных эффектов, которые включают плохое преодоление барьера кровь-мозг, очень короткую продолжительность действия и узкий интервал показателей терапевтического действия (мышечная релаксация, седативный эффект и переносимость), что ограничивает его использование.
В статье Urwyler et al., Mol. Pharmacol., 60, 963-971, 2001 сообщается о новом классе лигандов рецепторов GАВАB, называемых позитивными аллостерическими модуляторами, CGP7930 [2,6-ди-трет-бутил-4-(3-гидрокси-2,2-диметилпропил)фенол] и его альдегидном аналоге CGP13501. Эти лиганды не оказывают воздействия на их собственные GABAB-рецепторы, но по отношению к эндогенной GABA они увеличивают как активность, так и максимальную эффективность воздействия GABA на GABABR1R2 (Pin et al., Mol. Pharmacol., 60, 881-884, 2001). Интересно, что недавнее исследование модулятора CGP7930 (Binet et al., J Biol Chem., 279, 29085-29091, 2004) показало, что этот положительный модулятор непосредственно активизирует семь трансмембранных доменов (7TMD) субъединицы GABABR2. В статье Mombereau et al., Neuropsychopharmacology, 1-13, 2004 недавно сообщалось о седативном эффекте при экстренном и длительном лечении с использованием положительного модулятора GАВАB-рецептора, GS39783 (N,N-дициклопентил-2-метилсульфанил-5-нитропиримидин-4,6-диамин) (Urwyler et al., J. Pharmacol. Exp. Ther., 307, 322-330, 2003) в тестах оценки тревожности с использованием бокса с определенными циклами освещение-темнота и в тесте с приподнятым лабиринтом на моделях тревожности. Поскольку GАВАB-энхансеры не оказывают влияния на активность рецептора в отсутствие GABA, но действительно повышают аллостерически сродство GАВАB-рецептора к эндогенной GABA, ожидается, что эти лиганды будут характеризоваться лучшим профилем побочных эффектов по сравнению с баклофеном. Действительно, GS39783 при концентрации 0,1-200 мг/кг, перорально, не оказывает воздействия на спонтанную двигательную активность, показатели теста на координацию, температуру тела и показатели теста на растяжение мышц по сравнению с баклофеном, для которого эти побочные эффекты проявляются при концентрации 2,5-15 мг/кг, перорально. GS39783 не оказывает какого-либо воздействия на когнитивные функции, что оценивалось посредством тестов на пассивную реакцию избегания на мышах и крысах. Кроме того, GS39783 проявляет седативноподобное действие при исследованиях в тесте с крестообразным приподнятым лабиринтом (крысы), в O-аналоге теста с крестообразным приподнятым лабиринтом (мыши и крысы) и в тесте со стресс-индуцированной гипертермией (мыши). Таким образом, GS39783 представляет новое анксиолитическое средство, не вызывающее побочных эффектов, которые присущи применению баклофена или бензодиазепинов (Cryan et al., J Pharmacol Exp Ther., 310, 952-963, 2004). Доклинические исследования CGP7930 и GS39783 показали, что оба эти соединения являются эффективными против смертности, вызываемой самостоятельным введением кокаина у крыс (Smith et al., Psychopharmacology, 173, 105-111, 2004). Проведены доклинические исследования положительного модулятора CGP7930 в отношении лечения гастроэзофагеальной рефлюксной болезни (ГЭРБ), и была обнаружена эффективность CGP7930 (WO 03/090731 - применение положительных модуляторов GABAB-рецептора при желудочно-кишечных заболеваниях).
Сообщалось о позитивных аллостерических модуляторах для других членов третьего семейства рецепторов, сопряженных с G-белком (GPCR), включая mGlul-рецептор (Knoflach et al., Proc. Natl. Acad. Sci., USA, 98, 13402-13407, 2001; Wichmann et al., Farmaco, 57, 989-992, 2002), кальций-чувствительный рецептор (NFS R-467 и NPS R-568) (Hammerland et al., Mol. PharmacoL, 53, 1083-1088, 1998) (патент США №6313146), mGlu2-рецептор [LY487379, N-(4-(2-метоксифенокси)-фенил-N-(2,2,2-трифторэтилсульфонил)пирид-3-илметиламин и его аналоги] (WO 01/56990, потенциирующий фактор глутаматных рецепторов) и mGlu5-рецептор (СРРНА, N-{4-хлор-2-[(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)метил]фенил}-2-гидроксибензамид) (O'Brien et al., J. Pharmaco. Exp. Ther., 27, Jan. 27, 2004). Представляет интерес тот факт, что было показано, что эти позитивные модуляторы связываются с новым аллостерическим сайтом, расположенным внутри семи трансмембранных доменов (7TMD), усиливая таким образом сродство агониста посредством стабилизации активного сайта 7TMD-области (Knoflach et al., Proc. Natl. Acad. Sci., USA 98, 13402-13407, 2001; Schaffhauser et al., Mol. Pharmacol., 64, 798-810, 2003). Кроме того, NPS R-467, NPS R-568 (текалцет (Tecalcet)) и родственные ему соединения является первыми позитивными аллостерическими модуляторами, подвергнутыми клиническим испытаниям вследствие аллостерического способа воздействия.
Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые аддитивные соли с кислотами, получение соединений формулы I и их солей, лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемые аддитивные соли с кислотами, получение таких лекарственных средств и применение соединений формулы I и их фармацевтически приемлемых солей для контроля или профилактики заболеваний, в особенности заболеваний, нарушений или расстройств такого типа, как описано выше, например, таких как тревожность, депрессия, эпилепсия, шизофрения, когнитивные нарушения и расстройства, спастичность и ригидность скелетной мускулатуры, повреждение (травма) спинного мозга, рассеянный склероз, боковой амиотрофический склероз, церебральный (корковый) паралич, невропатическая боль и навязчивые желания, связанные с кокаином и никотином, психоз, панические расстройства, посттравматические стрессовые расстройства или желудочно-кишечные нарушения и расстройства.
В тексте настоящей заявки используются следующие определения обобщенных терминов, вне зависимости от того, используется ли рассматриваемый термин по отдельности или в комбинации.
При использовании в тексте настоящей заявки термин "алкил" означает линейную или разветвленную углеводородную группу, содержащую от 1 до 12 атомов углерода, например метил, этил, пентил, гексил, октил, нонил и т.п.
Термин "низший алкил" означает линейную или разветвленную алкильную группу, содержащую от 1 до 7 атомов углерода. Предпочтительные низшие алкильные группы содержат от 1 до 4 атомов углерода.
При использовании в тексте настоящей заявки термин "алкенил" означает линейную или разветвленную углеводородную группу, содержащую от 2 до 12 атомов углерода и по меньшей мере одну двойную связь, например, такую группу как этенил, пропенил, изопропенил, бутенил и т.п.
При использовании в тексте настоящей заявки термин "арилалкил" или "арилалкенил" означает ненасыщенную ароматическую кольцевую систему, например фенил или нафтил, которая присоединяется к алкильной или алкенильной углеродной цепи таким образом, как определено выше.
Термин "галоген" означает хлор, иод, фтор и бром.
Термин "галогеналкил" означает алкильную группу таким образом, как определено выше, которая замещена одним или более атомом галогена.
Термин "низший алкокси" означает группу, в которой алкильный остаток является таким, как определено выше, и алкильная группа присоединяется через атом кислорода.
Термин "циклоалкил" означает углеводородную кольцевую систему, содержащую от 3 до 6 атомов углерода, предпочтительным является циклопропил.
Термин "5-, 6- или 7-членная кольцевая система, которая необязательно содержит в дополнение к N-атому дополнительный гетероатом, выбранный из группы, состоящей из О, S и N" означает неароматическую кольцевую систему, например, такую как пирролидин, пиперидин, морфолин, тиоморфолин, 1-оксо-тиоморфолин, 1,1-диоксотиоморфолин, пиперазин, 1,4-диазепан, 1,4-оксазепан или т.п.
Термин "где R3 и R4 образуют вместе с N-атомом гетероциклическую кольцевую систему, которая содержит по меньшей мере два кольца и которая необязательно содержит один или два дополнительных гетероатома, выбранных из группы, состоящей из N и О" относится, например, к следующим группам:
, , , ,
Термин "фармацевтически приемлемые аддитивные соли с кислотами" включает соли с неорганическими или органическими кислотами, например, такими как хлороводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота (бутандикислота), винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п.
Предпочтительными соединениями согласно настоящему изобретению являются такие соединения, где Х означает -S-. Особенно предпочтительными соединениями этой группы являются такие соединения, где R1 представляет собой алкил и R3 и R4 вместе с N-атомом образуют пятичленную или шестичленную кольцевую систему, которая необязательно содержит дополнительный O-гетероатом и которая является незамещенной или замещенной низшим алкилом.
Предпочтительными соединениями этой группы являются такие соединения, где R3 и R4 образуют вместе с N-атомом морфолиновое кольцо, например следующие соединения:
4-(2-гексилсульфанил-6-метилпиримидин-4-илметил)морфолин,
4-(6-метил-2-пентилсульфанилпиримидин-4-илметил)-морфолин,
4-(2-гексилсульфанил-6-трифторметилпиримидин-4-илметил)морфолин,
4-(2-гексилсульфанил-6-этилпиримидин-4-илметил)морфолин и
4-[1-(2-гексилсульфанил-6-метилпиримидин-4-ил)-этил]морфолин.
Предпочтительными соединениями этой группы являются такие соединения, где R3 и R4 образуют вместе с N-атомом пирролидиновое или пиперидиновое кольцо, которое необязательно замещено низшим алкилом, например следующие соединения:
2-гексилсульфанил-4-метил-6-пирролидин-1-илметилпиримидин,
2-гексилсульфанил-4-метил-6-(2-метилпиперидин-1-илметил)пиримидин,
4-(2,6-диметилпиперидин-1-илметил)-2-гексилсульфанил-6-метилпиримидин и
4-(цис-2,6-диметилпиперидин-1-илметил)-2-гексилсульфанил-6-метилпиримидин.
Предпочтительными соединениями согласно настоящему изобретению являются такие соединения, где R1 представляет собой арилалкил, необязательно замещенный низшим алкилом, и R3 и R4 образуют вместе с N-атомом пяти- или шестичленную кольцевую систему, которая необязательно содержит дополнительный O-гетероатом, например следующее соединение:
4-[2-(4-трет-бутил-бензилсульфанил)-6-метилпиримидин-4-илметил]морфолин.
Кроме того, предпочтительными являются соединения, где R3 и R4 образуют вместе с N-атомом гетероциклическую кольцевую систему, которая содержит по меньшей мере два кольца и которая необязательно содержит один или два дополнительных гетероатома, выбранных из группы, состоящей из N и О, например следующее соединение:
(1S,5S)-3-(2-гексилсульфанил-6-метилпиримидин-4-илметил)-1,2,3,4,5,6-гексагидро-1,5-метанопиридо[1,2-а][1,5]диазоцин-8-он.
Соединения формулы I, где R представляет собой водород, являются наиболее предпочтительными.
Еще одним объектом настоящего изобретения являются соединения, где R5 представляет собой метил, или соединения, где Х представляет собой -NH-.
Вышеуказанные соединения формулы I могут быть получены согласно настоящему изобретению в соответствии со следующими вариантами способа:
а) взаимодействие соединения формулы:
с соединением формулы
с получением при этом соединения формулы
где R1-R4 являются такими, как указано выше, или
б) взаимодействие соединения формулы:
с амином формулы
R1NH2
с получением при этом соединения формулы
где R1-R4 являются такими, как указано выше, или
в) взаимодействие соединения формулы
с амином формулы
с получением при этом соединения формулы
где R1-R4 являются такими, как указано выше, или
г) взаимодействие соединения формулы
с амином формулы
с получением при этом соединения формулы
где R1-R4 являются такими, как описано выше, и если необходимо, полученное соединение формулы I превращают в фармацевтически приемлемую соль.
Далее получение соединений формулы I описывается более подробно.
Схемы 1-4 иллюстрируют способы получения соединений формулы I с использованием в качестве исходных соединений известных соединений, коммерческих продуктов или соединений, которые могут быть получены общеизвестными способами.
Кроме того, получение соединений формулы 1 подробно описывается в экспериментальных примерах 1-43.
При описании способа используются следующие сокращения и обозначения: ТЭА = триэтиламин, ТГФ = тетрагидрофуран, OXONE(R) = моноперсульфат калия, тройная соль, ДЦМ = 4-(дицианометилен)-2-метил-6-(4-диметиламиностирил)-4Н-пиран, ДМФ = N,N-диметилформамид.
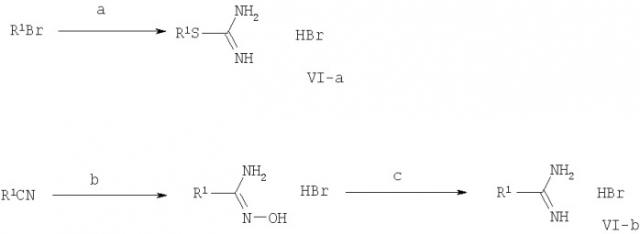
Схема 1
a) тиомочевина, ЕtOН, кипячение с обратным холодильником, 24 часа,
b) NH2OH HCl, ТЭА, ЕtOН, кипячение с обратным холодильником, 24 часа,
c) MsOH, RaNi, EtOH, H2, 3 часа.
В соответствии со схемой 1 промежуточные соединения формул VI-a и VI-b могут быть получены следующим образом.
Стадия а
Тиомочевину и соответствующее соединение формулы R1Вr, например 1-бромгексан, кипятят с обратным холодильником в атмосфере азота в среде спирта, например, такого как этанол, в течение приблизительно 20 ч. Затем спирт упаривают и после обычного выделения и очистки получают соответствующий гидробромид изотиомочевины формулы VI-a.
Стадия b
Цианид формулы R1CN и гидроксиламингидрохлорид растворяют в спирте, например в этаноле, и затем обрабатывают триэтиламином, после выделения и очистки получают соответствующий N-гидроксиамидин.
Стадия с
К раствору вышеуказанного N-гидроксиамидина, полученного на стадии b, в спирте, например в этаноле, добавляют свежий никель Ренея и метансульфоновую кислоту (MsOH). Реакционную смесь перемешивают в течение приблизительно 3 часов при комнатной температуре в атмосфере водорода. После выделения и очистки получают соответствующий амидинмезилат.
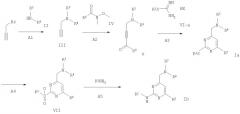
Схема 2
А1) K2СО3, МеОН, 0-20°С,
А2) изоPrMgCl, ТГФ, 20°С или BuLi, ТГФ -70°С,
A3) ТЭА, ТГФ, 20°С или NaOMe, МеОН,
A4) OXONE(R) (моноперсульфат калия, тройная соль), МеОН,
А5) ТГФ, 20°С.
В соответствии со схемой 2 промежуточные соединения формул VI-a и VI-b могут быть получены следующим образом.
Промежуточные соединения формулы IV
N,О-диметилгидроксиламин НСl суспендируют в атмосфере азота в ДХМ и охлаждают на льду. Медленно добавляют триэтиламин, затем медленно добавляют ацетилхлорид, температура достигает приблизительно 20°, несмотря на охлаждение льдом и медленное добавление. Перемешивание без охлаждения продолжают в течение приблизительно 30 мин. После экстракции и очистки получают N-метокси-N-метилацетамид.
Или:
N,O-диметилгидроксиламин • НСl суспендируют в атмосфере азота в ДХМ и охлаждают на льду. Медленно добавляют триэтиламин, затем медленно добавляют циклопропанкарбонилхлорид. Перемешивание без охлаждения продолжают в течение 1 часа. Экстракция: 2×ДХМ, 1×1 н. НСl, 1×NaCl. Перегонка: 75°С/20 мбар. Получают метоксиметиламид циклопропанкарбоновой кислоты.
Стадия А1
Соединение формулы HNR3R4 (II), например морфолин, растворяют в спирте, например в МеОН, и охлаждают на льду в атмосфере азота, затем добавляют карбонат калия и пропаргилбромид при перемешивании на льду. Перемешивание без охлаждения продолжают в течение приблизительно 4 часов. Полученную суспензию подвергают обычной процедуре выделения. Получают соединение формулы III, например 4-проп-2-инилморфолин.
Стадия А2
Соединение, полученное на стадии А1, растворяют в атмосфере азота в ТГФ и охлаждают до приблизительно -40°С. Затем добавляют раствор изопропилмагнийхлорида в ТГФ, поддерживая температуру ниже -20°С. Перемешивание при температуре от -40° до -30°С продолжают в течение приблизительно 30 мин. В отдельной колбе соединение формулы IV, например N-метокси-N-метилацетамид, растворяют в ТГФ в атмосфере азота и охлаждают до -10°С смесью лед/МеОН. Полученный таким образом, как описано выше, раствор Гриньяра переносят в раствор амида Вайнреба (Weinreb) при -10°С, используя тефлоновую трубку, при несколько повышенном давлении азота в реакционном сосуде. Перемешивание при температуре от -10° до 0°С продолжают в течение приблизительно 2 часов. Полученную суспензию обычным образом подвергают процедуре выделения продукта. Получают соединение формулы V, например, 5-морфолин-4-илпент-3-ин-2-он.
Стадия A3
Соединение, полученное на стадии А2, например 5-морфолин-4-илпент-3-ин-2-он, и соединение формулы VI-a, например гидробромид 2-гексилизотиомочевины, растворяют в атмосфере азота в ДМФ, затем добавляют N,N-диизопропилэтиламин и перемешивают при комнатной температуре в течение приблизительно 18 часов. Из полученной суспензии продукт выделяют общепринятым образом. Получают соединение формулы Iа, например 4-(2-гексилсульфанил-6-метилпиримидин-4-илметил)морфолин.
Стадия А4
Соединение формулы Ia, полученное на стадии A3, например 4-(2-гексилсульфанил-6-метилпиримидин-4-илметил)морфолин растворяют в МеОН и затем обрабатывают тройной солью моноперсульфата калия (OXONE(R)) в течение приблизительно 2 час. Получают соединение формулы VII, например, 4-(2-гексилсульфонил-6-метилпиримидин-4-илметил)морфолин.
Стадия А5:
Соединение формулы VII, полученное на стадии А4, и амин формулы R1NH2 растворяют в ТГФ и перемешивают при 20°С в течение ночи. Получают соединение формулы Ib.
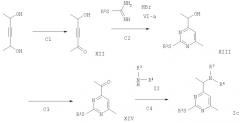
Схема 3
B1) BuLi, ТГФ, при температуре от -70°С до -30°С,
B2) ТЭА, ТГФ, 20°С,
B3) 4 н. НСl или ТФУ/Н2O,
B4) NaBH3CN или руВН3, ЕtOН/АсОН в соотношении 10:1, 20°С или
Тi(ОизоРr)4, неразб., NaBH3CN, изоРrОН.
В соответствии со схемой 3 соединения формулы Iа могут быть получены следующим образом.
Стадия В1
Диэтилацеталь пропаргилальдегида растворяют в ТГФ в атмосфере аргона и охлаждают до -70°С. Затем добавляют раствор бутиллития в гексане и продолжают перемешивание в течение приблизительно 30 минут при -30°С. Затем добавляют соответствующее соединение формулы IV, например N-метокси-N-метилацетамид, в ТГФ. Через 30 минут при -30°С реакцию останавливают добавлением к реакционной смеси насыщенного раствора NH4Cl. После обычной процедуры выделения продукта получают соответствующее соединение формулы IX, например 5,5-диэтокси-пент-3-ин-2-он.
Стадия В2
Соединение, полученное на стадии B1, например 5,5-диэтокси-пент-3-ин-2-он, и соответствующее соединение формулы VI-a, например гидробромид 2-гексилизотиомочевины, растворяют в атмосфере азота в ТГФ. Затем медленно добавляют триэтиламин, с охлаждением на бане со льдом, чтобы поддерживать температуру 20°С. Полученную суспензию перемешивают без охлаждения в течение приблизительно 5 часов. После обычной процедуры выделения получают продукт, например 4-диэтоксиметил-2-гексилсульфанил-6-метилпиримидин.
Стадия В3
Соединение, полученное на стадии В2, например 4-диэтоксиметил-2-гексилсульфанил-6-метилпиримидин, растворяют в ТГФ и содержащей воду Н2SО4 и затем нагревают при 50°С в течение приблизительно 33 часов. Затем полученный раствор выливают в холодный раствор Na2CO3 и подвергают обычной процедуре выделения. Получают соединение формулы XI, например 2-гексилсульфанил-6-метилпиримидин-4-карбальдегид.
Стадия В4
Соединение формулы XI, полученное на стадии В3, например 2-гексилсульфанил-6-метилпиримидин-4-карбальдегид, растворяют в этаноле и уксусной кислоте. Затем медленно добавляют соединение формулы II, например пирролидин и цианоборгидрид натрия, при 20°С и продолжают перемешивание в течение приблизительно 24 часов. Реакционную смесь подвергают обычной процедуре выделения продукта. Получают соединение формулы Iа, например 2-гексилсульфанил-4-метил-6-пирролидин-1-илметилпиримидин.
Схема 4
С1) СrО3 в 4 н. H2SO4, ацетон, 0-20°С,
С2) ТЭА, ТГФ, 20°С,
С3) СrО3 в 4 н. H2SO4, ацетон, 0-20°С,
С4) Ti(ОизоРr)4, NаВН3СN, изоРrОН.
В соответствии со схемой 4 соединения формулы 1 с могут быть получены следующим образом.
Стадия С1
Раствор 3-гексин-2,5-диола в ацетоне охлаждают на льду в атмосфере азота. Медленно добавляют реагент Джонса (Jones) (45 ммоль, 2 М СrО3 в 4 М Н2SO4) при 5°С в течение 2 часов. Полученный зеленый раствор декантируют для удаления солей хрома и экстрагируют, используя AcOEt и насыщенный раствор NaCl. Неочищенный продукт очищают. Получают 5-гидроксигекс-3-ин-2-он формулы XII.
Стадия С2
5-гидроксигекс-3-ин-2-он и соединение формулы VI-a, например гидробромид 2-гексил-изотиомочевины, растворяют в ТГФ. Затем добавляют триэтиламин и продолжают перемешивание в течение приблизительно 3 час. Полученный продукт выделяют и очищают, получая при этом соединение формулы XIII, например 1-(2-гексилсульфанил-6-метилпиримидин-4-ил)этанол.
Стадия С3
Соединение, полученное на стадии С2, например 1-(2-гексилсульфанил-6-метилпиримидин-4-ил)этанол, растворяют в атмосфере азота в ацетоне. Затем добавляют по каплям реагент Джонса (Jones), полученный из 20 г СrО3 в 100 мл 4 М Н2SО4. После перемешивания в течение приблизительно 2 часов при 20°С полученный раствор отделяют и очищают общепринятым образом. Получают соединение формулы XIV, например 1-(2-гексилсульфанил-6-метилпиримидин-4-ил)этанон.
Стадия С4
Соединение формулы XIV, например 1-(2-гексилсульфанил-6-метилпиримидин-4-ил)-этанон, и соединение формулы II, например морфолин, растворяют в тетраизопропилортотитанате и нагревают при приблизительно 80°С в течение 16 часов. Полученный раствор разбавляют 2-пропанолом и затем обрабатывают цианоборгидридом натрия при приблизительно 20°С в течение 6 часов. Полученный продукт формулы 1с например, 4-[1-(2-гексилсульфанил-6-метилпиримидин-4-ил)-этил]морфолин, выделяют и очищают общепринятым образом.
Как указывалось выше, соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. Установлено, что соединения согласно настоящему изобретению имеют сродство к рецептору
GАВАB.
Соединения исследовали в соответствии с приведенными ниже тестами.
Исследование внутриклеточной мобилизации Са2+
Клетки яичников китайских хомяков (СНО), стабильно экспрессирующие GABABR1aR2, а человека, и Gα16 высевают с плотностью 5·104 клетка/лунка в обработанные поли-D-лизином, 96-луночные черные планшеты с прозрачным дном («BD Biosciences», Пало-Альто, Калифорния, США). Через 24 часа клетки помещают на 90 минут при 37°С в 4 мкМ Flou-4-ацетоксиметилового сложного эфира (номер по каталогу F-14202, «Molecular Probes», Юджин, Орегон, США) в буфере для загрузки (1 × HBSS (солевой раствор Хэнка), 20 мМ HEPES, 2,5 мМ пробенецида (Probenecid). Солевой раствор Хэнка (HBSS - сокр. от англ. Hanks' Balanced Salt Solution) (10 х) (номер по каталогу 14065-049) и HEPES (1M) (номер по каталогу 15630-056) приобретены у фирмы «Invitrogen», Карлсбад, Калифорния, США. Пробенецид (250 мМ) (номер по каталогу Р8761) приобретен у фирмы Sigma, Buchs, Switzerland. Клетки пять раз промывают загрузочным буфером для того, чтобы удалить избыток красителя, и затем измеряют внутриклеточную мобилизацию кальция [Са2+]I, используя флуориметрический планшетный анализатор (FLIPR, «Molecular Devices», Менло Парк, Калифорния, США) таким образом, как описано ранее (Porter et al., Br. J. Pharmacol, 128, 13-20, 1999). Усиливающие агенты наносят за 15 минут до введения GABA. Для определения воздействия GABA строят кривые зависимости концентрация-отклик для GABA (0,0003-30 мкМ) в отсутствие и в присутствии 10 мкМ усиливающего агента. Изменение значения для GABA определяют как Log [ЕС50 (GABA+10 мкМ усиливающего агента)/ЕС50 (GABA в отдельности)]. Величину в % максимального усиливающего эффекта (% Emax) и эффективность (величину ЕС50) для каждого усиливающего агента определяют по кривой зависимости концентрация-отклик на усиливающий агент (0,001-30 мкМ) в присутствии 10 нМ (GABA) (ЕС10). Отклик измеряют как максимальное увеличение флуоресценции минус исходное значение, нормализованное по отношению к максимальному стимулирующему эффекту, индуцированному воздействием 10 мкМ GABA в отдельности (рассматривается как 100%) и 10 нМ GABA в отдельности (рассматривается как 0%). Данные соответствуют уравнению Y=100+(Max-100)/(1+(ЕС50/[лекарственное средство])n), где Мах представляет собой максимальный эффект, EC50 означает концентрацию, вызывающую половину максимального эффекта, и n означает коэффициент Хилла (тангенс угла наклона).
| При-мер | Исследование внутриклеточнй мобилизации Са2+ в клетках СНО-GАВАBR1аR2а-Gα16 | Изменение значения для GABA | |
| Еmах (%) при 10 нМ GABA (в отдельности) = 0%; 10 мкМ GАВА (в отдельности) = 100%; | ЕС50 (мкМ) при 10 нм GABA | log[EC50(GABA+10 мкМ cp)/EC50(GABA в отдельности)] | |
| 1 | 46 | 2,2 | -0,75 |
| 2 | 52 | 1,7 | -0,55 |
| 11 | 41 | 4,2 | -0,60 |
| 16 | 48 | 8,5 | -0,50 |
| 31 | 60 | 9,6 | -0,69 |
| 35 | 62 | 1,8 | -0,92 |
| 37 | 74,2 | 8,2 | -0,76 |
| 38 | 61 | 6,3 | -0,71 |
| 39 | 62 | 6,4 | -0,48 |
| 41 | 60 | 4,1 | -0,86 |
| 43 | 49 | 4,4 | -0,70 |
Соединения формулы I, а также их фармацевтически приемлемые аддитивные соли с кислотами могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий.
Соединения формулы I, а также их фармацевтически приемлемые аддитивные соли с кислотами могут быть переработаны вместе с фармацевтически инертным, неорганическим или органическим наполнителем с получением при этом таблеток, драже и твердых желатиновых капсул. В качестве таких носителей для таблеток, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли.
Подходящие носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п.
Подходящие носители для получения растворов и сиропов представляют собой, например, воду, полиолы, сахарозу, инвертный сахар, глюкозу и т.п.
Подходящие носители для растворов для инъекций представляют собой, например, воду, спирты, полиолы, глицерин, растительные масла и т.п.
Подходящие носители для суппозиториев представляют собой, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, агенты, улучшающие смачиваемость, эмульгаторы, подсластители, подкрашивающие агенты, агенты, улучшающие вкус и запах, соли для регулирования осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Фармацевтические композиции также могут содержать другие терапевтически значимые вещества.
Дозировка может варьироваться в широких пределах и, безусловно, должна в каждом конкретном случае соответствовать индивидуальным требованиям. В общем, в случае перорального введения подходящей является дневная дозировка, составляющая приблизительно от 10 до 1000 мг соеди