Фармацевтический состав карбоксамидных ингибиторов интегразы вич, содержащий композицию с контролируемой скоростью высвобождения
Иллюстрации
Показать всеИзобретение относится к области фармакологии и касается фармацевтического состава, пригодного для перорального введения в виде твердой лекарственной формы, содержащего эффективное количество основной соли соединения формулы 1 и композицию с контролируемой скоростью высвобождения, содержащую солюбилизирующий агент, гелеобразующий агент и водорастворимый наполнитель. Составы пригодны для использования при ингибировании интегразы ВИЧ, лечении и профилактике ВИЧ-инфекции, и при лечении, профилактике и замедлении возникновения СПИДа. 4 н. и 12 з.п. ф-лы, 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим составам, пригодным для перорального введения в твердой лекарственной форме, содержащей эффективное количество продукта соли лекарственного вещества и композицию с контролируемой скоростью высвобождения. Более конкретно, соль продукта лекарственного вещества является основной солью карбоксамида гидроксипиримидинона, а композиция с контролируемой скоростью высвобождения содержит солюбилизирующий агент, гелеобразующий агент и растворимый в воде наполнитель.
Уровень техники
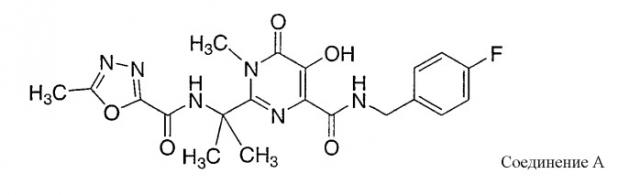
Карбоксамиды гидроксипиримидинона, описанные в WO 03/035077, и карбоксамиды гидрокситетрагидропиридопиримидинона и родственные карбоксамиды, описанные в WO 2004/058756, являются ингибиторами ВИЧ (HIV) интегразы, пригодными для лечения ВИЧ инфекции и СПИДа (AIDS). Некоторые из этих карбоксамидных соединений обнаруживают относительно низкую растворимость в воде, что может привести к слабому всасыванию соединения в желудочно-кишечном (GI) тракте после перорального введения. Растворимость этих соединений может быть улучшена путем введения лекарственных веществ в форме основных солей (то есть, солей, образованных реакцией соединений с основными солями, такими как гидроксиды металлов), но растворимость некоторых из получаемых солей может меняться в зависимости от pH. Более конкретно, основные соли могут быть относительно растворимыми в нейтральной или основной водной среде, но могут превращаться в менее растворимые формы в кислых условиях. Представителем таких солей является калиевая соль соединения A:
Калиевая соль соединения A является относительно растворимой в нейтральных или основных водных растворах, но в кислых растворах она имеет тенденцию к диспропорционированию до относительно нерастворимой формы свободного основания. Когда калиевую соль соединения А вводят перорально в твердой лекарственной форме, соединение может демонстрировать слабое всасывание в системной циркуляции вследствие потери или значительного снижения растворимости соли в кислых условиях, обычно имеющихся в желудке.
Удовлетворительная пероральная биодоступность может быть достигнута путем формирования этих солей вместе с агентом антинуклеации. Например, спрессованные таблетированные формы калиевой соли соединения А, содержащие гидроксипропилметилцеллюлозу (например, HPMC 2910) в качестве агента антинуклеации, демонстрировали улучшенную растворимость, в сравнении с аналогичными составами, не содержащими агента антинуклеации, в тестах на растворение in vitro, и улучшенную фармакокинетику (PK) при исследовании на животных. При пероральном введении вместе с HPMC таблетированные формы калиевой соли соединения А также позволили получить удовлетворительную фармакокинетику (PK) у человека. Полагают, что агент антинуклеации, используемый в этих составах, может удовлетворительно ингибировать и/или замедлять осаждение (или может иначе обеспечивать длительное перенасыщение) соединения лекарственного вещества в условиях кислой среды желудка или кишечника, так чтобы дать возможность лекарственному веществу более эффективно всасываться в системной циркуляции.
С другой стороны, в твердых лекарственных формах солей соединения, содержащих агент антинуклеации, соединение может обладать относительно быстрым всасыванием в системную циркуляцию (то есть, относительно коротким Tmax, временем, проходящим от момента введения дозы до момента достижения Cmax, максимальной концентрации соединения в плазме), с возможным, быстрым его снижением. Например, спрессованная таблетка, содержащая HPMC калиевую соль соединения А, упомянутую в предыдущем абзаце, демонстрировала относительно высокие величины Cmax, малые значения Tmax (например, от, приблизительно, 30 до 90 минут) и относительно низкие плазменные концентрации впоследствии. Высокие значения отношений пиковых и минимальных плазменных концентраций могут быть связаны с неблагоприятными эффектами; и низкие плазменные концентрации, следующие за Tmax, могут привести к малому всасыванию или отсутствию всасывания лекарственного вещества вне пределов желудка и перед устранением лекарственного вещества из желудочно-кишечного тракта (то есть, незначительному всасыванию или отсутствию всасывания в тонкой кишке или толстой кишке). Соответственно, существует потребность в твердых формах пероральных лекарственных составов данных соединений с контролируемым высвобождением, таким образом, чтобы обеспечить изменение профиля PK относительно профиля твердых лекарственных форм на основе агентов антинуклеации, (то есть, получение более длительного Tmax, более низкого отношения пиковых плазменных концентраций и минимальных плазменных концентраций, и/или получение более высоких минимальных плазменных концентраций после Tmax).
Раскрытие изобретения
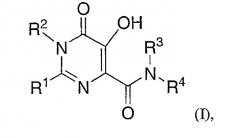
Настоящее изобретение относится к фармацевтическим составам для перорального введения, содержащим карбоксамид гидроксипиримидинона или родственные конденсированные циклические карбоксамиды и композицию, которая после введения контролирует высвобождение карбоксамида в системной циркуляции. Более конкретно, настоящее изобретение включает фармацевтический состав для перорального введения в виде твердой дозы, которая содержит эффективное количество основной соли соединения формулы I (альтернативно и более просто обозначаемое здесь как "Соединение I") и композицию, контролирующую скорость высвобождения, содержащую солюбилизирующий агент, гелеобразующий агент и, необязательно, растворимый в воде наполнитель; где формула I представляет собой:
где Rl представляет собой С1-6 алкил, замещенный:
(1) N(RA)-C(=O)-N(RC)RD,
(2) N(RA)-C(=O)-С1-6 алкилен-N(RC)RD,
(3) N(RA)SO2RB,
(4) N(RA)SO2N(RC)RD,
(5) N(RA)-C(=O)-С1-6 алкилен-SO2RB,
(6) N(RA)-C(=O)-С1-6 алкилен-SO2N(RC)RD,
(7) N(RA)C(=O)C(=O)N(RC)RD;
(8) N(RA)-C(=O)-HetA,
(9) N(RA)C(=O)C(=O)-HetA, или
(10) HetB;
R2 представляет собой - С1-6 алкил;
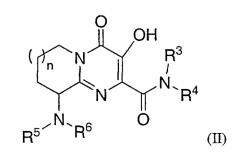
или, альтернативно, Rl and R2 соединены вместе так, что соединение Формулы I становится соединением Формулы ІІ:
R3 представляет собой -H или - С1-6 алкил;
R4 представляет собой -С1-6алкил, замещенный арилом (например, фенил), который, необязательно, замещен заместителями, в количестве от 1 до 4, каждый из которых независимо представляет собой галоген, -OH, -С1-4 алкил, -С1-4 алкил-ORA,
-С1-4 галогеналкил, -O-С1-4 алкил, -O-С1-4 галогеналкил, -CN, -NO2, -N(RA)RB; -С1-4алкил-N(RA)RB, -C(=O)N(RA)RB, -C(=O)RA, -CO2RA, -С1-4алкил-CO2RA, -OCO2RA, -SRA, -S(=O)RA, -SO2RA, -N(RA)SO2RB, -SO2N(RA)RB, -N(RA)C(=O)RB, -N(RA)CO2RB, -С1-4алкил-N(RA)CO2RB, метилендиокси, присоединенный к двум соседним кольцевым атомам углерода, фенил или -С1-4 алкилфенил;
R5 представляет собой:
(1) N(RA)-C(=O)-N(RC)RD;
(2) N(RA)-C(=O)-С1-6 алкилен-N(RC)RD,
(3) N(RA)SO2RB,
(4) N(RA)SO2N(RC)RD,
(5) N(RA)-C(=O)-С1-6 алкилен-SO2RB,
(6) N(RA)-C(=O)-С1-6 алкилен-SO2N(RC)RD,
(7) N(RA)C(=O)C(=O)N(RC)RD
(8) N(RA)-C(=O)-HetA или
(9) N(RA)C(=O)C(=O)-HetA;
R6 представляет собой -H или -С1-6 алкил;
n является целым числом, равным 1 или 2;
каждый RA независимо представляет собой -H или -С1-6 алкил;
каждый RB независимо представляет собой -H или -С1-6 алкил;
RC и RD, каждый независимо, представляют собой -H или -С1-6 алкил, или вместе с атомом азота, к которому они присоединены, образуют насыщенное 5- или 6-членное гетероциклическое кольцо, необязательно содержащее гетероатом, в дополнение к атому азота, присоединенному к RC и RD, выбранным из N, O и S, где S необязательно окислена до S(O) до S(O2), и где насыщенное гетероциклическое кольцо необязательно замещено 1 или 2 С1-6 алкильными группами;
HetA представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, где гетероароматическое кольцо необязательно замещено 1 или 2 заместителями, каждый из которых независимо представляет собой - С1-4 алкил, - С1-4 галогеналкил, -O-С1-4 алкил,
-O-С1-4 галогеналкил, или -CO2RA; и
HetB представляет собой 5-7-членное насыщенное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, независимо выбранных из N, О и S, где каждый атом S необязательно окислен до S(O) или S(O)2, и гетероциклическое кольцо необязательно замещено 1-3 заместителями, каждый из которых независимо представляет собой галоген, -С1-4алкил, -С1-4 фторалкил, -C(O)-С1-4 алкил, или -С1-4 алкил, замещенный OH.
Один вариант настоящего изобретения представляет собой обозначенный выше фармацевтический состав, в котором в соединении I: R2 является метилом; R3 является -H; и R4 представляет собой CH2-фенил, где фенил необязательно замещен 1 или 2 заместителями, каждый из которых независимо представляет собой бром, хлор, фтор, СН3, CF3, C(O)NH2, C(O)NH(СН3), C(O)N(СН3)2, SCH3, SO2CH3, или SO2N(СН3)2; а все другие варианты определены выше. Особенностью этого аспекта изобретения является то, что R4 представляет собой 4-фторбензил, 3,4-дихлорбензил, 3-хлор-4-фторбензил или 4-фтор-3-метилбензил. Еще одной особенностью является то, что R4 представляет собой 4-фторбензил.
Фармацевтические составы по настоящему изобретению могут обеспечить изменение PK профиля для соединения I, по сравнению с другими твердыми лекарственными формами, вводимыми перорально. Например, фармацевтический состав по настоящему изобретению, содержащий калиевую соль соединения A, демонстрирует при пероральном введении более длительное Tmax, более низкое отношение пиковой плазменной концентрации к минимальной плазменной концентрации и более высокие минимальные плазменные концентрации после прохождения Tmax. Сравнение проводилось с аналогичными составами, использующими агенты антинуклеации, вместо композиции с контролируемой скоростью высвобождения. Не привязываясь к какой-либо конкретной теории, все же полагают, что композиция с контролируемой скоростью высвобождения следующим образом ответственна за изменение профиля PK: солюбилизирующий агент действует так, чтобы препятствовать осаждению или минимизировать осаждение соединения I (которое, как указывали выше, может иметь низкую растворимость, в частности, в кислых условиях, существующих в желудке) в GI (желудочно-кишечном) тракте в течение нескольких часов после введения, посредством сохранения его в растворенной форме. Гелеобразующий агент воздействует, образуя гель вокруг частиц соединения I, где гель действует как диффузионный барьер, который замедляет высвобождение соединения I для всасывания в системном кровообращении. Растворимый в воде наполнитель после введения растворяется относительно быстро и действует, вытягивая воду в гелевый слой, образованный гелеобразующим агентом, и тем самым ускоряет диффузию лекарственного вещества и высвобождение. Два компонента (или три компонента, когда композиция с контролируемой скоростью высвобождения, содержит наполнитель, растворимый в воде) используют таким образом и в таких количествах, чтобы сохранять активное соединение в растворе и продлить высвобождение соединения так, чтобы безопасное и эффективное количество лекарственного вещества всасывалось в системную циркуляцию на протяжении длительного периода времени и из желудка, и из кишечного тракта.
Настоящее изобретение также включает в себя способы получения инкапсулированных и таблетированных форм фармацевтических составов по изобретению. Настоящее изобретение, кроме того, включает использование фармацевтического состава по изобретению для ингибирования ВИЧ-интегразы, для лечения или профилактики ВИЧ-инфекции или для лечения, замедления возникновения или профилактики СПИДа.
Разнообразные варианты осуществления, аспекты и особенности настоящего изобретения или будут описаны в дальнейшем или будут очевидны в результате описания, примеров и прилагаемой формулы изобретения.
Краткое описание чертежей
Фиг.1 представляет собой порошковую рентгенограмму калиевой соли соединения A, получаемого в примере 2.
Фиг.2 представляет собой кривую дифференциальной сканирующей калориметрии (DSC) для калиевой соли соединения A, получаемой в примере 2.
Фиг.3 представляет собой график по данным растворимости, полученный при исследовании растворимости, описанном в примере 8; то есть, график зависимости процента растворенного соединения A от времени растворения при исследовании растворимости полоксамерсодержащих таблеток, содержащих 400 мг соединения A.
Фиг.4 представляет собой график данных по растворимости, полученный при исследовании растворимости, описанный в примере 8; то есть, график зависимости процента растворенного соединения A от времени растворения, при исследовании растворимости лактозосодержащих таблеток, содержащих 100 мг соединения A.
Подробное описание изобретения
Доза перорально вводимых фармацевтических составов по настоящему изобретению включает эффективное количество основной соли соединения Формулы I в твердом виде. Соединения формулы I являются ингибиторами интегразы ВИЧ. Более конкретно, репрезентативные соединения, отображаемые Формулой I, тестировали в опыте по ингибированию интегразы, в котором перенос нити катализируется рекомбинантной интегразой, и обнаружили, что они являются активными ингибиторами интегразы ВИЧ. Активность ингибирования интегразы, например, можно определять, используя тест, описанный в Hazuda et al., J. Virol. 1997, 71: 7005-7011. Было обнаружено также, что репрезентативные соединения оказываются активными в тесте на ингибирование острой ВИЧ-инфекции T-лимфоидных клеток, который проводили в соответствии с Vacca et al., Proc. Natl. Acad. Sci. USA 1994, 91.: 4096-4100. Дальнейшее описание репрезентативных соединений, охватываемых Формулой I, способы их получения и тесты по измерению степени ингибирования ими активности интегразы и ингибирования ими репликации ВИЧ можно найти в WO 03/035077, описание которого полностью включено сюда в виде ссылки.
Используемый здесь термин "состав" предназначен для обозначения вводимого перорально твердого дозированного продукта, содержащего обозначенные ингредиенты, а также любого продукта, который получают в результате прямого или косвенного объединения указанных ингредиентов.
Используемый здесь термин "эффективное количество" означает количество соединения I (или другого фармацевтического агента), которое выявляет биологическую или медицинскую ответную реакцию в ткани, системе, животном или человеке, которая требуется для исследователя, ветеринара, лечащего врача или другого клинициста. Эффективное количество может быть "терапевтически эффективным количеством", применяемым для смягчения симптомов заболевания или состояния, подвергаемого лечению. Эффективное количество также может быть "профилактически эффективным количеством", применяемым для профилактики симптомов заболевания или состояния, которое предупреждают. Термин также относится к количеству соединения формулы I, достаточному для ингибирования интегразы ВИЧ и, тем самым, выявления требуемой ответной реакции (то есть, "эффективное количество для ингибирования").
Понятно, что основная соль соединения I, используемая в фармацевтических составах, входящих в объем настоящего изобретения, представляет собой фармацевтически приемлемую соль.
Термин "фармацевтически приемлемая соль" относится здесь к основной соли, которая обладает эффективностью первичного соединения и которая не является биологически или иным образом нежелательной (например, не является ни токсичной, ни действующей отрицательно на реципиента иным образом). Пригодные соли включают соли, образованные в результате реакции соединения I с основанием, включая, например, соли щелочных металлов (например, соли натрия или калия), соли щелочноземельных металлов (например, соли кальция или магния) и соли аммония. Соли щелочных металлов соединений могут быть получены обработкой соединения, растворенного в пригодном растворителе, водным раствором гидроксида щелочного металла (например, NaOH или KOH).
Один вариант осуществления настоящего изобретения представляет собой фармацевтический состав, первоначально описанный выше (то есть, первоначально описанный в части «Раскрытие изобретения»), где основная соль соединения I представляет собой соль щелочного металла соединения I (например, натриевая или калиевая соль соединения I).
Фармацевтические составы по настоящему изобретению включают композицию с контролируемой скоростью высвобождения, содержащую солюбилизирующий агент, гелеобразующий агент и, необязательно, растворимый в воде наполнитель. Пригодные солюбилизирующие агенты включают полоксамеры и макроголглицериды жирных кислот. Полоксамеры представляют собой блоксополимеры этиленоксида и пропиленоксида. Пригодные полоксамеры включают, например, полоксамеры, имеющие среднюю молекулярную массу в интервале от, приблизительно, 1000 до, приблизительно, 20000 при содержании оксиэтилена, составляющем от, приблизительно, 40 до, приблизительно, 90 мас.%. Репрезентативные полоксамеры, пригодные для использования в настоящем изобретении, включают полоксамер 188, полоксамер 237, полоксамер 338 и полоксамер 407. Пригодным макроголглицеридом жирной кислоты является стеароилмакроголглицерид, такой как GELUCIRE® 50/13 (распространяемый фирмой Gattefosse, Paramus, NJ), который представляют собой смесь моно-, ди- и триглицеридов и эфиров полиэтиленгликоля и моно- и ди-жирных кислот с температурами плавления в интервале от 46,0 до 51,0°C и величиной HLB, составляющей 13.
Пригодные гелеобразующие агенты включают эфиры глицерина и жирных кислот, такие как глицерилбегенат (например, Compritol® 888ATO, который является глицерилбегенатом, распространяемым фирмой Gattefosse) и высоковязкие HPMC. Термин "высоковязкие" HPMC относится к HPMC (гидроксипропилметилцеллюлоза), которая дает 2 мас.% (то есть, масса полимера/масса воды) водный раствор, имеющий вязкость, составляющую при 20°C, по меньшей мере, приблизительно, 2900 сП (cps) (1 сП=1 мПа·сек). Высоковязкая HPMC обычно дает 2 мас.% раствор, имеющий вязкость, по крайней мере, составляющую, приблизительно, 3100 сП (например, от, приблизительно, 3100 до, приблизительно, 100,000 сП) при 20°C. Пригодные высоковязкие HPMC включают такие HPMC, которые продают под торговой маркой METHOCEL® (Dow Chemical) (например, METHOCEL класса K4M, K15M, K100M) и METOLOSE® (Shin-Etsu). Высоковязкие HPMC могут быть использованы по-отдельности или в смесях из двух и более компонентов, где полимерная смесь представляет 2 мас.% раствор со средней вязкостью, составляющей, по меньшей мере, приблизительно, 2900 сП, и обычно составляющей по меньшей мере, приблизительно, 3100 сП. Средняя вязкость полимерной смеси обычно отличается от вязкости каждого составляющего полимера.
Пригодные растворимые в воде наполнители включают сахара, такие как лактоза, глюкоза, фруктоза, маннит и декстроза. В частности, пригодными являются лактоза и маннит. Лактоза является предпочтительным растворимым в воде наполнителем.
Еще один вариант осуществления настоящего изобретения представляет собой фармацевтический состав, определенный выше, в котором солюбилизирующий агент содержит полоксамер; гелеобразующий агент содержит высоковязкую гидроксипропилметилцеллюлозу; а необязательный растворимый в воде наполнитель содержит лактозу.
Еще один вариант осуществления настоящего изобретения представляет собой фармацевтический состав, определенный выше, в котором основную соль соединения I используют в количестве, находящемся в интервале от, приблизительно, 5 до, приблизительно, 75 мас.% по содержанию свободного фенола; солюбилизирующий агент содержит полоксамер, который используют в количестве, находящемся в интервале от, приблизительно, 5 до, приблизительно, 25 мас.%; гелеобразующий агент содержит высоковязкую гидроксипропилметилцеллюлозу, которую используют в количестве, находящемся в интервале от, приблизительно, 2 до, приблизительно, 15 мас.%; и необязательный водорастворимый наполнитель содержит лактозу, которую используют в количестве, находящемся в интервале от нуля до, приблизительно, 15 мас.%.
Фармацевтические составы по настоящему изобретению могут содержать дополнительные компоненты, включающие разбавители, смазывающие вещества, разрыхлители, антиоксиданты и тому подобное. Соответственно, еще один вариант осуществления настоящего изобретения представляет собой фармацевтический состав, определенный первоначально или определенный в любом из вышеприведенных вариантов осуществления, в которых состав дополнительно содержит разбавитель и смазывающее вещество.
Другой вариант осуществления настоящего изобретения представляет собой фармацевтический состав, первоначально определенный выше или определенный в любом из предшествующих вариантов осуществления, где состав является инкапсулированным или спрессованным в таблетку.
Еще один вариант осуществления настоящего изобретения представляет собой фармацевтический состав, определенный первоначально, в котором соединение I является соединением A. Этот состав здесь альтернативно обозначают как " состав Fl" или "Fl состав ".
Еще один вариант осуществления настоящего изобретения представляет собой Fl состав, определенный выше, в котором основная соль соединения I представляет собой соль щелочного металла соединения A.
Еще один вариант осуществления настоящего изобретения представляет собой Fl состав, определенный выше, в котором основная соль соединения I представляет собой калиевую соль соединения A. В одном аспекте этого варианта осуществления, калиевая соль соединения A является формой 1 кристаллической калиевой соли соединения A; где форма 1 калиевой соли является безводной кристаллической солью, характеризуемой по порошковой рентгенограмме, которую получают, используя излучение меди Кα (то есть, источником излучения является излучение, представляющее комбинацию CuKα1 и CuKα2), которое охватывает значения 2θ (то есть, отражения при значениях 2θ), составляющие 5,9, 12,5, 20,0, 20,6 и 25,6 градусов.
Еще один вариант осуществления настоящего изобретения представляет собой Fl состав, первоначально определенный выше, где солюбилизирующий агент содержит полоксамер; гелеобразующий агент содержит высоковязкую гидроксипропилметилцеллюлозу; а необязательный водорастворимый наполнитель содержит лактозу. В одном аспекте этого варианта осуществления, основная соль соединения A является калиевой солью соединения A, которую используют в количестве, находящемся в интервале от, приблизительно, 5 до, приблизительно, 75 мас.%, исходя из содержания свободного фенола. Полоксамер используют в количестве, находящемся в интервале от, приблизительно, 5 до, приблизительно, 25 мас.%. Высоковязкую гидроксипропилметилцеллюлозу используют в количестве, находящемся в интервале от, приблизительно, 2 до, приблизительно, 15 мас.%. Лактозу используют в количестве, находящемся в интервале от, приблизительно, 15 мас.%. В предпочтительном аспекте этого варианта осуществления, основная соль соединения A является калиевой солью соединения A, которую используют в количестве, заключенном в интервале от, приблизительно, 25 до, приблизительно, 75 мас.%, исходя из содержания свободного фенола. Полоксамер используют в количестве, заключенном в интервале от, приблизительно, 10 до, приблизительно, 20 мас.%. Высоковязкую гидроксипропилметилцеллюлозу используют в количестве, заключенном в интервале от, приблизительно, 3 до, приблизительно, 9 мас.%. Лактозу используют в количестве, находящемся в интервале от, приблизительно, 3 до, приблизительно, 9 мас.%. В этом варианте осуществления и предыдущих его аспектах, предпочтительным полоксамером является полоксамер 407 (особенно, полоксамер 407, измельченный до среднего размера частицы, находящемся в интервале от, приблизительно, 50 до, приблизительно, 150 микрон и, предпочтительно, измельченный до среднего размера частицы, заключенного в интервале от, приблизительно, 50 до, приблизительно, 105 микрон). Высоковязкая гидроксипропилметилцеллюлоза представляет собой HPMC K4M; а лактоза представляет собой высушенный спрей водного раствора лактозы. В частности, было обнаружено, что измельченный полоксамер дает более однородные и гомогенные смеси с частицами калиевой соли соединения А (в особенности, формы 1 кристаллической калиевой соли). В предшествующих аспектах этого варианта осуществления, калиевая соль соединения A, предпочтительно, является формой 1 кристаллической калиевой соли соединения A.
Еще один вариант осуществления настоящего изобретения представляет собой Fl состав, первоначально определенный выше или определенный в любом из предшествующих вариантов осуществления, где Fl состав дополнительно содержит разбавитель и смазывающее вещество.
Еще один вариант осуществления настоящего изобретения представляет собой Fl состав, первоначально определенный выше или определенный в любом из предшествующих вариантов осуществления, где состав является инкапсулированным или спрессованным в таблетку. В одном аспекте этого варианта осуществления, состав Fl является инкапсулированным для того, чтобы получить капсулу, содержащую основную соль соединения A (например, калиевую соль соединения А) в количестве, находящемся в интервале от, приблизительно, 5 мг до, приблизительно, 1000 мг (например, от, приблизительно, 5 мг до, приблизительно, 900 мг, или от, приблизительно, 5 мг до, приблизительно, 600 мг, или от, приблизительно, 10 мг до, приблизительно, 400 мг). В еще одном аспекте этого варианта осуществления Fl является спрессованным в таблетку, содержащую основную соль соединения A (например, калиевую соль соединения А) в количестве, находящемся в интервале от, приблизительно, 5 мг до, приблизительно, 1000 мг (например, от, приблизительно, 5 мг до, приблизительно, 900 мг или от, приблизительно, 5 мг до, приблизительно, 600 мг, или от, приблизительно, 10 мг до, приблизительно, 400 мг).
Заметим, что любая приводимая здесь ссылка на количество основной соли соединения I обозначает количество соединения I в свободном состоянии, не в форме соли. Таким образом, например, фраза «таблетка композиции, содержащая основную соль соединения I в количестве, находящемся в интервале от, приблизительно, 5 мг до, приблизительно, 1000 мг», обозначает таблетку композиции, содержащую количество лекарственного вещества соли, эквивалентное, приблизительно, количеству от 5 мг до, приблизительно, 1000 мг исходного соединения I (свободного фенола).
Еще один вариант осуществления настоящего изобретения представляет собой фармацевтический состав для перорального введения в форме твердой дозы (альтернативно обозначаемый здесь как "Состав F2" или "F2 состав "), которая содержит: (i) эффективное количество калиевой соли соединения A; (ii) композицию с контролируемой скоростью высвобождения, содержащую солюбилизирующий агент, гелеобразующий агент и водорастворимый наполнитель; (iii) разбавитель и (iv) смазывающее вещество; где солюбилизирующий агент содержит полоксамер; гелеобразующий агент содержит высоковязкую гидроксипропилметилцеллюлозу; водорастворимый наполнитель содержит лактозу; разбавитель содержит микрокристаллическую целлюлозу и, необязательно, фосфат кальция; а смазывающее вещество содержит стеарат металла и стеарилрилфумарат металла. В одном аспекте этого варианта осуществления, калиевую соль соединения A используют в количестве, находящемся в интервале от, приблизительно, 40 до, приблизительно, 60 мас.%, исходя из содержания свободного фенола; полоксамер используют в количестве, находящемся в интервале от, приблизительно, 10 до, приблизительно, 20 мас.%; высоковязкую гидроксипропилметилцеллюлозу используют в количестве, находящемся в интервале от, приблизительно, 3 до, приблизительно, 9 мас.%; лактозу используют в количестве, находящемся в интервале от, приблизительно, 3 до, приблизительно, 9 мас.%; микрокристаллическую целлюлозу используют в количестве, находящемся в интервале от, приблизительно, 5 до, приблизительно, 30 мас.%; фосфат кальций используют в количестве, находящемся в интервале от, приблизительно, нуля до, приблизительно, 15 мас.%; и стеарат металла и стеарилрилфумарат металла, каждый независимо, используют в количестве, находящемся в интервале от, приблизительно, 1 до, приблизительно, 3 мас.%. Предшествующий аспект отличает то, что полоксамер является полоксамером 407, измельченным до частиц, средний размер которых находится в интервале от приблизительно, 50 до 150 микрон; высоковязкая гидроксипропилметилцеллюлоза представляет собой HPMC K4M; лактоза представляет собой высушенный спрей водного раствора лактозы; микрокристаллическая целлюлоза представляет собой AVICEL PH-102; фосфат кальций является двухосновным фосфатом кальция; стеарат металла является стеаратом магния; и стеарилфумарат металл представляет собой стеарилфумарат натрия. В этом варианте осуществления и его предшествующих аспектах, калиевая соль соединения A предпочтительно, является формой 1 кристаллической калиевой соли соединения A.
Другой вариант осуществления по настоящему изобретению является F2 составом, только что определенным или определенным, исходя из его особенностей, где состав является инкапсулированным или спрессованным в таблетку, например, в капсулу или таблетку, содержащую калиевую соль соединения A, в количестве, которое находится в интервале от, приблизительно, 100 мг до, приблизительно, 600 мг, исходя из содержания свободного фенола.
Если не оговорено особо, массовые проценты, приведенные здесь, считают от общей массы всех компонентов композиции (учитывая, что, как было обозначено ранее, массовый процент основной соли соединения I выражают как массовый процент формы свободного основания соединения).
Как описано выше, фармацевтические составы по настоящему изобретению могут включать в себя разбавитель и смазывающее вещество. Разбавитель (в данной области техники обозначаемый также как "наполнитель") представляет собой вещество, используемое для придания объема композиции. Разбавитель может быть использован, например, для получения достаточного объема и/или сжимаемости, чтобы дать возможность композиции быть спрессованной в таблетку, имеющую удобный размер. Пригодные разбавители включают в себя безводный двухосновный фосфат кальция, дигидрат двухосновного фосфата кальция, трехосновный фосфат кальция, сульфат кальция, кальцийкарбоксиметилцеллюлозу, микрокристаллическую целлюлозу и порошкообразную целлюлозу. Предпочтительным разбавителем для использования в составах Fl и F2 является микрокристаллическая целлюлоза, необязательно, в комбинации с фосфатом кальция.
Пригодные формы микрокристаллической целлюлозы для использования в фармацевтических составах по изобретению включают в себя, кроме прочих, материалы, продаваемые как AVICEL PH-101, AVICEL PH-102, AVICEL PH-103 и AVICEL PH-105 (все распространяются фирмой FMC Corporation) и их смеси. Таким образом, например, микрокристаллическая целлюлоза, используемая в составах Fl и F2, может представлять собой AVICEL PH-102 или AVICEL PH-105 или их смесь.
Смазывающее вещество может иметь одну или несколько функций, зависящих от лекарственной формы композиции. Смазывающее вещество может, например, препятствовать прилипанию спрессованных таблеток к компрессорному оборудованию. Оно может улучшить движение гранул, получаемых гранулированием композиции перед компрессией или капсулированием, и/или оно может улучшить движение негранулированного порошка при наполнении капсулы. Пригодные смазывающие вещества включают стеарат кальция, глицерилмоностеарат, глицерилпальмитостеарат, гидрированное касторовое масло касторовое масло, гидрированное растительное масло, легкое минеральное масло, стеарат магния, минеральное масло, полиэтиленгликоль, стеариновая кислота, тальк, стеарат цинка, стеарилфумарат натрия. В одном аспекте изобретения, смазывающее вещество, используемое в составе по изобретению, является стеаратом магния, стеарилфумаратом натрия или комбинацией этих двух соединений. Когда фармацевтический состав является составом Fl или F2, смазывающее вещество обычно представляет собой комбинацию стеарата магния и стеарилфумарата натрия.
Фармацевтический состав по изобретению может также содержать разрыхлитель, который представляет собой вещество или смесь веществ, используемых для облегчения разделения или диспергирования состава после введения. Пригодные разрыхлители включают в себя альгиновую кислоту, кальций- карбоксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу, коллоидную двуокись кремния, натрий-кроскармеллозу, кросповидон, гуаровую камедь, алюмосиликат магния, метилцеллюлозу, микрокристаллическую целлюлозу, полиакрилин калия, повидон, альгинат натрия, натрийкрахмалгликолат и крахмал. Разрыхлитель, используемый в фармацевтическом составе по изобретению, может быть “супер-разрыхлителем”, таким как натрий-кроскармеллоза, кросповидон или натрийкрахмалгликолат.
Антиоксидант может быть использован в фармацевтическом составе по изобретению для того, чтобы препятствовать окислительной деструкции активного ингредиента и/или других компонентов фармацевтического состава или минимизировать ее. Пригодный антиоксидант включает в себя токоферол или его сложный эфир, алкилгаллат (например, пропилгаллат), бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), аскорбиновую кислоту, аскорбат натрия, лимонную кислоту и метабисульфит натрия. Фармацевтические составы по настоящему изобретению могут, например, включать в себя BHA.
Фармацевтические составы по настоящему изобретению могут быть сформированы в спрессованные таблетки или капсулы. Спрессованные таблетки могут быть получены посредством гранулирования, где общий размер частиц состава увеличивается путем постоянного агрегирования более мелких частиц. Может быть использовано влажное или сухое гранулирование. Влажное гранулирование может быть выполнено, например, смачивая хорошо перемешанную смесь сухих ингредиентов (например, соли соединения I, композиции, контролирующей скорость высвобождения, разбавителя, необязательно разрыхлителя, и, необязательно антиоксиданта) с удовлетворительным растворителем (например, водой или водой вместе со спиртовым сорастворителем) для увлажнения сухой смеси, так чтобы частицы в смеси соединялись друг с другом, образуя более крупные частицы, и затем просеивая, измельчая, или иным образом, воздействуя на размер частиц. Как только получаемый жидкий гранулят образован, он может затем быть высушен и измельчен до частиц нужного размера (то есть, гранул). Гранулы смешивают со смазывающим веществом, и смазанные гранулы спрессовывают в таблетки.
Для чувствительных к влаге композиций, гранулирование может быть выполнено или посредством влажного гранулирования с неводным растворителем или путем сухого гранулирования. Сухое гранулирование может также быть перспективной альтернативой влажному гранулированию, когда композиция является термально чувствительной и подвержена деструкции при температурах, используемых во время высушивания влажных гранул. Сухое гранулирование может быть выполнено, например, путем сухого смешивания соли соединения I, композиции, контролирующей скорость высвобождения, первой части смазывающего вещества и, необязательно, других ингредиентов (например, разбавителя, или разбавителя и разрыхлителя), затем прессуя смешанную композицию в б