Производные 4-фенилпиримидин-2-карбонитрила
Иллюстрации
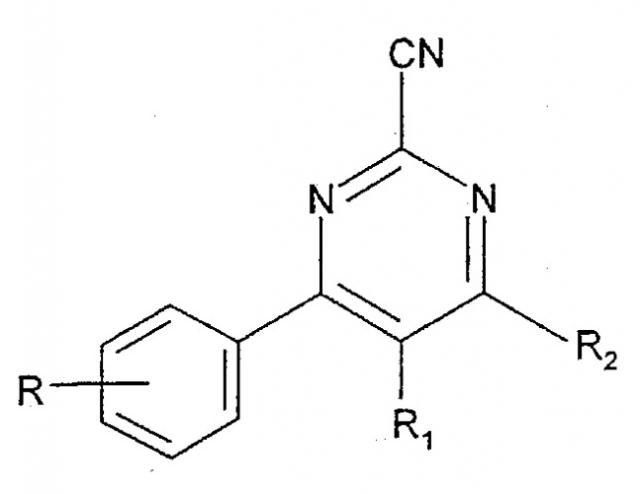
Показать всеИзобретение относится к новым производным 4-фенилпиримидин-2-карбонитрила формулы I
значения R, R1, R2 приведены в формуле изобретения) или к их фармацевтически приемлемым солям, обладающим свойствами ингибитора катепсина К и катепсина S. Изобретение также относится к применению производных формулы I для лечения катепсин К- и катепсин S-связанных нарушений, а также к фармацевтической композиции, содержащей указанное производное. 5 н. и 4 з.п. ф-лы.
Реферат
Изобретение относится к производным 4-фенилпиримидин-2-карбонитрила, к содержащим их фармацевтическим композициям, а также к применению этих производных для получения лекарственного средства для лечения катепсин K- и катепсин S-связанных заболеваний, таких как атеросклероз, заболеваний костей, таких как остеопороз, воспалительных и иммунных нарушений, таких как ревматоидный артрит и рассеянный склероз, и хронической боли, такой как невропатическая боль.
Цистеинпротеазы представляют собой класс пептидаз, характеризующихся наличием остатка цистеина в каталитическом сайте фермента, и эти протеазы связаны с нормальным разложением и процессингом белков. Многие патологические нарушения или заболевания являются результатом аномальной активности цистеинпротеаз, такой как суперэкспрессия или усиленная активация. Цистеиновые катепсины, например катепсин B, K, L, S, V, F, представляют собой класс лизосомальных ферментов, которые участвуют в различных нарушениях, включая воспаление, ревматоидный артрит, остеоартрит, остеопороз, опухоли, коронарные заболевания, атеросклероз, аутоиммунные заболевания и инфекционные заболевания.
Катепсин K обладает сильной коллагенолитической, эластазной и желатиназной активностью (Bromme et al., J. Biol, Chem, 271, 2126-2132, 1996) и преимущественно экспрессируется в остеокластах (Bromme et Okamoto, Biol. Chem. Hopp-Seyler, 376, 379-384, 1995). Он расщепляет ключевые белки костного матрикса, включая коллаген типа I и II (Kaffienah et al., Biochem. J. 331, 727-732, 1998), желатин, остеопонтин и остеонектин, и также участвует в метаболизме внеклеточного матрикса, необходимом для нормального роста и восстановления костей (Bossard et al., J. Biol. Chem. 271, 12517-12524, 1996). Ингибирование катепсина K должно привести к снижению опосредуемой остеокластом резорбции кости.
Ингибиторы катепсина K могут поэтому представлять собой новые терапевтические средства для лечения болезненных состояний у человека, таких как остеопороз.
Sukhova et al (J. Clin. Invest. 102, 576-583, 1998) продемонстрировали, что клетки (макрофаги), которые мигрируют и накапливаются в развивающихся атеросклеротических бляшках у человека, также синтезируют мощные эластазы катепсин K и S.
Деградация матрикса, особенно в волокнистой крышке таких бляшек, является критическим процессом в дестабилизации атеросклеротического поражения. Таким образом, метаболизм компонентов внеклеточного матрикса, коллагена и эластина, которые придают герметичность волокнистому колпачку поражения, может критически влиять на клинические проявления атеросклероза, такие как тромбоз коронарной артерии в результате разрушения атеросклеротической бляшки. Ингибирование катепсинов K и/или S на участках бляшек, склонных к разрыву, может таким образом представлять собой эффективный способ предотвращения таких событий.
Как катепсин K, катепсин S также обладает сильной эластолитической (Arch. Biochem. Biophys., 299, 334-339, 1992; J. Biol. Chem., 267, 7258-7262, 1992) и коллагенолитической активностью (Biochem. J., 256, 433-440, 1998). Патологически измененные человеческие артерии суперэкспрессируют катепсин K и S и показывают взаимный дефицит цистатина C, наиболее распространенного эндогенного ингибитора цистеинпротеаз (J. Clin. Invest. 102, 576-583, 1998; J. Clin. Invest. 104, 1191-1197, 1999). Sukhova et al (J. Clin. Invest. 111, 897-906, 2003) продемонстрировали, что дефицит катепсина S уменьшает атеросклероз у мышей с дефицитом ЛПНП-рецепторов. Bromme et al (Biochem. Biophys. Research Comm. 312, 1019-1024, 2003) также продемонстрировали, что и катепсин К и S способны к разложению HDL3 и свободного от липидов apoA-I in vitro. Это дополнительно указывает на катепсин К и S как терапевтическую цель для атеросклероза.
Показано, что катепсин S является ключевым ферментом, участвующим в инвариантном процессинге цепи в антигенпредставляющих клетках человека и мыши (J. Clin. Invest. 110, 361-369, 2002). Этот инвариантный процессинг цепи регулирует функцию класса II MHC и связан с воспалительными и аутоиммунными нарушениями. Saegusa et al (J. Clin. Invest. 110, 361-369, 2002) продемонстрировали, что ингибирование катепсина S in vivo изменяет представление аутоантигена и развитие органоспецифического аутоиммунитета.
В Международной Заявке на патент WO 03/020287 также раскрыто, что мРНК для катепсина S активируется в животных моделях хронической боли и что введение ингибиторов катепсина S вызывает реверсирование механической гиперальгезии у этих животных.
Производные 4-аминопиримидин-2-карбонитрила были описаны в качестве ингибиторов катепсинов К и/или S в Международной заявке на патент WO 03/020278 (Novartis Pharma GMBH), тогда как структурно-родственные производные 4-аминопиримидин-2-карбонитрила были недавно раскрыты в WO 04/000819 (ASTRAZENECA AB) как ингибиторы катепсина S. Пирролопиримидины были аналогично раскрыты как ингибиторы катепсина K и/или S в WO 03/020721 (Novartis Pharma GMBH) и WO 04/000843 (ASTRAZENECA AB).
В настоящее время обнаружено, что производные 4-фенилпиримидин-2-карбонитрила, имеющие общую формулу I
в которой R обозначает 1-3 возможных заместителя, независимо выбранных из (С1-6)алкила (в случае необходимости замещенного одним или более галогенами), (С1-6)алкилокси (в случае необходимости замещенного одним или более галогенами), циано, галогена, гидрокси, нитро, (С3-6)циклоалкила, CO(С1-6)алкила, S(С1-6)алкила, SO(С1-6)алкила, SO2(С1-6)алкила, SO2NH(С1-6)алкила, SO2NH2, NHCO(С1-8)алкила и CO2H; или 2 заместителя R в смежных положениях вместе обозначают OCH2O, OCH2CH2O или CH2CH2O;
R1 обозначает Н или (С1-6)алкил;
R2 обозначает (С2-6)алкил, в случае необходимости замещенный ОН, (С1-4)алкилокси, (С6-10)арилокси, (С6-10)арил(С1-4)алкилокси, одним или более атомов галогена, NR3R4, CO2H или CONR6R7;
R3 и R4 независимо обозначают Н, (С1-8)алкил [в случае необходимости замещенный одним или более атомов галогена, (С1-4)алкилокси или (С6-10)арилокси], (С3-8)циклоалкил [в случае необходимости замещенный одним или более атомов галогена], (С1-4)алкил, замещенный 4-8-членным насыщенным гетероциклом, включающим гетероатом, выбранный из О, S и NR5, 4-8-членный насыщенный гетероцикл, включающий гетероатом, выбранный из О, S и NR5, (С6-10)арил, (С2-9)гетероарил [в случае необходимости замещенный 1-3 заместителями, выбранными из галогена, CF3, (С1-4)алкила и (С1-4)алкилокси], (С6-10)арил(С1-4)алкил или (С2-9)гетероарил(С1-4)алкил; или
R3 и R4 вместе с азотом, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, в случае необходимости замещенный одним или более галогенами или CONR8R9, и который может дополнительно включать 1 или более гетероатомов, выбранных из О, S и NR5; или
R3 обозначает Н или (С1-4)алкил; и R4 обозначает (С1-4)алкил, замещенный CONR8R9, COOR10, NR8, R9, NR8COR9 или NR8CONR9R10;
R5 обозначает Н, (С1-4)алкил [в случае необходимости замещенный (С3-8)циклоалкилом, (С6-10)арилом или (С2-5)- гетероарилом], (С3-8)циклоалкил, (С6-10)арил или (С2-5)гетероарил;
R6 и R7 независимо обозначают Н, (С1-4)алкил или 4-8-членный насыщенный гетероцикл, включающий гетероатом, выбранный из О, S и NR5; или
R6 и R7 вместе с азотом, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, в случае необходимости замещенный одним или более галогенами, и который может дополнительно включать 1 или более гетероатомов, выбранных из О, S и NR5;
R8 и R9 независимо обозначают Н или (С1-4)алкил; или
R8 и R9 вместе с атомами, с которыми они связаны, образуют 4-8-членный насыщенный гетероцикл, который может дополнительно включать 1 или более гетероатомов, выбранных из О, S и NR5;
R10 обозначает Н или (С1-4)алкил;
или их фармацевтически приемлемая соль являются ингибиторами катепсина K и катепсина S и могут поэтому использоваться для получения лекарственного средства для лечения катепсин K- и катепсин S-связанных нарушений, таких как, например, атеросклероз, заболевания костей, такие как остеопороз, воспалительные и иммунные нарушения, такие как ревматоидный артрит и рассеянный склероз, и хроническая боль, такая как невропатическая боль.
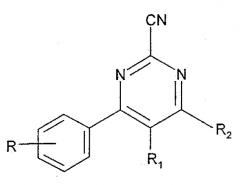
Следующий аспект изобретения относится к производным 4-фенилпиримидин-2-карбонитрила, имеющим общую формулу I
формула I
в которой
R обозначает 1-3 возможных заместителя, независимо выбранных из (С1-6)алкила [в случае необходимости замещенного одним или более галогенами], (С1-6)алкилокси [в случае необходимости замещенного одним или более галогенами], циано и галогена;
R1 обозначает Н или (С1-6)алкил;
R2 обозначает (С2-6)алкил, в случае необходимости замещенный ОН, (С1-4)алкилокси, одним или более атомами галогена или NR3R4;
R3 и R4 независимо обозначают Н, (С1-8)алкил [в случае необходимости замещенный одним или более галогенами], (С3-8) циклоалкил [в случае необходимости замещенный одним или более галогенами], 4-8-членный насыщенный гетероцикл, включающий гетероатом, выбранный из О, S и NR5, (С6-10)арил, (С2-9)гетероарил, (С6-10)арил(С1-4)алкил или (С2-9)гетероарил-(С1-4)алкил; или
R3 и R4 вместе с азотом, с которым они связаны, образуют 4-8-членный насыщенный гетероцикл, в случае необходимости замещенный одним или более галогенами, и который может дополнительно включать 1 или более гетероатомов, выбранных из О, S и NR5;
R5 обозначает Н, (С1-4)алкил [в случае необходимости замещенный (С3-8) циклоалкилом, (С6-10)арилом или (С2-5) гетероарилом], (С3-8)циклоалкил, (С6-10)арил или (С2-5)гетероарил; или к их фармацевтически приемлемой соли.
Термин (С1-6)алкил, как используется в определениях формулы I, означает разветвленный или неразветвленный алкил, содержащий 1-6 атомов углерода, такой как гексил, пентил, 3-метилбутил, бутил, изобутил, третичный бутил, пропил, изопропил, этил и метил.
Термин (С2-6)алкил аналогично означает разветвленный или неразветвленный алкил, содержащий 2-6 атомов углерода, такой как гексил, пентил, 3-метилбутил, бутил, изобутил, третичный бутил, пропил, изопропил и этил. Предпочтительным (С2-6)алкилом, как используется в определении R2 в формуле I, является н-пропил.
Термин (С1-4)алкил означает разветвленный или неразветвленный алкил, содержащий 1-4 атома углерода, такой как бутил, изобутил, третичный бутил, пропил, изопропил, этил и метил.
Термин (С1-8)алкил означает разветвленный или неразветвленный алкил, содержащий 1-8 атомов углерода, такой как октил, гептил, гексил, пентил, 3-метилбутил, бутил, изобутил, третичный бутил, пропил, изопропил, этил и метил.
Термин (С3-6) циклоалкил означает циклоалкил, содержащий 3-6 атомов углерода, такой как циклогексил, циклопентил, циклобутил и циклопропил.
Термин (С3-8) циклоалкил аналогично означает циклоалкил, содержащий 3-8 атомов углерода, такой как циклооктил, циклогептил, циклогексил, циклопентил, циклобутил и циклопропил.
Термин (С6-10)арил означает радикал, полученный из ароматической группы, содержащей 6-10 атомов углерода, такой как, например, фенил и нафтил.
Термин (С6-10)арил(С1-4)алкил означает (С1-4)алкил, который замещен (С6-10)арилом, таким как, например, бензил.
Термин (С2-9)гетероарил означает 5- или 6-членный циклический ароматический радикал, содержащий 1-3 гетероатома, выбранных из азота, кислорода или серы, и к которому может быть присоединено другое 5- или 6-членное (гетеро)ароматическое кольцо. Примерами таких гетероарильных групп являются пиридил, имидазолил, пиразолил, пиримидинил, тиазолил, изотиазолил, оксазолил, изоксазолил, тиенил, оксадиазолил, хинолил, изохинолил, бензотиазолил, бензимидазолил и т.п. Предпочтительными гетероарилами являются 2-пиридил и 3-пиридил.
Термин (С2-5)гетероарил означает 5- или 6-членный циклический ароматический радикал, содержащий 1-3 гетероатома, выбранных из азота, кислорода или серы. Примерами таких гетероарильных групп являются пиридил, имидазолил, пиразолил, пиримидинил, тиазолил, изотиазолил, оксазолил, изоксазолил, тиенил, оксадиазолил и т.п. Предпочтительными гетероарилами являются 2-пиридил и 3-пиридил.
Термин (С2-9)гетероарил(С1-4)алкил означает (С1-4)алкил, замещенный (С2-9)гетероарилом, такой как, например, пиридин-4-илметил.
В определениях в формуле I R3 и R4, и/или R6 и R7, и/или R8 и R9 могут, вместе с азотом, с которым они связаны, образовывать 4-8-членный насыщенный гетероцикл, такой как аназетидин, пирролидин, пиперидин или 1Н-азепин. Такие кольца могут содержать 1 или более дополнительных гетероатомов, выбранных из О, S или NR5, с образованием таких колец, как морфолин, тиоморфолин, гексагидро-1,4-оксазепин, пиперазин, гомопиперазин, имидазолидин или тетрагидротиазол.
Термин «галоген» означает F, Cl, Br или I. Когда галоген является заместителем в алкильной группе, предпочтительным является F. Предпочтительным галоген-замещенным алкилом является трифторметил.
Предпочтительными согласно изобретению производными 4-фенилпиримидин-2-карбонитрила согласно формуле I являются такие, в которых R2 обозначает (С2-6)алкил, замещенный ОН, (С1-4)алкилокси, одним или более галогенов или NR3R4.
Другими предпочтительными соединениями являются соединения, в которых R2 обозначает пропил, замещенный в положении 3 группой NR3R4.
Более предпочтительными являются производные формулы I, в которых 4-фенил включает трифторметиловый заместитель в метаположении.
Особенно предпочтительными производными 4-фенилпиримидин-2-карбонитрила по изобретению являются:
- 4-(3-гидрокси-1-пропил)-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-(3-(пиперидин-1-ил)-пропил)-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-этилпропиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2карбонитрил;
- 4-[3-(4-метил-[1,4]диазепин-1-ил)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-(3-циклогексиламинопропил)-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-{3-[метил-(1-метилпиперидин-4-ил)-амино]-пропил)-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(4-метилпиперазин-1-ил)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-(3-изопропиламинопропил)-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(4-пиридин-2-ил-пиперазин-1-ил)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(карбамоилметиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(карбоксиметиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(2-диметиламиноэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(2-ацетиламиноэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-{3-[2-(2-оксоимидазолидин-1-ил)-этиламино]-пропил}-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-(3,4-диметилфенил)-6-[3-(метилкарбамоилметиламино)-пропил]-пиримидин-2-карбонитрил;
- 4-[3-(2-ацетиламиноэтиламино)-пропил]-6-(3,4-диметилфенил)-пиримидин-2-карбонитрил;
- 4-(3,4-диметилфенил)-6-{3-[2-(2-оксоимидазолидин-1-ил)-этиламино]-пропил}-пиримидин-2-карбонитрил;
- 4-[3-(3-диметиламинопропиламино)-пропил]-6-(3,4-диметилфенил)-пиримидин-2-карбонитрил;
- 4-(3,4-диметилфенил)-6-{3-[2-(1-метилпирролидин-2-ил)-этиламино]-пропил}-пиримидин-2-карбонитрил;
- 4-(3-циклопропиламино-пропил)-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-(S)-метил-2-метоксиэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-(S)-карбамоилэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-(R)-карбамоилэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-этил-1-метилпропиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-метилциклопропиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(2-гидроксиэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(1-карбамоил-1-метилэтиламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил;
- 4-[3-(2-оксопирролидин-3-(S)-иламино)-пропил]-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил; или их фармацевтически приемлемая соль.
Изобретение относится в следующем аспекте к фармацевтическим композициям, включающим производное 4-фенилпиримидин-2-карбонитрила, имеющее общую формулу I, или его фармацевтически приемлемую соль, в смеси с фармацевтически приемлемыми вспомогательными веществами.
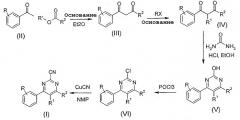
Производные 4-фенилпиримидин-2-карбонитрила общей Формулы I могу быть получены, как изображено в Схеме 1, конденсацией производного ацетофенона, имеющего формулу (II), в которой R имеет значение, как определено выше, со сложным эфиром формулы R'-ОС(O)R2, в котором R' представляет собой (С1-6)алкил, и R2 имеет значение, определенное выше, с получением производного 1,3-диона формулы (III). В случае необходимости, группа R1 может быть введена алкилированием производного 1,3-диона в присутствии основания, например карбоната калия, и подходящего растворителя, например ТГФ или ацетона, при нагревании, с получением производного 2-алкил-1,3-диона, имеющего формулу (IV). Циклизацией 1,3-диона (IV) с мочевиной в присутствии кислоты, например, концентрированного водного гидрохлорида в подходящем растворителе, например этаноле, с нагреванием получают производное 2-гидрокси-4-фенилпиримидина формулы (V). Обработка соединения формулы (V) POCl3 при высокой температуре приводит к производному 2-хлор-4-фенилпиримидина формулы (VI), которое в результате цианирования цианидом меди в растворителе, например диметилформамиде или N-метилпирролидиноне, и с помощью микроволнового нагревания приводит к производному 4-фенилпиримидин-2-карбонитрила общей Формулы I.
Стадия цианирования может также быть осуществлена с использованием цианида цинка в качестве реагента с катализатором на основе переходного металла, например тетракистрифенилфосфинпалладием, в подходящем растворителе, например диметилформамиде, диметоксиэтане или N-метилпирролидиноне.
Схема 1
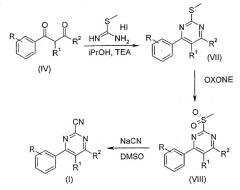
В альтернативном способе, как изображено на Схеме 2, производное 1,3-диона формулы (IV) обрабатывают S-метил изотиоуриниййодидом в подходящем растворителе, например изопропаноле, и подходящем основании, например, триэтиламине, получая производное 2-метилсульфанил-4-фенилпиримидина формулы (VII). Окисление производного формулы VII моноперсульфатом калия (Oxone) или м-хлорпербензойной кислотой (MCPBA) в подходящем растворителе, например метаноле, воде, хлороформе или их смеси, приводит к производному 2-метансульфонил-4-фенилпиримидина формулы (VIII), которое в результате обработки цианидом натрия в подходящем растворителе, например диметилсульфоксиде, приводит к производным 4-фенилпиримидин-2-карбонитрила общей Формулы I.
Схема 2
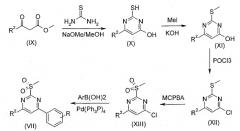
В другом способе, как изображено на Схеме 3, производное β-сложного кето-эфира формулы (IX), в которой R2 имеет значение, определенное выше, конденсируют с тиомочевиной в присутствии метилата натрия, получая производное 2-меркапто-4-гидроксипиримидина формулы (X), которое, в результате S-метилирования йодометаном в присутствии основания, например гидроксида калия, приводит к производному 2-метилсульфанил-4-гидроксипиримидина формулы (XI). Обработка соединения формулы XI POCl3 дает производное 2-метилсульфанил-4-хлорпиримидина формулы (XII), окисление которого с использованием MCPBA приводит к производному 2-метансульфонил-4-хлорпиримидина формулы (XIII).
Схема 3
Реакция сочетания соединения XIII с фенилбороновыми кислотами с использованием катализатора на основе переходного металла дает производные 2-метансульфонил-4-фенилпиримидина формулы (VII), которые могут впоследствии быть преобразованы в производные 4-фенилпиримидин-2-карбонитрила общей Формулы I обработкой цианидом натрия в подходящем растворителе, например диметилсульфоксиде.
В альтернативном способе, изображенном на схеме 4, для введения группы фенила в положение 4 пиримидина, соединение, имеющее формулу XIII (см. схему 3), может быть введено в реакцию с гексаметилбисстаннаном, с получением производного 2-метансульфонил-4-триметилстаннилпиримидина формулы (XIV), которое в результате реакции с цианидом натрия в диметилсульфоксиде приводит к производному 2-циано-4-триметилстаннилпиримидина формулы (XV). В результате реакции сочетания по Stille соединения формулы XV с арилгалидом с использованием катализатора на основе переходного металла, как описано в общей литературе, получают производное 4-фенилпиримидин-2-карбонитрила общей Формулы I.
Схема 4
Производные 4-фенилпиримидин-2-карбонитрила общей Формулы I, в которой R2 обозначает (С2-6)алкил, замещенный группой NR3R4, могут быть получены исходя из соответствующего спиртового производного, как изображено на схеме 5 для соединений по изобретению, в которых R2 обозначают заместитель, представляющий собой 3-OH-пропил.
Окислением подходящего спиртового производного формулы (I) перйодинатом Десса-Мартина, или с использованием альтернативной процедуры окисления, получают соответствующее производное альдегида согласно формуле (XVI), которое затем конденсируют с амином формулы HNR3R4 в условиях восстановительного аминирования, получая указанные производные 4-фенилпиримидин-2-карбонитрила по изобретению.
Схема 5
Производные 4-фенилпиримидин-2-карбонитрила общей Формулы I, в которой R2 обозначает (С2-6)алкилкарбоновую кислоту или карбоксамиды, могут быть получены исходя из соответствующего спиртового производного, как изображено на схеме 6 для соединений по изобретению, в которых R2 обозначает заместитель, представляющий собой 3-OH-пропил.
Окислением подходящего спиртового производного формулы (I) с использованием хлорита натрия и гипохлорида натрия в присутствии ТЕМРО в качестве катализатора получают соответствующую кислоту (XVIII). Реакцией сочетания этой кислоты с первичными или вторичными аминами с различными реагентами сочетания, например EDCI, PyBOP, HBTU и др., получают соответствующий карбоксамид (XIX) в качестве продукта реакции.
Схема 6
В другом способе, как изображено на схеме 7, для введения фенила в положение 4 пиримидина, соединение, имеющее формулу XV (см. схему 4), обрабатывают йодом, получая производное 2-циано-4-йодпиримидина формулы (XX). Затем, с использованием сочетания типа Stille, или Suzuki, или Negishi соединения формулы XX с арилбороновыми кислотами или другими целевыми ариловыми соединениями металлов с использованием катализатора на основе переходного металла, как описано в общей литературе, получают производные 4-фенилпиримидин-2-карбонитрила общей Формулы I.
Схема 7
В другом способе, как изображено на схеме 8, для введения R2 и фенила в положения 6 и 4 соответственно пиримидина, реакцией сочетания соединения XXI с арилгалидами с переходным металлом в качестве катализатора, с последующим удалением защитной группы бензила получают соединение общей формулы I, где R2 обозначает 3-гидроксипропил, который может быть далее дериватизирован согласно схеме 5 с получением соединения с различными R2 и фенилом в положениях 6 и 4 пиримидина.
Схема 8
Соединение XXI может синтезироваться согласно схеме 3 и схеме 4 с β-кетоэфиром с R2 как 4-бензоксипропил (XXIV), который может синтезироваться, как изображено на схеме 9. Реакцией 4-бензоксимасляной кислоты с кислотой Мелдрама в присутствии изопропенилхлорформиата с DMAP в качестве основания получают ацилированное производное кислоты Мелдрама, которое затем преобразуют в XXIV этанолизом с помощью кислоты. Альтернативно, соединение XXIV может также синтезироваться из этил- или метилацетоацетата (XXV) через широко задокументированную химию двойного аниона с 3-бензоксиэтилбромидом (XXVI) в качестве алкилирующего агента.
В получении производных 4-фенилпиримидин-2-карбонитрила общей Формулы I, в которой группа R2 содержит атом азота основного амина (в форме NR3R4 или NR5), такой азот должен быть временно защищен, например, с помощью защитной группы для лабильного к кислоте трет.-бутилоксикарбонила (Вос). Другие подходящие защитные группы для функциональных групп, которые должны быть временно защищены в ходе синтеза, известны в уровне техники, например, из Wuts, P. G.M. and Greene, T. W.: Protective Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999.
Схема 9
Соединения по изобретению, которые могут быть в форме свободного основания, могут быть выделены из реакционной смеси в форме фармацевтически приемлемой соли.
Фармацевтически приемлемые соли могут также быть получены путем обработки свободного основания формулы I органической или неорганической кислотой, такой как, но не ограничиваясь ими, хлорид водорода, бромид водорода, йодид водорода, серная кислота, фосфорная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, метансульфоновая кислота, фумаровая кислота, янтарная кислота, винная кислота, лимонная кислота, бензойная кислота и аскорбиновая кислота.
Соединения по изобретению могут существовать в сольватированной, а также в несольватированной формах, включая гидратированные формы. В общем, сольватированные формы эквивалентны несольватированным формам и входят в рамки настоящего изобретения.
Соединения согласно настоящему изобретению могут существовать как аморфные формы, но также возможны и многочисленные кристаллические формы. В общем, все физические формы эквивалентны для применений, рассмотренных в соответствии с настоящим изобретением, и входят в рамки этого изобретения.
Производные 4-фенилпиримидин-2-карбонитрила по изобретению и их соли могут содержать центр хиральности в одной или более боковых цепях R, R1-R10 и могут поэтому быть получены в виде чистого энантиомера, или как смесь энантиомеров, или как смесь, содержащая диастереомеры. Способы асимметричного синтеза, посредством которого получают чистые стереоизомеры, известны в уровне техники, например синтез с хиральной индукцией или проводимый исходя из хиральных промежуточных соединений, энантиоселективные ферментативные преобразования, разделение стереоизомеров или энантиомеров с использованием хроматографии на хиральных средах. Такие способы, например, описаны в Chirality in Industry (edited by A. N. Collins, G. N. Sheldrake and J. Crosby, 1992; John Wiley).
Было обнаружено, что соединения по изобретению являются ингибиторами человеческого катепсина K и катепсина S и могут поэтому, в следующем аспекте изобретения, использоваться в терапии и, в частности, для получения лекарственного средства для лечения остеопороза, атеросклероза и родственных катепсин K- и катепсин S-зависимых нарушений, например воспалительных и иммунных нарушений, таких как ревматоидный артрит, хроническая боль, такая как невропатическая боль, и других нарушений, связанных с аномальной резорбцией костей, таких как болезнь Педжета, остеоартрит, остеолитический рак кости и метастатическое заболевание кости.
Соединения по изобретению могут вводиться энтерально или парентерально и для человека предпочтительно в суточной дозе 0,001-100 мг на кг массы тела, предпочтительно 0,01-10 мг на кг массы тела. В смеси с фармацевтически подходящими вспомогательными средствами, например, как описано в стандартной ссылке Gennaro et al., Remington's Pharmaceutical Sciences, (20th ed., Lippincott Williams & Wilkins, 2000, см., в частности, Part 5: Pharmaceutical Manufacturing), соединения могут быть прессованы в твердые лекарственные формы, такие как пилюли, таблетки, или обработаны с получением капсул или суппозиториев. Посредством фармацевтически подходящих жидкостей соединения могут также быть использованы в форме раствора, суспензии, эмульсии, например, для использования в качестве препарата для инъекции или в виде спрея, например для использования в качестве спрея для носа.
Для получения лекарственных форм, например таблеток, можно использовать обычные добавки, такие как наполнители, красители, полимерные связующие и т.п. В общем, может использоваться любая фармацевтически приемлемая добавка, которая не нарушает функцию активных соединений.
Подходящие носители, с которыми композиции могут вводиться, включают лактозу, крахмал, производные целлюлозы и т.п. или их смеси, в подходящих количествах.
Изобретение далее иллюстрируется следующими примерами.
Методы
Общие химические процедуры. Все реактивы были либо приобретены из общих коммерческих источников, либо синтезированы согласно описанным в литературе процедурам с использованием коммерческих источников. Данные протонного ЯМР (1Н ЯМР) были получены на спектрометре Bruker DPX 400 и отнесены к внутреннему TMS. Масс-спектры регистрировали на Shimadzu LC-8A (ВЭЖХ) PE Sciex API 150EX LCMS. Аналитический анализ ЖХМС с обратной фазой был выполнен на колонке LUNA C18 (5µ; 30×4,6 мм) в условиях градиента (от 90% воды/0,1% муравьиной кислоты до 90% ацетонитрил/0,1% муравьиной кислоты) при скорости потока 4 мл/мин.
Аббревиатуры
Диметилформамид (ДМФ), N-метилпирролидинон (NMP), дихлорметан (DCM), диметилсульфоксид (ДМСО), тетрагидрофуран (ТГФ), 1,2-диметоксиэтан (DME), высокоэффективная жидкостная хроматография (ВЭЖХ), диизопропилэтиламин (DIPEA), триэтиламин (ТЕА), уширенный (br), синглет (s), дуплет (d), триплет (t), трифторуксусная кислота (ТФК), трет.-бутилоксикарбонил (Вос), 1-(3-диметиламинопропил)-3-этил карбодиимид HCl (EDCl), 1-гидроксибензотриазол (HOBt), 2,2,6,6-тетраметил-1-пиперидинилокси (ТЕМРО).
ПРИМЕР 1
4-Пропил-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил
A: 3-гидрокси-1-(3-трифторметилфенил)-гекс-2-ен-1-он
К перемешиваемой суспензии амида натрия (0,78 г) в эфире (40 мл), в атмосфере азота, добавляли 3-трифторацетофенон (1,52 мл). Смесь перемешивали в течение 5 минут, затем медленно добавляли этилбутират (1,32 мл). Полученную смесь нагревали с обратным холодильником в течение ночи, охлаждали до комнатной температуры и гасили водой (20 мл). Эфирный слой удаляли и водный слой подкисляли HCl (5M), затем экстрагировали простым эфиром (3 x 20 мл). Органические слои объединяли, промывали водой (20 мл), высушивали над сульфатом натрия и упаривали при пониженном давлении, получая сырой продукт в форме масла. Флэш-хроматографией на силикагеле получали 3-гидрокси-1-(3-трифторметилфенил)-гекс-2-ен-1-он в форме масла (0,74 г).
1Н ЯМР (CDCl3) δ: 8,12 (с, 1Н), 8,06 (д, 1Н), 7,77 (д, 1Н), 7,59 (т, 1Н), 6,19 (с, 1Н), 3,88 (уш. с, 1Н), 2,44 (т, 2H), 1,69-1,79 (м, 2H), 1,01 (т, 3H).
B: 6-пропил-4-(3-трифторметилфенил)-1 H-пиримидин-2-он
Перемешиваемую смесь 3-гидрокси-1-(3-трифторметилфенил)-гекс-2-ен-1-она (259 мг), мочевины (90 мг), HCl (0,15 мл, 5M) и этанола (5 мл) нагревали с обратным холодильником в течение 16 часов. Добавляли дополнительное количество мочевины (60 мг) и HCl (0,15 мл, 5M) и нагревание с обратным холодильником продолжали в течение 24 часов. Смеси позволяли охладиться и растворитель выпаривали при пониженном давлении. Остаток растворяли в смеси этилацетата (20 мл) и воды (20 мл), органический слой отделяли и затем промывали раствором насыщенного карбоната натрия (20 мл), затем водой (20 мл). Экстракт этилацетата высушивали над сульфатом натрия и упаривали при пониженном давлении, получая 6-пропил-4-(3-трифторметилфенил)-1H-пиримидин-2-он в виде твердого вещества коричневого цвета (204 мг). МС m/z 283,0 (M+1), 100%.
C: 2-хлор-4-пропил-6-(3-трифторметилфенил)-пиримидин
Смесь 6-пропил-4-(3-трифторметилфенил)-1H-пиримидин-2-она (204 мг) и хлорангидрида фосфорной кислоты (3 мл) перемешивали и нагревали с обратным холодильником в течение 72 часов, затем оставляли для охлаждения, после чего выливали на смесь лед/простой эфир (20 мл). Эфирный слой отделяли, промывали насыщенным раствором карбоната натрия (20 мл), высушивали над сульфатом натрия и упаривали при пониженном давлении, получая 2-хлор-4-пропил-6-(3-трифторметилфенил)-пиримидин в форме темно-коричневого масла (239 мг).
МС m/z 301,3 (M+1), 100%.
D: 4-пропил-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил
К раствору 2-хлор-4-пропил-6-(3-трифторметилфенил)-пиримидина (50 мг) в 1-метил-2-пирролидиноне (2 мл) добавляли цианид меди (I) (60 мг). Суспензию нагревали в микроволновой печи при 200°C в течение 20 минут, затем вливали в смесь этилацетата (10 мл) и водного раствора аммиака (5 мл). Органический слой отделяли, промывали водой (10 мл), высушивали над сульфатом натрия и упаривали при пониженном давлении. Препаративной ВЭЖХ получали целевое соединение 4-пропил-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил в виде смолы коричневого цвета (4,1 мг).
1Н ЯМР (CDC13) δ: 8,27-8,37 (м, 2H), 7,82 (д, 1Н), 7,34 (с, 1Н), 7,68 (т, 1Н), 2,88 (т, 2H), 1,78-1,91 (м, 2H), 1,03 (т, 3H). МС m/z 292,0 (M+1), 100%.
ПРИМЕР 2
5-Метил-4-пропил-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил
A: 2-метил-1-(3-трифторметилфенил)-гексан-1,3-дион
К перемешиваемой суспензии карбоната калия (596 мг) в ацетоне (7 мл) добавляли 3-гидрокси-1-(3-трифторметилфенил)-гекс-2-ен-1-он (190 мг), затем йодометан (0,45 мл). Смесь нагревали с обратным холодильником в течение 6 часов, охлаждали до комнатной температуры и растворитель упаривали при пониженном давлении. Полученное масло растворяли в этилацетате (20 мл), промывали водой (3×20 мл), высушивали над сульфатом натрия и упаривали при пониженном давлении, получая сырой продукт в форме масла.
Флэш-хроматографией на силикагеле получали 2-метил-1-(3-трифторметилфенил)-гексан-1,3-дион в форме масла (102 мг).
1Н ЯМР (CDC13) δ: 8,14 (с, 1Н), 8,06 (д, 1Н), 7,77 (д, 1Н), 7,56 (т, 1Н), 4,41 (кв, 1Н), 2,29-2,48 (м, 2H), 1,46-1,55 (м, 2H), 1,40 (д, 3H), 0,78 (т, 3H).
B: 5-метил-6-пропил-4-(3-трифторметилфенил)-1 H-пиримидин-2-он
Перемешиваемую смесь 2-метил-1-(3-трифторметилфенил)-гексан-1,3-диона (102 мг), мочевины (45 мг), HCl (0,10 мл, 5M) и этанола (4 мл) нагревали с обратным холодильником в течение 16 часов. Добавляли дополнительное количество мочевины (30 мг) и HCl (0,10 мл, 5M) и нагревание с обратным холодильником продолжали в течение 24 часов. Смеси позволяли охладиться и растворитель выпаривали при пониженном давлении. Остаток растворяли в смеси этилацетата (10 мл) и воды (10 мл), органический слой отделяли и затем промывали раствором насыщенного карбоната натрия (10 мл), затем водой (10 мл). Экстракт этилацетата высушивали над сульфатом натрия и упаривали при пониженном давлении, получая 5-метил-6-пропил-4-(3-трифторметилфенил)-1Н-пиримидин-2-он в форме желтого масла (64 мг).
МС m/z 297,4 (M+1), 100%.
C: 2-хлор-5-метил-4-пропил-6-(3-трифторметилфенил)-пиримидин
Смесь 5-метил-6-пропил-4-(3-трифторметилфенил)-1H-пиримидин-2-она (64 мг) и хлорангидрида фосфорной кислоты (3 мл) перемешивали и нагревали с обратным холодильником в течение 24 часов, затем оставляли для охлаждения и выливали на смесь лед/простой эфир (20 мл). Эфирный слой отделяли, промывали насыщенным раствором карбоната натрия (10 мл) и воды (10 мл), высушивали над сульфатом натрия и упаривали при пониженном давлении, получая 2-хлор-5-метил-4-пропил-6-(3-трифторметилфенил)-пиримидин в форме масла (64 мг).
МС m/z 315,0 (M+1), 100%.
D: 5-метил-4-пропил-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил
К раствору 2-хлор-5-метил-4-пропил-6-(3-трифторметилфенил)-пиримидина (50 мг) в диметилформамиде (1 мл) добавляли цианид цинка (II) (16 мг) и тетракис(трифенилфосфин)-палладий (0) (16 мг). Суспензию нагревали в микроволновой печи при 150°C в течение 5 минут, затем вливали в этилацетат (50 мл) и промывали водой (2×10 мл). Органический слой отделяли, высушивали над сульфатом натрия и упаривали при пониженном давлении. Препаративной ВЭЖХ получали 5-метил-4-пропил-6-(3-трифторметилфенил)-пиримидин-2-карбонитрил в виде смолы желтого цвета (11 мг). 1Н ЯМР (CDC13) δ: 7,63-7,81 (м, 4H), 2,87 (т, 2H), 2,39 (с, 3H), 1,80-1,90 (м,