Способ синтеза 2,5-диоксан-1,4-дионов
Иллюстрации
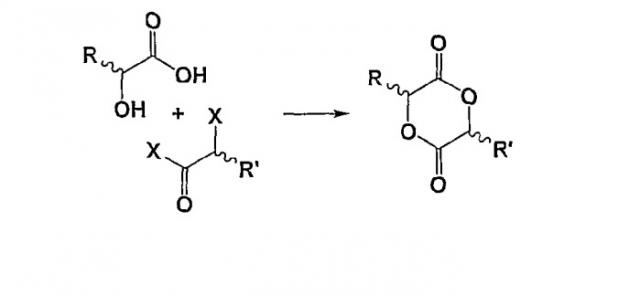
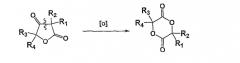
Показать всеИзобретение относится к новому способу синтеза 2,5-диоксан-1,4-дионов формулы (I)
в которой R1, R2, R3 и R4 означают независимо атом водорода, атом галогена; (С2-С6)алкенил; (С3-С7)циклоалкил; циклогексенил; радикал формулы -(CH2)m-V-W;
V означает ковалентную связь, атом кислорода или радикал -С(O)-O-; W означает атом водорода, (С1-С18)алкильный радикал, необязательно замещенный одним или несколькими гало-радикалами, одинаковыми или разными; арильный или аралкильный радикал, причем арильные или аралкильные радикалы необязательно замещены одним или несколькими одинаковыми или разными заместителями, выбранными из: -(CH2)n-Y-Z, галогена, нитро и циано; Y означает -О-, -S- или ковалентную связь; Z означает атом водорода или (С1-С6)алкильный радикал, необязательно замещенный одним или несколькими атомами галогена, одинаковыми или разными; или аралкил; m и n означают независимо целое число от 0 до 4;
окислением кетоновой группы циклического соединения формулы (II)
в которой R1, R2, R3 и R4 такие, как определено выше; причем указанный способ реализуется в присутствии окислителя, который является надкислотой, и катализатора, который является сильной кислотой, выбранной из сульфоновых кислот. Этот продукт используется для получения полимеров молочной кислоты (PLA). Технический результат - новый способ получения ассиметричных мономеров на основе 2,5-диоксан-1,4-дионов. 7 з.п. ф-лы, 1 ил. , 5 табл.
Реферат
Настоящее изобретение относится к новому способу синтеза 2,5-диоксан-1,4-дионов.
Сополимеры молочной и гликолевой кислот (PLGA) обычно получают (со)полимеризацией с раскрытием цикла лактидов и гликолидов. Эти мономеры, являющиеся производными молочной кислоты и гликолевой кислоты, представляют собой аналоги 2,5-диоксан-1,4-дионов. Модифицирование свойств PLGA имеет большое значение, в частности, при ее применении в качестве биоразлагаемой и биоусвояемой матрицы для контролируемого удерживания и высвобождения активных веществ. Довольно удивительно, что подход, который состоит в модифицировании заместителей скелета 2,5-диоксан-1,4-диона, до настоящего времени не был разработан, что можно объяснить на практике достаточно слабой доступностью этих звеньев.
Симметричные мономеры, такие, как лактид или гликолид, обычно получают из соответствующих α-гидроксикислот. Этот подход является сложным, так как он требует удаления образующейся воды и перегонки мономера в вакууме. Чтобы получить асимметричные мономеры, нужно использовать два разных предшественника, обычно α-гидроксикислоту и моно- или дигалогензамещенное производное (C.-M. Dong et al., J. Polym. Soi. Part A: Polym. Chem. 2000, 35, 4179-4184; M. Leemhuis et al, Eur. J. Org. Chem. 2003, 3344-3349).
На практике главным ограничением всех стратегий синтеза является, вероятно, последний этап замыкания 6-звенного цикла, который естественным образом конкурирует с образованием димеров и олигомеров путем межмолекулярных, а не внутримолекулярных реакций. Таким образом, Заявитель рассматривает новый путь синтеза 2,5-диоксан-1,4-дионов.
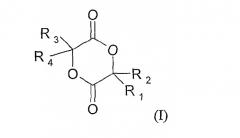
Таким образом, объектом настоящего изобретения является способ получения 2,5-диоксан-1,4-дионов формулы (I)
в которой R1, R2, R3 и R4 означают независимо атом водорода, гало-, (C2-C6)алкенил; (C3-C7)циклоалкил, циклогексенил, радикал формулы -(CH2)m-V-W, где
V означает ковалентную связь, атом кислорода или радикал -C(O)-O-;
W означает атом водорода, (C1-C18)алкильный радикал, необязательно замещенный одним или несколькими гало-радикалами, одинаковыми или разными; арильный или аралкильный радикал, причем арильные или аралкильные радикалы необязательно замещены одним или несколькими заместителями, одинаковыми или разными, выбранными из: -(CH2)n-Y-Z, гало-, нитро и циано;
Y означает -О-, -S- или ковалентную связь;
Z означает атом водорода или (C1-C6)алкильный радикал, необязательно замещенный одним или несколькими атомами галогена, одинаковыми или разными; или аралкил;
m и n означают независимо целое число от 0 до 4;
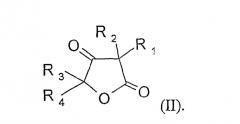
путем окисления кетоновой группы циклического соединения формулы (II)
В приведенных выше определениях, выражение "галоген" означает атом фтора, хлора, брома или йода, предпочтительно хлор, фтор или бром. Выражение (C1-C6)алкил означает алкильный радикал, имеющий от 1 до 6 атомов углерода, линейный или разветвленный, такой как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, втор-бутильный и трет-бутильный, пентильный или амильный, изопентильный, неопентильный, 2,2-диметилпропильный, гексильный, изогексильный или 1,2,2-триметилпропильный радикал. Термин (C1-C18)алкил означает алкильный радикал, имеющий от 1 до 18 атомов углерода, линейный или разветвленный, такой как радикалы, содержащие от 1 до 6 атомов углерода, такие как определенные выше, а также гептил, октил, 1,1,2,2-тетраметилпропил, 1,1,3,3-тетраметилбутил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил. Под выражением "алкил, замещенный по меньшей мере одним атомом галогена", следует понимать любую алкильную цепь, линейную или разветвленную, содержащую по меньшей мере один гало-радикал, расположенный внутри цепи, такой, например, как -CHCl-CH3, а также -CF3.
Также, в настоящей заявке радикал (CH2)i (i - целое число, которое может означать m и n, как определенные выше) означает углеводородную цепь, линейную или разветвленную, с i атомами углерода. Так, радикал -(CH2)3- может означать -CH2-CH2-CH2-, но также и -CH(CH3)-CH2-, -CH2-CH(CH3)- или -C(CH3)2-.
Под (C2-C6)алкенилом понимается линейный или разветвленный алкильный радикал, насчитывающий от 2 до 6 атомов углерода и имеющий по меньшей мере одну ненасыщенность (двойную связь), как, например, винил, аллил, пропенил, бутенил или пентенил.
Термин "(C3-C7)циклоалкил" означает моноциклическую насыщенную углеродную систему, содержащую от 3 до 7 атомов углерода, предпочтительно циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Выражение "арил" означает ароматический радикал, образованный единственным циклом или конденсированными циклами, как, например, фенильный, нафтильный, флуоренильный или антрильный радикал. Термин "аралкил" (арилалкил) означает предпочтительно радикалы, в которых арильный и алкильный радикалы таковы, как определено выше, как, например, бензил или фенэтил.
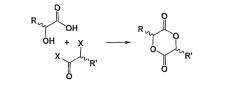
Таким образом, в процессе превращения соединения (II) в соединение (I)
конкурирующие реакции димеризации и олигомеризации, которые наблюдаются в синтезе лактида или гликолида путем конденсации, полностью исключаются.
Для превращения кетоновой группы соединения (II) в сложноэфирную группу может применяться несколько типов окисления; так, окисление может проводиться, например, в присутствии окислителя, такого как надкислота или пероксид (по реакции окисления Baeyer Villiger), в присутствии металлического катализатора (S.I. Murahashi et al, Tetrahedron Lett. 1992, 33, 7557-7760 и C. Bolm et al, Tetrahedron Lett. 1993, 34, 3405-3408) или также ферментативным путем (M.D. Mihovilovic et al, Eur. J. Org. Chem. 2002, 3711-3730).
Предпочтительно, способ согласно изобретению проводится в присутствии окислителя по реакции окисления Байера-Виллигера. В этом случае реакция окисления очень предпочтительно происходит по положению, наиболее близкому к кетогруппе, чтобы 2,5-диоксан-1,4-дионы могли быть получены с высокой селективностью. Предпочтительно, окислитель применяется в присутствии катализатора.
Окислитель (агент окисления), применяемый для осуществления способа согласно изобретению, может быть надкислотой или пероксидом. В качестве примера надкислоты можно назвать трифторуксусную кислоту (TFPAA), перуксусную кислоту (PAA), метахлорпербензойную кислоту (m-CPBA), предпочтительно в сочетании с кислотами Льюиса (SnCl4, Sn(OTf)3, Re(OTf)3) или сильными кислотами (сульфоновые кислоты, нафион-H, CF3COOH и т.д.). В качестве примера пероксида можно назвать перекись водорода (H2O2); причем перекись водорода применяется одна или в присутствии катализатора, которым может быть кислота Льюиса (как BF3) или металлический комплекс, в гомогенной фазе (Mo, Re, Pt) или гетерогенной фазе (цеолиты с оловом, гидроталькит с оловом); можно также назвать бис(триметилсилил)пероксид Me3SiOOSiMe3, который будет использоваться в присутствии кислоты Льюиса (Me3SiOTf, SnCl4 или BF3-OEt2).
В частности, объектом настоящего изобретения является способ, какой описан выше, отличающийся тем, что окислитель является надкислотой или пероксидом.
Предпочтительно, окислитель является надкислотой. Надкислота используется предпочтительно в присутствии кислоты Льюиса или сильной кислоты, в частности в присутствии сильной кислоты, выбранной из сульфоновых кислот.
Очень предпочтительно, надкислота является метахлорпербензойной кислотой (m-CPBA). Метахлорпербензойная кислота предпочтительно используется в присутствии трифторметансульфоновой кислоты.
Предпочтительно также, окислитель является пероксидом.
Названные выше агенты окисления как правило имеются в продаже. Не имеющиеся в продаже агенты могут быть синтезированы способами, известными специалисту. Так, трифторперуксусная кислота, которой в продаже нет, может быть легко получена действием перекиси водорода H2O2 на трифторуксусную кислоту или трифторуксусный ангидрид CF3CO2H и (CF3CO)2O, соответственно (R. Liotta et al, J. Org. Chem. 1980, 45, 2887-2890; M. Anastasia et al, J. Org. Chem. 1985, 50, 321-325; P.A.Krasutsky et al., J. Org. Chem. 2001, 66, 1701-1707). Аналогично, бис(триметилсилил)пероксид тоже не продается, но может быть легко получен, исходя из комплекса H2O2-1,4-диазабицикло[2,2,2]октан [DABCO, N(CH2CH2)3N] и Me3SiCl (P.G. Cookson et al, J. Organomet.Chem. 1975, 99, C31-C32; M. Taddei et al., Synth. Comm. 1986, 633-635).
Циклические кетоэфиры формулы (II), применяемые в качестве предшественников для синтеза 2,5-диоксан-1,4-дионов (I), таких как определенные выше, легко могут быть получены классическими способами, известными специалисту (E.B. Reid et al, J. Org. Chem. 1950, 15, 572-582).
Объектом настоящего изобретения является также, в частности, способ, такой как определенный выше, отличающийся тем, что арильный радикал является фенильным радикалом, а аралкильный радикал является бензильным радикалом.
Объектом настоящего изобретения является также, в частности, способ, как определенный выше, отличающийся тем, что R1, R2, R3 и R4 означают независимо атом водорода или радикал формулы -(CH2)m-V-W, где V означает ковалентную связь, а W означает (C1-C6)алкильный радикал, а m более предпочтительно равно нулю. Предпочтительно R1, R2, R3 и R4 означают независимо атом водорода, метильный радикал или этильный радикал.
Объектом настоящего изобретения является также, в частности, способ, как определенный выше, отличающийся тем, что R1 и R2 означают независимо радикал формулы -(CH2)m-V-W, причем V означает ковалентную связь, m равно нулю, и W является (C1-C6)алкильным радикалом, а R3 и R4 означают независимо атом водорода или радикал формулы -(CH2)m-V-W, где V означает ковалентную связь, m равно нулю, а W является (C1-C6)алкильным радикалом.
Объектом настоящего изобретения является также, в частности, способ, как определенный выше, отличающийся тем, что R1 и R2 означают независимо метильный или этильный радикал, а R3 и R4 означают независимо атом водорода или метильный или этильный радикал.
Объектом настоящего изобретения являются также соединения формулы (I), полученные по определенному выше способу.
Экспериментальная часть
Пример 1: 3,3-диметил-2,5-диоксан-1,4-дион
Стадия 1: синтез предшественника (II)
Синтез соединения (II) проводится по следующей реакционной схеме:
проводиться согласно работе H.C. Brown et al., J. Am. Chem. Soc. 1988, 110, 1539-1546. Стадии синтеза соединений (3) и (4) могут осуществляться согласно работе M. Conrad et al., Ber. 1898, 31, 2726-2731. Наконец, конечная стадия получения соединения (II) из соединения (4) может проводиться в соответствии с работой E.B. Reid et al, J. Org. Chem. 1950, 15, 572-582.
Этап 2: синтез 3,3-диметил-2,5-диоксан-1,4-диона
Условия 1.
Раствор 5 г циклического кетоэфира (39 ммоль) и 13,5 г метахлорпербензойной кислоты (2 экв.) в 100 мл дихлорметана кипятят с обратным холодильником в течение 48 часов. Проверка аликвоты реакционной среды методом 1H-ЯМР выявила полную конверсию 5-звенного цикла и преимущественное образование 3,3-диметил-2,5-диоксан-1,4-диона (выход согласно спектроскопии: 85%).
Условия 2.
Раствор 5 г циклического кетоэфира (39 ммоль) и 8,1 г метахлорпербензойной кислоты (1,2 экв.) в 40 мл дихлорметана кипятят с обратным холодильником в течение 24 часов. Полнота конверсии 5-звенного цикла определяется по данным 1H-ЯМР для взятой пробы. Затем реакционную среду охлаждают до -18°C в течение ночи, затем фильтруют через пористую керамику, чтобы удалить образовавшуюся метанхлорбензойную кислоту. Фильтрат концентрируют в вакууме. Радикал перекристаллизовывают из этилацетата при -18°C. Таким путем получено 3,9 г аналитически чистого 3,3-диметил-2,5-диоксан-1,4-диона (выход выделенного продукта 70%). Характеристики продукта: 1H-ЯМР [4,97 (с, 2H), 1,70 (с, 6H)]; 13C-ЯМР [167,7 и 163,9 (С=O), 79,8 (Cq), 65,8 (CH2), 25,8 (CH3)]; рентгенографический анализ: см. чертеж, Т.пл.: 84-85°C, и согласно элементному анализу: вычислено C: 50,00, H: 5,56; найдено C: 49,98, H: 5,33.
Условия 3.
Раствор 1 г циклического кетоэфира (7,8 ммоль), 2,7 г метахлорпербензойной кислоты (2 экв.) и 70 мкл трифторметансульфоновой кислоты (0,1 экв.) в 20 мл дихлорметана перемешивают в течение 3 часов при температуре окружающей среды. Растворитель удаляют в вакууме, затем среду анализируют. 1H-ЯМР выявил полную конверсию 5-звенного цикла и преимущественное образование 3,3-диметил-2,5-диоксан-1,4-диона (выход согласно спектроскопии: 60%).
Пример 2: 3-этил-3-метил-2,5-диоксан-1,4-дион
Стадия 1: синтез предшественника (II)
Синтез соединения (II) проводится по той же реакционной схеме, что и в примере 1:
Стадия 2: синтез 3-этил-3-метил-2,5-диоксан-1,4-диона
Раствор 0,5 г циклического кетоэфира (3,5 ммоль) и 1,21 г метахлорпербензойной кислоты (2 экв.) в 10 мл дихлорметана кипятили с обратным холодильником в течение 48 часов. После охлаждения до температуры окружающей среды растворитель удаляют в вакууме. Анализ по 1H-ЯМР выявил полную конверсию 5-звенного цикла и преимущественное образование 3-этил-3-метил-2,5-диоксан-1,4-диона (выход согласно спектроскопии: 75%). Характеристики 1H-ЯМР [4,97 (с, 2H), 1,95 (кв, 2H, 3JHH=7,5 Гц), 1,67 (с, 3H), 1,03 (т, 3H, 3JHH=7,5 Гц)].
| Таблица 1 | ||||
| Кристаллографические данные для соединения примера 1 | ||||
| Эмпирическая формула | C6 H8 O4 | |||
| Молекулярная масса | 144,12 | |||
| Температура | 193(2) K | |||
| Длина волны | 0,71073 Е | |||
| Кристаллографическая система | ромбическая | |||
| Пространственная группа | P2(1)2(1)2(1) | |||
| Параметры решетки | a=5,8935(10)Е | α=90° | ||
| b=9,6410(16)Е | β=90°. | |||
| c=11,6372(19)Е | γ=90° | |||
| Объем | 661,22(19) Е3 | |||
| Z | 4 | |||
| Плотность (расчет) | 1,448 т/м3 | |||
| Коэффициент поглощения | 0,123 мм-1 | |||
| F(000) | 304 | |||
| Размер кристалла | 0,2 x 0,2 x 0,6 мм3 | |||
| Значения тэта для сбора данных | от 2,74 до 26,38° | |||
| Значения индексов h, k, l | -7<=h<=4, -12<=k<=12, -14<=l<=14 | |||
| Собрано отражений | 4337 | |||
| Независимые отражения | 1346 [R(int)=0,0559] | |||
| Отношение данных собр./теор. до тэта 26,38° | 100,0% | |||
| Поправка на поглощение | нет | |||
| Способ установления структуры | Метод наименьших квадратов на полной матрице F2 | |||
| Данные/ограничения/параметры | 1346/0/93 | |||
| Коэффициент корреляции по F2 | 1,070 | |||
| Конечные индексы R [I>2сигма(I)] | R1=0,0308, wR2=0,0742 | |||
| Индексы R (все данные) | R1=0,0364, wR2=0,0774 | |||
| Абсолютные структурные параметры | 0,2(12) | |||
| Макс. и мин. остаточная плотность электрического заряда | 0,182 и -0,144 e.В-3 | |||
| Таблица 2 | ||||
| Координаты атомов (x 104) и эквивалентные параметры изотропного смещения (Е2x103) соединений примера 1.U(eq) определяется как треть следа ортогонального тензора Uij. | ||||
| x | y | z | U(eq) | |
| C(1) | 1812(2) | 3446(2} | 10097(1) | 25(1) |
| O(1) | 2005(2) | 3362(1) | 11125(1) | 32(1) |
| C(2) | 1817(3) | 2391(2) | 8227(1) | 30(1) |
| O(2) | 1915(2) | 2288(1) | 9464(1) | 28(1) |
| C(3) | 320(3) | 3535(2) | 7795(1) | 28(1) |
| O(3) | -557(2) | 3507(1) | 6861(1) | 39(1) |
| C(4) | 1500(2) | 4820(2) | 9471(1) | 26(1) |
| O(4) | -18(2) | 4628(1) | 8487(1) | 29(1) |
| C(5) | 3794(3) | 5354(2) | 9049(1) | 35(1) |
| C(6) | 310(3) | 5865(2) | 10226(1) | 37(1) |
| Таблица 3 | |
| Длины связи [Е] и валентные углы [°] соединения примера 1 | |
| C(1)-O(1) | 1,2047(17) |
| C(1)-O(2) | 1,3391(19) |
| C(1)-C(4) | 1,523(2) |
| C(2)-O(2) | 1,4435(16) |
| C(2)-C(3) | 1,499(2) |
| C(3)-O(3) | 1,2033(18) |
| C(3)-O(4) | 1,3412(19) |
| C(4)-O(4) | 1,4643(18) |
| C(4)-C(6) | 1,510(2) |
| C(4)-C(5) | 1,528(2) |
| O(1)-C(1)-O(2) | 119,12(14) |
| O(1)-C(1)-C(4) | 123,02(14) |
| O(2)-C(1)-C(4) | 117,85(12) |
| O(2)-C(2)-C(3) | 114,11(12) |
| C(1)-O(2)-C(2) | 119,30(12) |
| O(3)-C(3)-O(4) | 119,77(15) |
| O(3)-C(3)-C(2) | 122,60(14) |
| O(4)-C(3)-C(2) | 117,63(12) |
| O(4)-C(4)-C(6) | 104,80(12) |
| O(4)-C(4)-C(1) | 109,75(12) |
| C(6)-C(4)-C(1) | 110,98(13) |
| O(4)-C(4)-C(5) | 109,40(12) |
| C(6)-C(4)-C(5) | 111,91(14) |
| C(1)-C(4)-C(5) | 109,88(12) |
| C(3)-O(4)-C(4) | 118,55(12) |
| Таблица 4 | ||||||
| Параметры анизотропного смещения (Е2x103) для соединения примера 1.Показатель коэффициента анизотропного смещения имеет вид: -2π2[h2 a*2U11+...+2hka*b*U12] | ||||||
| U11 | U22 | U33 | U23 | U13 | U12 | |
| C(1) | 16(1) | 33(1) | 26(1) | 2(1) | -1(1) | 0(1) |
| O(1) | 29(1) | 45(1) | 23(1) | 5(1) | -2(1) | 2(1) |
| C(2) | 33(1) | 33(1) | 24(1) | -3(1) | 0(1) | 1(1) |
| O(2) | 30(1) | 29(1) | 25(1) | 2(1) | -2(1) | 2(1) |
| C(3) | 25(1) | 36(1) | 23(1) | 3(1) | 0(1) | -5(1) |
| O(3) | 44(1) | 48(1) | 25(1) | 0(1) | -8(1) | -2(1) |
| C(4) | 25(1) | 30(1) | 23(1) | 1(1) | -4(1) | 0(1) |
| O(4) | 30(1) | 30(1) | 27(1) | 2(1) | -7(1) | 3(1) |
| C(5) | 33(1) | 36(1) | 34(1) | 3(1) | -2(1) | -10(1) |
| C(6) | 41(1) | 36(1) | 35(1) | -4(1) | -3(1) | 9(1) |
| Таблица 5 | ||||
| Координаты атомов водорода (x104) и параметры изотропного смещения (Е2x103) для соединения примера 1 | ||||
| x | y | z | U(eq) | |
| H(2A) | 1262 | 1499 | 7913 | 36 |
| H(2B) | 3372 | 2540 | 7930 | 36 |
| H(5A) | 4514 | 4648 | 8565 | 52 |
| H(5B) | 4770 | 5554 | 9710 | 52 |
| H(5C) | 3570 | 6203 | 8600 | 52 |
| H(6A) | 58 | 6723 | 9792 | 56 |
| H(6B) | 1252 | 6064 | 10900 | 56 |
| H(6C) | -1153 | 5487 | 10476 | 56 |
1. Способ получения 2,5-диоксан-1,4-дионов формулы (I) в которой R1, R2, R3 и R4 означают независимо атом водорода, атом галогена;(С2-С6)алкенил; (С3-С7)циклоалкил; циклогексенил; радикал формулы -(CH2)m-V-W;V означает ковалентную связь, атом кислорода или радикал -С(O)-О;W означает атом водорода, (С1-С18)алкильный радикал, необязательно замещенный одним или несколькими гало-радикалами, одинаковыми или разными; арильный или аралкильный радикал, причем арильные или аралкильные радикалы необязательно замещены одним или несколькими одинаковыми или разными заместителями, выбранными из: -(CH2)n-Y-Z, галогена, нитро и циано;Y означает -О-, -S- или ковалентную связь;Z означает атом водорода или (С1-С6)алкильный радикал, необязательно замещенный одним или несколькими атомами галогена, одинаковыми или разными; или аралкил;m и n означают независимо целое число от 0 до 4;окислением кетоновой группы циклического соединения формулы (II) в которой R1, R2, R3 и R4 такие, как определено выше;причем указанный способ реализуется в присутствии окислителя, который является надкислотой, и катализатора, который является сильной кислотой, выбранной из сульфоновых кислот.
2. Способ получения по п.1, отличающийся тем, что окислитель является метахлорпербензойной кислотой.
3. Способ получения по п.2, отличающийся тем, что окислитель применяется в присутствии трифторметансульфоновой кислоты.
4. Способ получения по одному из пп.2 и 3, отличающийся тем, что арильный радикал является фенильным радикалом, а аралкильный радикал является бензильным радикалом.
5. Способ получения по одному из пп.2 и 3, отличающийся тем, что R1, R2, R3 и R4 означают независимо атом водорода или радикал формулы -(CH2)m-V-W с V, означающим ковалентную связь, и W является (С1-С6) алкильным радикалом.
6. Способ получения по одному из пп.2 и 3, отличающийся тем, что R1, R2, R3 иR4 означают независимо атом водорода, метальный радикал или этильный радикал.
7. Способ получения по одному из пп.2 и 3, отличающийся тем, что R1 и R2 означают независимо радикал формулы -(CH2)m-V-W, где V означает ковалентную связь, m равно нулю, и W является (C1-С6) алкильным радикалом, a R3 и R4 означают независимо атом водорода или радикал формулы -(CH2)m-V-W, где V означает ковалентную связь, m равно нулю, a W является (С1-С6) алкильным радикалом.
8. Способ получения по одному из пп.2 и 3, отличающийся тем, что R1 и R2 означают независимо метальный радикал или этильный радикал, a R3 и R4 означают независимо атом водорода или метильный или этильный радикал.