Фармацевтические композиции, содержащие zd6474
Иллюстрации
Показать всеЗаявленное изобретение относится к химико-фармацевтической промышленности и касается фармацевтической композиции, содержащей ZD6474 или его фармацевтически приемлемую соль, хрупкий разбавитель и второй разбавитель, который практически нерастворим и обладает пластичностью при сжатии. Хрупкий разбавитель представляет собой гидрофосфат кальция, а второй разбавитель, который практически нерастворим и обладает пластичностью при сжатии, представляет собой микрокристаллическую целлюлозу. Заявленная фармацевтическая композиция обеспечивает хорошую биодоступность для активного вещества. 4 з.п. ф-лы, 2 табл, 2 ил.
Реферат
Настоящее изобретение касается фармацевтических композиций, особенно фармацевтических композиций, содержащих ZD6474 или его фармацевтически приемлемую соль, методов получения указанных фармацевтических композиций, указанных фармацевтических композиций для применения с целью получения антиангиогенного эффекта и/или эффекта снижения сосудистой проницаемости у теплокровного животного, такого как человек, применения указанных фармацевтических композиций в производстве лекарственных средств для применения с целью получения антиангиогенного эффекта и/или эффекта снижения сосудистой проницаемости у теплокровного животного, такого как человек, и способа получения антиангиогенного эффекта и/или эффекта снижения сосудистой проницаемости у теплокровного животного, такого как человек, включающего введение такой фармацевтической композиции.
Нормальный ангиогенез играет важную роль в различных процессах, включая эмбриональное развитие, заживление раны и несколько компонентов женской репродуктивной функции. Нежелательный или патологический ангиогенез ассоциируется с болезненными состояниями, в том числе с диабетической ретинопатией, псориазом, раком, ревматоидным артритом, атеромой, саркомой Капоши и гемангиомой (Fan и др., 1995, Trends Pharmacol. Sci. 16: 57-66; Folkman, 1995, Nature Medicine 1: 27-31). Считается, что изменение проницаемости сосудов играет роль и в нормальных, и в патологических физиологических процессах (Cullinan-Bove и др., 1993, Endocrinology 133: 829-837; Sengeretal, 1993, Cancer and Metastasis Reviews, 12: 303-324). Было обнаружено несколько полипептидов, включая кислотные и основные факторы роста фибробластов (aFGF и bFGF) и сосудисто-эндотелиальный фактор роста (VEGF), с ростпромотирующим действием in vitro на эндотелиальные клетки. Из-за ограниченной экспрессии его рецепторов, активность фактора роста VEGF в отличие от FGF является относительно специфичной к эндотелиальным клеткам. Недавно полученные доказательства свидетельствуют, что VEGF является важным стимулятор как нормального, так и патологического ангиогенеза (Jakeman и др., 1993, Endocrinology, 133: 848-859; Kolch и др., 1995, Breast Cancer Research and Treatment, 36:139-155) и сосудистой проницаемости (Connolly и др., 1989, J. Biol. Chem. 264: 20017-20024). Антагонизм действия VEGF в результате секвестрации VEGF с антителом может привести к ингибированию роста опухоли (Kim и др., 1993, Nature 362: 841-844). Рецепторные тирозинкиназы (RTK) играют важную роль в передаче биохимических сигналов через плазматическую мембрану клеток. Эти трансмембранные молекулы как правило состоят из внеклеточного лигандсвязывающего домена, присоединенного через сегмент в плазматической мембране к внутриклеточному домену тирозинкиназы. Связывание лиганда с рецептором обуславливает симулирование связанной с рецептором активности тирозинкиназы, которая приводит к фосфорилированию остатков тирозина на рецепторе и других внутриклеточных молекулах. Эти изменения в фосфорилировании тирозина инициируют сигнальный каскад, приводящий к различным клеточным реакциям. До настоящего времени было идентифицировано по крайней мере девятнадцать различных подсемейств RTK, которые характеризуются по гомологии аминокислотных последовательностей. Одно из этих подсемейств на сегодняшний день составляют fms-подобный тирозинкиназный рецептор, Flt-1 (также упоминается как VEGFR-1), рецептор, содержащий домен с киназной вставкой, KDR (называемый также как VEGFR-2 или Flk-1) и другой fms-подобный тирозинкиназный рецептор, Flt-4. Две из этих родственных RTK (Flt и KDR), как было установлено, связывают VEGF с высоким аффинитетом (De Vries и др., 1992, Science 255: 989-991; Terman и др., 1992, Biochem. Biophys. Res. Comm. 1992, 187:1579-1586). Связывание VEGF с указанными рецепторами, экспрессированными в гетерологичных клетках, ассоциировалось с изменениями в состоянии фосфорилирования тирозина в клеточных белках и потоках кальция.
VEGF - ключевой стимул для васкулогенеза и ангиогенеза. Этот цитокин индуцирует фенотип сосудистого роста путем стимулирования пролиферации эндотелиальных клеток, экспрессии и миграции протеазы и перемещение, и последующей организации клеток для образования капиллярных трубок (Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, Т., Feder, J., и Connolly, D.T., Science (Washington DC), 246: 1309-1312, 1989; Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., и Charles, S.T., Microvasc. Res., 55: 29-42, 1998; Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. и Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996.). Кроме того, VEGF индуцирует существенное повышение проницаемости сосудов (Dvorak, H.F., Detmar, M., Claffey, К.Р., Nagy, J.A., van de Water, L., и Senger, D.R., (Int. Arch. Allergy ImmunoL, 707. - 233-235, 1995; Bates, D.O., Heald, R.I., Curry, F.E. и Williams, B.J. Physiol. (Lond.), 523: 263-272, 2001), способствуя образованию гиперпроницаемой, незрелой сосудистой сетки, характерной для патологического ангиогенеза.
Показано, что достаточно активации только KDR для того, чтобы промотировать все основные фенотипические реакции на VEGF, включая пролиферацию эндотелиальных клеток, миграцию и выживаемость, а также индукцию проницаемости сосудов (Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C, Biittner, M., Rziha, H-J., и Dehio, C, EMBO J., 18: 363-37r4, 1999; Zeng, H., Sanyal, S. and Mukhopadhyay, D., J. Biol. Chem., 276; 32714-32719,2001; Gille, H., Kowalski, J., Li, В., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. and Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001).
Производные хиназолина, которые являются ингибиторами тирозинкиназы рецептора VEGF, описаны в Публикациях Международных патентных заявок №№WO 98/13354 и WO 01/32651. В WO 98/13354 и WO 01/32651 описаны соединения, которые обладают активностью против тирозинкиназы рецептора VEGF (VEGF RTK), в то же время обладая некоторой активностью против рецепторной тирозинкиназы эпидермального фактора роста (EGF) (EGF RTK).
ZD6474 является 4-(4-бром-2-фторанилин)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолином:
ZD6474 подпадает под широкое общее описание WO 98/13354 и проиллюстрирован примерами в WO 01/32651 (Пример 2). ZD6474 является мощным ингибитором VEGF RTK, а также обладает некоторой активностью к EGF RTK. Показано, что ZD6474 проявляет широкий спектр противоопухолевой активности на ряде моделей после перорального приема раз в сутки (Wedge S.R., Ogilvie D.J., Dukes M. и др., Proc. Am. Assoc. Cane. Res. 2001; 42: abstract 3126).
В WO 98/13354 Пример 77 описывает некоторые лекарственные формы соединения формулы I. В Примере 11 из WO 01/32651 описаны подобные лекарственные формы соединения формулы I. В WO 01/32651 также описывается приготовление лекарственной формы соединений, которая использовалась для введения крысам в 14-дневном испытании токсичности: "Соединения были сперва подготовлены путем суспендирования в 1% (об./об.) растворе полиоксиэтилен(20)сорбитанмоноолеата в деионизированной воде, перетиранием на шаровой мельнице при 4°С в течение ночи (не менее 15 часов). Соединения повторно суспендировали путем взбалтывания непосредственно перед введением."
В целом, фармацевтические композиции соединений формулы I в WO 01/32651 можно приготовить стандартным способом, используя обычные вспомогательные вещества. Разыскивались пероральные лекарственные формы (например, таблетки, капсулы, гранулы, пеллеты, леденцы и т.д.) ZD6474 для клинических испытаний и коммерческого использования.
При разработке пероральной лекарственной формы, особенно таблетки, необходимо учитывать механические свойства активного фармацевтического компонента и любых предложенных вспомогательных веществ.
Механические свойства материалов, таких как порошки, можно описать с точки зрения следующих характеристик:
(a) твердость или сопротивление деформации, которая может быть измерена путем определения твердости вдавливанием;
(b) давление текучести (обозначается Ру и также известно как предел текучести), которое представляет собой точку, в которой происходит пластическая деформация, которую можно измерить с помощью исследований прессования;
(c) чувствительность к скорости деформации (ЧСД), которая представляет собой процентное возрастание давления текучести, начиная от медленной до быстрой скорости удара, которую можно измерить с помощью исследований прессования; и
(d) модуль упругости, который является отношением напряжения к растяжению (натяжением), который можно измерить с помощью многочисленных методов, которые хорошо известны специалисту, квалифицированному в области приготовления лекарственных форм.
Материалы можно, в целом, классифицировать по пути, которым они деформируются под сжимающим усилием: или хрупким разрушением, или пластической деформацией. Степень деформации для хрупкого материала не зависит от скорости и продолжительности процесса сжатия (то есть применения сжатия), в результате чего значение чувствительности к скорости деформации для таких материалов равно 0% (нулевой %). Деформация пластического материала зависит от скорости и продолжительности процесса сжатия, и это описывается чувствительностью к скорости деформации.
При разработке пероральной лекарственной формы, особенно таблетки, обычно используют смесь порошков: некоторых хрупкой природы, чтобы минимизировать чувствительность к скорости деформации, а некоторых умеренной пластической природы, чтобы увеличить поверхности, доступные для образования связей при сжатии.
Таблеточные прессы, используемые в коммерческом производстве, как правило, работают с намного более высокими скоростями, чем прессы, используемые в исследованиях и разработке. Поскольку скорость пресса возрастает, продолжительность процесса сжатия (то есть периода, в течение которого применяется сжатие; также известный как время пребывания) уменьшается. Это не влияет на сжатие хрупкого материала с ЧСД, равной 0%, но в случае пластического материала, для которого деформация зависит от скорости и продолжительности сжатия, более быстрый пресс, как правило, производил бы более мягкие таблетки. Поэтому избыток пластического материала в лекарственной форме может привести к трудностям при переходе к производству больших количеств на более быстрых компрессионных машинах, используемых в полномасштабном производстве.
ZD6474 является чрезвычайно пластическим материалом с давлением текучести, составляющим 22 МПа, и с очень высокой чувствительностью к скорости деформации, равной 197%. Эти свойства делают приготовление твердой пероральной лекарственной формы ZD6474 трудной задачей. Например, при изготовлении таблетки эти свойства могут привести к проблемам получения достаточно твердых таблеток, особенно при переходе от относительно медленных таблетировочных машин (соответственно, с длительными процессами сжатия), которые используются в исследованиях и разработке для маленького количества таблеток, к более быстрым компрессионным машинам (с короткими периодами сжатия), которые используются в полномасштабном коммерческом производстве.
Чтобы противодействовать пластичности действующего вещества, такого как ZD6474, специалист, квалифицированный в данной области, как правило, сделал бы попытку "разжижить" материал большими количествами дополнительного вспомогательного вещества, такого как хрупкое вспомогательное вещество. Однако это может ограничить нагрузку действующего вещества, которая может быть достигнута при приготовлении лекарственной формы, то есть процент активного компонента в ней, и может привести к получению очень больших таблеток, которые трудно проглотить.
Стандартное хрупкое вспомогательное вещество (тяжелый карбонат магния) использовалось в начальной испытуемой композиции лекарственной формы ZD6474, чтобы противодействовать пластичности и высокой чувствительности к скорости деформации ZD6474. Испытуемая композиция лекарственной формы включала следующее.
Композиция ядра таблетки по 100 мг ZD6474 (композиция с карбонатом магния)
| Компонент | мг/таблетку | Функция |
| ZD6474 | 100,0 | Действующее вещество |
| Тяжелый карбонат магния | 262,8 | Разжижитель |
| Гидроксипропилцеллюлоза (ГПМЦ 606) | 16,0 | Связующее вещество |
| Кроскармеллоза натрия (Ac-di-sol) | 16,0 | Дезинтегрант |
| Лаурилсульфат натрия (НЛС) | 1,2 | Смачивающее вещество |
| Стеарат магния | 4,0 | Любрикант |
| Общий вес таблетирования | 400,0 мг |
К сожалению композиция лекарственной формы с карбонатом магния не обладала необходимыми свойствами распадаемости и растворения для приготовления таблеток, потому что при хранении этой лекарственной формы в условиях высокой влажности (75% относительная влажность) и высокой температура (40°С) было обнаружено, что у таблеток очень длительный период распада (более 30 минут) и отрицательный результат в тесте «Растворение».
ZD6474 плохо растворим в воде (0,033 мг/мл при 25°С), и по системе классификации Британской Фармакопеи 2001-2002 (см. Таблицу 1 ниже) его можно охарактеризовать как "практически нерастворимое" или "нерастворимое" соединение. Как правило, при приготовлении лекарственной формы практически нерастворимого действующего вещества с целью повышения скорости растворения включают растворимые разжижители. Чтобы улучшить растворение ZD6474, приготовили еще одну композицию лекарственной формы со свободно растворимым разжижителем - моногидратом лактозы. Моногидрат лактозы был выбран, потому что он представляет собой свободно растворимый наполнитель, но также и потому, что у него относительно низкая чувствительность к скорости деформации, равная 19,4%, и по этой причине он также представляет собой относительно хрупкий наполнитель. Эта испытуемая композиция лекарственной формы включала следующее.
Композиция ядра таблетки по 200 мг ZD6474 (композиция с моногидратом лактозы)
| Компонент | мг/таблетку | Функция |
| ZD6474 | 200,0 | Действующее вещество |
| Лактозы моногидрат (450 меш) | 356,2 | Разжижитель |
| Кроскармеллоза натрия (Ac-di-sol) | 24,0 | Дезинтегрант |
| Повидон | 12,0 | Связующее вещество |
| Лаурилсульфат натрия | 1,8 | Смачивающее вещество |
| Стеарат магния | 6,0 | Любрикант |
| Общий вес | 600,0 |
При производстве и испытании стабильности композиции с моногидратом лактозы было отмечено, что до тех пор, пока могли быть достигнуты соответствующие распадаемость и растворение, таблетки были мягкими, имели плохой внешний вид и разрушались при последующей обработке и манипуляциях с ними. Эти проблемы обнаружились при применении относительно медленных таблетировочных машин при разработке, они бы усилились при переходе к большим масштабам производства с более быстрыми компрессионными машинами. Кроме этого максимальная нагрузка действующего вещества, которую можно было бы достигнуть с этой композицией и произвести таблетку, которая не расслаивается, составляла 33%. Необходимо, чтобы нагрузка действующего вещества была как можно более высокой с целью минимизации размера индивидуальной таблетки.
Чтобы попробовать решить проблемы пластичности и растворения в отдельно взятой лекарственной форме, был создана еще одна композиция лекарственной формы, включающая хрупкий наполнитель для улучшения свойств сжатия и свободно растворимый наполнитель для улучшения распадаемости и растворения.
Для этой композиции лекарственной формы в качестве хрупкого наполнителя использовался гидрофосфат кальция, а как свободно растворимый наполнитель - моногидрат лактозы. Эта испытуемая композиция лекарственной формы включала следующее.
Композиция ядер таблетки по 400 мг ZD6474 (композиция с фосфатом кальция/моногидратом лактозы)
| Компонент | мг/таблетку | Функция |
| ZD6474 | 400,0 | Действующее вещество |
| Гидрофосфат кальция | 317 | Разжижитель |
| Моногидрат лактозы | 200 | Разжижитель |
| Крахмальный гликолят натрия | 50 | Дезинтегрант |
| Повидон | 20 | Связующее вещество |
| Лаурилсульфат натрия | 3 | Смачивающее вещество |
| Стеарат магния | 10 | Любрикант |
| Общий вес | 1000,0 мг |
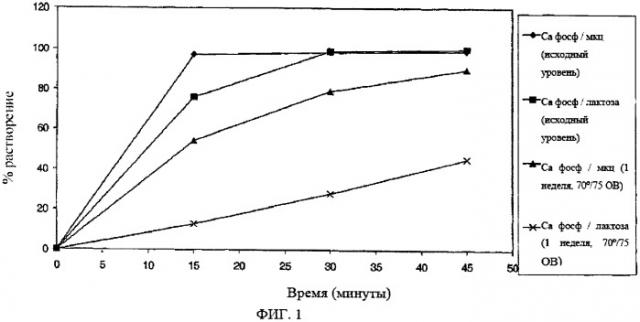
Однако при хранении в условиях высокой влажности (75% относительная влажность) и высокой температуры (70°С) эта композиция лекарственной формы также демонстрировала длительные периоды распадания и растворения (см. рис.1).
Цель настоящего изобретения состоит в том, чтобы обеспечить фармацевтические композиции ZD6474, обладающие необходимыми хорошими свойствами сжатия, необходимой твердостью, сопротивлением излому, а также обладающие необходимой хорошей распадаемостью и растворимостью, позволяющие обеспечить высокую нагрузку действующего вещества, при этом без расслаивания при приготовлении таблетки.
Предпочтительно, фармацевтические композиции ZD6474 являются твердыми пероральными лекарственными формами ZD6474, особенно таблетками с ZD6474.
Неожиданно нами было обнаружено, что композиция ZD6474 с хрупким наполнителем в качестве основного вспомогательного вещества и вторым наполнителем, который является практически нерастворимым и обладает пластичностью при сжатии, обладает особыми преимуществами. Можно было бы ожидать, что практически нерастворимый наполнитель обеспечит более длительный период распадаемости и растворения по сравнению со свободно растворимым наполнителем (например, моногидратом лактозы), и можно было бы ожидать, что добавление еще одного пластичного материала к композиции ZD6474 будет губительным для свойств сжатия. Однако неожиданно и к удивлению нами было обнаружено, что добавление второго пластичного наполнителя с относительно высокой ЧСД к композиции ZD6474, включающей хрупкий наполнитель, обеспечивает улучшенные свойств сжатия с точки зрения твердости и сопротивления к расслаиванию.
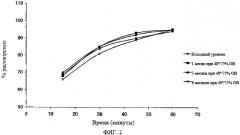
На Фиг.1 показано сравнение профилей растворения таблеток ZD6474 примера настоящего изобретения (содержащих гидрофосфат кальция и микрокристаллическую целлюлозу (мкц)) и композиций с фосфатом кальция / моногидратом лактозы, описанных выше, перед и после хранения при 70°С/75% относительной влажности (О В) в течение 7 дней (показанные примеры - для вариантов по 100 мг).
Данные указывают, что композиция лекарственной формы, содержащей практически нерастворимую микрокристаллическую целлюлозу, обеспечивает более быстрое растворение и большую стабильность после хранения при высокой температуре и влажности.
Согласно настоящему изобретению предоставляется фармацевтическая композиция, включающая ZD6474 или его фармацевтически приемлемую соль, хрупкий разжижитель и второй разжижитель, который практически нерастворим и обладает пластичностью при сжатии.
Хрупкий разжижитель или наполнитель предпочтительно является содержащим кальций или магний неорганическим соединением, таким как гидрофосфат кальция, фосфат кальция, безводный фосфат кальция, карбонат кальция, сульфат кальция или оксид магния.
В одном аспекте настоящего изобретения хрупкий разжижитель является гидрофосфатом кальция.
В другом аспекте настоящего изобретения хрупкий разжижитель является фосфатом кальция.
Практически нерастворимые разжижители или наполнители с пластичностью при сжатии включают микрокристаллическую целлюлозу (мкц), крахмал, этилцеллюлозу и карбоксиметилцеллюлозу.
В одном аспекте настоящего изобретения практически нерастворимый разжижитель с пластичностью при сжатии представляет собой микрокристаллическую целлюлозу.
Соответственно, соотношение массы ZD6474 или его фармацевтически приемлемой соли к хрупкому наполнителю составляет от 1:0,5 до 1:7, например, от 1:1 до 1:6, в частности от 1:1 до 1:4, и наиболее предпочтительно от 1:1 до 1:2.
Соответственно, соотношение массы практически нерастворимого наполнителя с пластичностью при сжатии к хрупкому наполнителю составляет от 1:3 до 1:12, например от 1:3,5 до 1:10, в частности от 1:4 до 1:4,5.
Соответственно, фармацевтическая композиция содержит, например, от 20 до 80%, в частности от 30 до 55%, главным образом от 40 до 50%, особенно от 40 до 45% по массе, на основании общей массы композиции, хрупкого разжижителя.
Соответственно, фармацевтическая композиция содержит, например, от 0,1 до 30%, предпочтительно от 2 до 15%, в частности от 3 до 12%, главным образом от 4 до 11%, особенно от 5 до 10% по массе, на основании общей массы композиции, практически нерастворимого разжижителя с пластичностью при сжатии.
Фармацевтические композиции настоящего изобретения предпочтительно представлены в дозированной лекарственной форме. ZD6474 будет, как правило, вводиться теплокровному животному в дозе в пределах диапазона, 5-5000 мг на квадратный метр площади тела животного, то есть приблизительно 0,1-100 мг/кг. Предусмотрена доза в диапазоне, например, 1-100 мг/кг, предпочтительно 1-50 мг/кг, и это количество обычно обеспечивает терапевтически эффективную дозу. Дозированная лекарственная форма, такая как таблетки или капсулы, будет обычно содержать, например, 1-500 мг активного компонента, предпочтительно 40-400 мг.
Таким образом, композиция может содержать от 1 мг до 500 мг ZD6474 или его фармацевтически приемлемой соли. Подходящие количества ZD6474 или его фармацевтически приемлемой соли составляют, например, 1, 10, 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг, в зависимости от требуемой дозы и конкретной формы фармацевтической композиции. В одном аспекте настоящего изобретения фармацевтическая композиция содержит 50, 100, 150, 200, 300 или 400 мг ZD6474 или его фармацевтически приемлемой соли.
Как правило, ZD6474 или его фармацевтически приемлемая соль будет присутствовать в количестве, находящемся в пределах диапазона от 1 до 99%, и соответственно от 1 до 70%, например от 5 до 65%, и особенно от 10 до 60% по массе фармацевтической композиции.
Согласно другому аспекту настоящего изобретения предлагается фармацевтическая композиция, содержащая ZD6474 или его фармацевтически приемлемую соль, хрупкий разжижитель, второй разжижитель, который практически нерастворим и обладает пластичностью при сжатии, и дезинтегрант.
К подходящим дезинтегрантам относятся вещества, известные в области приготовления лекарственных форм, такие как перечисленные в Руководстве по Фармацевтическим вспомогательным веществам (The Handbook of Pharmaceutical Excipients, 4th edition, eds Rowe, R.С. и др.. Pharmaceutical Press, 2003). Предпочтительные дезинтегранты включают крахмальный гликолят натрия, кросповидон, крокармеллозу натрия и крахмал.
Подходящее соотношение массы ZD6474 или его фармацевтически приемлемой соли к дезинтегранту составляет от 2:1 до 20:1, в частности от 3:1 до 15:1, более конкретно от 4:1 до 10:1 и наиболее конкретно от 6:1 до 9:1.
Соответственно, фармацевтическая композиция будет содержать от 0,01 до 10%, например от 1 до 8%, в частности от 2 до 7%, и более конкретно от 3 до 6% по массе дезинтегранта.
В фармацевтическую композицию согласно настоящему изобретению могут необязательно быть включены другие дополнительные вспомогательные вещества. К дополнительным вспомогательным веществам относятся, например, связующие вещества, смачивающие вещества и любриканты.
Согласно другому аспекту настоящего изобретения предлагается фармацевтическая композиция, содержащая ZD6474 или его фармацевтически приемлемую соль, хрупкий разжижитель, второй разжижитель, который практически нерастворим и обладает пластичностью при сжатии, дезинтегрант и один или больше смачивающих веществ, связующих веществ и любрикантов.
Согласно другому аспекту настоящего изобретения предлагается твердая фармацевтическая композиция для перорального применения, содержащая ZD6474 или его фармацевтически приемлемую соль, хрупкий разжижитель, второй разжижитель, который практически нерастворим и обладает пластичностью при сжатии, дезинтегрант и один или больше смачивающих веществ, связующих веществ и любрикантов.
Соответственно один или больше связующих веществ будут присутствовать в количестве от 0,5 до 50% по массе, например от 1 до 10% по массе.
Соответственно один или больше смачивающих веществ будут присутствовать в количестве от 0,01 до 10%, например от 0,01 до 1% по массе.
Соответственно один или больше любрикантов будут присутствовать в количестве от 0,1 до 10% по массе, например от 0,5 до 1,5% по массе.
К еще одной группе дополнительных вспомогательных веществ, которые могут быть добавлены, относятся консерванты, стабилизаторы, антиоксиданты, улучшители текучести кремнезема, антиадгезивы или глиданты.
Определенная фармацевтическая композиция настоящего изобретения включает:
(a) от 1 до 70 (в частности, от 5 до 50) частей ZD6474 или его фармацевтически приемлемой соли;
(b) от 1 до 96 (в частности, от 10 до 70) частей хрупкого разжижителя; и
(c) от 0,1 до 20 (в частности, от 1 до 15) частей второго разжижителя, который практически нерастворим и обладает пластичностью при сжатии;
где все части указаны по массе, а сумма частей (а)+(b)+(с)=100.
Другая конкретная фармацевтическая композиция настоящего изобретения включает:
(a) от 1 до 70 (в частности, от 5 до 50) частей ZD6474 или его фармацевтически приемлемой соли;
(b) от 1 до 96 (в частности, от 10 до 70) частей хрупкого разжижителя;
(c) от 0,1 до 20 (в частности, от 1 до 15) частей второго разжижителя, который практически нерастворим и обладает пластичностью при сжатии;
(d) от 0,1 до 12 (в частности, от 1 до 10) частей дезинтегранта;
(e) от 0 до 5 (в частности, от 0 до 2) частей смачивающего вещества;
(f) от 0,01 до 8 (в частности, от 0,05 до 5) частей связующего вещества; и
(g) от 0,01 до 8 (в частности, от 0,05 до 5) частей любриканта;
где все части указаны по массе, а сумма частей (а)+(b)+(с)+(d)+(е)+(f)+(g)=100.
Если фармацевтическая композиция согласно изобретению является твердой дозированной формой, такой как таблетки, пеллеты или гранулы, твердая композиция необязательно может дополнительно включать подходящую оболочку, например пленочную оболочку. Оболочка может использоваться для обеспечения защиты от, например, действия влажности или разложения при свете, для окрашивания лекарственной формы или, чтобы модифицировать или контролировать высвобождение ZD6474 из лекарственной формы.
Согласно одному аспекту настоящего изобретения предлагается твердая фармацевтическая композиция для перорального применения, содержащая ZD6474 или его фармацевтически приемлемую соль, хрупкий разжижитель, второй разжижитель, который практически нерастворим и обладает пластичностью при сжатии, и оболочку.
Термин «хорошие свойства сжатия» касается механических свойств материала или смеси порошкообразных компонентов. Материал с хорошими свойствами сжатия будет затвердевать под сжимающим усилием с образованием "спрессованной формы", которая обладает необходимой твердостью, не имеет склонности к разрушению при механическом перемешивании, не склонна к расслаиванию и может быть сформирована на более высоких скоростях обработки, где скорости натяжения выше, а период времени, отведенный для сжатия, короче.
Термин «необходимая твердость» означает достаточную механическую силу, которая предохранит спрессованную форму от разрушения при последующей обработке или транспортировке. Этот показатель связан с размером таблетки и при измерении в килопондах (kp), как правило, составляет не менее 0,8 × диаметр таблетки (мм), предпочтительно не менее 1 × диаметр таблетки, более предпочтительно не менее 1,1 × диаметр таблетки, в частности не менее 1,2 × диаметр таблетки, особенно не менее 1,3 × диаметр таблетки. Чем больше твердость, тем более прочная таблетка, но при очень высоком уровне твердости период распадаемости может быть недопустимо большим.
Термин «расслаивание» означает полное или частичное отделение блюдцеподобного диска от верхней или нижней поверхности таблетки при сжатии материала для образования таблетки или в течение последующих процессов и/или обработки. Отслоение описано в Carstensen, J.Т., Solid pharmaceutics: mechanical properties and rate phenomena. Academic press. New York (1980) and in Sheth и др., Pharmaceutical dosage forms: Tablets. Vol 1. Ed Liebermann and Lachmann, Pub. Marcel Dekker, New York (1980).
Термин «истираемость» означает явление, при котором поверхности таблетки разрушаются и/или демонстрируют признаки растрескивания или разлома вследствие механического перемешивания (например, при обработке, манипуляциях с ними или транспортировке).
Термин «распадаемость» означает процесс, вследствие которого таблетка распадается на составные части при контакте с жидкостью.
Термин «соответсвующее время распадаемости" означает, например, время распадаемости менее 12 минут, желательно менее 10 минут, удобно менее 9 минут, предпочтительно менее 8 минут, более предпочтительно менее 7 минут, в частности менее 6 минут, более конкретно менее 5 минут, и особенно менее 4 минут.
Термин «растворение» означает процесс, при котором растворяются частицы действующего вещества. Для всасывания действующего вещества оно должно сначала раствориться в жидкости в месте всасывания.
Термин «высокая нагрузка действующего вещества» означает, что таблетки с высокой дозой, например больше 300 мг, могут быть сделаны такого размера, что их могут проглотить пациенты. Например, нагрузка действующего вещества 40% ZD6474 позволяет получить таблетку по 200 мг с массой сжатия, то есть общим весом таблетки, 500 мг, которая в диаметре имеет 11 мм.
Термин «хрупкий» как «хрупкий разжижитель» означает, что материал имеет давление текучести (Ру), равное больше, чем 300 МПа, и/или чувствительность к скорости деформации от 0 до 10%.
Термин «пластичный» как «пластичность при сжатии» означает, что материал имеет давление текучести меньше 150 МПа, предпочтительно меньше, чем 120 МПа, особенно меньше, чем 100 МПа, и/или имеет чувствительность к скорости деформации от 10 до 150%, предпочтительно от 10 до 100%, особенно от 30 до 80%.
Термины «свободно растворимый» и «практически нерастворимый» описаны в Британской Фармакопеи 2001-2002 гг. и используются для описания количества вещества (материала), которое может быть растворено в воде при температуре 15-25°С. Полный набор определений указан в Таблице 1.
| Таблица 1. | ||
| Определения растворимости в воде | ||
| Описательный термин | Приблизительный объем воды в миллилитрах на грамм вещества | Миллиграммы на миллилитр (мг/мл) |
| Очень хорошо | Меньше чем 1 | >1000 |
| растворимый | ||
| Свободно растворимый | От 1 до 10 | От 100 до 1000 |
| Растворимый | От 10 до 30 | От 33,3 до 100 |
| Умеренно растворимый | От 30 до 100 | От 10 до 33,3 |
| Незначительно | От 100 до 1000 | От 1 до 10 |
| растворимый | ||
| Очень незначительно | От 1000 до 10000 | От 0,1 до 1 |
| растворимый | ||
| Практически | Больше чем 10000 | <0,1 |
| нерастворимый или | ||
| нерастворимый |
Настоящее изобретение касается фармацевтических композиций, содержащих ZD6474 или его фармацевтически приемлемую соль.
Соли ZD6474 для применения в фармацевтических композициях будут фармацевтически приемлемыми солями, но в производстве ZD6474 и его фармацевтически приемлемых солей могут использоваться и другие соли. Такие соли могут быть образованы с помощью неорганического или органического основания, содержащего фармацевтически приемлемый катион. К таким солям с неорганическими или органическими основаниями относятся, например, соли щелочных металлов, такие как соли натрия или калия, соли щелочноземельных металлов, такте как соли кальция или магния, соли аммония или, например, соли с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2-гидроксиэтил)амином.
ZD6474 может быть синтезирован согласно любому из известных способов получения ZD6474. Например, ZD6474 может быть получен согласно любому из способов, описанных в WO 01/32651; например, описанных в Примерах 2 (а), 2 (b) и 2 (с) WO 01/32651.
Предпочтительно, для приготовления фармацевтических композиций настоящего изобретения применяется безводное свободное основание ZD6474.
Фармацевтические композиции настоящего изобретения могут быть приготовлены путем стандартной грануляции из раствора или сухого смешивания, прессования и затем, необязательно, если желательны покрытия, с помощью процесса покрытия пленочной оболочкой.
Согласно настоящему изобретению предлагается способ изготовления фармацевтической композиции, содержащей ZD6474 или его фармацевтически приемлемую соль, который включает:
(a) смешивание ZD6474, хрупкого разжижителя, второго разжижителя, который практически нерастворим и обладает пластичностью при сжатии, и, необязательно, других вспомогательных веществ для получения гомогенной смеси;
(b) добавление подходящей жидкости к порошкам при смешивании до получения подходящей влажной массы;
(c) высушивание смеси.
Согласно настоящему изобретению предлагается способ изготовления фармацевтической композиции, содержащей ZD6474 или его фармацевтически приемлемую соль, который включает:
(a) смешивание ZD6474, хрупкого разжижителя, такого как гидрофосфат кальция, второго разжижителя, который практически нерастворим и обладает пластичностью при сжатии, такого как микрокристаллическая целлюлоза, необязательно, с другими разжижителями, такими как кросповидон и повидон, вместе в подходящей емкости, такой как гранулятор с большим усилием сдвига, для получения гомогенной смеси;
(b) добавление подходящей жидкости к порошкам при смешивании до получения подходящей влажной массы;
(c) пропускание влажных гранул через подходящее сито для удаления больших частиц;
(d) высушивание смеси;
(e) пропускание образовавшихся таким образом высушенных гранул через дополнительное сито и смешивание смеси с подходящим любрикантом, таким как стеарат магния.
Полученный порошок может быть сжат в ядра таблетки, которые можно, при желании, покрыть с помощью чашечного устройства для нанесения покрытия. Пленочная оболочка может быть нанесена путем распыления водной суспензии компонентов покрытия на ядра таблетки.
Предлагается еще один способ изготовления фармацевтической композиции, содержащей ZD6474 или его фармацевтически приемлемую соль, который включает: смешивание ZD6474, хрупкого разжижителя, такого как гидрофосфат кальция, второго разжижителя, который практически нерастворим и обладает пластичностью при сжатии, такого как микрокристаллическая целлюлоза, необязательно, с другими разжижителями, такими как кросповидон и повидон, вместе в подходящей емкости, для получения гомогенной смеси.
Сухой порошок, образовавшийся таким образом, может быть спрессован в ядра таблетки.
Альтернативно, порошок может быть сформирован в гранулы путем сухой грануляции, например уплотнением с помощью ролика, а полученные гранулы сжаты в ядра таблеток.
Приготовленные фармацевтические композиции могут быть превращены в таблетки, или гранулы, или капсулы и могут подвергаться испытаниям с применением описанных ниже методов.
Тест «Растворение»
Растворение таблеток ZD6474 проверялось с помощью метода, описанного в Таблице 2. Применялся предварительный критерий оценки Q=75% через 45 минут, где Q - процентная доля ZD6474, растворенного в заданное время.
| Таблица 2 | |
| Прибор | Оборудование по USP - покрытые тефлоном лопасти, прозрачные стеклянные сосуды растворения, как минимум шесть положений. Метод II из Фармакопеи Соединенных Штатов (лопастной мешалки) |
| Объем среды | 1000 мл |
| Среда растворения | 0,5% раствор натрия лаурилсульфата (НЛС) |
| Скорость перемешивания | 100 оборотов в минуту |
| Температура | 37,0°С±0,5°С |
| Объем пробы | 10 мл |
| Время отбора проб | 15, 30, 45, 60 минут* |
| * дополнительные периоды времени 5, 10 и 90 минут использовались для таблеток, которые имели изменение в композиции или способе. |
Подготовка среды растворения
Было приготовлено два литра среды 5% НЛС, например, путем растворения 100 г лаурилсульфата натрия (также известный как додецилсульфат натрия) в 2 литрах воды при непрерывном размешивании в течение приблизительно 30 минут. Затем приготовили подходящее количество среды 0,5% НЛС путем разбавления среды 5% НЛС в 10 раз, например 2 литра 5% НЛС растворили в 20 литрах воды для получения 20 литров среды 0,5% НЛС.
Тест «Распадаемость»
Время распадаемости 6 индивидуальных таблеток было определено, как описано в Тесте А в Европейской Фармакопее (Ph. Eur. 2002), с использованием воды в качестве жидкости для погружения и без применения дисков. Было зарегистрировано время (минуты), через которое все 6 таблеток распались.