Модуляция бета-катенин/tcf-активируемой транскрипции
Иллюстрации
Показать всеИзобретение относится к способу модуляции экспрессии гена-мишени, индуцируемой β-катенином, с использованием агента, который увеличивает связывание р300 с β-катенином и уменьшает связывание СВР с β-катенином, включающему приведение композиции, содержащей β-катенин, СВР и р300, где β-катенин имеет вероятность связывания с СВР в сравнении с р300, в контакт с агентом в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300, причем указанный агент является соединением, имеющим структуру, выбранную из формулы (I), или его стереоизомерами:
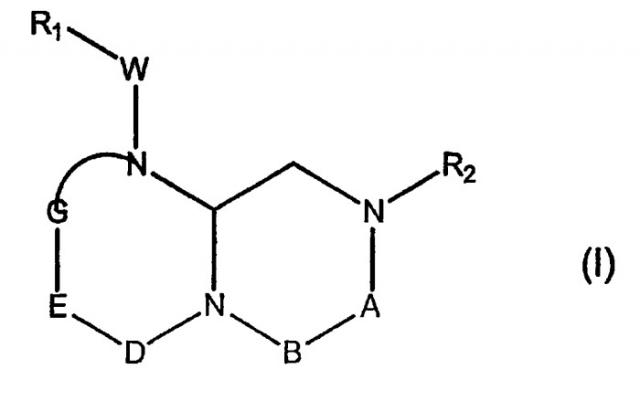
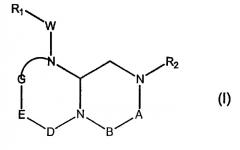
где А обозначает -(С=O)-, В обозначает -(CHR4)-, D обозначает -(С=O)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, W обозначает -(C=O)NH-, X обозначает азот или СН, Z обозначает СН, n=0 или 1. Значения заместителей R1 и R2 указаны в формуле изобретения. Также изобретение относится к композиции для модуляции экспрессии гена-мишени, индуцируемой β-катенином. 2 н. и 7 з.п. ф-лы, 8 табл., 30 ил.
Реферат
УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Изобретение относится к соединениям и способам модуляции транскрипции, активируемой β-катенином/TCF, например, селективным ингибированием генов, на которые нацелен путь Wnt/β-катенина.
Описание предшествующего уровня техники
Путь Wnt/β-катенина инициирует каскад передачи сигнала, критический как для нормального развития, так и для инициации и прогрессирования рака (Wodarz et al., “Mechanisms of Wnt signaling in development,” Annu. Rev. Cell Dev. Biol. 14:59-88 (1998); Morin, P.J. “Beta-catenin signaling and cancer,” Bioessays 21:1021-30 (1999); Moon et al., “The promise and perils of Wnt signaling through beta-catenin,” Science 296:1644-46 (2002); Oving et al., “Molecular causes of colon cancer,” Eur. J. Clin. Invest. 32:448-57 (2002)). Отличительным признаком этого пути является то, что он активирует транскрипционную роль мультифункционального белка β-катенина. В нормальных клетках большая часть β-катенина обнаруживается в клеточной мембране в связанном с кадгерином виде, где он играет важную роль в адгезии клеток. Другой пул β-катенина обнаружен в цитоплазме и ядре, где он регулирует транскрипцию (Gottardi et al., “Adhesion signaling: how beta-catenin interacts with its partners,” Curr. Biol. 11:R792-4 (2001)). В его различных ролях в качестве медиатора клеточной адгезии в плазматической мембране и в качестве активатора транскрипции β-катенин взаимодействует со множеством белков, большинство которых, несмотря на отсутствие значимой гомологии последовательности, конкурируют за одни и те же армадилло-повторы β-катенина. Кристаллическая структура вместе с мутационными исследованиями картировала сайты связывания β-катенина нескольких белков в различные армадилло-повторы (Gottardi et al., “Adhesion signaling: how beta-catenin interacts with its partners,” Curr. Biol. 11:R792-4 (2001); Huber et al., “The structure of the beta-catenin/E-cadherin complex and the molecular basis of diverse ligand recognition by beta-catenin,” Cell 105:391-402 (2001)).
Цитоплазматический пул β-катенина регулируется через фосфорилирование “деструктивным комплексом”, который включает в себя гликогенсинтазу-киназу-3β (GSK-3β), казеинкиназу-1α (СК-1α), белок скелета молекулы, аксин, и опухолевый супрессор, белок аденоматозного семейного кишечного полипоза (АРС), среди других белков (Behrens J., “Control of beta-catenin signaling in tumor development,” Ann. N.Y. Acad. Sci. 910:21-33 (2000); discussion 33-5). В отсутствие передачи сигнала Wnt, фосфорилирование метит цитоплазматический β-катенин для направляемого SCF-комплексом (Skp1-Cullin-F-box) убиквитинилирования и протеосомной деградации. Активация Wnt-пути инактивирует функцию GSK-3β, предотвращая фосфорилирование β-катенина, позволяя посредством этого накапливание β-катенина в цитоплазме и последующее перемещение в ядро, где он образует транскрипционно активный комплекс и запускает экспрессию его генов-мишеней. Ключевой стадией в активации генов-мишеней является образование комплекса между β-катенином и членами семейства фактора Т-клеток (TCF)/лимфоидного энхансерного фактора (LEF-1) факторов транскрипции (Brantjes et al., “TCF: Lady Justice casting the final verdict on the outcome of Wnt signaling,” Biol. Chem. 383:255-61 (2002)). Для генерирования транскрипционно активного комплекса β-катенин рекрутирует коактиваторы транскрипции, CREB-связывающий белок (СВР) или его близкородственный гомолог р300 (Hecht et al., “The p300/CBP acetyltransferases function as transcriptional coactivators of beta-catenin in vertebrates,” EMBO J. 19:1839-50 (2000); Takemaru et al., “The transcriptional coactivator CBP interacts with beta-catenin to activate gene expression,” J. Cell Biol. 149:249-54 (2000)), а также другие компоненты основного аппарата транскрипции.
Точный механизм, при помощи которого комплекс β-катенин/TCF активирует транскрипцию Wnt-чувствительных генов, не выяснен, но домены β-катенина, участвующие в активации транскрипции, были картированы в NH2- и СООН-концах (Staal et al., “Wnt signals are transmitted through N-terminally dephosphorylated beta-catenin,” EMBO J. 3:63-68 (2002)). СООН-концевой район β-катенина состоит из приблизительно 100 аминокислот, и было показано, что он взаимодействует с ТАТА-связывающим белком (ТВР) (Hecht et al., “Functional characterization of multiple transactivating elements in beta-catenin, some of which interact with the TATA-binding protein in vitro,” J. Biol. Chem. 274:18017-25 (1999)). При слиянии с LEF-1 СООН-конец является достаточным для стимуляции трансактивации (Vleminsky et al., “The C-terminal transactivation domain of beta-catenin is necessary and sufficient for signaling by the LEF-1/beta-catenin complex in Xenopus laevis,” Mech. Dev. 81:65-74 (1999)). NH2-концевая часть β-катенина состоит из приблизительно 130 аминокислот, содержащих сайты фосфорилирования GSK-3β, необходимые для протеосомной деградации.
Путь Wnt/β-катенина в норме регулирует экспрессию ряда генов, участвующих в стимуляции пролиферации и дифференцировки. Однако, в >85% случаев рака ободочной кишки один из компонентов деструктивного комплекса, APC, и/или сам β-катенин является мутированным, приводящим к увеличению ядерного β-катенина и конститутивной активации генов-мишеней (Fearnhead et al., “Genetics of colorectal cancer: hereditary aspects and overview of colorectal tumorigenesis,” Br. Med. Bull. 64:27-43 (2002)). Многие из этих генов, в том числе cyclin D1 (Shtutman et al., “The cyclin D1 gene is target of the beta-catenin/LEF-1 pathway,” Proc. Natl. Acad. Sci. USA 96:5522-27 (1999); Tetsu et al., “Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells,” Nature 398:442-26 (1999)) и c-myc (He et al., “Identification of с-MYC as a target of the APC pathway,” Science 281:1509-12 (1998)), которые играют решающие роли в росте, пролиферации и дифференцировке клеток, вместе с генами, необходимыми для инвазивного роста, такими как matrilysin (Crawford et al., “The metalloproteinase matrilysin is a target of beta-catenin transactivation in intestinal tumors,” Oncogene 18:2883-91 (1999)), fibronectin (Gradl et al., “The Wnt/Wg signal transducer beta-catenin controls fibronectin expression,” Mol. Cell. Biol. 19:5576-87 (1999)), CD44 (Wielenga et al., “Expression of CD44 in Apc and Tcf mutant mice implies regulation by WNT pathway,” Am. J. Pathol. 154:515-23 (1999)), µPAR (Mann et al., “Target genes of beta-catenin-T cell-factor/lymphoid-enhancer-factor signaling in human colorectal carcinomas”, Proc. Natl. Acad. Sci. USA 96:1603-08 (1999)), и активируются ненадлежащим образом.
При условии, что большинство случаев рака ободочной кишки включает в себя активацию пути передачи сигнала β-катенина, и при условии того факта, что множественные мутации приводят к этой активации, существует явная необходимость в лекарственных средствах, которые ослабляют ядерные функции β-катенина. Данное изобретение обеспечивает агенты, которые противодействуют β-катенин/TCF-опосредуемой транскрипции, и обеспечивает также связанные с этим преимущества, описанные подробно ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце, данное изобретение обеспечивает агенты, которые являются антагонистами β-катенин/TCF-опосредуемой транскрипции, и способы их применения. В одном аспекте данное изобретение обеспечивает способы, посредством которых субпопуляция β-катенин/TCF-чувствительных генов специфически отрицательно регулируется, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, посредством которых связывание между СВР и β-катенином разрушается, но связывание между структурно родственным коактиватором р300 и β-катенином не разрушается, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте, данное изобретение обеспечивает способы, посредством которых гены, которые стимулируются СВР, но не р300, селективно активируются, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. Кроме того, данное изобретение обеспечивает способы, посредством которых гены, которые стимулируются р300, но не СВР, селективно активируются, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, при помощи которых клетки карциномы лечат химическим агентом для остановки развития в G1-фазе клеточного цикла, где пролонгированное лечение этим химическим агентом индуцирует апоптоз, который не детектируется в нормальных клетках ободочной кишки (колоноцитах). Этими клетками карциномы могут быть, например, клетки ободочной кишки, молочной железы, предстательной железы и т.д.
Например, в одном аспекте данное изобретение обеспечивает способ модуляции β-катенин-индуцируемой экспрессии генов. Этот способ предусматривает контактирование композиции с агентом, где эта композиция содержит β-катенин, СВР и р300, и β-катенин имеет вероятность связывания с СВР в сравнении с р300. Этот агент присутствует в данной композиции в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300. Другими словами, в отсутствие этого агента β-катенин связывается с СВР и р300 в отличающейся степени, чем степень связывания, наблюдаемая в присутствии этого агента. Например, в зависимости от его химической структуры, этот агент может производить следующее: увеличивать связывание СВР с β-катенином, при необязательном уменьшении связывания р300 с β-катенином; или увеличивать связывание р300 с β-катенином при необязательном уменьшении связывания СВР с β-катенином. Этот способ может выполняться in vivo или ex vivo. В одном аспекте этот способ выполняют ex vivo и данная композиция содержит стволовую клетку. В другом аспекте этот способ выполняют in vivo, и эта композиция находится в млекопитающем. Способ данного изобретения может быть использован для лечения различных медицинских состояний. Например, в различных аспектах данного изобретения: это млекопитающее может страдать от рака, и это количество является эффективным для лечения рака; эта композиция находится в клетке, и этот агент увеличивает вероятность того, что эта клетка будет дифференцироваться; эта композиция находится в клетке, и этот агент увеличивает вероятность того, что эта клетка будет пролиферировать.
В другом аспекте данное изобретение обеспечивает композицию, содержащую β-катенин, СВР, р300 и агент. β-катенин имеет большую вероятность связывания с СВР в сравнении с р300, и этот агент присутствует в этой композиции в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300. Другими словами, в отсутствие этого агента β-катенин связывается с СВР и р300 в отличающейся степени, чем степень связывания, наблюдаемая в присутствии этого агента. Например, в зависимости от его химической структуры, этот агент может производить следующее: увеличивать связывание СВР с β-катенином, при необязательном уменьшении связывания р300 с β-катенином; или увеличивать связывание р300 с β-катенином при необязательном уменьшении связывания СВР с β-катенином. Эта композиция может находиться in vivo или ex vivo. В одном аспекте эта композиция находится ex vivo и эта композиция дополнительно содержит стволовую клетку. В другом аспекте эта композиция находится in vivo и эта композиция находится в млекопитающем, например в мыши.
В другом аспекте данное изобретение обеспечивает способ модуляции активности Wnt-пути, предусматривающий: (а) контактирование компонентов Wnt-пути с соединением, которое активирует Wnt-путь, для обеспечения активированного Wnt-пути; и (b) контактирование активированного Wnt-пути с химическим агентом, который полностью или существенно препятствует связыванию между р300 и катенином, но вызывает незначительное ингибирование или не вызывает ингибирования связывания между СВР и катенином. Необязательно, Wnt-путь находится внутри клетки. Необязательно, этот способ выполняют ex vivo. Необязательно, соединение, которое активирует Wnt-путь, выбрано из LiCl или ингибитора GSK.
В другом аспекте данное изобретение обеспечивает способ модуляции пролиферации клеток, предусматривающий: (а) обеспечение популяции клеток при условиях, где часть этой популяции будет пролиферировать и часть этой популяции будет дифференцироваться; и (b) добавление химического агента к этой популяции, где этот агент вызывает увеличение части клеток, которые пролиферируют, относительно части клеток, которые дифференцируются. В различных необязательных вариантах осуществления этого способа: это соединение препятствует связыванию между р300 и катенином; этот способ дополнительно предусматривает добавление агента к этой популяции, который активирует Wnt-путь; этой популяцией клеток является популяция стволовых клеток; этот способ выполняют ex vivo; этот способ дополнительно предусматривает добавление агента, который вызывает дифференцировку популяции клеток, где, например, клетки в данной популяции дифференцируются с образованием клеток крови, или клетки в данной популяции дифференцируются с образованием нервных клеток.
В другом аспекте данное изобретение обеспечивает способ для поддержания стволовой клетки в недифференцированном состоянии, предусматривающий контактирование этой стволовой клетки с агентом, который ингибирует клеточную дифференцировку или стимулирует пролиферацию клеток, в количестве, эффективном для поддержания стволовой клетки в недифференцированном состоянии. В некоторых вариантах осуществления, агент, используемый в этом способе, селективно ингибирует взаимодействие β-катенин/р300 относительно взаимодействия β-катенин/СВР.
Вкратце, в других аспектах данное изобретение обеспечивает:
способ селективного ингибирования взаимодействия β-катенин/СВР относительно взаимодействия β-катенин/р300, причем этот способ предусматривает введение соединения в композицию, где эта композиция содержит β-катенин, СВР и р300, и это соединение селективно ингибирует взаимодействие β-катенин/СВР относительно взаимодействия β-катенин/р300;
способ селективного ингибирования взаимодействия β-катенин/р300 относительно взаимодействия β-катенин/СВР, причем этот способ предусматривает введение соединения в композицию, где эта композиция содержит β-катенин, СВР и р300, и это соединение селективно ингибирует взаимодействие β-катенин/р300 относительно взаимодействия β-катенин/СВР;
способ усиления перемещения β-катенина из ядра в цитозоль, причем этот способ предусматривает введение соединения в клетку, где эта клетка содержит ядро и цитозоль, а ядро содержит β-катенин, и это соединение вызывает перемещение β-катенина из ядра в цитозоль;
способ селективного ингибирования экспрессии генов, на которые нацелен Wnt/β-катенин-путь, причем этот способ предусматривает введение соединения в композицию, содержащую гены, на которые нацелен Wnt/β-катенин-путь, причем это соединение вызывает изменение экспрессии генов, на которые нацелен Wnt/β-катенин-путь.
В способах и композициях данного изобретения химический агент необязательно выбран из соединений формулы (I):
где А обозначает -(CHR3)- или -(С=О)-, В обозначает -(CHR4)- или -(С=О)-, D обозначает -(CHR5)- или -(С=О)-, Е обозначает -(ZR6)- или -(С=О)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(С=О)-(XR9)- или -(С=О)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает кислород или серу, Х и Z обозначают независимо азот или СН, n=0 или 1; и R1, R2, R3, R4, R5, R6, R7, R8 и R9 являются одинаковыми или различными и независимо выбраны из части боковой цепи аминокислоты, производного части боковой цепи аминокислоты или остальной молекулы, и их стереоизомеров.
В некоторых вариантах осуществления, R1, R2, R3, R4, R5, R6, R7, R8 и R9 формулы (I) независимо выбраны из группы, состоящей из аминоС2-5алкила, гуанидиноС2-5алкила, С1-4алкилгуанидиноС2-5алкила, диС1-4алкилгуанидино-С2-5алкила, амидиноС2-5алкила, С1-4алкиламиноС2-5алкила, диС1-4алкиламидиноС2-5алкила, С1-3алкокси, фенила, замещенного фенила (где заместители выбраны независимо из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бензила, замещенного бензила (где заместители на бензиле независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), нафтила, замещенного нафтила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бис-фенилметила, замещенного бис-фенилметила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридила, замещенного пиридила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридилС1-4алкила, замещенного пиридилС1-4алкила (где заместители пиридина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиримидилС1-4алкила, замещенного пиримидилС1-4алкила (где заместители пиримидина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси или нитро, карбокси, циано, сульфурила или гидроксила), триазин-2-ил-С1-4алкила, замещенного триазин-2-ил-С1-4алкила (где заместители триазина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазоС1-4алкила, замещенного имидазолС1-4алкила (где заместители имидазола независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолинилС1-4алкила, N-амидинопиперазинил-N-С0-4алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, С1-5диалкиламиноС2-5алкила, N-амидинопиперидинилС1-4алкила и 4-аминоциклогексилС0-2алкила.
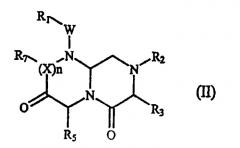
В некоторых вариантах осуществления, А обозначает -(CHR3)-, В обозначает -(С=О)-, D обозначает -(CHR5)-, Е обозначает -(С=О)-, G обозначает -(XR7)n-, и это соединение имеет следующую общую формулу (II):
где R1, R2, R3, R5, R7, W, X и n имеют определенные в формуле (I) значения.
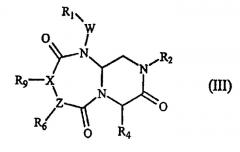
В некоторых вариантах осуществления, А обозначает -(С=О)-, В обозначает -(CHR4)-, D обозначает -(С=О)-, Е обозначает -(ZR6)-, G обозначает -(С=О)-(XR9)-, и это соединение имеет следующую общую формулу (III):
где R1, R2, R4, R6 R9, W и Х имеют определенные в формуле (I) значения, Z обозначает азот или СН (когда Z обозначает СН, тогда Х обозначает азот).
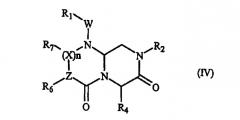
В некоторых вариантах осуществления, А обозначает -(С=О)-, В обозначает -(CHR4)-, D обозначает -(С=О)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, и это соединение имеет следующую общую формулу (IV):
где R1, R2, R4, R6, R7, W, X и n имеют определенные в формуле (I) значения, и Z обозначает азот или СН, при условии, что, когда Z обозначает азот, тогда n равно нулю, и когда Z обозначает СН, тогда Х обозначает азот и n не равно нулю.
В некоторых вариантах осуществления, это соединение имеет следующую общую формулу (VI):
где Ra обозначает бициклическую арильную группу, имеющую 8-11 членов кольца, которые могут иметь 1-3 гетероатома, выбранных из азота, кислорода или серы, и Rb обозначает моноциклическую арильную группу, имеющую 5-7 членов кольца, которые могут иметь 1-2 гетероатома, выбранных из азота, кислорода или серы, и арильное кольцо в этом соединении может иметь один или несколько заместителей, выбранных из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы и низшей алкоксигруппы. Необязательно, Ra обозначает нафтильную, хинолинильную или изохинолинильную группу, а Rb обозначает фенил, пиридил или пиперидил, все из которых могут быть замещенными одним или несколькими заместителями, выбранными из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы и низшей алкоксигруппы. В некоторых вариантах осуществления, Ra обозначает нафтил, а Rb обозначает фенил, которые могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы и низшей алкоксигруппы.
В некоторых вариантах осуществления, это соединение выбрано из СОЕДИНЕНИЙ 1, 3, 4 и 5.
В других аспектах данное изобретение обеспечивает способы скрининга, т.е. способы, при помощи которых могут быть идентифицированы биологически активные соединения и/или может быть оценена их эффективность. Например, данное изобретение обеспечивает способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей СВР 1-111; (b) контактирования смеси стадии (а) с частью молекулы, содержащей β-катенин; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей β-катенин, стадии (b), с частью молекулы, содержащей СВР 1-111, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с частью молекулы, содержащей β-катенин, малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (d) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей р300 1-111 с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей β-катенин; (b) контактирования смеси стадии (а) с частью молекулы, содержащей СВР 1-111; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей СВР 1-111, стадии (b), с частью молекулы, содержащей β-катенин, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей β-катенин, с частью молекулы, содержащей СВР 1-111, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (d) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей р300 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей (1) β-катенин, ассоциированный с СВР 1-111; (b) определения, посредством анализа, диссоциирует ли указанная молекула стадии (а) СВР 1-111 от β-катенина; и (с) идентификации, после определения, что указанная малая молекула стадии (а) диссоциирует связывание β-катенина от СВР 1-110, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (d) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (с) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (е) определения, посредством анализа, не ингибирует ли указанная молекула стадии (d) связывание указанной части молекулы, содержащей р300 1-111, с β-катенином; и (f) подтверждения, после определения, что указанная малая молекула стадии (d) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей р300 1-111; (b) контактирования смеси стадии (а) с частью молекулы, содержащей β-катенин; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей β-катенин, стадии (b), с частью молекулы, содержащей р300 1-111, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей р300 1-111, с частью молекулы, содержащей β-катенин, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (d) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей β-катенин; (b) контактирования смеси стадии (а) с частью молекулы, содержащей р300 1-111; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей р300 1-111, стадии (b), с частью молекулы, содержащей β-катенин, стадии (а); (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей β-катенин, с частью молекулы, содержащей р300 1-111, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (d) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей (1) β-катенин, ассоциированный с р300 1-111; (b) определения, посредством анализа, диссоциирует ли указанная молекула стадии (а) р300 1-111 от β-катенина; и (с) идентификации, после определения, что указанная малая молекула стадии (а) диссоциирует связывание β-катенина от р300 1-110, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (d) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (с) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (е) определения, посредством анализа, не ингибирует ли указанная молекула стадии (d) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (f) подтверждения, после определения, что указанная малая молекула стадии (d) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
В других аспектах данное изобретение обеспечивает последовательности нуклеиновых кислот и пептидов, где эти последовательности применимы в качестве, например, терапевтических средств, или, например, в способах скрининга. Таким образом, в различных примерных аспектах данное изобретение обеспечивает:
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую SEQ ID NO:1, или последовательность, имеющую по меньшей мере 80% идентичность относительно SEQ ID NO:1, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую фрагмент SEQ ID NO:1, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенный и выделенный пептид, содержащий SEQ ID NO:2, или пептид, имеющий по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР;
по существу очищенный и выделенный пептид, содержащий фрагмент SEQ ID NO:2, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:1, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из фрагмента SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенный и выделенный пептид, состоящий по существу из SEQ ID NO:2, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР;
по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:2, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:1, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из фрагмента SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенный и выделенный пептид, состоящий из SEQ ID NO:2, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР;
по существу очищенный и выделенный пептид, состоящий из фрагмента SEQ ID NO:2, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую SEQ ID NO:3, или последовательность, имеющую по меньшей мере 80% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую фрагмент SEQ ID NO:3, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенный и выделенный пептид, содержащий SEQ ID NO:4, или пептид, имеющий по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком р300;
по существу очищенный и выделенный пептид, содержащий фрагмент SEQ ID NO:4, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из фрагмента SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенный и выделенный пептид, состоящий по существу из SEQ ID NO:4, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком р300;
по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:4, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из фрагмента SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенный и выделенный пептид, состоящий из SEQ ID NO:4, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком р300;
по существу очищенный и выделенный пептид, с