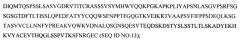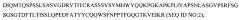Способ лечения рассеянного склероза
Иллюстрации
Показать всеГруппа изобретений, включающая способ и изделие, относится к медицине, предназначена для лечения рассеянного склероза. Вводят анти-CD20 антитела в количестве 0,5-4,0 г. Через 16-60 недель повторяют введение. Проводится до 4 и более воздействий антитела. Каждое из воздействий - в виде одной или двух доз антитела. Антитело может вводиться внутривенно, подкожно или подоболочечно. При этом может использоваться второе лекарственное средство. Изделие, содержащее инструкцию и контейнер с 0,5-4,0 г антитела. Дополнительно изделие может содержать контейнер со вторым лекарственным средством и инструкцию по его применению. Изобретения позволяют увеличить время до подтвержденного прогрессирования заболевания, уменьшить частоту рецидивов. 2 н. и 36 з.п.ф-лы, 3 табл., 6 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение относится к способам лечения рассеянного склероза (множественного склероза) (МС) у субъекта с использованием специальных схем и протоколов введения доз и к изделию с инструкциями в отношении такого использования.
Область техники
Рассеянный склероз
Рассеянный склероз (МС) является воспалительным демиелинизирующим дегенеративным заболеванием центральной нервной системы человека (ЦНС). Он является заболеванием, распространенным по всему миру, которое поражает приблизительно 300000 лиц в Соединенных Штатах; он является заболеванием молодых взрослых, причем у 70-80% пациентов он появляется в возрасте между 20 и 40 годами (Anderson et al. Ann Neurology 31(3):333-6 (1992); Noonan et al. Neurology 58:136-8 (2002)). МС является гетерогенным нарушением, на основе клинического течения, оценки изображения сканирующей ядерно-магнитной резонансной томографии (ЯМР-томографии) и анализа патологии материала биопсии и аутопсии (Lucchinetti et al. Ann Neurol 47:707-17 (2000)). Это заболевание манифестируется в большом количестве возможных комбинаций нарушений, в том числе синдромов спинного мозга, ствола головного мозга, черепного нерва, мозжечка, церебрального и когнитивного синдромов. Прогрессирующая потеря трудоспособности является судьбой большинства пациентов с МС, в частности, с 25-летней перспективой. Половина пациентов с МС нуждаются в палке для хождения в пределах 15 лет от возникновения заболевания. МС является основной причиной неврологической недееспособности у молодых взрослых и взрослых среднего возраста и до прошлого десятилетия не имел известных благоприятных способов лечения. МС трудно диагностировать вследствие неспецифических клинических показателей, что привело к развитию высокоструктурированных диагностических критериев, которые включают в себя несколько технологических достижений, состоящих из сканирующей ЯМР-диагностики, вызванных (индуцированных) потенциалов и исследований цереброспинальной жидкости (CSF). Все диагностические критерии основываются на общих принципах рассеянных повреждений в белом веществе мозга, встречающихся в различное время и не объяснимого другими этиологиями, такими как инфекция, сосудистое нарушение или аутоиммунное нарушение (McDonald et al. Ann Neurol 50:121-7 (2001)). МС имеет четыре картины заболевания: рецидивирующий-ремиттирующий МС (RRMS; 80-85% случаев при возникновении), первичный прогрессирующий МС (PPMS; 10-15% при возникновении), прогрессирующий рецидивирующий МС (PRMS; 5% при возникновении) и вторичный прогрессирующий МС (SPMS) (Kremenchutzky et al. Brain 122 (Pt 10):1941-50 (1999); Confavreux et al. N Engl J Med 343(20):1430-8 (2000)). По приближенной оценке у 50% пациентов с RRMS в течение 10 лет будет развиваться SPMS и у до 90% пациентов с RRMS будет в конечном счете развиваться SPMS (Weinshenker et al. Brain 112(Pt 1):133-46 (1989)).
В настоящее время шесть лекарственных средств в четырех классах являются одобренными в Соединенных Штатах Америки для лечения RRMS, в то время как никакие лекарственные средства не были одобрены для PPMS. Способы лечения RRMS включают в себя следующее: класс интерферонов, IFN-бета-1а (REBIF® и AVONEX®) и IFN-бета-1b (BETASERON®); глатирамер ацетат (COPAXONE®), полипептид; натализумаб (TYSABRI®) и митоксатрон (NOVANTRONE®), цитотоксический агент. Другие лекарственные средства использовали с переменными степенями успеха, в том числе кортикостероиды, метотрексат, циклофосфамид, азатиоприн и внутривенный (IV) иммуноглобулин. Благоприятные эффекты одобренных в настоящее время способов лечения являются относительно скромными (~30%) для скорости рецидива и предупреждения нетрудоспособности при RRMS, как предполагается по результатам двух недавних мета-анализов (Filippini et al. Lancet 361:545-52 (2003)).
В других клинических исследованиях оценивали другие иммуномодулирующие средства для лечения в МС, в том числе ингибиторы фактора некроза опухолей α и измененные пептидные лиганды, которые скорее ухудшали, чем улучшали течение МС (Lenercept Multiple Sclerosis Study Group and the University of British Columbia MS/MRI Neurology 53:457-65 (1999); Bielekova et al. Nat Med 2000;6:1167-75 (2000), опечатки приведены в Nat Med 6:1412 (2000)).
Господствовала преобладающая точка зрения на патофизиологию МС, что воспаление опосредуется главным образом CD4+ Тh1 Т-клетками. Терапевтические подходы, основанные на этой теории, такие как использование IFN-бета и глатирамерацетата, уменьшают, но полностью не предотвращают проявление обострений или накопление недееспособности.
Существование гуморального компонента в МС человека безоговорочно признавалось в течение десятилетий, как было показано включением олигоклональных полос CSF и увеличенным внутриоболочечным синтезом IgG в диагностических критериях для МС (Siden A. J Neurol 221:39-51 (1979); McDonald et al., Ann Neurol 50:121-7 (2001); Andersson et al., Eur J Neurol 9:243-51 (2002); O'Connor, P. Neurology 59:S1-33 (2002)). Присутствие олигоклональных полос, увеличенных свободных легких цепей и увеличенного внутриоболочечного синтеза IgМ коррелирует с активностью заболевания МС и может быть прогностическим фактором более тяжелых результатов (Rudick et al. Mult Scler 1:150-5 (1995); Zeman et al. Acta Cytol 45:51-9 (2001); Izquierdo et al. Acta Neurol Scand 105:158-63 (2002); Wolinsky J. J Neurol Sci 206:145-52 (2003); Villar et al. Ann Neurol 52:222-6 (2002)).
Антимиелиновые антитела (против миелинового основного белка (МВР) и миелинового олигодендроцитарного гликопротеина (MOG)) были детектированы в сыворотке пациентов с прогрессирующей и рецидивирующей формами МС (Reindl et al. Brain 122:2047-56 (1999); Egg et al. Mult Scler 7(5): 285-9 (2001)). Антимиелиновые антитела были также детектированы в CSF пациентов с МС (Reindl et al. Brain 122:2047-56 (1999); Egg et al. Mult Scler 7(5): 285-9 (2001); Andersson et al., Eur J Neurol 9:243-51 (2002)). Дополнительные типы антител, такие как антиганглиозидные антитела или антинейрофиламентные антитела, наблюдали у пациентов с МС (Mata et al. Mult Scler 5:379-88 (1999); Sadatipour et al. Ann Neurol 44:980-3 (1998)). Недавнее сообщение указывало на то, что присутствие сывороточных анти-MOG- и анти-MBP-антител было сильным прогностическим фактором прогрессирования из клинически изолированного демиелинизирующего события в точно определенный RRMS (Berger et al. N Engl J Med 349:139-45 (2003)). Корректированный коэффициент риска в отношении получения обострения был равен 76,5 для пациентов, которые были серопозитивными в отношении обоих антител, и 31,6 для пациентов, которые были серонегативными только в отношении анти-MOG-антител.
На Международном консорциуме по патологии определено, что антитела, связанные с миелином, присутствуют в большинстве пациентов с МС, с клетками плазмы и В-клетками, также обнаруживаемыми в повреждениях МС, что обеспечило дополнительное доказательство в отношении гуморальной роли в МС (Prineas and Wright, Lab Invest 38:409-21 (1978); Esiri M. Neuropathol Appl Neurobiol 6:9-21 (1980); Genain et al. Nat Med 5:170-5 (1999); Lucchinetti et al. Ann Neurol 47:707-17 (2000); Wingerchuk et al. Lab Invest 81:263-81 (2001)). В-клетки являются детектируемыми в цереброспинальной жидкости (CSF) пациентов с МС, и присутствие относительно высокой доли В-клеток может быть показателем более тяжелого прогрессирования недееспособности (Cepok et al. Brain 124(Pt 11):2169-76 (2001)).
Ритуксимаб, как сообщалось, истощал периферические В-клетки у всех субъектов с RRMS или синдромом опсоклонуса-миоклонуса и уменьшал количество В-клеток CSF у некоторых пациентов (Pranzatelli et al. Neurology 60(Suppl1) PO5.128:A395 (2003); Cross et al. “Preliminary Results from a Phase II Trial of Rituximab in MS” (abstract) Eighth Annual Meeting of the Americas Committees for Research and Treatment in Multiple Sclerosis ACTRIMS 20-1 (October, 2004)). См. также Cree et al. “Tolerability and Effects of Rituximab “Anti-CD20 Antibody” in Neuromyelitis Optica and Rapidly Worsening Multiple Sclerosis” Meeting of the Am. Acad. Neurol. (April, 2004).
CD20-антитела и терапия с их применением
Лимфоциты являются одним из многих типов лейкоцитов, продуцируемых костным мозгом во время процесса гемопоэза. Имеются две основных популяции лимфоцитов: В-лимфоциты (В-клетки) и Т-лимфоциты (Т-клетки). Лимфоцитами, которые здесь представляют особый интерес, являются В-клетки.
В-клетки созревают в костном мозге и покидают костный мозг, экспрессируя антигенсвязывающее антитело на их клеточной поверхности. Когда «необученная» В-клетка впервые встречается с антигеном, в отношении которого является специфическим ее мембраносвязанное антитело, эта клетка начинает быстро делиться, и ее потомство дифференцируется в В-клетки иммунологической памяти и эффекторные клетки, называемые «плазматическими клетками» (плазмацитами). В-клетки памяти имеют большую продолжительность жизни и продолжают экспрессировать мембраносвязанное антитело с той же самой специфичностью, что и исходная родительская клетка. Плазматические клетки не продуцируют мембраносвязанное антитело, но вместо этого продуцируют антитело в форме, которая может быть секретирована. Секретируемые антитела являются главной эффекторной молекулой гуморального иммунитета.
Антиген CD20 (также называемый консервативным антигеном дифференцировки В-лимфоцитов человека, Вр35) является гидрофобным трансмембранным белком с молекулярной массой приблизительно 35 кД, локализованным на пре-В- и зрелых В-лимфоцитах (Valentine et al. J. Biol. Chem. 264(19):11282-11287 (1989); и Einfeld et al. EMBO J. 7(3):711-717 (1988)). Этот антиген экспрессируется также на более чем 90% В-клеточных не-ходжкинских лимфом (NHL) (Anderson et al. Blood 63(6):1424-1433 (1984)), но не обнаруживается на гемопоэтических стволовых клетках, про-В-клетках, нормальных плазматических клетках или других нормальных тканях (Tedder et al. J. Immunol. 135(2):973-979 (1985)). CD20 регулирует раннюю стадию (ранние стадии) в процессе активации для инициации клеточного цикла и дифференцировки (Tedder et al. см. выше) и, возможно, функционирует в качестве канала ионов кальция (Tedder et al. J. Cell. Biochem. 14D:195 (1990)).
При условии экспрессии CD20 в В-клеточных лимфомах этот антиген может служить в качестве кандидата для «нацеливания» на такие лимфомы. По существу, такое нацеливание может быть в общем виде следующим: антитела, специфические в отношении поверхностного антигена CD20 В-клеток, вводят пациенту. Эти анти-CD20-антитела специфически связываются с антигеном CD20 (очевидно) как нормальных, так и злокачественных В-клеток; это антитело, связанное с поверхностным антигеном CD20, может приводить к разрушению и истощению неопластических В-клеток. Кроме того, химические агенты или радиоактивные метки, имеющие потенциал разрушения опухоли, могут быть конъюгированы с анти-CD20-антителом, так что этот агент специфически “доставляется” к неопластическим В-клеткам. Независимо от этого подхода, первичной задачей является разрушение опухоли; конкретный подход может определяться конкретным используемым анти-CD20-антителом, и, следовательно, доступные подходы к нацеливанию на антиген CD20 могут значительно варьироваться.
Антитело Ритуксимаб (RITUXAN®) является генетически сконструированным химерным мышиным/человеческим моноклональным антителом, направленным против антигена CD20. Ритуксимаб является антителом, называемым “C2B8” в Патенте США № 5736137, выданном 7 апреля 1998 года (Anderson et al.). RITUXAN® показан для лечения пациентов с рецидивирующей или трудноизлечимой низкозлокачественной или фолликулярной, CD20-положительной, В-клеточной не-ходжкинской лимфомой. Исследования механизма действия in vitro показали, что RITUXAN® связывает комплемент человека и лизирует лимфоидные В-клеточные линии через комплемент-зависимую цитотоксичность (CDC) (Reff et al. Blood 83(2):435-445 (1994)). Дополнительно, он имеет существенную активность в анализах на антитело-зависимую клеточную цитотоксичность (ADCC). Более недавно было показано, что RITUXAN® имеет антипролиферативные действия в анализах включения тимидина, обработанного тритием, и непосредственно индуцирует апоптоз, тогда как другие анти-CD19- и CD20-антитела прямо не индуцируют апоптоз (Maloney et al. Blood 88(10):637a (1996)). Синергизм между RITUXAN® и химиотерапией и токсином также наблюдали экспериментально. В частности, RITUXAN® сенсибилизирует устойчивые к лекарственным средствам линии клеток В-клеточной лимфомы человека к цитотоксическим эффектам доксорубицина, CDDP, VP-16, дифтерийного токсина и рицина (Demidem et al. Cancer Chemotherapy & Radiopharmaceutical 12(3):177-186 (1997)). Преклинические исследования in vivo показали, что RITUXAN® истощает В-клетки из периферической крови, лимфатических узлов и костного мозга собакоподобных обезьян, предположительно через комплемент- и клеточно-опосредованные процессы (Reff et al. Blood 83(2):435-445 (1994)).
Ритуксимаб был одобрен в Соединенных Штатах в ноябре 1997 года для лечения пациентов с рецидивирующей или трудноизлечимой низкозлокачественной или фолликулярной CD20+ В-клеточной не-ходжкинской лимфомой (NHL) в дозе 375 мг/м2 один раз в неделю в виде четырех доз. В апреле 2001 года Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) одобрило дополнительные притязания в отношении лечения низкозлокачественной NHL: повторное лечение (один раз в неделю в виде четырех доз) и дополнительную схему введения доз (один раз в неделю в виде восьми доз). Более чем 300000 пациентов получали Ритуксимаб либо в виде монотерапии, либо в комбинации с иммуносупрессором или химиотерапевтическими лекарственными средствами. Пациентов лечили также Ритуксимабом в качестве поддерживающей терапии в течение до 2 лет (Hainsworth et al. J Clin Oncol 21:1746-51 (2003); Hainsworth et al. J Clin Oncol 20:4261-7 (2002)).
Ритуксимаб изучался также в различных незлокачественных аутоиммунных нарушениях, в которых В-клетки и аутоантитела, по-видимому, играют роль в патофизиологии заболевания (Edwards et al. Biochem Soc Trans 30:824-8 (2002)). Сообщалось, что Ритуксимаб потенциально ослабляет признаки и симптомы ревматоидного артрита (RА) (Leandro et al. Ann Rheum Dis. 61:883-8 (2002); Emery et al. Arthritis Rheum 48(9):S439 (2003)), красной волчанки (Eisenberg R. Arthritis Res Ther 5:157-9 (2003); Leandro et al. Arthritis Rheum 46:2673-7 (2002)), иммунной тромбоцитопении (D'Arena et al. Leuk Lymphoma 44:561-2 (2003)), аутоиммунной анемии (Zaja et al., Haematologica 87:189-95 (2002) (опечатки приведены в Haematologica 87:336 (2002)), аутоиммунной невропатии (Pestronk et al. J. Neurol Neurosurg Psychiatry 74:485-9 (2003)), паранеопластического синдрома опсоклонуса-миоклонуса (Pranzatelli et al. Neurology 60(Suppl1) PO5.128:A395 (2003)) и рецидивирующего-ремиттирующего рассеянного склероза (RRMS) (Cross et al. (abstact) Eighth Annual Meeting of the Americas Committees for Research and Treatment in Multiple Sclerosis 20-1 (2003)).
Исследование фазы II (WA16291) проводили на пациентах с ревматоидным артритом (RА) с получением результатов 48-дневного последующего врачебного (катамнестического) наблюдения по безопасности и эффективности Ритуксимаба (Emery et al. Arthritis Rheum 48(9):S439 (2003); Szczepanski et al. Arthritis Rheum 48(9):S121 (2003)). В целом 161 пациент были равномерно рандомизированы на четыре ветви лечения: метотрексат; только Ритуксимаб; Ритуксимаб плюс метотрексат; Ритуксимаб плюс циклофосфамид (СТХ). Схемой лечения Ритуксимабом была схема 1 г, вводимый внутривенно в дни 1 и 15. Инфузии Ритуксимаба пациентам с RА хорошо переносились большинством пациентов, и 36% пациентов испытывали по меньшей мере одно неблагоприятное событие во время их первой инфузии (в сравнении с 30% пациентов, получавших плацебо). В целом, считалось, что большинство неблагоприятных событий были слабыми - умеренными по тяжести и были хорошо сбалансированными во всех группах лечения. В целом, было 19 серьезных неблагоприятных событий во всех четырех ветвях исследования на протяжении 48 недель, которые были слегка более частыми в группе Ритуксимаб/CTX. Случаи инфекций были хорошо сбалансированными по всем группам. Средний коэффициент серьезной инфекции в этой популяции пациентов с RА был 4,66 на 100 пациентов-лет, который является более низким, чем коэффициент инфекций, требующий госпитализации в случае пациентов с RА (9,57 на 100 пациентов-лет), сообщенный в эпидемиологическом исследовании на основе сообщества (Doran et al. Arthritis Rheum 46:2287-93 (2002)).
Сообщенный профиль безопасности Ритуксимаба у небольшого количества пациентов с неврологическими нарушениями, включающими аутоиммунную невропатию (Pestronk et al. J. Neurol Neurosurg Psychiatry 74:485-9 (2003)), синдром опсоклонуса-миоклонуса (Pranzatelli et al. Neurology 60(Suppl1) PO5.128:A395 (2003)) и RRMS (Cross et al. Preliminary results from a phase II trial of Rituximab in MS (abstact) Eighth Annual Meeting of the Americas Committees for Research and Treatment in Multiple Sclerosis 20-1 (2003)), был сходным с профилем, о котором сообщалось в онкологии или при лечении RА. В продолжающемся спонсируемом исследователем испытании (IST) Ритуксимаба в комбинации с интерфероном-бета (IFN-бета) или глатирамерацетатом у субъектов с RRMS (Cross et al., см. выше) 1 из 10 подвергнутых лечению субъектов госпитализировали для ночного наблюдения после того как он испытал умеренную лихорадку и озноб после первой инфузии Ритуксимаба, тогда как 9 субъектов завершили схему с четырьмя инфузиями без каких-либо сообщенных неблагоприятных событий.
Патенты и публикации патентов, относящихся к антителам против CD20, включают в себя Патенты США № 5776456, 5736137, 5843439, 6399061 и 6682734, а также US 2002/0197255, US 2003/0021781, US 2003/0082172, US 2003/0095963, US 2003/0147885 (Anderson et al.); Патент США № 6455043, US 2003/0026804 и WO 2000/09160 (Grillo-Lopez, A.); WO 2000/27428 (Grillo-Lopez and White); WO 2000/27433 и US 2004/0213784 (Grillo-Lopez and Leonard); WO 2000/44788 (Braslawsky et al.); WO 2001/10462 (Rastetter, W.); WО 01/10461 (Rastetter and White); WO 2001/10460 (White and Grillo-Lopez); US 2001/0018041, US 2003/0180292, WO 2001/34194 (Hanna and Hariharan); US 2002/0006404 и WO 2002/04021 (Hanna and Hariharan); US 2002/0012665 и WO 2001/74388 (Hanna, N.); US 2002/0058029 (Hanna, N.); US 2003/0103971 (Hariharan and Hanna); US 2002/0009444 и WO 2001/80884 (Grillo-Lopez, A.); WO 2001/97858 (White, C.); US 2002/0128488 и WO 2002/34790 (Reff, M.); WO 2002/060955 (Braslawsky et al.); WO 2002/096948 (Braslawsky et al.); WO 2002/079255 (Reff and Davies); US Patent № 6171586 и WO 1998/56418 (Lam et al.); WO 1998/58964 (Raju, S.); WO 1999/22764 (Raju, S.); WO 1999/51642, Патент США № 6194551, Патент США № 6242195, Патент США № 6528624 и Патент США № 6538124 (Idusogie et al.); WO 2000/42072 (Presta, L.); WO 2000/67796 (Curd et al.); WO 2001/03734 (Grillo-Lopez et al.); US 2002/0004587 и WO 2001/77342 (Miller and Presta); US 2002/0197256 (Grewal, I.); US 2003/0157108 (Presta, L.); WO 04/056312 (Lowman et al.); US 2004/0202658 и WO 2004/091657 (Benyunes, K.); WO 2005/000351 (Chan, A.); US 2005/0032130A1 (Beresini et al.); US 2005/0053602A1 (Brunetta, P.); Патенты США №№ 6565827, 6090365, 6287537, 6015542, 5843398 и 5595721, (Kaminski et al.); Патенты США №№ 5500362, 5677180, 5721108, 6120767 и 6652852 (Robinson et al.); Патент США № 6410391 (Raubitschek et al.); Патент США № 6224866 и WO 00/20864 (Barbera-Guillem, E.); WO 2001/13945 (Barbera-Guillem, E.); US2005/0079174A1 (Barbera-Guillem et al.); WO 2000/67795 (Goldenberg); US 2003/0133930 и WO 2000/74718 (Goldenberg and Hansen); US 2003/0219433 и WO 2003/68821 (Hansen et al); W02004/058298 (Goldenberg and Hansen); WO 2000/76542 (Golay et al.); WO 2001/72333 (Wolin and Rosenblatt); Патент США № 6368596 (Ghetie et al.); Патент США № 6306393 и US 2002/0041847 (Goldenberg, D.); US 2003/0026801 (Weiner and Hartmann); WO 2002/102312 (Engleman, E.); US 2003/0068664 (Albitar et al.); WO 2003/002607 (Leung, S.); WO 2003/049694, US 2002/0009427 и US 2003/0185796 (Wolin et al.); WO 2003/061694 (Sing and Siegall); US 2003/0219818 (Bohen et al.); US 2003/0219433 и WO 2003/068821 (Hansen et al.); US 2003/0219818 (Bohen et al.); US2002/0136719 (Shenoy et al.); WO 2004/032828 (Wahl et al.); и WO 2002/56910 (Hayden-Ledbetter). См. также патенты США 5849898 и EP 330191 (Seed et al.); EP332865A2 (Meyer and Weiss); Патент США № 4861579 (Meyer et al.); US2001/0056066 (Bugelski et al.); WO 1995/03770 (Bhat et al.); US 2003/0219433 Al (Hansen et al.); WO 2004/035607 (Teeling et al.); US 2004/0093621 (Shitara et al.); WO 2004/103404 (Watkins et al.); WO 2005/000901 (Tedder et al.); US 2005/0025764 (Watkins et al.); WO 2005/016969 и US 2005/0069545 A1 (Carr et al.); WO 2005/014618 (Chang et al.). Некоторые из них включают в себя, inter alia, лечение рассеянного склероза.
Публикации, касающиеся терапии с использованием Ритуксимаба, включают в себя: Perotta и Abuel "Response of chronic relapsing ITP of 10 years duration to Rituximab" Abstract # 3360 Blood 10(1)(part 1-2): p. 88В (1998); Stashi et al. "Rituximab chimeric anti-CD20 monoclonal antibody treatment for adults with chronic idopathic thrombocytopenic purpura" Blood 98(4):952-957 (2001); Matthews, R. "Medical Heretics" New Scientist (7 April, 2001); Leandro et al. "Clinical outcome in 22 patients with rheumatoid arthritis treated with В lymphocyte depletion" Ann Rheum Dis 61:833-888 (2002); Leandro et al. "Lymphocyte depletion in rheumatoid arthritis: early evidence for safety, efficacy and dose response. Arthritis and Rheumatism 44(9): 5370 (2001); Leandro et al. "An open study of В lymphocyte depletion in systemic lupus erythematosus", Arthritis & Rheumatism 46(1):2673-2677 (2002); Edwards and Cambridge "Sustained improvement in rheumatoid arthritis following a protocol designed to deplete В lymphocytes" Rhematology 40:205-211 (2001); Edwards et al. "B-lymphocyte depletion therapy in rheumatoid arthritis and other autoimmune disorders" Biochem. Soc. Trans., 30(4):824-828 (2002); Edwards et al. "Efficacy and safety of Rituximab, a B-cell targeted chimeric monoclonal antibody: A randomized, placebo controlled trial in patients with rheumatoid arthritis. Arthritis and Rheumatism 46(9): S197 (2002); Levine and Pestronk "IgM antibody-related polyneuropathies: B-cell depletion chemotherapy using Rituximab" Neurology 52: 1701-1704 (1999); DeVita et al. "Efficacy of selective В cell blockade in the treatment of rheumatoid arthritis" Arthritis & Rheum 46:2029-2033 (2002); Hidashida et al. "Treatment of DMARD-Refractory rheumatoid arthritis with Rituximab." Presented at the Annual Scientific Meeting of the American College of Rheumatology; Oct 24-29; New Orleans, LA 2002; Tuscano, J. "Successful treatment of Infliximab-refractory rheumatoid arthritis with Rituximab" Presented at the Annual Scientific Meeting of the American College of Rheumatology; Oct 24-29; New Orleans, LA 2002; Specks et al. "Response of Wegener's granulomatosis to anti-CD20 chimeric monoclonal antibody therapy" Arthritis & Rheumatism 44(12):2836-2840 (2001); Anolik et al., "B lympocyte Depletion in the Treatment of Systemic Lupus (SLE): Phase I/II Trial of Rituximab (RITUXAN®) in SLE" Arthritis And Rheumatism, 46(9), S289-S289 Abstract 717 (October, 2002), and Albert et al., "A Phase I Trial of Rituximab (Anti-CD20) for Treatment of Systemic Lupus Erythematosus" Arthritis And Rheumatism, 48(12): 3659-3659, Abstract LB9 (December, 2003); Martin and Chan "Pathogenic Roles of В cells in Human Autoimmunity: Insights from the Clinic" Immunity 20:517-527 (2004).
Раскрытие изобретения
Данное изобретение включает в себя, по меньшей мере частично, выбор дозы для анти-CD20-антитела, которая обеспечивает безопасную и активную схему лечения субъектов с рассеянным склерозом, таким как PPMS или RRMS.
Таким образом, данное изобретение относится к способу лечения рассеянного склероза у субъекта, предусматривающему введение эффективного количества CD20-антитела субъекту для обеспечения начального воздействия антитела в количестве приблизительно 0,5-4 г с последующим вторым воздействием антитела приблизительно 0,5-4 г, причем это второе воздействие антитела не проводят до приблизительно 16-60 недель после начального воздействия антитела, и каждое из воздействий антитела проводят субъекту в виде одной или двух доз антитела.
Кроме того, данное изобретение относится к изделию, содержащему: (а) контейнер, содержащий CD20-антитело; и (b) вкладыш упаковки с инструкциями в отношении лечения рассеянного склероза у субъекта, где эти инструкции указывают, что субъекту вводят количество антитела, которое является эффективным для проведения начального воздействия антитела в количестве приблизительно 0,5-4 г с последующим вторым воздействием антитела в количестве приблизительно 0,5-4 г, причем это второе воздействие антитела не проводят до приблизительно 16-60 недель после начального воздействия антитела, и каждое из воздействий антитела проводят субъекту в виде одной или двух доз антитела.
Краткое описание чертежей
Фиг.1А обозначает сопоставление последовательностей, сравнивающее аминокислотные последовательности вариабельного домена легкой цепи (VL) каждого из мышиного 2Н7 (SEQ ID NO:1), гуманизированного варианта 2Н7.v16 (SEQ ID NO:2) и подгруппы I легкой каппа-цепи человека (SEQ ID NO:3). CDR VL 2Н7 и hu2Н7.v16 являются следующими: CDR1 (SEQ ID NO:4), CDR2 (SEQ ID NO:5) и CDR3 (SEQ ID NO:6).
Фиг.1В обозначает сопоставление последовательностей, сравнивающее аминокислотные последовательности вариабельного домена тяжелой цепи (VН) каждого из мышиного 2Н7 (SEQ ID NO:7), гуманизированного варианта 2Н7.v16 (SEQ ID NO:8) и консенсусной последовательности человека подгруппы III тяжелой цепи (SEQ ID NO:9). CDR VН 2Н7 и hu2Н7.v16 являются следующими: CDR1 (SEQ ID NO:10), CDR2 (SEQ ID NO:11) и CDR3 (SEQ ID NO:12).
На фиг.1А и фиг.1В CDR1, CDR2 и CDR3 в каждой цепи заключены в скобки, фланкированы каркасными районами FR1-FR4, как указано. 2Н7 относится к мышиному антителу 2Н7. Звездочки между двумя рядами последовательностей указывают положения, которые различаются между этими двумя последовательностями. Нумерация остатков соответствует Kabat et al. Sequences of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), с инсерциями, показанными как а, b, c, d и е.
Фиг.2 показывает аминокислотную последовательность легкой цепи зрелого 2Н7.v16 (SEQ ID NO:13).
Фиг.3 показывает аминокислотную последовательность тяжелой цепи зрелого 2Н7.v16 (SEQ ID NO:14).
Фиг.4 показывает аминокислотную последовательность тяжелой цепи зрелого 2Н7.v31 (SEQ ID NO:15). L-цепь 2Н7.v31 является такой же, что и для 2Н7.v16.
Фиг.5 показывает сопоставление легких цепей зрелых 2Н7.v16 и 2Н7.v511 (SEQ ID NO:13 и 16 соответственно) с нумерацией Kabat остатков вариабельного домена и нумерацией Eu остатков константного домена.
Фиг.6 показывает сопоставление тяжелых цепей зрелых 2Н7.v16 и 2Н7.v511 (SEQ ID NO:14 и 17 соответственно) с нумерацией Kabat остатков вариабельного домена и нумерацией Eu остатков константного домена.
Подробное описание предпочтительных вариантов осуществления
I. Определения
В-клетка является лимфоцитом, который созревает в костном мозге и включает необученную В-клетку, В-клетку памяти или эффекторную В-клетку (плазматическую клетку, плазмацит). Здесь В-клетка может быть нормальной или незлокачественной В-клеткой.
«Маркер поверхности В-клетки» или «поверхностный антиген В-клетки» обозначает в данном контексте антиген, экспрессируемый на поверхности В-клетки, который может быть мишенью антитела, которое связывается с ним. Примеры поверхностных маркеров В-клеток включают в себя поверхностные маркеры лейкоцитов CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CDw79а, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 и CD86 (в отношении описаний см. The Leukocyte Antigen Facts Book, 2nd Edition, 1997, ed. Barclay et al. Academic Press, Harcourt Brace & Co., New York). Другие поверхностные маркеры В-клеток включают в себя RP105, FcRH2, CR2 В-клеток, CCR6, P2X5, HLA-DOB, CXCR5, FCER2, BR3, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA и 239287. Маркер В-клеточной поверхности, представляющий здесь особый интерес, преимущественно экспрессируется на В-клетках в сравнении с другими не-В-клеточными тканями млекопитающего и может экспрессироваться как на предшественниках В-клеток, так и на зрелых В-клетках. Предпочтительным поверхностным маркером В-клеток является здесь предпочтительно CD20.
Антиген «CD20», или «CD20», является негликозилированным фосфобелком 35 кДа, обнаруживаемым на поверхности более чем 90% В-клеток из периферической крови или лимфоидных органов. CD20 присутствует как на нормальных В-клетках, так и на злокачественных В-клетках, но не экспрессируется на стволовых клетках. Другие названия CD20 в литературе включают в себя “консервативный антиген В-лимфоцитов” и “Вр35”. Антиген CD20 описан, например, в Clark et al. Proc. Natl. Acad. Sci. (USA) 82:1766 (1985).
“Антитело-антагонист” обозначает здесь антитело, которое, после связывания с маркером поверхности В-клетки на В-клетках, разрушает или истощает В-клетки у млекопитающего и/или подавляет одну или несколько функций В-клеток, например, уменьшением или предотвращением гуморальной реакции, индуцируемой этой В-клеткой. Антитело-антагонист предпочтительно способно истощать В-клетки (т.е. уменьшать циркулирующие уровни В-клеток) в млекопитающем, обработанным этим антителом. Такое истощение может быть достигнуто посредством различных механизмов, таких как антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC) и/или комплемент-зависимая цитотоксичность (CDC), ингибирование пролиферации В-клеток и/или индукция смерти В-клеток (например, через апоптоз).
«Антитело-зависимая клеточно-опосредованная цитотоксичность» и «ADCC» относится к клеточно-опосредованной реакции, в которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, природные клетки-киллеры (NК-клетки), нейтрофилы и макрофаги) узнают связанное антитело на клетке-мишени и затем вызывают лизис этой клетки-мишени. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на стр. 464 Ravetсh and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки ADCC-активности представляющей интерес молекулы может быть выполнен анализ ADCC in vitro, такой как описанный в Патенте США № 5500362 или 5821337. Применимые для таких анализов эффекторные клетки включают в себя мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NК-клетки). Альтернативно или наряду с этим ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, в модели животного, такой как описанная в Clynes et al. PNAS (USA) 95:652-656 (1998).
«Эффекторные клетки человека» являются лейкоцитами, которые экспрессируют один или несколько FcR и выполняют эффекторную функцию. Предпочтительно, эти клетки экспрессируют по меньшей мере FcγRIII и выполняют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают в себя мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NК-клетки), моноциты, цитотоксические Т-клетки и нейтрофилы; причем предпочтительными являются PBMC и NК-клетки.
Термины “Fc-рецептор” или “FcR” используют для описания рецептора, который связывается с Fc-районом антитела. Предпочтительным FcR является нативная последовательность FcR человека. Кроме того, предпочтительным является FcR, который связывается с IgG-антителом (гамма-рецептор) и включает в себя подклассы FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают в себя FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые различаются прежде всего в их цитоплазматических доменах. Активирующий рецептор FcγRIIA содержит мотив активации иммунорецептора на основе тирозина (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIВ содержит мотив ингибирования иммунорецептора на основе тирозина (ITIM) в его цитоплазматическом домене (см. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR рассматриваются в Ravetch и Kinet, Ann. Rev. Immunol. 9:457-921 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). FcR, в том числе те, которые должны быть идентифицированы в будущем, включены здесь под термином «FcR». Этот термин включает в себя также рецептор новорожденных, FcRn, который является ответственным за перенос материнских IgG в плод (Guyer et al. J. Immunol. 117:587 (1976) и Kim et al. J. Immunol. 24:249 (1994)).
«Комплемент-зависимая цитотоксичность» или «CDC» относится к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента начинается со связывания первого компонента системы комплемента С1q с молекулой (например, антителом), находящейся в комплексе с родственным антигеном. Для оценки активации комплемента может быть выполнен CDC-анализ, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
«Ингибирующие рост антитела» являются антителами, которые предотвращают или уменьшают пролиферацию клеток, экспрессирующих антиген, с которым связывается это антитело. Например, антитело может предотвращать или уменьшать пролиферацию В-клеток in vitro и/или in vivo.
Антителами, которые «индуцируют апоптоз», являются антитела, которые индуцируют программированную смерть клеток, например В-клетки, как определено стандартными анализами апоптоза, такими как связывание аннексина V, фрагментация ДНК, сморщивание клеток, расширение эндоплазматического ретикулума, фрагментация клеток и/или образование мембранных пузырьков (называемых апоптотическими телами).
Термин “антитело” используется в данном контексте в самом широком смысле слова и он конкретно включает в себя моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител, пока они проявляют желаемую биологическую активность.
«Фрагменты антител» содержат часть интактного антитела, предпочтительно содержащую его район связывания антигена. Примеры фрагментов антител включают в себя фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; одноцепочечные молекулы антител и мультиспецифические антитела, образованные из фрагментов антител.
Для целей данного изобретения “интактное антитело” обозначает антитело, содержащее вариабельные домены тяжелой и легкой цепей, а также Fc-район.
“Нативные антитела” являются обычно гетеротетрамерными гликопротеинами приблизительно 150000 дальтон, состоящими из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как количество дисульфидных связей варьируется среди тяжелых цепей различных изотипов иммуноглобулинов. Каждая тяжелая и легкая цепь имеет также дисульфидные мостики внутри цепи на регулярных расстояниях друг от друга. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на ее другом конце; константный домен легкой цепи сопоставлен с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи сопоставлен с вариабельным доменом тяжелой цепи. Считается, что конкретные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Термин “вариабельный” относится к тому факту, что некоторые части вариабельных доменов в значительной степени различаются по их последовательности среди антител и используются в связывании и специфичности каждого конкретного антитела в отношении его конкретного антигена. Однако эта вариабельность не распределена равномерно по вариабельным доменам антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными районами в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называются каркасными районами (FR). Вариабельные домены нативных тяжелой и легкой цепей, каждый, содержат четыре FR, принимающих в значительной степени конфигурацию β-складки, соединенных тремя гипервариабельными районами, которые образуют петли, соединяющие эту β-структуру, и в некоторых случаях образующие часть этой β-структуры. Гипервариабельные районы в каждой цепи удерживаются вместе в тесной близости этими FR и с гипервариабельными районами из другой цепи, способствуют образованию антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной цитотоксичности (ADCC).
Расщепление папаином антител дает два идентичных антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, каждый из которых имеет единственный антигенсвязывающий сайт, и остальной «Fc»-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2-фрагмент, который имеет два антигенсвязывающих сайта и все еще способен перекрестно связывать антиген.
«Fv» является минимальным фрагментом антитела, который содержит полный антиген-узнающий и антигенсвязывающий сайт. Этот район состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи в плотной, нековалентной связи. Именно в этой конфигурации три гипервариабельных района каждого вариабельного домена взаимодействуют для определения антигенсвязывающего сайта на поверхности VH-VL-димера. Вместе эти шесть гипервариабельных районов сообщают антигенсвязывающую специфичность антителу. Однако даже единственный вариабельный домен (или половина Fv, содержащая только три гипервариабельных района, специфических в отношении антигена) способен узнавать и связывать антиген, хотя и при более низкой аффинности, чем полный сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков к карбоксильному концу тяжелой цепи СН1 домену, включая один или несколько остатков цистеина из шарнирной области антитела. Fab'-SH является здесь обозначением Fab', в котором остаток (остатки) цистеина константных доменов несут по меньшей мере одну свободную тиоловую группу. Фрагменты антитела F(ab')2 первоначально были получены в виде пары Fab'-фрагментов, которые имеют между ними цистеины шарнирной области. Известны также другие химические сочетания фрагментов антител.
«Легкие цепи» антител (иммуноглобулинов) из любого вида позвоночного могут быть отнесены к одному из двух явно отличающихся типов, названных каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей антитела могут быть отнесены к различным классам. Имеются пять основных классов интактных антител: IgА, IgD, IgЕ и IgМ, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgА и IgА2. Константные домены тяжелой цепи, которые соответствуют этим различным классам антител, называют α, δ, ε, γ и µ соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Одноцепочечные Fv» или «scFv»-фрагменты антител содержат VH- и VL-домены антитела, где эти домены присутствуют в единой полипептидной цепи. Предпочтительно этот Fv-полипептид дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена. В отношении обзора scFv см. Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин «диатела» относится к малым фрагментам антител с двумя антигенсвязывающими сайтами, пр