Способ получения энтекавира и промежуточные продукты для его получения
Иллюстрации
Показать всеИзобретение относится к новому улучшенному способу получения энтекавира, соответствующего формуле (I) и обладающего противовирусным действием для возможного использования в лекарственном средстве с низким содержанием активного компонента, например, при лечении гепатита В. Изобретение также относится к новым промежуточным продуктам и способам их получения. Энтекавир соответствует общей формуле (I)
Способ его получения заключается в том, что соединение формулы 7с или его смесь с соединением формулы 8а, где Rb представляет собой С1-С4алкил, подвергают окислению преимущественно пероксидатом, таким как пероксидат карбоната натрия, пероксидат пирофосфата натрия и др.
Соединение формулы 7с или его смесь с соединением формулы 8а получают контактированием соединения 7а по меньшей мере с одной кислотой, выбранной из галоидированной метансульфокислоты и, возможно, метансульфокислоты, возможно, в присутствии соединения 8а, с последующей обработкой по меньшей мере одним водным основанием. Изобретение также включает получение соединения 7а и 8а. 8 н. и 19 з.п. ф-лы.
Реферат
Предпосылки создания изобретения
Энтекавир [1S-(1α, 3α, 4β)]-2-амино-1,9-дигидро-9-[4-гидрокси-3-гидроксиметил)-2-метиленциклопентил]6Н-пурин-6-она моногидрат в настоящее время применяется как лекарство для лечения вирусных инфекций - гепатита В.
Энтекавир и его применение в качестве антивирусного агента описаны Zahler и др. в патенте США №5206244. Усовершенствованные способы получения энтекавира описаны Bisacchi и др. в заявке WO 98/09964 и Pendri и др. в заявке WO 2004/052310 и в заявке США 20040192912.
Colonno и др. в заявке WO 01/64221 описывают композиции, содержащие низкую дозу энтекавира, вводимые ежедневно для лечения гепатита В и/или сопутствующих инфекций.
Сущность изобретения
Данное изобретение направлено на различные способы получения энтекавира, как указано в формуле изобретения. Энтекавир является моногидратом соединения формулы I, структура которого показана ниже:
Данное изобретение относится также к различным промежуточным продуктам, используемым при получении энтекавира, и к способам получения таких промежуточных продуктов.
Подробное описание изобретения
Сокращения
Для упрощения в данной заявке использованы сокращения, имеющие значения, приведенные ниже.
| AcOH | уксусная кислота |
| Ac2O | уксусный ангидрид |
| AP | площадь ЖХВР |
| Bn | бензил |
| BnBr | бензилбромид |
| BHT | 2,6-дитрет-бутил-4-метилфенол |
| CHP | гидроперекись кумола или α,α-диметилбензилгидроперекись |
| CSA | (1R)-(-)-камфосульфокислота |
| DCM | дихлорметан |
| DDQ | 2,3-дихлор-5,6-дициан-1,4-бензохинон |
| (-)-DIPT | диизопропил-D-тартрат |
| DMF | N,N-диметилформамид |
| DMSO | диметилсульфоксид или метилсульфоксид |
| EtOAc | этилацетат |
| FMSA | фторметансульфокислота |
| KHMDS | гексаметилдисилазид калия или бис(триметилсилил)амид калия |
| KOtBu | трет-бутоксид калия |
| MCPBA | мета-хлорпербензойная кислота |
| MSA | метансульфокислота |
| NMP | 1-метил-2-пирролидинон |
| PMB | пара-метоксибензил |
| PMBCl | пара-метоксибензилхлорид |
| PPTS | 4-толуолсульфонат пиридиния |
| PTSA | п-толуолсульфокислота |
| RAP | относительная поверхность |
| TBAF | тетрабутиламмонийфторид |
| TBAHS | кислый сульфат тетрабутиламмония |
| TBHP | гидроперекись трет-бутила |
| TFA | трифторуксусная кислота |
| THF | тетрагидрофуран |
| TFMSA | трифторметансульфокислота |
| Ti(OiPr)4 | изопропоксид титана |
| TiOF | триизопропилорто-формиат |
Определения
Следующие термины для целей данного описания, включая формулу изобретения, имеют соответствующие значения, указанные ниже. Следует иметь в виду, что, когда делается ссылка на общий термин, такой как кислота, основание, окисляющий агент и т.д., специалист может сделать нужный выбор таких реагентов из тех соединений, которые даны в определениях ниже, а также из тех реагентов, которые можно найти в литературных источниках.
Термин "ангидрид" относится обычно к соединениям, которые будут реагировать с водой или растворителем с образованием кислоты, например он включает ангидриды карбоновых кислот формулы R-С(=O)-О-C(=O)R', где R и R' выбраны из алкильных или арильных групп, определенных ниже, более предпочтительны соединения, в которых R и R' выбраны из метила и этила.
Термин "кислота" относится к любому соединению, которое содержит водород и диссоциирует в воде или растворителе с образованием положительных ионов водорода, а также кислоты Льюиса, включая, но не ограничиваясь этим, кислоты, такие как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, тригалоидуксусная кислота (например, TFA), бромистый водород, малеиновая кислота, сульфокислоты, такие как толуолсульфокислота и камфосульфокислоты, пропионовые кислоты, такие как (R)-хлорпропионовая кислота, фталаминовые кислоты, такие как N-[(R)-1-(1-нафтил)-этил]-фталаминовая кислота, винные кислоты, такие как L-винная кислота и дибензол-L-винная кислота, молочные кислоты, камфорные кислоты, аспартовые кислоты, цитронелловые кислоты, ВСl3, ВBr3 и т.д. Таким образом, этот термин включает слабые кислоты, такие как этановая, и сернистый водород; сильные органические кислоты, такие как метансульфокислота, трифторуксусная кислота и т.д.
Термин "алкил" включает линейные или разветвленные алкильные группы, содержащие от 1 до 12 атомов углерода, более предпочтительно, от 1 до 8 атомов углерода и, наиболее предпочтительно, от 1 до 4 атомов углерода, если не оговорено иное. Термин "алкил" включает такие группы, которые могут иметь до 4 (более предпочтительно, 0-2) заместителей, выбранных из группы не мешающих заместителей, перечисленных ниже. Термин "низший алкил" относится к алкильным группам, содержащим от 1 до 4 атомов углерода. Когда используется нижний индекс со ссылкой на алкил или другую группу, он относится к числу атомов углерода, которое может содержать эта группа. Например, термин "C1-C4 алкил" относится к алкильным группам с 1-4 атомами углерода, которые включают метил, этил, пропил, изопропил, н-бутил, изобутил и трет-бутил. Алкильные группы, входящие в другие радикалы, также являются линейными или разветвленными, если иное не оговорено. Когда термин "алкил" используется как приставка в сочетании с другой группой, как, например, в случае алкиларила, это означает, что алкильная группа, определение которой дано выше, является двухвалентной (то есть алкиленом), создавая связь с другой указанной группой. Так, алкиларил включает бензил и т.д.
Термин "алкокси" включает алкильные группы, определение которых дано выше, связанные через атом кислорода, а именно -О-алкил. "C1-C4 алкокси" относится к -О-C1-С4 алкилу.
Термин "соль щелочного металла" относится к солям, образованным с щелочными металлами, предпочтительно, к солям натрия, лития или калия.
Термин "аллил" относится к группе -СН2-СН=СН2, а также к таким группам, которые, возможно, содержат один или несколько (предпочтительно, 0-1) не мешающих заместителей, указанных ниже.
"Антиокислитель" относится к химическому соединению или комплексу, которые эффективно замедляют или ингибируют скорость реакции окисления. Примеры антиоксидантов могут включать без ограничения β-каротен, ZnO2, ароматические амины, фенолы, хиноны, в том числе ВНТ, лимонную кислоту, аскорбиновую кислоту, витамин Е, бензойную кислоту, фосфорную кислоту и т.д.
Термин "арил" включает моноциклические или бициклические ароматические группы, содержащие 6-12 атомов углерода в кольце, то есть фенил и нафтил, а также гетероарильные группы, например 4-7-членные моноциклические, 7-11-членные бициклические или 10-15-членные трициклические ароматические кольцевые системы, которые содержат по меньшей мере один гетероатом и по меньшей мере одно углеродсодержащее кольцо. Примерами моноциклических гетероарильных групп являются пирролил, пиразолил, пиразолинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, фуранил, тиенил, оксадиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил и т.п. Примеры бициклических гетероарильных групп включают индолил, бензтиазолил, бенздиоксолил, бензоксазолил, бензотиенил, хинолинил, тетрагидроизохинолинил, изохинолинил и т.п.
Термин "арил" включает арильные группы, которые могут содержать до 4 (предпочтительно, 0-2) не мешающих заместителей.
Термин "основание" включает гидроокиси или алкоксиды, гидриды или соединения, такие как амин и его производные, которые принимают протоны в воде или растворителе. Так, примеры оснований включают, без ограничения, гидроокиси щелочных металлов и алкоксиды (а именно, MOR, где М обозначает щелочной металл, такой как калий, литий, натрий, и К обозначает водород или алкил, определенный выше, более предпочтительно когда R обозначает линейную или разветвленную цепь С1-5 алкила, включая, без ограничения, гидроокись калия, трет-бутоксид калия, трет-пентоксид калия, гидроокись натрия, трет-бутоксид натрия, гидроокись лития и т.д.); другие гидроокиси, такие как гидроокись магния (Mg(OH)2) или гидроокись кальция (Са(ОН)2), гидроокись бария (Ва(ОН)2); гидриды щелочных металлов (то есть МН, где М указан выше, в том числе без ограничения, гидриды натрия, калия и лития); алкилированные дисилазиды, такие как, например, гексаметилдисилазид калия и гексаметилдисилазид лития; карбонаты, такие как карбонат калия (К2СО3), карбонат натрия (Na2СО3), бикарбонат калия (КНСО3) и бикарбонат натрия (NaНСО3), гидроокиси алкиламмония, такие как гидроокись тетрабутиламмония (ТВАН) и т.д. Водные основания включают гидроокиси металлов, например гидроокиси металлов группы 1 / группы 2, таких как Li, Na, К, Mg, Ca и т.д. (например, водные LiOH, NaOH, КОН и т.д.), гидроокиси алкиламмония и водные растворы карбонатов. Неводные основания включают, без ограничения, амины и их производные, например триалкиламин (например, Et3N, диизопропилэтиламин и т.д.) и ароматические амины (например, Ph-NH2, PhN(Me)H и т.д.); алкоксиды щелочных металлов, гидриды щелочных металлов, алкилированные дисилазиды и неводные растворы карбонатов.
Термин "бензил" включает группу -СН2-фенил, а также такие группы, которые могут содержать не мешающие заместители у метила или фенила, входящих в бензил, если иное не оговорено.
Термин "галоидный бензил" относится к бензильной группе, содержащей галоидный заместитель в алкильной части бензильной группы, то есть Ph-СН2-X, где Х обозначает галоид и Ph обозначает фенильное кольцо, определенное ниже.
"Бензилокси" относится к группе -О-бензил, где бензил определен выше.
Термин "диастереоселективное эпоксидирование" относится к реакции, при которой предпочтительно образуется один диастереомерный эпоксид. Термин "диастереоселективное эпоксидирование" включает эпоксидирование Sharpless'a, когда эпоксидирование аллильного спирта предпочтительно приводит к образованию одного энантиомера. Однако термин "диастереоселективное эпоксидирование" также более широко включает эпоксидирование диастереомерного соединения или эпоксидирование соединения, не являющегося рацематом. Термин "диастереоселективное эпоксидирование" включает энантиоселективное окисление олефинов как описано в Bonini and Righi, "A Critical Outlook And Comparison of Enantioselective Oxidation Methodologies of Olefins", Tetrahedron, Vol.58 (2002), at pp.4981-5021, эта статья включена в данную заявку в качестве ссылки.
"Галоид" или "гало" относится к F, Cl, Br или I.
Термин "галоидированная метансульфокислота" относится к метансульфокислоте, замещенной одним, двумя или тремя атомами галоида, например это могут быть монофторметансульфокислота, дифторметансульфокислота, трифторметансульфокислота, монохлорметансульфокислота, дихлорметансульфокислота, трихлорметансульфокислота, монобромметансульфокислота, дибромметансульфокислота, трибромметансульфокислота, монойодметансульфокислота и дийодметансульфокислота.
Термин "гидридный реагент" относится к реагентам, которые способны доставлять ионы Н-. Примеры гидридных реагентов включают, без ограничения, литийалюминийгидрид (LiAlH4), боргидрид натрия (NaBH4), Red-Al® (бис[2-метоксиэтоксиалюминий]гидрид натрия), боргидрид цинка, диизобутилалюминийгидрид, боргидрид натрия - хлорид церия, триэтиборгидрид лития, 9-BBN гидрид лития, боран-сульфидный комплекс, 5,5-дифенил-2-метил-3,4-пропан-1,3,2-оксазаборолидин (Реагент Corey), литий-три-трет-бутоксиалюминийгидрид, цианборгидрид натрия, литий-три-втор-бутилборгидрид (L - Selectride®), диизобутилалюминийхлорид, боран-тетрагидрофурановый комплекс и т.п.
Термин "гидроперекись" означает соединение или комплекс, содержащие гидроперекисную группу Н02', такие как соединения формулы (RPOOH), где RP обозначает водород (например, перекись водорода H2O2), или алкил, замещенный алкил, арил, алкиларил, замещенный арил, замещенный алкиларил или другие группы (включая, без ограничения, соединения, в которых метильная часть бензильной группы может быть замещена). Таким образом, гидроперекиси включают α,α-диметилбензилгидроперекись, трет-бутилгидроперекись и т.п.
"Группы, защищающие гидроксил", означают такие группы, которые, по мнению специалиста, подходят для защиты заместителя - ОН в алкиле или кольцевой системе, описанной в данной заявке, и которые могут быть удалены при снятии защиты при условиях, известных специалистам, описанных, например, в самом последнем издании Greene and Wuts, Protecting Groups in Organic Synthesis, включенной в качестве ссылки в данную заявку. Для иллюстрации неограничивающие примеры групп, защищающих гидроксил, включают группы простого эфира (например, бензиловые эфиры, силиловые эфиры, такие как трет-бутилдиметилсилиловый эфир), сложноэфирные группы (например, бензоатные, ацетатные) и ацетальные (например, МОР).
Термин "гомохиральный диэфир винной кислоты" включает отдельные диастереомеры алкилтартратов, в том числе диэтилтартрат и диизопропилтартрат.
"Металлический катализатор" относится к соединениям и комплексам, включающим металлические элементы, которые эффективны в качестве катализаторов, и включает без ограничения, "катализаторы на основе переходных металлов". Металлические катализаторы включают, без ограничения, изопропоксид титана (IV), соли палладия, такие как палладиевый (О) катализатор, например тетракис (трифенилфосфин) палладий, трифлат меди (I), ацетат родия (II), Rh6(СО)16 и т.д.
Термин "не мешающий заместитель" относится к заместителю, который связан с соединением или комплексом, идентифицированным в данной заявке, который не делает эти соединение или комплекс не работающими по отношению к функциональности или к цели, которую нужно достичь с помощью конкретных соединения или комплекса и которые совместимы с последовательностью указанных реакций. Такие заместители могут быть выбраны специалистом в зависимости от конкретной стадии реакции и функции, которая должна быть получена. Примеры не мешающих заместителей могут включать, без ограничения, такие группы, как алкил, галоид, циано, нитро, трифторметил, трифторметокси, -OR, -SR, -C(=O)R, -CO2R, арил, алкиларил, С3-7 циклоалкил, -NRR'2, -NRC(=O)R', -SO(q)R", -NRSO(q)R", -SO(q)R", -C(=O)NRR' и т.п.; и алкильные группы, замещенные 1-4 (предпочтительно, 1-2) галоидами, циано, нитро, трифторметил, трифторметокси, -OR, -SR, -C(=O)R, -СО2Р, арил, алкиларил, С3-7 циклоалкил, -NRR'2, -NRC(=O)R', -SO(q)R", -NRSO(q)R", -SO(q)R", -C(=O)NRR' и т.п., где R и R' обозначают водород, алкил, бензил или арил, определенные выше, R" обозначает алкил, бензил или арил, определенные выше, и q равен 1, 2 или 3.
Термин "производные ортоформиата" означает реагенты, эффективные для получения диоксоланов из вицинальных диолов или для образования имидазольных колец из вицинальных диаминов, например, в производных 5,6-диаминопиримидина. Неограничивающие примеры включают триэтил-орто-формиат, триметил-орто-формиат, триизопропил-орто-формиат, диэтоксиметилацетат и диизопропилоксиметилацетат.
"Окисляющий агент" или "окисляющий источник" относится к любому соединению или комплексу, который известен в уровне техники как превращающий функциональную группу в молекуле из низшего состояния окисления в высшее состояния окисления. Например, окисляющие агенты могут включать, без ограничения, м-СРВА, перекись водорода, АсООН в АсОН, пероксимоносульфат калия, перйодат натрия, перкарбонат натрия, перманганат калия, окись рутения и т.п. Окисляющие агенты можно использовать в присутствии одной или нескольких добавок, таких как KF, КНСО3, NEt3, AcONa и т.п. Как известно специалисту, добавки могут быть выбраны в зависимости от конкретных окисляющих агентов и условий реакции.
Термин "перкислота" включает, без ограничения, монопероксифталат магния (МРРА), пербензойные кислоты и перуксусную кислоту.
Термин "пероксогидраты" относится к кристаллическим аддуктам, содержащим молекулярную перекись водорода, например пероксогидрат карбоната натрия (известный как перкарбонат натрия, например Na2СО3·1,5Н2O2), пероксогидрат мочевины (CO(NH2)2·H2O2), пероксогидрат меламина, (С3Н6N6·Н2O2), пероксогидрат пирофосфата натрия (Na4P2O7·2H2O2), гидрат пероксогидрата сульфата натрия (2Na2SO4·H2O2·2H2O), пероксогидраты карбоната калия, пероксогидраты карбоната рубидия и пероксогидраты карбоната цезия (последние три имеют общую формулу М2СО3·3Н2O2).
Термин "фенил" включает фенильные кольца, возможно замещенные заместителями в количестве до 4 (предпочтительно, 0-2), являющимися не мешающими, как определено выше. Если термин "фенил" используют как суффикс, следующий за другим термином, например, в случае алкилфенила или алкоксифенила, это означает, что фенильная группа соединена через двухвалентную группу другой названной группы. Так, алкилфенил включает бензил, фенилхэтил и т.п.
"Защитная группа" включает, без ограничения, такие группы, которые указаны выше, например, в последнем издании Green and Wuts, Protecting Groups in Organic Synthesis, включенном в качестве ссылки.
Термин "восстанавливающий агент" относится к любому соединению или комплексу, которое известно как превращающее функциональную группу в молекуле из одного состояния окисления в меньшее состояние окисления. Примеры восстановителей включают, без ограничения, NaBH4, LAH, боргидрид лития, диизобутилалюминийгидрид, бис(2-метоксиэтокси)алюминийгидрид натрия и т.п. Термин "восстанавливающий агент" включает "гидридные реагенты", описанные выше.
Термин "сильное не-нуклеофильное основание" означает неводное основание, которое не действует как нуклеофил, такое как бистриметилсилиламид лития, натрия или калия, диизопропиламид лития, гидрид лития, калия или натрия.
Термин "основание трет.-амин" означает триалкиламин, такой как триэтиламин, N,N-диметилэтиламин, диизопропилэтиламин (основание Hunig) или тетраметилендиамин (TMEDA) или азотсодержащий гетероцикл, такой как пиридин.
Термин "триметилсилилирующий реагент" означает реагент, эффективный для получения триметилсилилового эфира из спирта. Неограничивающие примеры включают хлортриметилсилан, триметилсилилтрифторметансульфонат и т.п.
Дополнительно следует иметь в виду, что когда в способах получения и в формуле изобретения есть артикль "а" в отношении реагента, например "a base", "a metal catalyst", "a hydroperoxide" и т.п., это означает "по меньшей мере один" и таким образом включает отдельные реагенты, а также смеси реагентов. Так, например, стадия реакции с применением "a base" или, например, с применением "a base (основания, выбранного из гидроокиси калия, трет-бутоксида калия, трет-пентоксида калия, гидроокиси натрия, трет-бутоксида натрия, гидрококиси лития" охватывает применение гидроокиси калия в качестве основания или, где это нужно, смеси гидроокиси калия и еще одного или более дополнительных оснований, указанных в вышеприведенной группе, из которой делают выбор. Специалист может сделать соответствующий выбор для стадий реакции и условий реакции, и цель будет достигнута.
Способы получения
Соединение энтекавир и новые промежуточные продукты для него могут быть получены, например, способами, описанными на следующих схемах реакции. Примеры реагентов и методик проведения реакций приведены ниже или описаны выше. Исходные вещества могут быть легко получены методами, описанными в заявках WO 2004/052310 и US 20040192912. Растворители, температуры, величины давления, исходные вещества, содержащие желательные группы, и другие условия реакции могут быть легко выбраны специалистом.
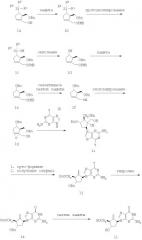
Соединение формулы I (энтекавир) может быть получено из спирта формулы 1а согласно Схеме 1. В спирте формулы 1a Ra обозначает аллил, фенил или фенил, замещенный одним, двумя или тремя C1-C4 алкилами или C1-C4 алкокси; предпочтительно Ra обозначает фенил; и каждый Rb независимо обозначает C1-C4 алкил, предпочтительно метил. Определения Ra и Rb одинаковы по всему тексту описания, если не указано иное. Первичная спиртовая группа соединения формулы 1а защищена защитной группой РМВ путем обработки галоидным соединением РМВ (например, РМВ-С1) в присутствии основания и, возможно, катализатора (например, TBAHS), в среде органического растворителя, такого как толуол, с получением соединения формулы 1b. Соединение формулы 1b может быть превращено в соединение формулы 1с путем протодесилилирования. Стадия протодесилилирования может быть осуществлена по реакции с комплексом трехфтористый бор-уксусная кислота или кислотой Бронстеда, такой как TFA, MSA, FMSA или тетрафторборная кислота, в среде инертного растворителя, например DCM, или же протодесилилирование может быть осуществлено с основанием (например, гидроокисью, такой как NaOH или КОН, алкоксидом, таким как ROtBu) или сильной кислотой (например, TFA) в среде полярного апротонного растворителя, такого как DMF, DMSO или NMP, с получением соединения формулы 1с. Это соединение формулы 1с затем окисляется с применением окисляющего реагента, например Н2O2, в присутствии KF и КНСО3 с образованием спирта формулы 1d. Кроме того, для превращения силильной группы в гидроксильную могут применяться и другие методы, см., например, Fleming I. (Chemtracts - Organic Chemistry, 1996, 9, 1-64) и Jones G.R. et al. (Tetrahedron, 1996, 52, 7599-7662), оба источника включены в данную заявку в качестве ссылок.
Спирт формулы 1d защищен в виде бензилового эфира формулы 1е с применением галоидного бензила, такого как BnBr, в присутствии основания, такого как KHMDS или NaH, и в органическом растворителе, таком как толуол. Группа РМВ в соединении формулы 1е может быть удалена путем обработки DDQ в среде органического растворителя, такого как СН2Сl2, в присутствии воды с получением соединения формулы 1f.
Соединение формулы 1f затем может быть диастереоселективно эпоксидировано. Например, эпоксидирование можно провести, применяя гомохиральный диэфир винной кислоты, гидроперекись и металлический катализатор, такой как катализатор на основе переходного металла, с получением циклопентанэпоксида формулы 1g. Согласно одному из вариантов гомохиральный диэфир представляет собой (-)-диизопропилтартрат[(-)-DIPT], гидроперекисью является ТВНР или СНР и катализатором служит изопропоксид титана (IV). Предпочтительно проводить реакцию в среде инертного растворителя, например DCM или толуола.
Эпоксид формулы 1g затем сочетается с солью щелочного металла (например, лития) и пуринового соединения формулы 1h, где Y обозначает Сl, Br, I или BnО, в диполярном апротонном растворителе, таком как DMF, с получением соединения 1i. Соединение формулы 1h может быть получено способами, описанными Igi et al., в ЕР 534095 (1993) и Lolli et al., в J.Labelled Compounds and Radiopharmaceuticals, 41 (3), 243-252 (1998). Предпочтительно проводить сочетание циклопентанэпоксида формулы 1g с литиевой солью 2-амино-6-бензилпурина. Соединение формулы 1i, где Y обозначает бензилокси, может быть очищено путем кристаллизации из растворителей, таких как этилацетат и гексаны.
Группа вицинального диола соединения формулы 1i затем может быть превращена в алкеновую группу. По одному из вариантов соединение формулы 1i можно обработать производным орто-формиата, например триметил-орто-формиатом, в присутствии каталитического количества кислоты, такой как TFA или PTSA, или кислого катализатора, такого как PPTS. Полученную смесь диоксоланов (предпочтительно сырую) нагревают со смесью уксусного ангидрида и, возможно, уксусной кислоты с образованием метиленового соединения формулы 1j. Или же эту реакцию можно провести в присутствии антиоксиданта, такого как ВНТ.
Соединение 1k можно получить из соединения формулы 1j путем гидролиза. Согласно одному из вариантов, когда Y обозначает ОBn, 6-О-бензилоксигруппа может быть гидролизована (как любая боковая 2-ацетамидная группа, образовавшаяся при ацетилировании 2-аминогруппы пурина во время обработки уксусным ангидридом) путем нагревания соединения формулы 1j с водным раствором минеральной кислоты, такой как 2N НСl, с получением метиленового соединения формулы 1k. По другому варианту, когда Y обозначает Сl, Br или I, 6-галоидная группа может быть гидролизована водным основанием (например, водным раствором гидроокиси). Наконец, удаление оставшейся защитной группы бензилового эфира в соединении формулы 1k при обработке кислотой Льюиса, такой как ВСl3, ВBr3 и т.д., или кислотой Бронстеда, такой как MSA, TFMSA и т.д., в инертном растворителе, таком как DCM, обеспечивает получение соединения формулы I.
Схема 1
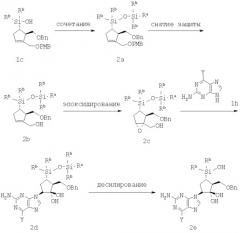
Альтернативные пути синтеза соединения формулы 1 описаны на Схемах 2 и 3. На Схеме 2 соединение формулы 1 с также может быть превращено в соединение формулы 2а при обработке силилирующим реагентом RaSi(Rb)2-галоидид, причем этим силилирующим агентом служит предпочтительно фенилдиметилхлорсилан, в присутствии основания, такого как имидазол. Снятие защиты группы РМВ в соединении формулы 2а может быть достигнуто с применением DDQ в среде органического растворителя, такого как CH2Cl2, в присутствии воды с получением аллилового спирта формулы 2b, который может быть превращен в соединение формулы 2с эпоксидированием, как описано на Схеме 1. Сочетание соединения формулы 2с с соединением формулы 1h, где Y указан выше, в присутствии основания щелочного металла (например, LiOH) в диполярном апротонном растворителе, таком как DMF, приводит к получению соединения 2d, которое затем можно превратить в соединение формулы 2е путем десилилилирования, которое проводят основанием, таким как KOtBu, в среде полярного апротонного растворителя, такого как DMSO.
Схема 2
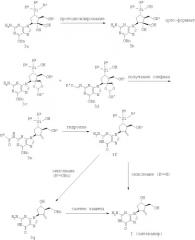
Как показано на Схеме 3, соединение формулы I может быть также получено из соединения формулы 3а, которое описано как соединения формул 78А и 73 в WO 200/052310. Соединение формулы 3b может быть получено из соединения формулы 3а путем протодесилилирования, как описано на Схеме 1. Соединение формулы 3b может быть затем превращено в смесь соединения формулы 3с и соединения формулы 3d при обработке производным орто-формиата, например триметил-орто-формиатом, в присутствии каталитического количества кислоты, такой как TFA или PTSA, или кислого катализатора, такого как PPTS. Следующая стадия образования олефина проводится обработкой полученной смеси соединений 3с и 3d ангидридом кислоты формулы Rd-С(=O)-О-С(=O)-Rd, где Rd обозначает C1-C4 алкил, предпочтительно метил; и, возможно, кислотой формулы Rd-С(=O)ОН, где Rd обозначает C1-C4 алкил, предпочтительно метил, и предпочтительно в присутствии антиоксиданта, такого как ВНТ, с получением соединения 3е. Rd имеет то же значение, что указано выше, по всему описанию, если не указано иное. Гидролиз соединения 3е водной минеральной кислотой, такой как 6М НСl, в органическом растворителе, таком как МеОН, приводит к образованию соединения 3f. Последующее окисление соединения формулы 3f методом, представленным на Схеме 1, обеспечивает получение соединения формулы I (энтекавир), где Rc обозначает Н; или соединения формулы 3g, где Rc обозначает Bn, которое можно превратить в соединение формулы I (энтекавир) путем удаления защитной группы ОBn методом, показанным на Схеме 1.
Схема 3
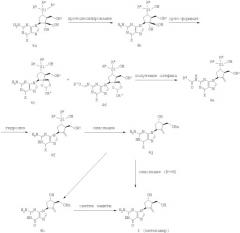
Точно так же соединение формулы 1 можно получить из соединения формулы 4а, где Х означает Сl, Вr или I (йод) согласно Схеме 4. Соединение формулы 4а описано как соединения формул 78В и 73 в WO 2004/052310. Превращение соединения формулы 4а в соединение 4f аналогично показанному на Схеме 3. Соединение формулы 4g может быть получено из соединения формулы 4f путем окисления методом, показанным на Схеме 1. Гидролиз соединения формулы 4g при обработке водным основанием приводит к получению соединения формулы I (энтекавир), где Rc обозначает Н; или соединения формулы 4h, где Rc обозначает Bn, которое можно превратить в соединение формулы I (энтекавир) путем удаления защитной группы OBn методом, показанным на Схеме 1.
Схема 4
Схема 5
На Схеме 5 показан альтернативный синтез энтекавира из соединения формулы 3b. Соединение формулы 5а можно получить из соединения 3b путем окисления, как показано на Схеме 1. Соединение формулы 5d может быть получено из соединения формулы 5а через стадии добавления орто-формиата и получения олефина, как показано выше. Последующий гидролиз соединения формулы 5d водной минеральной кислотой, такой как 6М НСl, в среде органического растворителя, такого как МеОН, приводит к получению соединения формулы I (энтекавира), когда Rc обозначает Н; или соединения формулы 5е, где Rc обозначает Bn, которое можно превратить в соединение формулы I (энтекавир) путем удаления защитной группы OBn методом, показанным на Схеме 1.
Подобно этому соединение формулы I может быть получено из соединения формулы 4b, где Х обозначает Сl, Вr или I (йод) согласно Схеме 6. Превращение соединения формулы 4b в соединение формулы 6d аналогично методу, показанному на Схеме 5. Гидролиз соединения формулы 6d при обработке водной минеральной кислотой, такой как 6М НСl, в среде органического растворителя, такого как МеОН, приводит к получению соединения формулы 6е. Обработка соединения формулы 6е водным основанием приводит к образованию соединения формулы (I) (энтекавира), когда Rc обозначает Н; или соединения формулы 5е, где Rc обозначает Bn, которое можно превратить в соединение формулы I (энтекавир) путем удаления защитной группы OBn методом, показанным на Схеме 1.
Схема 6
Схема 7
Далее на Схеме 7 описан синтез соединения формулы I из соединения 7а, которое может быть получено согласно способу, описанному Pendri et al. в WO 2004/052310. Обработка соединения 7а по меньшей мере одной кислотой, выбранной из: (i) галоидированных метансульфоновых кислот и (ii) возможно, метансульфокислоты; предпочтительно смесью кислот, таких как трифторметансульфокислота/метансульфокислота или монофторметансульфокислота/метансульфокислота; с последующей обработкой по меньшей мере одним водным основанием (например, LiOH, NaOH, КОН и т.д.) приводит к получению соединения формулы 7b как основного продукта (обычно выход от примерно 85% до примерно 95%). Соединение формулы 7с (димер соединения 7b) также может быть получено и может составить от примерно 5% до примерно 15% от общего выхода (например, 9,5% и 14,5%).
Если используется галоидированная метансульфокислота, ее количество может быть меньше примерно 20 мол. экв. в расчете на 1 мол. экв. используемого соединения 7а. Например, количество указанной галоидированной метансульфокислоты может быть меньше примерно 10 мол. экв. (например, 5 экв. монофторметансульфокислоты) в расчете на 1 мол. экв. используемого соединения 7а. Когда применяют смесь кислот, таких как метансульфокислота/трифторметансульфокислота, количество указанной метансульфокислоты может быть меньше примерно 10 мол. экв., количество указанной трифторметансульфокислоты может быть меньше примерно 10 мол. экв. в расчете на 1 мол. экв. использованного соединения 7а. Например, количество указанной метансульфокислоты может быть менее примерно 7 мол. экв. (например, около 1-7 экв., или около 1,5-6,7 экв., или около 2 экв.), а количество указанной трифторметансульфокислоты может быть меньше примерно 6 мол. экв. (например, примерно 1-5 экв. или примерно 2,5-3,5 экв.) в расчете на 1 мол. экв. используемого соединения 7а.
Окисление соединения 7b или смеси соединений 7b и 7с приводит к получению соединения формулы I. Стадия окисления может быть проведена с применением по меньшей мере одного окисляющего агента, такого как пероксогидраты. Пероксогидраты являются кристаллическими аддуктами, содержащими молекулярную перекись водорода, например пероксогидрат карбоната натрия (известный как перкарбонат натрия, например Na2CO3·1,5H2O2), пероксогидрат мочевичны (CO(NH2)2·Н2O2), пероксогидрат меламина (С3Н6N6·Н2O2), пероксогидрат пирофосфата натрия (Na4P2O7·2Н2O2), гидрат пероксогидрата сульфата натрия (2Na2SO4·Н2O2·Н2O), пероксогидрат карбоната калия, пероксогидрат карбоната рубидия и пероксогидрат карбоната цезия (последние три соединения имеют общую формулу М2СО3·3Н2O2). Предпочтительным пероксогидратом на этой стадии окисления является пероксогидрат карбоната натрия.
Схема 8
Альтернативно, соединение 7а может быть обработано по меньшей мере одной кислотой, выбранной из: (i) галоидированной метансульфокислоты и (ii) возможно, метансульфокислоты, как указано выше, с последующей обработкой по меньшей мере одним неводным основанием (например, NReRfRg, где Re, Rf и Rg независимо обозначают водород, алкил, циклоалкил, арил, или указанные Rg и Rf вместе с атомом N, к которому они присоединены, могут образовать гетероцикл) с образованием соединения 7с в качестве основного продукта (обычно выход около 80-95%). Примеры оснований включают третичные амины, такие как триэтиламин, N,N-диметилэтиламин, диизопропилэтиламин (основание Hunig) или тетраметилендиамин (TMEDA), или азотсодержащий гетероцикл, такой как пиридин. Соединение формулы 8а может также образоваться с выходом до 20% (например, 5%, 10% или 15%). Далее, окисление соединения 7с или смеси соединений 7с и 8а приводит к получению соединения формулы I. Стадию окисления можно провести, используя по меньшей мере один окисляющий агент, такой как пероксогидраты (например, пероксогидрат карбоната натрия), как описано выше.
Нижеприведенные примеры иллюстрируют данное изобретение, но никоим образом не ограничивают его объем.
Пример 1
Получение соединения 1b':
Соединение 1a' (6,02 г, 17,1 ммол., 1,00 экв.) растворяли в толуоле (6,70 мл). Добавляли РМВ - С1 (пара-метоксибензилхлорид) (7,00 мл, 51,2 ммол., 3,00 экв.) и затем TBAHS (кислый сульфат тетрабутиламмония) (0,577 г, 1,71 ммол., 0,01 экв.) и 50% NaOH (6,70 мл). Смесь перемешивали 4 ч при комнатной температуре. Реакционную смесь соединяли с водой (23 мл) и толуолом (50 мл), и фазы разделялись. Органический слой промывали опять водой (23 мл), и фазы снова разделялись. Соединенные водные слои экстрагировали толуолом (50 мл), а соединенные органические слои концентрировали в роторном испарителе. Сырой продукт подвергали хроматографии на колонке с применением колонки со 120 г двуокиси кремния и градиентом подвижной фазы 2-15% этилацетата в гексанах. Нужные фракции соединяли и концентрировали с получением соединения формулы 1b' (6,17 г) в виде желтого масла с выходом 76%. 1H ЯМР (360 MHz, СDСl3) δ 7.54-7.52 (m, 2H) 7.35-7.22 (m, 9H), 6.92-6.87 (m, 3H), 5.71 (s, 1H), 4.49-4.35 (m, 4H), 4.06-4.04 (m, 2H), 3.84 (s, 3H), 3.41-3.37 (m, 1H), 3.30-3.28 (m, 1H), 2.92 (s, 1H), 2.57-2.56 (m, 1H), 2.33-2.31 (m, 1H), 1.64-1.59 (m, 1H), 0.27 (s, 6Н); 13С ЯМР (90 MHz, CDCl3) δ 159.5, 142.8, 139.0, 138.9, 134.3, 131.0, 129.8, 129.7, 129.3, 129.0, 128.7, 128.7, 128.2, 128.1, 114.2, 114.1, 77.6, 73.4, 72.1, 68.1, 55.7, 48.4, 33.8, 25.6, -4.2, -4.2; MS (инфузия)=473 (M+H+); HRMS m/c (рассчит. для С30Н37О3Si (M+Н+): 473.2512, найдено 473.2501.
Пример 2
Получение соединения 1с':
Соединение 1b' (6,17 г, 13,1 ммол., 1,0 экв.) растворяли в ДМСО (62 мл) и трет-бутоксид калия (5,00 г, 44,0 ммол., 3,37 экв.) добавляли с получением густой суспензии. Реакционную смесь перемешивали при комнатной температуре в течение суток, после чего исходное вещество не обнаруживалось при помощи ЖХВР. Реакционную смесь перемещали в разделительную воронку и загружали этилацетат (124 мл) и воду (124 мл). Фазы разделялись, и водный слой дважды экстрагировали этилацетатом (2×124 мл). Соединенные органические слои концентрировали с получением остатка, который очищали на хроматографической колонке со 120 г двуокиси кремния с градиентом подвижной фазы 10-50% этилац