Соединения для ингибирования ферментов
Иллюстрации
Показать всеИзобретение относится к α',β'-эпоксидам пептидов формулы (III) и (IV), которые ингибируют химотрипсино-подобную активность 20S протеасомы. 2 н. и 17 з.п. ф-лы.
Реферат
Область техники
Данное изобретение относится к соединениям и способам ингибирования ферментов. В частности, изобретение относится к терапевтическим способам, основанным на ингибировании ферментов.
Уровень техники
У эукариот деградация белка преимущественно опосредована метаболическим путем убиквитина, в котором белки, которые становятся мишенью для разрушения, лигируются с полипептидом из 76 аминокислот убиквитином. Ставшие мишенью, убиквитинированные белки затем служат субстратами для 26S протеасомы, мультикаталитической протеазы, которая расщепляет белки на короткие пептиды посредством действия ее трех основных протеолитических активностей. Обладая основной функцией во внутриклеточном метаболизме белка, опосредованная протеасомой деградация также играет ключевую роль во многих процессах, таких как презентация главного комплекса гистосовместимости (MHC) класса I, апоптоз, деление клетки и активация NF-κB.
20S протеасома представляет собой 700 кДа комплекс мультикаталитических протеаз цилиндрической формы, содержащий 28 субъединиц, организованных в четыре кольца, который играет важную роль при регуляции роста клеток, презентации главного комплекса гистосовместимости (MHC) класса I, апоптозе, процессинге антигенов, активации NF-κB и трансдукции провоспалительных сигналов. В дрожжах и других эукариотах 7 различных субъединиц α формируют внешние кольца и 7 различных субъединиц β составляют внутренние кольца. Субъединицы α служат в качестве участков связывания для 19S (PA700) и 11S (PA28) регуляторных комплексов, а также в качестве физического барьера для внутренней протеолитической полости, образованной двумя кольцами из субъединиц β. Таким образом, in vivo, протеасома, как полагают, существует в виде частицы 26S («26S протеасома»). Эксперименты in vivo показали, что можно легко найти зависимость между ингибированием формы 20S протеасомы и ингибированием 26S протеасомы. Расщепление N-концевой пропоследовательности субъединицы β во время образования частицы высвобождает N-концевые остатки треонина, которые служат каталитическими нуклеофилами. Субъединицы, ответственные за каталитическую активность в протеасоме, таким образом, содержат N-концевой нуклеофильный остаток, и данные субъединицы принадлежат семейству гидролаз с N-концевой нуклеофильной группой (Ntn) (где N-концевой нуклеофильный остаток представляет собой, например, Cys, Ser, Thr и другие нуклеофильные группы). Данное семейство включает, например, пенициллин-G-ацилазу (PGA), пенициллин-V-ацилазу (PVA), глутамин-ФРПФ-амидотрансферазу (GAT) и бактериальную гликозиласпарагиназу. В дополнение к распространенным экспрессируемым субъединицам β, высшие позвоночные животные также имеют три индуцируемые γ-интерфероном субъединицы β (LMP7, LMP2 и MECL1), которые замещают их нормальные соответствующие части, X, Y и Z соответственно, таким образом изменяя каталитическую активность протеасомы. При помощи различных пептидных субстратов три основные протеолитические активности были определены для 20S протеасомы эукариот: химотрипсино-подобная активность (CT-L), при которой происходит расщепление после больших гидрофобных остатков; трипсино-подобная активность (T-L), при которой происходит расщепление после основных остатков, и петидилглутамил-пептидгидролазная активность (PGPH), при которой происходит расщепление после кислотных остатков. Протеасоме также приписывают две дополнительные менее изученные активности: активность BrAAP, при которой происходит расщепление после аминокислот с разветвленной цепью, и активность SNAAP, при которой происходит расщепление после небольших нейтральных аминокислот. В основные протеолитические активности протеасомы, по-видимому, вносят вклад различные каталитические участки, поскольку ингибиторы, точечные мутации в субъединицах β и замена индуцируемых γ-интерфероном субъединиц β изменяют данные активности в различной степени.
Существует несколько примеров небольших молекул, которые использовали для ингибирования активности протеасомы; однако данным соединениям, в основном, недостает специфичности, устойчивости или активности, необходимой для исследования и использования роли протеасомы на клеточном и молекулярном уровне. Поэтому синтез низкомолекулярного ингибитора(ов) с повышенной специфичностью к месту связывания, с улучшенной устойчивостью и растворимостью и с увеличенной активностью необходим для того, чтобы осуществить исследование роли протеасомы на клеточном и молекулярном уровне.
Сущность изобретения
Изобретение относится к классам молекул, известным как α',β'-эпоксиды пептидов и α',β'-азиридины пептидов. Подразумевается, что исходные молекулы эффективно, необратимо и селективно связываются с гидролазами, содержащими N-концевые нуклеофильные группы (Ntn), и могут специфически ингибировать определенную активность ферментов, обладающих множественной каталитической активностью.
Ранее предполагали, что протеасома только удаляет денатурированные белки и белки с неправильной укладкой, а теперь обнаружили, что протеасома образуют протеолитический аппарат, который регулирует уровни разнообразных внутриклеточных белков посредством их деградации зависимым от сигналов способом. Следовательно, существует большой интерес к обнаружению реагентов, которые могут специфически изменять активности протеасомы и других гидролаз Ntn и, таким образом, использоваться в качестве зондов для изучения роли данных ферментов в биологических процессах. Здесь описаны, синтезированы и исследованы соединения, которые действуют на гидролазы Ntn. Описаны и заявлены эпоксиды пептидов и азиридины пептидов, которые могут сильно, селективно и необратимо ингибировать определенные активности протеасомы.
В отличие от некоторых других ингибиторов на основе пептидов описанные здесь эпоксиды пептидов и азиридины пептидов, как ожидают, существенно не ингибируют непротеасомные протеазы, такие как трипсин, химотрипсин, катепсин В, папаин и кальпаин, при концентрациях вплоть до 50 мкМ. При более высоких концентрациях можно наблюдать ингибирование, но следовало бы ожидать, что оно будет конкурентным и не необратимым, если ингибитор просто конкурирует с субстратом. Также ожидают, что новые эпоксиды пептидов и азиридины пептидов ингибируют активацию NF-κB и стабилизируют уровни p53 в культуре клеток. Кроме того, данные соединения, как ожидается, обладают противовоспалительной активностью. Таким образом, данные соединения могут представлять собой уникальные молекулярные зонды, которые обладают многоцелевым назначением для исследования функции фермента Ntn при нормальных биологических и патологических процессах.
В одном аспекте изобретение относится к ингибиторам, включающим трехчленное кольцо, содержащее гетероатом. Такие ингибиторы могут ингибировать каталитическую активность ферментов гидролаз с N-концевой нуклеофильной группой (например, 20S протеасома или 26S протеасома), если указанные ингибиторы присутствуют в концентрациях ниже приблизительно 50 мкМ. Относительно 20S протеасомы, определенные ингибиторы гидролазы ингибируют химотрипсино-подобную активность 20S протеасомы, когда ингибитор присутствует в концентрациях ниже приблизительно 5 мкМ, и не ингибируют трипсино-подобную активность или активность PGPH 20S протеасомы, когда присутствует в концентрациях ниже приблизительно 5 мкМ. Ингибитор гидролазы может представлять собой, например, α',β'-эпоксикетон или α',β'-азиридинкетон, и пептид может представлять собой тетрапептид. Пептид может включать разветвленные или линейные боковые цепи, такие как водород, C1-6-алкил, C1-6-гидроксиалкил, C1-6-алкоксиалкил, арил, C1-6-аралкил, C1-6-алкиламид, C1-6-алкиламин, C1-6-карбоновая кислота, C1-6-эфир карбоновой кислоты, C1-6-алкилтиол или C1-6-алкилтиоэфир, например изобутил, 1-нафтил, фенилметил и 2-фенилэтил. α'-Углерод α',β'-эпоксикетона или α',β'-азиридинкетона может представлять собой хиральный атом углерода, такой как углерод в конфигурации (R) или β, как они определены здесь.
В другом аспекте изобретение относится к фармацевтическим композициям, включающим фармацевтически приемлемый носитель и фармацевтически эффективное количество ингибитора гидролазы, который среди прочего облегчает симптомы нейродегенеративного заболевания (такого как болезнь Альцгеймера), заболевания, вызывающего мышечное истощение, рака, хронических инфекционных заболеваний, лихорадки, бездействия мускулатуры, денервации, поражения нерва, голодания и связанных с иммунной системой состояний.
В другом аспекте изобретение относится к противовоспалительным композициям.
В другом аспекте изобретение относится к следующим способам: ингибирования или уменьшения инфицирования ВИЧ у пациента; влияния на уровень экспрессии вирусного гена у пациента; изменения множества антигенных пептидов, продуцируемых протеасомой в организме; определения, регулируются ли протеолитической активностью определенной гидролазы Ntn клеточный процесс, процесс развития или физиологический процесс или продуцирование в организме; лечения болезни Альцгеймера у пациента; снижения скорости деградации мышечных белков в клетке; снижения скорости внутриклеточной деградации белка в клетке; снижения скорости деградации белка p53 в клетке; ингибирования роста связанных с p53 раковых образований у пациента; ингибирование презентации антигена в клетке; подавления иммунной системы пациента; ингибирования деградации IκB-α в организме; уменьшения содержания NF-κB в клетке, мускулатуре, органе или у пациента; воздействия на циклин-зависимые циклы эукариотических клеток; лечения пролиферативных заболеваний у пациента; воздействия на зависимое от протеасомы регулирование онкогенных белков в клетке; лечения роста опухоли у пациента; лечения связанного с p53 апоптоза у пациента; и скрининга белков, процессируемых гидролазами с N-концевой нуклеофильной группой в клетке. Каждый из данных способов включает введение или контактирование с эффективным количеством композиции, содержащей описанные здесь ингибиторы гидролазы, пациенту, в клетку, в ткань, орган или организм.
Другие характеристики и преимущества изобретения станут очевидны из следующего ниже подробного описания и из формулы изобретения.
Подробное описание изобретения
Изобретение относится к композициям, применимым в качестве ингибиторов фермента. Данные композиции, главным образом, применимы для ингибирования ферментов, содержащих нуклеофильную группу на N-конце. Например, активность ферментов или субъединиц ферментов, содержащих N-концевые аминокислоты с нуклеофильными группами в их боковых цепях, такие как треонин, серин или цистеин, можно успешно ингибировать описанными здесь ингибиторами фермента. Активности ферментов или субъединиц ферментов, содержащих неаминокислотные нуклеофильные группы на их N-концах, такие как, например, защитные группы или углеводороды, можно также успешно ингибировать описанными здесь ингибиторами фермента.
Несмотря на то, что это не связано с какой-либо определенной теорией процесса, полагают, что такая N-концевая нуклеофильная группа Ntn образует ковалентные аддукты с эпоксидной функциональной группой описанных здесь ингибиторов фермента. Например, в субъединице β5/Pre2 20S протеасомы N-концевой треонин, как полагают, необратимо образует морфолиновый или пиперазиновый аддукт при реакции с эпоксидом или азиридином пептида, таких как описано ниже. Такое образование аддукта повлекло бы за собой расщепление с размыканием цикла эпоксида или азиридина.
В вариантах осуществления, включающих такие группы, связанные с α'-углеродами, стереохимическая конфигурация α'-углерода (углерод, который образует часть эпоксидного или азиридинового кольца) может представлять собой (R) или (S). Изобретение частично базируется на структурно-функциональной информации, описанной здесь, которая предполагает следующее предпочтительное стереохимическое взаиморасположение. Следует отметить, что предпочтительное соединение может содержать большое количество стереоцентров, обозначенных как взаиморасположенные сверху-снизу (или β-α, где β, как изображено здесь, находится выше плоскости страницы) или как (R)-(S) (то есть не требуется, чтобы каждый стереоцентр в соединении соответствовал установленному предпочтению). В некоторых предпочтительных вариантах осуществления стереохимия α'-углерода представляет собой (R), то есть атом X находится в расположении β или выше плоскости молекулы.
Что касается стереохимии, правила Кана-Ингольда-Прелога для определения абсолютной стереохимии представляют собой следующее. Данные правила описаны, например, в Organic Chemistry, Fox and Whitesell; Jones and Bartlett Publishers, Boston, MA (1994); Section 5-6, pp 177-178, раздел которой таким образом включен сюда путем ссылки. Пептиды могут содержать повторяющиеся структуры основной цепи с боковыми цепями, расходящимися от звена основной цепи. Вообще, каждое звено основной цепи содержит боковую цепь, связанную с ней, хотя в некоторых случаях боковая цепь представляет собой атом водорода. В других вариантах осуществления не каждое звено основной цепи содержит связанную боковую цепь. Пептиды, используемые для получения эпоксидов пептида или азиридинов пептида, имеют два или более звеньев основной цепи. В некоторых вариантах осуществления, применимых для ингибирования химотрипсино-подобной активности (CT-L) протеасомы, присутствует от двух до восьми звеньев основной цепи, и в некоторых вариантах осуществления для ингибирования CT-L присутствует от двух до шести звеньев основной цепи.
Боковые цепи, отходящие от звеньев основной цепи, могут включать природные алифатические или ароматические боковые цепи аминокислот, такие как водород (глицин), метил (аланин), изопропил (валин), втор-бутил (изолейцин), изобутил (лейцин), фенилметил (фенилаланин), и боковую цепь, представляющую собой аминокислоту пролин. Боковые цепи могут также представлять собой разветвленные или линейные алифатические или ароматические группы, такие как этил-, н-пропил-, н-бутил-, трет-бутил- и арилзамещенные производные, такие как 1-фенилэтил, 2-фенилэтил, (1-нафтил)метил, (2-нафтил)метил, 1-(1-нафтил)этил, 1-(2-нафтил)этил, 2-(1-нафтил)этил, 2-(2-нафтил)этил и подобные соединения. Арильные группы могут дополнительно замещаться разветвленными или линейными C1-6-алкильными группами, или замещенными алкильными группами, ацетилом и тому подобным или дополнительно арильными группами, или замещенными арильными группами, такими как бензоил и тому подобное. Гетероарильные группы также можно использовать в качестве заместителей боковых цепей. Гетероарильные группы включают азот-, кислород- и серосодержащие арильные группы, такие как тиенил, бензотиенил, нафтотиенил, тиантренил, фурил, пиранил, изобензофуранил, хроменил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, индолил, пуринил, хинолил и тому подобное.
В некоторых вариантах осуществления полярные или заряженные остатки можно вводить в эпоксиды пептидов или азиридины пептидов. Например, можно вводить встречающиеся в природе аминокислоты, такие как содержащие гидроксигруппу (Thr, Tyr, Ser) или серосодержащие (Met, Cys), а также и заменимые аминокислоты, например таурин, карнитин, цитруллин, цистин, орнитин, норлейцин и другие. Также можно вводить не встречающиеся в природе заместители боковых цепей с заряженными или полярными группами, такими как, например, цепи C1-6-алкил или C6-12-арильные группы с одной или более гидрокси-, алкокси- с короткой цепью, сульфидной, тио-, карбоксильной, эфирной, фосфо-, амидо- и аминогруппами, или такими заместителями, замещенными одним или более атомами галогенов. В некоторых предпочтительных вариантах осуществления существует, по меньшей мере, одна арильная группа, присутствующая в боковой цепи пептидной части.
В некоторых вариантах осуществления звенья основной цепи представляют собой амидные звенья [-NH-CHR-C(=O)-], в которых R представляет собой боковую цепь. Такое обозначение не исключает встречающуюся в природе аминокислоту пролин или другие не встречающиеся в природе циклические вторичные аминокислоты, которые известны специалистам в данной области.
В других вариантах осуществления звенья основной цепи представляют собой N-алкилированные амидные звенья (например, N-метил и тому подобное), олефиновые аналоги (в которых одна или более амидных связей заменены на олефиновые связи), аналоги тетразола (в которых кольцо тетразола придает цис-конфигурацию основной цепи) или комбинации таких связей в основной цепи. В еще одних вариантах осуществления α-углерод аминокислоты модифицирован введением α-алкильного заместителя, например аминоизомасляная кислота. В некоторых дополнительных вариантах осуществления боковые цепи локально модифицированы, например, ΔE- или ΔZ-дегидромодификацией, в которой присутствует двойная связь между α и β атомами боковой цепи, или, например, ΔE- или циклопропильной ΔZ-модификацией, в которой присутствует циклопропильная группа между α и β атомами боковой цепи. В еще одних дополнительных вариантах осуществления, использующих группы аминокислот, можно использовать D-аминокислоты. Дополнительные осуществления могут включать в себя циклизацию боковой цепи к основной цепи, образование дисульфидной связи, образование лактама, азосвязь и другие модификации, обсуждаемые в книге "Peptides and Mimics, Design of Conformationally Constrained" by Hruby and Boteju, in "Molecular Biology and Biotechnology: A Comprehensive Desk Reference", ed. Robert A. Meyers, VCH Publishers (1995), pp. 658-664, которая, таким образом, включена сюда в качестве ссылки.
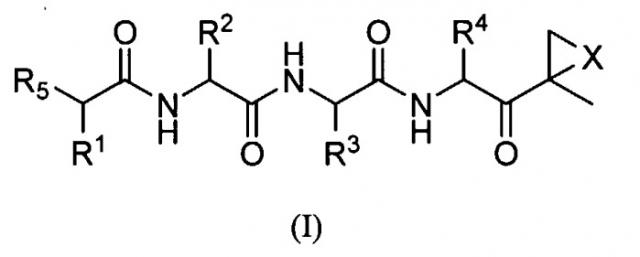
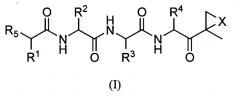
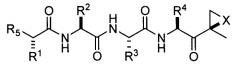
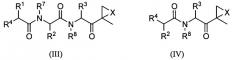
Один аспект изобретения относится к соединениям, имеющим структуру формулы (I), или их фармацевтически приемлемой соли.
где каждый A независимо выбран из C=O, C=S и SO2, предпочтительно C=O;
каждый B независимо выбран из C=O, C=S и SO2, предпочтительно C=O;
D отсутствует или представляет собой C1-8-алкил;
G выбран из О, NH и N-C1-6-алкила;
K отсутствует или выбран из C=O, C=S и SO2, предпочтительно K отсутствует или представляет собой C=O;
L отсутствует или выбран из C=O, C=S и SO2, предпочтительно L отсутствует или представляет собой C=O;
M отсутствует или представляет собой C1-8-алкил;
Q отсутствует или выбран из О, NH и N-C1-6-алкила, предпочтительно Q отсутствует, представляет собой О или NH, наиболее предпочтительно Q отсутствует;
X выбран из О, S, NH и N-C1-6-алкила, предпочтительно представляет собой О;
каждый V независимо отсутствует или выбран из О, S, NH и N-C1-6-алкила, предпочтительно V отсутствует или представляет собой О;
W отсутствует или независимо выбран из О, S, NH и N-C1-6-алкила, предпочтительно представляет собой О;
Y отсутствует или выбран из О, NH, N-C1-6-алкила, S, SO, SO2, CHOR10 и CHCO2R10;
каждый Z независимо выбран из О, S, NH и N-C1-6-алкила, предпочтительно представляет собой О;
R1, R2, R3 и R4 каждый независимо выбран из C1-6-алкила, C1-6-гидроксиалкила, C1-6-алкоксиалкила, арила, C1-6-аралкила и R14DVKOC1-3-алкила-, где, по меньшей мере, один из R1 и R3 представляет собой R14DVKOC1-3-алкил-;
R5 представляет собой N(R6)LQR7;
R6 выбран из водорода, OH и C1-6-алкила, предпочтительно представляет собой C1-6-алкил;
R7 представляет собой дополнительную цепь аминокислот, водород, защитную группу, арил или гетероарил, любой из которых необязательно замещен галогеном, карбонилом, нитро, гидрокси, арилом, C1-5-алкилом; или R7 выбран из C1-6-алкила, C1-6-алкенила, C1-6-алкинила, C1-6-аралкила, C1-6-гетероаралкила, R8ZA-C1-8-алкила-, R11Z-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-ZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-Z-C1-8-алкила-, R8ZA-C1-8-алкил-ZAZ-C1-8-алкила-, гетероциклилMZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкила-, (R10)2N-C1-8-алкила-, (R10)3N+-C1-8-алкила-, гетероциклилM-, карбоциклилM-, R11SO2C1-8-алкила- и R11SO2NH; или
R6 и R7, взятые вместе, представляют собой C1-6-алкил-Y-C1-6-алкил, C1-6-алкил-ZA-C1-6-алкил, A-C1-6-алкил-ZA-C1-6-алкил, A-C1-6-алкил-A или C1-6-алкил-A, предпочтительно C1-2-алкил-Y-C1-2-алкил, C1-2-алкил-ZA-C1-2-алкил, А-C1-2-алкил-ZA-C1-2-алкил, A-C1-3-алкил-A или C1-4-алкил-A, с образованием цикла, предпочтительно R6 представляют собой водород и R7 представляют собой C1-6-алкил;
R8 и R9 независимо выбраны из водорода, катиона металла, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, арила, гетероарила, C1-6-аралкила и C1-6-гетероаралкила, предпочтительно из водорода, катиона металла и C1-6-алкила или R8 и R9, взятые вместе, представляют собой C1-6-алкил, с образованием цикла;
каждый R10 независимо выбран из водорода и C1-6-алкила, предпочтительно из C1-6-алкила;
каждый R11 независимо выбран из водорода, OR10, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, карбоциклила, гетероциклила, арила, гетероарила, C1-6-аралкила и C1-6-гетероаралкила;
R14 выбран из водорода, (R15O)(R16O)P(=O)W-, R15GB-, гетероциклила-, (R17)2N-, (R17)3N+-, R17SO2GBG- и R15GBC1-8-алкила-, где группа C1-8-алкил необязательно замещена OH, C1-8-алкилW (необязательно замещенным галогеном, предпочтительно фтором), арилом, гетероарилом, карбоциклилом, гетероциклилом и C1-6-аралкилом, предпочтительно, по меньшей мере, наличие одного R14, который является отличным от водорода;
R15 и R16 независимо выбраны из водорода, катиона металла, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, арила, гетероарила, C1-6-аралкила и C1-6-гетероаралкила, предпочтительно из водорода, катиона металла и C1-6-алкила, или R15 и R16, взятые вместе, представляют собой C1-6-алкил, с образованием цикла; и
каждый R17 независимо выбран из водорода, OR10, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, карбоциклила, гетероциклила, арила, гетероарила, C1-6-аралкила и C1-6-гетероаралкила;
при условии, что R6 представляет собой H, L представляет собой C=O и Q отсутствует, R7 не является водородом, C1-6-алкилом или замещенным или незамещенным арилом или гетероарилом и
D, G, V, K и W выбраны так, что не существует связей О-О, N-O, S-N или S-O.
Подходящие N-концевые защитные группы, известные в области синтеза пептидов, включают трет-бутоксикарбонил (Boc), бензоил (Bz), флуорен-9-илметоксикарбонил (Fmoc), трифенилметил (тритил) и трихлорэтоксикарбонил (Troc) и тому подобное. Использование различных N-защитных групп, например бензилоксикарбонильной группы или трет-бутоксикарбонильной группы (Boc), различных конденсирующих реагентов, например, дициклогексилкарбодиимид (DCC), 1,3-диизопропилкарбодиимид (DIC), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC), N-гидроксиазабензотриазол (HATU), карбонилдиимидазол или моногидрат 1-оксибензотриазола (HOBT) и различных условий расщепления: например, трифторуксусная кислота (TFA), HCl в диоксане, гидрирование Pd-C в органических растворителях (таких как метанол или этилацетат), трис-трифторацетат бора и бромциан, и реакции в растворе с выделением и очисткой промежуточных продуктов хорошо известны в области пептидного синтеза и в равной степени применимы для получения рассматриваемых соединений.
В некоторых вариантах осуществления R1, R2, R3 и R4 каждый независимо выбран из C1-6-алкила, C1-6-гидроксиалкила, C1-6-алкоксиалкила, арила, C1-6-аралкила и R14DVKOC1-3-алкила-, где, по меньшей мере, один из R1 и R3 представляет собой R14DVKOC1-3-алкил-. В предпочтительных вариантах осуществления один из R1 и R3 представляет собой C1-6-аралкил и другой представляет собой R14DVKOC1-3-алкил- и R2 и R4 независимо представляет собой C1-6-алкил. В наиболее предпочтительном осуществлении один из R1 и R3 представляет собой 2-фенилэтил или фенилметил и другой представляет собой R14DVKOCH2- и R14DVKO(CH3)СН-, и оба R2 и R4 представляют собой изобутил.
В некоторых вариантах осуществления каждый R11 независимо выбран из водорода, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, карбоциклила, гетероциклила, арила, гетероарила, C1-6-аралкила и C1-6-гетероаралкила.
В некоторых вариантах осуществления каждый R17 независимо выбран из водорода, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, карбоциклила, гетероциклила, арила, гетероарила, C1-6-аралкила и C1-6-гетероаралкила.
В некоторых вариантах осуществления L и Q отсутствуют и R7 выбран из водорода, дополнительной цепи аминокислот, C1-6-ацила, защитной группы, арила, гетероарила, C1-6-алкила, C1-6-алкенила, C1-6-алкинила, C1-6-аралкила и C1-6-гетероаралкила. В некоторых таких вариантах осуществления R6 представляет собой C1-6-алкил и R7 выбран из бутила, аллила, пропаргила, фенилметила, 2-пиридила, 3-пиридила и 4-пиридила.
В других вариантах осуществления L представляет собой SO2, Q отсутствуют и R7 выбран из C1-6-алкила и арила. В некоторых таких вариантах осуществления R7 выбран из метила и фенила.
В некоторых вариантах осуществления L представляет собой C=O и R7 выбран из
C1-6-алкила, C1-6-алкенила, C1-6-алкинила, арила, C1-6-аралкила, гетероарила и C1-6-гетероаралкила, R8ZA-C1-8-алкила-, R11Z-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-ZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-Z-C1-8-алкила-, R8ZA-C1-8-алкил-ZAZ-C1-8-алкила-, гетероциклилMZAZ-C1-8-алкила-, (R10)2N-C1-8-алкила-, (R10)3N+-C1-8-алкила-, гетероциклилM-, карбоциклилM-, R11SO2C1-8-алкила- и R11SO2NH-. В некоторых вариантах осуществления L представляет собой C=O, Q отсутствует и R7 представляет собой H.
В некоторых вариантах осуществления R6 представляет собой C1-6-алкил, R7 представляет собой C1-6-алкил, Q отсутствует и L представляет собой C=O. В некоторых таких вариантах осуществления R7 представляет собой этил, изопропил, 2,2,2-трифторэтил или 2-(метилсульфонил)этил.
В других вариантах осуществления L представляет собой C=O, Q отсутствует и R7 представляет собой C1-6-аралкил. В некоторых таких вариантах осуществления R7 выбран из 2-фенилэтила, фенилметила, (4-метоксифенил)метила, (4-хлорфенил)метила и (4-фторфенил)метила.
В других вариантах осуществления L представляет собой C=O, Q отсутствует, R6 представляет собой C1-6-алкил и R7 представляет собой арил. В некоторых таких вариантах осуществления R7 представляет собой замещенный или незамещенный фенил.
В некоторых вариантах осуществления L представляет собой C=O, Q отсутствует или представляет собой О и R7 представляет собой (CH2)nкарбоциклил. В некоторых таких вариантах осуществления R7 представляет собой циклопропил или циклогексил.
В некоторых вариантах осуществления L и A представляют собой C=O, Q отсутствует, Z представляют собой О и R7 выбран из R8ZA-C1-8-алкила-, R11Z-C1-8-алкила-, R8ZA-C1-8-алкил-ZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-ZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-Z-C1-8-алкила- и гетероциклилMZAZ-C1-8-алкила-. В некоторых таких вариантах осуществления R7 представляет собой гетероциклилMZAZ-C1-8-алкил-, где гетероциклил представляет собой замещенный или незамещенный оксодиоксоленил или N(R12)(R13), где R12 и R13, взятые вместе, представляют собой C1-6-алкил-Y-C1-6-алкил, предпочтительно C1-3-алкил-Y-C1-3-алкил, с образованием цикла.
В некоторых предпочтительных вариантах осуществления L представляет собой C=O, Q отсутствует и R7 выбран из (R8O)(R9O)P(=O)O-C1-8-алкила-, (R10)2N-C1-8-алкила, (R10)3N+(СН2)n- и гетероциклил-M-. В некоторых таких вариантах осуществления R7 представляет собой -C1-8-алкилN(R10)2 или -C1-8-алкилN+(R10)3, где R10 представляет собой C1-6-алкил. В некоторых других таких вариантах осуществления R7 представляет собой гетероциклилM-, где гетероциклил выбран из морфолиновой группы, пиперидиновой группы, пиперазиновой группы и пирролидиновой группы.
В некоторых вариантах осуществления L представляет собой C=O, R6 представляет собой C1-6-алкил, Q выбран из О и NH и R7 выбран из C1-6-алкила, циклоалкил-M, C1-6-аралкила и C1-6-гетероаралкила. В других вариантах осуществления L представляет собой C=O, R6 представляет собой C1-6-алкил, Q выбран из О и NH и R7 представляет собой C1-6-алкил, где C1-6-алкил выбран их метила, этила и изопропила. В дополнительных вариантах осуществления L представляет собой C=O, R6 представляет собой C1-6-алкил, Q выбран из О и NH и R7 представляет собой C1-6-аралкил, где аралкил представляет собой фенилметил. В других вариантах осуществления L представляет собой C=O, R6 представляет собой C1-6-алкил, Q выбран из О и NH и R7 представляет собой C1-6-гетероалкил, где гетероалкил представляет собой (4-пиридил)метил.
В некоторых вариантах осуществления L отсутствует или представляет собой C=O и R6 и R7, взятые вместе, представляют собой C1-6-алкил-Y-C1-6-алкил, C1-6-алкил-ZA-C1-6-алкил или C1-6-алкил-А, с образованием цикла. В некоторых предпочтительных вариантах осуществления L представляет собой C=O, Q и Y отсутствуют и R6 и R7, взятые вместе, представляют собой C1-3-алкил-Y-C1-3-алкил. В другом предпочтительном осуществлении L и Q отсутствуют и R6 и R7, взятые вместе, представляют собой C1-3-алкил-Y-C1-3-алкил. В другом предпочтительном осуществлении L представляет собой C=O, Q отсутствует, Y выбран из NH и N-C1-6-алкила и R6 и R7, взятые вместе, представляют собой C1-3-алкил-Y-C1-3-алкил. В другом предпочтительном осуществлении L представляет собой C=O, Y отсутствует и R6 и R7, взятые вместе, представляют собой C1-3-алкил-Y-C1-3-алкил. В другом предпочтительном осуществлении L и A представляют собой C=O и R6 и R7, взятые вместе, представляют собой C1-2-алкил-ZA-C1-2-алкил. В другом предпочтительном осуществлении L и A представляют собой C=O и R6 и R7, взятые вместе, представляют собой C2-3-алкил-A.
В некоторых вариантах осуществления R14 представляет собой (R15O)(R16O)P(=O)W-. В некоторых таких вариантах осуществления D, V, K и W отсутствуют. В других таких вариантах осуществления V и K отсутствуют, D представляет собой C1-8-алкил и W представляет собой O. В еще одних таких вариантах осуществления D представляет собой C1-8-алкил, K представляет собой C=O и V и W представляют собой O.
В некоторых вариантах осуществления R14 представляет собой R15GB-. В предпочтительных вариантах осуществления B представляет собой C=O, G представляет собой О, D представляет собой C1-8-алкил, V представляет собой О и K представляет собой C=O.
В некоторых вариантах осуществления R14 представляет собой гетероциклил-. В предпочтительных таких вариантах осуществления D представляет собой C1-8-алкил. В некоторых таких вариантах осуществления V представляет собой О, K представляет собой C=O и гетероциклил представляет собой оксодиоксоленил. В других таких вариантах осуществления V отсутствует, K отсутствует или представляет собой C=O и гетероциклил представляет собой N(R18)(R19), где R18 и R19, взятые вместе, представляют собой J-T-J, J-WB-J или B-J-T-J, T отсутствует или выбран из О, NR17, S, SO, SO2, CHOR17, CHCO2R15, C=O, CF2 и CHF и J отсутствует или представляет собой C1-3-алкил.
В некоторых вариантах осуществления R14 представляет собой (R17)2N- или (R17)3N+- и предпочтительно V отсутствует. В предпочтительных таких вариантах осуществления D представляет собой C1-8-алкил и K отсутствует или представляет C=O. В некоторых вариантах осуществления, где V отсутствует и R14 представляет собой (R17)2N-, D отсутствует, K отсутствует или представляет собой C=O, предпочтительно K представляет собой C=O.
В некоторых вариантах осуществления R14 представляет собой R17SO2GBG-. В предпочтительных таких вариантах осуществления B представляет собой C=O, D, V и K отсутствуют и G представляет собой NH или NC1-6-алкил.
В некоторых вариантах осуществления R14 представляет собой R15GBC1-8-алкил. В предпочтительных вариантах осуществления B представляет собой C=O, G представляет собой О и группа C1-8-алкил необязательно замещена OH, C1-8-алкилом (необязательно замещенным галогеном, предпочтительно фтором), C1-8-алкилW, арилом, гетероарилом, карбоциклилом, гетероциклилом и C1-6-аралкилом. В некоторых таких вариантах осуществления группа C1-8-алкил представляет собой незамещенный, моно- или дизамещенный C1-алкил.
В некоторых вариантах осуществления соединения формулы I имеет следующую стереохимическую конфигурацию:
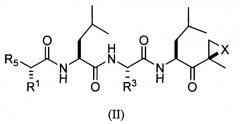
В предпочтительных вариантах осуществления ингибитор имеет структуру формулы II или ее фармацевтически приемлемой соли
где каждый A независимо выбран из C=O, C=S и SO2, предпочтительно C=O;
каждый B независимо выбран из C=O, C=S и SO2, предпочтительно C=O;
D отсутствует или представляет собой C1-8-алкил;
G выбран из О, NH и N-C1-6-алкила;
K отсутствует или выбран из C=O, C=S и SO2, предпочтительно K отсутствует или представляет собой C=O;
L отсутствует или выбран из C=O, C=S и SO2, предпочтительно L отсутствует или представляет собой C=O;
M отсутствует или представляет собой C1-8-алкил;
Q отсутствует или выбран из О, NH и N-C1-6-алкила, предпочтительно Q отсутствует, представляет собой О или NH, наиболее предпочтительно Q отсутствует или представляет собой О;
X выбран из О, S, NH и N-C1-6-алкила, предпочтительно представляет собой О;
каждый V независимо отсутствует или выбран из О, S, NH и N-C1-6-алкила, предпочтительно V отсутствует или представляет собой О;
W отсутствует или независимо выбран из О, S, NH и N-C1-6-алкила, предпочтительно представляет собой О;
Y отсутствует или выбран из О, NH, N-C1-6-алкила, S, SO, SO2, CHOR10 и CHCO2R10;
каждый Z независимо выбран из О, S, NH и N-C1-6-алкила, предпочтительно представляет собой О;
R1 и R3 каждый независимо выбран из C1-6-алкила, C1-6-гидроксиалкила, C1-6-алкоксиалкила, арила, C1-6-аралкила и R14DVKOC1-3-алкила-, где, по меньшей мере, один из R1 и R3 представляет собой R14DVKOC1-3-алкил-;
R5 представляет собой N(R6)LQR7;
R6 выбран из водорода, OH и C1-6-алкила, предпочтительно представляет собой C1-6-алкил;
R7 представляет собой дополнительную цепь аминокислот, водород, защитную группу, арил или гетероарил, любой из которых необязательно замещен галогеном, карбонилом, нитро, гидрокси, арилом, C1-5-алкилом, или R7 выбран из C1-6-алкила, C1-6-алкенила, C1-6-алкинила, C1-6-аралкила, C1-6-гетероаралкила, R8ZA-C1-8-алкила-, R11Z-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-ZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкил-Z-C1-8-алкила-, R8ZA-C1-8-алкил-ZAZ-C1-8-алкила-, гетероциклилMZAZ-C1-8-алкила-, (R8O)(R9O)P(=O)O-C1-8-алкила-, (R10)2N-C1-8-алкила-, (R10)3N+-C1-8-алкила-, гетероциклилM-, карбоциклилM-, R11SO2C1-8-алкила- и R11SO2NH или
R