Способ получения сульфата атазанавира
Иллюстрации
Показать всеИзобретение относится к способу получения ингибитора ВИЧ-протеазы сульфата атазанавира в виде кристаллов Формы А, который включает взаимодействие раствора свободного основания атазанавира в органическом растворителе, в котором сульфат атазанавира практически не растворяется, при температуре от 35°С до 55°С с первой порцией концентрированной серной кислоты в количестве, достаточном для реакции с менее, чем примерно 15 вес.% свободного основания атазанавира, добавление зародышей кристаллов Формы А сульфата атазанавира к реакционной смеси в качестве кристаллов сульфата атазанавира, добавление дополнительного количества концентрированной серной кислоты в несколько стадий, где кислота добавляется со все возрастающей скоростью, с образованием кристаллов сульфата атазанавира и сушку сульфата атазанавира с образованием кристаллов Формы А. Также предложен способ получения сульфата атазанавира в виде кристаллов Формы С. 6 н. и 14 з.п. ф-лы, 11 ил., 6 табл.
Реферат
Область техники
Данное изобретение относится к способу получения ингибитора ВИЧ-протеазы бисульфата атазанавира и его новых форм.
Уровень техники
Патент США № 5849911, Fässler et al. раскрывает ряд азапептидных ингибиторов ВИЧ-протеазы (который включает атазанавир), имеющих структуру:
где
R1 обозначает низший алкоксикарбонил,
R2 обозначает вторичный или третичный алкил или низший алкилтио - низший алкил,
R3 обозначает фенил, который является незамещенным или замещенным одним или несколькими низшими алкоксильными радикалами, или С4-С8-циклоалкил,
R4 обозначает фенил или циклогексил, каждый из которых замещен в 4-положении ненасыщенным гетероциклилом, который присоединен через атом углерода в кольце, имеет 5-8 атомов в кольце, содержит от 1 до 4 гетероатомов, выбранных из азота, кислорода, серы, сульфинила (-SO-) и сульфонила (-SO2-), и является незамещенным или замещенным низшим алкилом или фенил - низшим алкилом,
R5, независимо от R2, имеет одно из значений, указанных для R2, и
R6, независимо от R1, обозначает низший алкоксикарбонил или его соль, при условии, что имеется, по меньшей мере, одна солеобразующая группа, которая включает различные группы фармацевтически приемлемых солей присоединения к кислоте.
Предусмотрены несколько способов получения азапептидов, включая получение соединения, где R1 и R6 и R2 и R5 обозначают в каждом случае два идентичных радикала, при этом диаминосоединение формулы:
конденсируют с кислотой формулы:
или ее реакционноспособным производным, где R′1 и R′2 и R2 и R5 имеют значение, указанное для R1 и R6 и для R2 и R5 соответственно.
При получении указанным выше способом атазанавира диаминосоединение (а) формулы:
получают путем сочетания эпоксида:
с гидразинкарбаматом:
в присутствии изопропилового спирта с получением защищенного диамина:
который обрабатывают соляной кислотой в присутствии растворителя, такого как тетрагидрафуран, с получением диамина (а):
Диамин выделяют и используют на следующей стадии сочетания, когда он реагирует с кислотой (b):
или ее реакционноспособным эфиром, с применением агента сочетания, такого как O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N′,N′-тетраметилуронийтертафторборат) (TPTU).
Было установлено, что свободное основание диамина нестабильно и поэтому его нежелательно применять при получении свободного основания атазанавира.
В патенте США № 6087383, Singh et al. описана бисульфатная соль азапептидного ингибитора ВИЧ-протеазы, известного как атазанавир, который имеет формулу:
(называемый также бисульфатом атазанавира или сульфатом атазанавира).
В примере 3 Singh et al. описывают получение бисульфата атазанавира в виде кристаллов Типа-II, которые представляют собой гидратированную гигроскопичную и кристаллическую форму и в виде кристаллов Типа-I, которые представляют собой безводную/десольватированную кристаллическую форму.
Сущность изобретения
Согласно данному изобретению предусмотрены новые формы бисульфата атазанавира, которые включают Конфигурацию С и Форму Е3. Предпочтительной является Конфигурация С. Кроме того, в соответствии с данным изобретением предусмотрен способ получения бисульфата атазанавира в кристаллической Форме А (объемное лекарство) (которое называется кристаллами Типа-I в примере 3 патента США №6087383, Singh et al.). Кристаллическая Форма А, полученная по изобретению, имеет желательное однородное распределение частиц по размерам и практически постоянный средний размер частиц и применяется для превращения в Конфигурацию С, частично кристаллическое вещество, которое используют вместе с различными эксципиентами для приготовления лекарства.
Способ получения кристаллической Формы А бисульфата атазанавира по изобретению использует модифицированную методику кубической кристаллизации, когда серная кислота добавляется со все возрастающей скоростью в соответствии с кубическим уравнением (приведенным ниже), и включает стадии взаимодействия раствора свободного основания атазанавира в органическом растворителе (в котором бисульфатная соль атазанавира практически не растворяется) с первой порцией концентрированной серной кислоты в количестве, достаточном для реакции с менее, чем примерно 15%, предпочтительно, менее, чем примерно 12 вес.% свободного основания атазанавира, добавления кристаллических зародышей Формы А бисульфата атазанавира к реакционной смеси, добавления дополнительного количества концентрированной серной кислоты на многочисленных стадиях с возрастающей скоростью в соответствии с кубическим уравнением для образования кристаллов Формы А.
Кроме того, согласно данному изобретению предусмотрен способ получения формы атазанавира, которая получена из бисульфата атазанавира и включает бисульфат атазанавира и которая называется Конфигурацией С. Конфигурация С может быть получена путем суспендирования кристаллов Формы А в воде и сушки. Или же Конфигурация С может быть получена выдержкой кристаллов Формы А в условиях высокой относительной влажности, величина которой более примерно 95% RH (водяной пар), в течение, по меньшей мере, 24 ч. Конфигурация С может быть также получена путем мокрого гранулирования бисульфата атазанавира или комбинации бисульфата атазанавира и эксципиентов и сушки мокрого гранулята.
Согласно предпочтительному варианту кристаллы Формы А смешивают с эксципиентами, входящими в состав препарата, такими как один или несколько объемных агентов, например лактоза, одного или нескольких дезинтегрантов, таких как кросповидон, и подвергаются мокрому гранулированию с получением Конфигурации С в смеси с эксципиентами.
Далее, согласно данному изобретению предусмотрена новая форма бисульфата атазанавира, а именно, Форма Е3, которая является сильнокристаллической формой триэтанольного сольвата бисульфата атазанавира.
Форму Е3 получают суспендированием свободного основания атазанавира в этаноле, обработки суспензии концентрированной серной кислотой, нагревания, введения в полученный раствор зародышей мокрых (этанольных) кристаллов Е3, обработки смеси гептаном (или другим растворителем, таким как толуол или гексан), фильтрования и сушки.
Кроме того, в соответствии с данным изобретением предусмотрен способ получения кристаллов бисульфата атазанавира Формы А, который включает стадии получения триаминной соли формулы:
(предпочтительно, гидрохлоридная (3М) соль) и без выделения триаминной соли взаимодействие этой триаминной соли с активным сложным эфиром, предпочтительно, формулы:
в присутствии основания и органического растворителя с получением свободного основания атазанавира, которое, без выделения, превращается в бисульфат атазанавира путем модифицированной кубической кристаллизации, как описано в данной заявке.
Кроме того, в соответствии с данным изобретением предусмотрена новая композиция на основе бисульфата атазанавира, которая включает бисульфат атазанавира в виде кристаллической Формы А или Конфигурации С и фармацевтически приемлемый носитель для активного ингредиента. Фармацевтически приемлемый носитель может включать наполнители, связующее, дезинтегранты, смазывающие агенты и другие обычные эксципиенты.
Согласно изобретению различные формы бисульфата атазанавира могут быть охарактеризованы различными методами, которые хорошо известны специалистам. Эти формы могут быть охарактеризованы с использованием метода кристаллографии монокристалла, который основан на измерениях ячейки монокристалла Формы при фиксированной температуре определения. Подробное описание элементарных ячеек приведено в Stout and Jensen, X-Ray Structure Determination: A practical Guide, Macmillan Co., New York (1968), Chapter 3. Или же уникальное расположение атомов в пространстве внутри кристаллической решетки может быть охарактеризовано согласно наблюдаемым фракционным атомным координатам. Другим методом характеристики кристаллической структуры является порошковая кристаллография, когда экспериментальный или наблюдавшийся профиль дифракции сравнивается с имитированным профилем, характеризующим чистый порошковый материал, оба определяются при одной и той же температуре, но измерения нужной формы характеризуются как ряд величин 2Θ.
Могут быть использованы и другие средства, характеризующие форму, такие как ядерный магнитный резонанс в твердом состоянии (SSNMR), дифференциальная сканирующая калориметрия (DSC) и термогравиметрический анализ (TGA). Эти параметры также могут быть применены в комбинации для характеристики нужной формы.
Кристаллы Формы А могут быть охарактеризованы параметрами элементарной ячейки, равными:
Размеры ячейки:
а=9,86(5) Ǻ
b=29,245(6) Ǻ
с=8,327(2) Ǻ
α=93,56(2)°
β=114,77(3)°
γ=80,49(3)°
Пространственная группа 1
Молекулы/асимметричная единица 2,
при этом кристаллическая форма имеется при примерно 22°С.
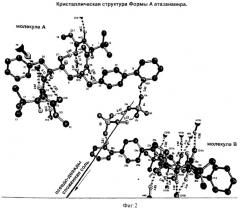
Форму А можно охарактеризовать фракционными атомными координатами, указанными в Таблице 3, и кристаллической структурой, приведенной на Фиг.2.
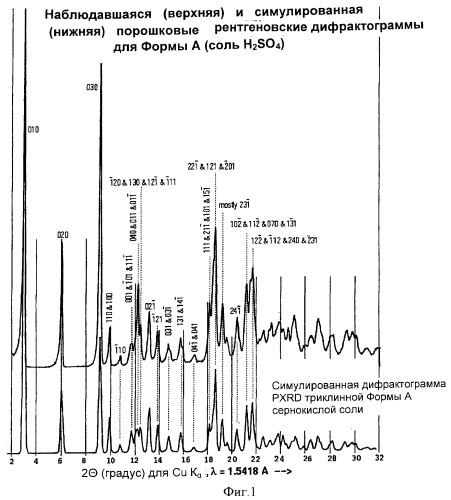
Форма А может быть охарактеризована имитированной и наблюдавшейся порошковой кристаллограммами, как показано на Фиг.1.
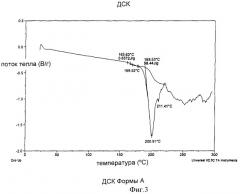
Форма А может быть также охарактеризована методом дифференциальной сканирующей калориметрии (DSC) с получением термограммы, имеющей эндотерму с началом пика при примерно 165,6°С, как показано на Фиг.3.
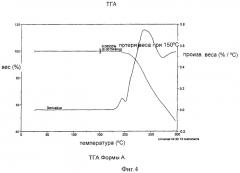
Форма А может быть охарактеризована кривой термогравиметрического анализа (TGA), которая показывает незначительную потерю веса при температуре около 100-150°С, как показано на Фиг.4.
Форма А может быть охарактеризована химическими сдвигами при проведении ЯМР в твердом состоянии (SSNMR), как показано в Таблице 4, и спектром, приведенным на Фиг.5.
Форма А может быть охарактеризована фракционными атомными координатами, перечисленными в Таблице 5.
Форма А соли может быть охарактеризована изотермами влага - сорбция с увеличением веса, равным около 0,1% в интервале RH от 25 до 75% при 25°С.
Согласно одному аспекту изобретения Конфигурация С может быть охарактеризована методом порошковой кристаллографии, как показано на Фиг.5.
Согласно другому аспекту изобретения Конфигурация С может быть охарактеризована термограммой дифференциальной сканирующей калориметрии, как показано на Фиг.7, на термограмме видна эндотерма в интервале от примерно 76,7°С до примерно 96,6°С и от примерно 156,8°С до примерно 165,9°С.
Согласно другому аспекту изобретения Конфигурация С может быть охарактеризована кривой термогравиметрического анализа; где видны потеря веса, равная примерно 2,4%, до примерно 125°С и потеря веса, равная примерно 4,4%, до примерно 190°С, как показано на Фиг.8.
Согласно данному изобретению Форма Е3 может быть охарактеризована кристаллографическими параметрами, как показано в Таблице 5, равными:
а=10,749(5) Ǻ
b=13,450(4) Ǻ
с=9,250(2) Ǻ
α=98,33(2)°
β=95,92(3)°
γ=102,83(3)°
Пространственная группа P1
Молекулы/асимметричная единица 1,
при этом кристаллическая форма наблюдается при примерно -23°С.
Согласно другому аспекту изобретения Форма Е3 может быть охарактеризована фракционными атомными координатами, перечисленными в Таблице 6.
Согласно еще одному аспекту изобретения Форма Е3 может быть охарактеризована симулированной и наблюдавшейся дифрактограммами, показанными на Фиг.9.
Согласно еще одному аспекту изобретения Форма Е3 может быть охарактеризована термограммой дифференциальной сканирующей калориметрии, на которой эндотерма обычно находится в пределах от примерно 89,4°С до примерно 96,6°С, как показано на Фиг.11.
Согласно еще одному аспекту изобретения Форма Е3 может быть охарактеризована кривой термогравиметрического анализа, на которой потеря веса, равная примерно 14,7%, наблюдается при примерно 150°С, как показано в Таблице 8.
Согласно еще одному аспекту изобретения Форма Е3 может быть охарактеризована структурой кристаллов, как показано на Фиг.10.
Краткое описание фигур
На Фиг.1 показаны рассчитанная (симулированная) (22°С) и наблюдаемая (экспериментально при комнатной температуре) порошковые дифрактограммы (Cu Kα λ=1,5418 Ǻ) Формы А.
На Фиг.2 показана кристаллическая структура Формы А.
Фиг.3 представляет термограмму Формы А, полученную методом дифференциальной сканирующей калориметрии (DSC).
На Фиг.4 показана кривая, полученная методом дифференциальной сканирующей калориметрии (DSC), для образца Формы А.
На Фиг.5 представленные данные 13С ЯМР в твердом состоянии для Формы А.
Фиг.6 представляет наблюдаемую (экспериментальную при комнатной температуре) дифрактограмму Конфигурации С, полученную методом порошковой кристаллографии (Cu Кα λ=1,5418 Ǻ).
На Фиг.7 показана термограмма Конфигурации С, полученная методом дифференциальной сканирующей калориметрии.
На Фиг.8 представлена кривая, полученная методом термогравиметрического анализа для Конфигурации С.
На Фиг.9 показана рассчитанная (симулированная) (22°С) и наблюдаемая (экспериментальная при комнатной температуре) дифрактограммы Формы Е3, полученные методом порошковой кристаллографии.
На Фиг.10 показана структура кристаллов Формы Е3 и
На Фиг.11 представлены термограмма Формы Е3, полученная методом дифференциальной сканирующей калориметрии, и кривая термогравиметрического анализа для Формы Е3.
Подробное описание изобретения
Данное изобретение предусматривает, по меньшей мере частично, формы бисульфата атазанавира, а именно, форму Е3 и Конфигурацию С в качестве новых материалов, в частности, в фармацевтически приемлемой форме. Термин «фармацевтически приемлемая», используемый в данном описании, относится к таким соединениям, материалам, композициям и/или дозированным формам, которые, с точки зрения здравого медицинского суждения, пригодны для контактирования с тканями человека и животных без проявления сильной токсичности, раздражения, аллергической реакции или других проблемных осложнений при разумном отношении польза/риск. Согласно некоторым предпочтительным вариантам кристаллические формы свободного основания и его соли получают в практически чистом виде. Термин «практически чистый», используемый в данной заявке, означает соединение, имеющее степень чистоты более примерно 90%, включая, например, примерно 91%, примерно 92%, примерно 93%, примерно 94%, примерно 95%, примерно 96%, примерно 97%, примерно 98%, примерно 99% и примерно 100%.
Используемый термин «полиморф» относится к кристаллическим формам, имеющим одинаковый химический состав, но различное пространственное расположение молекул, атомов и/или ионов, образующих кристалл.
Используемый термин «сольват» относится к кристаллической форме молекулы, атома и/или ионов, которая содержит молекулы растворителя или растворителей, введенных в кристаллическую структуру. Молекулы растворителя в сольвате могут располагаться упорядочение и/или неупорядоченно. Сольват может содержать стехиометрическое или нестехиометрическое количество молекул растворителя. Например, сольват с нестехиометрическим количеством молекул растворителя может образоваться при частичной потере растворителя из сольвата.
Образцы кристаллических форм могут быть получены с практически чистой фазовой гомогенностью, что указывает на наличие доминирующего количества одной кристаллической формы и, возможно, незначительных количеств одной или нескольких кристаллических форм. Наличие более, чем одной кристаллической формы в образце может быть определено такими методами, как порошковая рентгеновская кристаллография (PXRD) или ядерный магнитный резонанс в твердом состоянии (SSNMR). Например, наличие экстрапиков на дифрактограмме, экспериментально измеренной, по сравнению с симулированной дифрактограммой, может свидетельствовать о более, чем одной кристаллической форме в образце. Симулированная дифрактограмма может быть рассчитана, исходя из данных для монокристалла (см. Smith D.K., "A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns" Lawrance Laboratory, Livermore, California, UCRL-7196 (April 1963). Кристаллическая форма предпочтительно имеет чисто гомогенную фазу, о чем свидетельствует менее 10%, предпочтительно, менее 5% и, более вероятно, менее 2% общей площади пиков в экспериментальной дифрактограмме, появляющейся от экстрапиков, которые отсутствуют на симулированной дифрактограмме (PXRD). Более предпочтительна кристаллическая форма, имеющая практически чистую гомогенную фазу с менее 1% общей площади пиков на экспериментальной дифрактограмме (PXRD), возникающей от экстрапиков, которые отсутствуют на симулированной дифрактограмме (PXRD).
Методы получения кристаллических форм известны из уровня техники. Кристаллические формы могут быть получены разными методами, включая, например, кристаллизацию перекристаллизацию из подходящего растворителя, сублимацию, рост из расплава, превращение в твердое состояние из другой фазы, кристаллизацию из суперкритической жидкости, а также струйное распыление. Методы кристаллизации или перекристаллизации кристаллических форм из смеси растворителей включают, например, выпаривание растворителя, уменьшение температуры смеси растворителей, введение зародышей кристаллов в сверхнасыщенную смесь соединения и/или соли в растворителе, сушку смеси при замораживании и добавление антирастворителей (противорастворителей) к смеси растворителей.
Кристаллы лекарств, включая полиморфы, методы их получения и характеристика кристаллов лекарств обсуждаются в Solid-State Chemistry of Drugs, S.R.Byrn, R.R.Pfeiffer, and J.G. Stowell, 2nd Edition, SSCI, West Lafayette, Indiana (1999).
В случае метода кристаллизации с применением растворителя выбор растворителя или растворителей обычно зависит от одного или нескольких факторов, таких как растворимость соединения, методика кристаллизации, давление паров растворителя. Можно применять комбинацию растворителей, например, соединение может быть солюбилизировано в первом растворителе с получением раствора с последующим добавлением антирастворителя для уменьшения растворимости соединения в растворе и образования кристаллов. Противорастворитель представляет собой растворитель, в котором соединение плохо растворяется. Подходящие растворители для получения кристаллов включают полярные и неполярные растворители.
По одному способу получения кристаллов бисульфат атазанавира суспендируют и/или перемешивают в подходящем растворителе с получением суспензии, которая может быть нагрета для ускорения растворения. Термин «суспензия» здесь обозначает насыщенный раствор бисульфата атазанавира или его соли, который может также содержать дополнительное количество бисульфата атазанавира или его соли с получением гетерогенной смеси бисульфата атазанавира или его соли и растворителя при данной температуре. Подходящие растворители в этом случае включают, например, полярные апротонные растворители и полярные протонные растворители и смеси двух или более этих растворителей, как описано в данной заявке.
Зародыши кристаллов могут быть добавлены к любой смеси для ускорения кристаллизации. Специалисту ясно, что введение зародышей используется как средство регулирования роста конкретной кристаллической формы или как средство регулирования распределения частиц по размерам в кристаллическом продукте. Соответственно, расчет количества необходимых зародышей зависит от размера доступных зародышей и желаемого размера средней частицы продукта, как описано, например, в «Programmed cooling of batch crystallizers», J.W.Mullin and J.Nyvlt, Chemical Engineering Science (1971) 26: 369-377. Вообще зародыши небольшого размера необходимы для эффективного регулирования роста кристаллов в партии. Зародыши небольшого размера могут быть получены пропусканием через сито, измельчением или микронизацией кристаллов большего размера или путем микрокристаллизации растворов. Следует обращать внимание, чтобы измельчение или микронизация кристаллов не приводили к любому изменению кристаллизации из желаемой кристаллической формы (а именно, изменению с получением аморфной формы или другого полиморфа).
Охлажденную смесь можно отфильтровать под вакуумом, выделенные твердые вещества можно промыть подходящим растворителем, таким как растворитель холодной перекристаллизации, и высушить в токе азота с получением желательной кристаллической формы. Выделенный твердый продукт можно подвергнуть анализу при помощи подходящего метода спектроскопии или анализа, такого как SSNMR, DSC, PXRD или т.п., для подтверждения образования предпочтительной кристаллической формы продукта.
Полученная кристаллическая форма обычно получается в количестве более примерно 70 вес.% выделенного продукта, предпочтительно более 90% в расчете на вес бисульфата атазанавира, первоначально применявшегося в способе кристаллизации. Продукт может быть измельчен или пропущен через сито с отверстиями для разделения кусков продукта, если это необходимо.
Кристаллические формы могут быть получены непосредственно из реакционной среды на последней стадии получения бисульфата атазанавира. Это может быть достигнуто, например, при применении на последней стадии способа растворителя или смеси растворителей, из которых может кристаллизоваться бисульфат атазанавира. Иначе кристаллические формы могут быть получены путем перегонки или добавления растворителя. Подходящие растворители для этой цели включают любой из растворителей, описанных в данной заявке, включая протонные полярные растворители, такие как спирты, и апротонные полярные растворители, такие как кетоны.
В общем реакционная смесь может быть отфильтрована для удаления любых нежелательных примесей, неорганических солей и т.п. с последующей промывкой растворителем, использованным для реакции или кристаллизации. Полученный раствор можно концентрировать для удаления избытка растворителя или газообразных компонентов. Если применяется отгонка, то конечное количество собранного дистиллята может меняться в зависимости от параметров процесса, например размера сосуда, степени перемешивания и т.п. В общем, реакционный раствор может быть отогнан до примерно {фракция (1/10)} от первоначального раствора перед заменой растворителя. Можно по ходу отбирать образцы и анализировать для определения степени реакции и вес.% продукта согласно стандартным методикам. Если желательно, дополнительно может быть добавлен или удален реакционный растворитель для оптимизации концентрации. Предпочтительно, чтобы конечная концентрация была примерно 50 вес.%, в этот момент обычно получается суспензия.
Может быть предпочтительно добавлять растворители в реакционный сосуд без отгонки реакционной смеси. Предпочтительными растворителями для этой цели являются такие растворители, которые могут в конечном счете оседать в кристаллической решетке, как обсуждалось выше в связи с обменом растворителями. Хотя конечно концентрация может меняться в зависимости от желательной степени чистоты, выделения и т.п., конечная концентрация свободного основания I в растворе, предпочтительно, равна от примерно 4% до примерно 7%. Реакционную смесь можно перемешивать после добавления растворителя и одновременно нагревать. Например, можно перемешивать реакционную смесь в течение примерно 1 ч, нагревая ее до примерно 70°С. Горячая смесь фильтруется и промывается реакционным растворителем, добавленным растворителем или их смесью. Для начала кристаллизации в любой раствор для кристаллизации можно добавить зародыши кристаллов.
Различные формы, описанные здесь, можно отличить одну от другой при помощи различных методов анализа, известных специалисту в данной области. Такие методы включают, без ограничения, метод ядерного магнитного резонанса в твердом состоянии (SSNMR), метод порошковой рентгеновской кристаллографии (PXRD), метод дифференциальной сканирующей калориметрии (DSC) и/или метод термогравиметрического анализа (TGA).
Специалисту ясно, что рентгеновская дифрактограмма может быть получена с ошибкой измерения, которая зависит от применяемых условий измерения. В частности, общеизвестно, что интенсивности на дифрактограмме могут флуктуировать в зависимости от применяемых условий измерения и формы или морфологии кристалла. Далее, следует понимать, что относительные интенсивности могут также меняться в зависимости от условий эксперимента и, соответственно, точный порядок интенсивности не следует принимать во внимание. Дополнительно, ошибка в измерении угла дифракции в случае обычной рентгеновской дифрактограммы составляет обычно примерно 0,2% или менее, предпочтительно, около 0,1% (как указано ниже), и такая степень ошибки измерения должна приниматься во внимание как имеющая отношение к вышеупомянутым углам дифракции. Соответственно, следует иметь в виду, что кристаллические формы по изобретению не ограничены кристаллическими формами, которые обеспечивают получение рентгеновских дифрактограмм, полностью идентичных дифрактограммам, показанным на прилагаемых фигурах в данной заявке. Любые кристаллические формы, которые обеспечивают получение рентгеновских дифрактограмм, практически идентичных, показанным на прилагаемых фигурах, входят в объем данного изобретения. Способность оценить практическую идентичность рентгеновских дифрактограмм находится в компетенции специалиста в данной области.
Термин «Форма», используемый в отношении Формы А и Формы Е3, относится к гомогенной кристаллической структуре.
Термин «Конфигурация», используемый по отношению к Конфигурации С, относится к характерной рентгеновской дифрактограмме.
Термин «бисульфат атазанавира» относится к бисульфату атазанавира, а также к сульфату атазанавира.
При проведении способа получения кристаллов Формы А бисульфаты атазанавира по изобретению применяют модифицированный метод кубической кристаллизации, когда свободное основание атазанавира растворяют в органическом растворителе, в котором бисульфат атазанавира практически не растворяется, включающем ацетон, смесь ацетона и N-метилпирролидона, этанол, смесь этанола и ацетона и т.п., с получением раствора, в котором концентрация свободного основания атазанавира составляет от примерно 6,5 до примерно 9,7 вес.%, предпочтительно, от примерно 6,9 до примерно 8,1 вес.%.
Раствор свободного основания атазанавира нагревают при температуре в интервале от примерно 35°С до примерно 55°С, предпочтительно, от примерно 40°С до примерно 50°С и подвергают взаимодействию с таким количеством концентрированной серной кислоты (содержащей от примерно 95 до примерно 100% H2SO4), которое является достаточным для реакции с менее, чем 15%, предпочтительно, от примерно 5 до менее, чем примерно 12%, более предпочтительно, от примерно 8 до примерно 10 вес.% свободного основания атазанавира. Таким образом, исходный раствор свободного основания атазанавира вначале будет взаимодействовать с менее, чем 15%, предпочтительно, от примерно 5 до менее, чем примерно 12 вес.% применяемой серной кислоты. Во время реакции реакционную смесь поддерживают при температуре в пределах от примерно 35 до примерно 55°С, предпочтительно, от примерно 40°С до примерно 50°С.
Реакцию продолжают в течение промежутка времени, составляющего от примерно 12 до примерно 60 мин, предпочтительно, от примерно 15 до примерно 30 мин.
В реакционную смесь добавляют зародыши кристаллов Формы А бисульфата атазанавира в количестве, находящемся в пределах от примерно 0,1 до примерно 80%, предпочтительно, от примерно 3 до примерно 8% в расчете на вес свободного основания атазанавира, остающегося в реакционной смеси, поддерживая температуру реакционной смеси, равную от примерно 35 до примерно 55°С, предпочтительно, от примерно 40°С до примерно 50°С.
Реакцию продолжают до начала кристаллизации. Затем вводят серную кислоту в несколько стадий со все возрастающей скоростью согласно кубическому уравнению, описанному ниже, с получением бисульфата атазанавира, который в процессе сушки образует кристаллы Формы А.
Размер частиц кристаллов и морфология полученного бисульфата атазанавира зависят от скорости добавления серной кислоты, которая определяет скорость кристаллизации. Было установлено, что модифицированная методика «кубической» кристаллизации (кислота добавляется со все возрастающей скоростью согласно кубическому уравнению) обеспечивает образование сравнительно больших, более хорошо определенных кристаллов бисульфата атазанавира наряду с более узким интервалом размеров частиц и меньшим количеством мелких частиц, чем в случае кристаллизации при добавлении с постоянной скоростью. Было показано, что медленная начальная скорость подачи кислоты облегчает рост кристаллов без вторичного образования зародышей. Таким образом, поскольку площадь поверхности увеличивается с увеличением размера частиц, слой зародышей способен выдержать возрастающую скорость добавления кислоты без индуцирования вторичного образования зародышей. Медленная начальная скорость добавления дает кристаллам время стать больше, при этом возрастает их средний размер. Кубическая кристаллизация обеспечивает образование более плотного остатка на фильтре, что способствует удалению жидкости из осадка и промывке, а также образованию продукта, который легче поддается сушке с меньшим количеством твердых комков, чем при кристаллизации при постоянной скорости добавления.
Используемый метод кубической кристаллизации проводится при контролируемой температуре согласно публикации Mullin "Crystallization, 3rd Ed.", 1993, Butterworth - Heineman Pubs. и определяется следующим уравнением:
где Tmax = температура начала кристаллизации,
Tmin = температура окончания кристаллизации,
время = время прохождения кристаллизации,
времявсе = общее время кристаллизации.
Так как кристаллизация бисульфата атазанавира регулируется скоростью добавления серной кислоты, переменная величина температуры в уравнении (1) заменяется объемом кислоты. В этом уравнении переменная, обозначающая минимальный объем, отсутствует:
где Vвремя = объем серной кислоты, добавляемый во время прохождения кристаллизации,
Vвесь = общий объем кислоты, составляющий 90% от загрузки,
время = время прохождения кристаллизации,
времявсе = общее время кристаллизации.
Уравнение (2) называется «кубическим уравнением».
Регулируя скорость кристаллизации с помощью этого уравнения, можно регулировать в приемлемых пределах образование зародышей, так как в системе поддерживается постоянный низкий уровень перенасыщения.
Кристаллы Формы А идентифицируются методам рентгеновской порошковой кристаллографии и структурой кристаллов, как показано на Фиг.1 и 2, соответственно.
Кристаллическая Форма А бисульфата атазанавира или конфигурация С, а также Форма Е3, полученные, как описано выше, представляют собой конечный бисульфат атазанавира и могут применяться как лекарственные продукты для введения пациентам.
В соответствии со способом по изобретению Конфигурация С может быть получена путем действия воды на кристаллы Формы А с последующей сушкой.
Согласно другому способу по изобретению Конфигурация С может быть получена при выдержке кристаллов Формы А в условиях высокой относительной влажности, величина которой превышает примерно 95%, предпочтительно, она равна от примерно 95 до примерно 100% RH (водяной пар) в течение, по меньшей мере, 24 ч, предпочтительно, от примерно 24 до примерно 48 ч.
Согласно еще одному варианту изобретения Конфигурацию С получают мокрым гранулированием Формы А бисульфата атазанавира с получением гранул бисульфата атазанавира и затем гранулы высушивают.
При проведении процесса гранулирования бисульфат атазанавира гранулируют в воде и сушат при температуре в пределах от примерно 40°С до примерно 80°С, предпочтительно, в пределах от примерно 50°С до примерно 60°С. Стадию сушки предпочтительно проводить в течение примерно 2 ч, до примерно 20 ч, предпочтительно, в течение от примерно 8 ч до примерно 10 ч.
Конфигурация С может быть также получена мокрым гранулированием Формы А бисульфата атазанавира в присутствии обычных фармацевтических добавок, например, одного или нескольких объемных агентов, предпочтительно, лактозы, одного или нескольких дезинтегрантов, предпочтительно, кросповидона, и сушкой, как описано выше, с получением Конфигурации С в смеси с эксципиентами.
Именно Конфигурация С, Форма А или Форма Е3, предпочтительно Конфигурация С, используются в составе для введения при лечении болезней, вызванных вирусами, как описано ниже.
Конфигурация С характеризуется методом рентгеновской порошковой кристаллографии, как показано на Фиг.3.
Форму Е3 получают путем суспендирования свободного основания атазанавира в этаноле, обработки суспензии концентрированной серной кислотой при мольном отношении кислота: свободное основание в пределах от примерно 1:1 до примерно 1,1:1, нагревания полученного раствора при температуре от примерно 30°С до примерно 40°С, введения зародышей мокрых (этанол) кристаллов Е3 сульфата атазанавира, обработки смеси гептаном (или другим растворителем, таким как гексан или толуол), фильтрования и сушки формы Е3 бисульфата атазанавира (триэтанольный сольват).
Стадия зародышеобразования включает применение определенного количества зародышей для осуществления образования кристаллов Е3, например, мольное отношение зародышей Формы Е3 бисульфата атазанавира к свободному основанию составляет от примерно 0,02:1 до примерно 0,04:1.
Форму Е3 идентифицируют методом рентгеновской порошковой кристаллографии, что показано на Фиг.7, и структурой кристаллов, как показано на Фиг.6.
Согласно данному изобретению атазанавир в форме его свободного основания получают путем обработки раствора защищенной триаминной соли формулы
(где PG обозначает защитную группу, такую как трет.бутилоксикарбонил (Boc) или трифторацетил, предпочтительно Boc), кислотой, предпочтительно, соляной (когда применяют Boc) или основанием (когда применяют трифторацетил) в присутствии органического растворителя, такого как метиленхлорид, тетрагидрофуран или метанол, причем этот растворитель, предпочтительно, является метиленхлоридом, при температуре в пределах от примерно 25°С до примерно 50°С, предпочтительно, от примерно 30°С до примерно 40°С с образованием триаминной соли кислоты, предпочтительно, соляной, формулы:
и без выделения триаминной соли, взаимодействия этой соли с активным эфиром кислоты формулы:
предпочтительно, активным эфиром формулы:
в присутствии основания, такого как K2HPO4, диизопропилэтиламин, N-метилморфолин, карбонат натрия или карбонат калия, предпочтительно K2HPO4, в присутствии органического растворителя, такого как метиленхлорид, смесь этилацетата и бутилацетата, ацетонитрил или этилацетат, предпочтительно, метиленхлорид, при температуре в пределах от примерно 25°С до примерно 50°С, предпочтительно, от примерно 30°С до примерно 40°С с получением свободного основания атазанавира.
Защищенный исходный триамин получают по реакции эпоксида:
где PG обозначает,