Соединения и композиции в качестве миметиков тро
Иллюстрации
Показать все1. Изобретение относится к новым соединениям формулы I
где: n означает 0 или 1; Z означает N, CR8, где R8 означает Н, С1-С6алкил; R1, R2, R4 и R5 независимо означают Н, галоген, ОН, -XNR9R10, где X означает химическую связь, a R9 и R10 означают Н; R3 означает -NR11S(O)2R12, -NR11C(O)R12, -C(O)OR11, -NR11R12, S(O)2NR11R12 и -C(O)NR11R12, где R11 и R12 независимо означают H, С1-С6алкил; R6 означает галоген, С1-С6алкил; R7 означает фенил, замещенный 1 или 2 группами, независимо выбранными из фтора и С1-С6алкила, и его фармацевтически приемлемым солям. Соединения проявляют активность миметика ТРО, что позволяет получать из них лекарственные средства для повышения уровня тромбоцитов в крови животного. 4 н. и 4 з.п. ф-лы.
Реферат
В соответствии с 35 USС §119(е) данная заявка испрашивает более ранний приоритет, основанный на предварительной заявке США сер. номер 60/708438, зарегистрированной 15 августа 2005 г. Полное описание этой заявки включено в описание настоящей заявки в виде ссылки в полном объеме.
Область техники, к которой относится изобретение
В изобретении предлагается новый класс соединений, фармацевтические композиции, включающие такие соединения, и способы применения таких соединений для лечения или профилактики заболеваний или нарушений, ассоциированных с аномальной или разрегулированной активностью ТРО, прежде всего заболеваний или нарушений, которые сопровождаются тромбоцитопенией.
Предпосылки создания изобретения
Мегакариоциты представляют собой клетки костного мозга, которые отвечают за продуцирование тромбоцитов, циркулирующих в кровотоке. Тромбопоэтин (ТРО), кроветворный цитокин, поддерживает процесс клеточной пролиферации и дифференциации кроветворных стволовых клеток и необходим для регуляции мегакариоцитов.
Новые соединения по настоящему изобретению можно использовать в качестве миметиков ТРО для лечения заболеваний или состояний, которые предшествуют и/или приводят к снижению содержания в крови ТРО или тромбоцитов, которые включают, без ограничения перечисленным, лучевую терапию, химиотерапию, иммунотерапию, рак, вирусные инфекции и трансплантацию, такую как трансплантация костного мозга или стволовых клеток.
Краткое изложение сущности изобретения
Одним объектом настоящего изобретения являются соединения формулы I
в которых
n выбирают из 0, 1, 2 и 3,
Z выбирают из N и CR8, где R8 выбирают из группы, включающей водород, галоген, C1-С6алкил, галоген(C1-С6)алкил, причем любой алкил в составе R8 необязательно содержит группу метилен, которая заменена на атом или группу, выбранную из группы, включающей -S(O)0-2-, -C(O)-, -NR9- и -O-, причем R9 выбирают из группы, включающей водород и С1-6алкил,
R1, R2, R4 и R5 независимо выбирают из группы, включающей водород, галоген, гидрокси, циано, нитро, -XNR9R10, C1-С6алкил, галоген(C1-С6)алкил, C1-С6алкокси и галоген(C1-С6)алкокси, причем Х выбирают из группы, включающей химическую связь и C1-С6алкилен, а R9 и R10 независимо выбирают из группы, включающей водород и C1-С6алкил,
R3 выбирают из группы, включающей водород, C1-С6алкил, С3-С8гетероциклоалкил, С5-С10гетероарил, -OS(O)2R11, -NR11S(O)2R12, -NR11C(O)R12, -NR11C(O)NR11R12, -NR11C(O)C(O)OR12, -NR11C(O)OR12, -OC(O)NR11R12, -C(O)OR11, -C(O)R13, -NR11R12, -NR11R13, -S(O)2NR11R12 и -C(O)NR11R12, где R11 и R12 независисимо выбирают из группы, включающей водород, C1-С6алкил, галоген(C1-С6)алкил, C1-С6алкокси, циано(C1-С6)алкил, гидрокси(C1-С6)алкил и C1-С6алкил, замещенный группой -NR9R10, R13 означает С3-С8гетероциклоалкил, необязательно замещенный 1-3 группами C1-С6алкил, причем любой гетероциклоалкил или гетероарил R3 необязательно замещен 1-3 группами, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6алкокси, циано(C1-С6)алкил, гидрокси(C1-С6)алкил, галоген(C1-С6)алкил и галоген(C1-С6)алкокси,
R6 выбирают из группы, включающей галоген и C1-С6алкил, а
R7 выбирают из группы, включающей галоген, циано, C1-С6алкил, С2-С6алкенил, С2-С6алкинил, галоген(C1-С6)алкил, С6-С10арил, С5-С10гетероарил, С3-С8гетероциклоалкил и С3-С12циклоалкил, причем любой алкил, алкенил, алкинил, арил, гетероарил, циклоалкил или гетероциклоалкил необязательно замещен 1-5 группами, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6алкокси, циано(C1-С6)алкил, гидрокси(C1-С6)алкил, галоген(C1-С6)алкил и галоген(C1-С6)алкокси, -NR14R15, -XOR14, -S(O)2R14, С3-С12циклоалкил, С3-С8гетероциклоалкил, С6-С10арил и С3-С8гетероарил, где Х означает химическую связь или C1-С6алкилен, a R14 и R15 независимо выбирают из группы, включающей C1-С6алкил, циано(C1-С6)алкил, гидрокси(C1-С6)алкил, галоген(C1-С6)алкил и галоген(C1-С6)алкокси, причем любой арил, гетероарил, циклоалкил и гетероциклоалкил в составе R7 необязательно замещен 1-3 группами, независимо выбранными из группы, включающей галоген, C1-С6алкил, C1-С6алкокси, циано(C1-С6)алкил, гидрокси(C1-С6)алкил, галоген(C1-С6)алкил и галоген(C1-С6)алкокси, и N-оксиды, пролекарства, защищенные производные, индивидуальные изомеры и смеси изомеров, и фармацевтически приемлемые соли и сольваты (например, гидраты) указанных соединений.
Вторым объектом настоящего изобретения является фармацевтическая композиция, которая содержит соединение формулы I или его N-оксид, индивидуальные изомеры и смеси изомеров или фармацевтически приемлемую соль, в смеси с одним или более пригодными эксципиентами.
Третьим объектом настоящего изобретения является способ лечения заболевания или состояния у животного, при котором за счет повышения уровня тромбоцитов в крови можно снизить или уменьшить интенсивность патологического состояния и/или симптомов заболевания или состояния, заключающийся в том, что животному вводят терапевтически эффективное количество соединения формулы I или его N-оксида, индивидуальных изомеров и смеси изомеров или его фармацевтически приемлемой соли.
Четвертым объектом настоящего изобретения является применение соединения формулы I для получения лекарственного средства, предназначенного для лечения заболевания или состояния у животного, при котором пониженный уровень тромбоцитов способствует развитию патологического состояния и/или симптомов заболевания или состояния.
Пятым объектом настоящего изобретения является способ получения соединений формулы I и их N-оксидов, пролекарств, защищенных производных, индивидуальных изомеров и смеси изомеров или фармацевтически приемлемых солей указанных соединений.
Подробное описание изобретения
Определение терминов
"Алкил" в виде отдельной группы или структурного фрагмента в составе других групп, например галогеналкила и галогеналкокси, может содержать прямую или разветвленную цепь. С1-С4алкокси включает метокси, этокси и т.п. Галогеналкил включает трифторметил, пентафторэтил и т.п.
"Арил" означает моноциклическую или конденсированную бициклическую ароматическую систему, содержащую в цикле 6-10 атомов углерода. Например, арил может означать фенил или нафтил, предпочтительно фенил. "Арилен" означает двухвалентный радикал, образованный арильной группой.
"Гетероарил" имеет значения, указанные для арила, в котором один или более атомов в цикле являются гетероатомами. Например, гетероарил включает пиридил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, тиенил и т.п.
"Циклоалкил" означает насыщенную или частично ненасыщенную, моноциклическую, конденсированную бициклическую или мостиковую полициклическую систему, содержащую в цикле указанное число атомов. Например, С3-С10циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил и т.п.
"Гетероциклоалкил" означает циклоалкил, имеющий значения, указанные в описании заявки, при условии, что один или более атомов углерода в цикле заменен на фрагмент, выбранный из группы, включающей -O-, -N=, -NR-, -С(O)-, -S-, -S(O) - или -S(O)2-, где R означает водород, C1-С4алкил или N-защитную группу. Например, С3-С8гетероциклоалкил, используемый при описании соединений по изобретению, включает морфолино, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинилон, 1,4-диокса-8-азаспиро[4.5]дец-8-ил и т.п.
"Галоген" предпочтительно означает хлор или фтор, а также бром или иод.
"Тромбопоэтин (ТРО)" известен также в области техники как лиганд с-Mpl, лиганд mpl, мегапоэтин и фактор роста и развития мегакариоцитов.
"Лечение" означает способ ослабления или подавления заболевания и/или сопутствующих симптомов.
Описание предпочтительных вариантов осуществления изобретения
В настоящем изобретении предлагаются соединения, композиции и способы лечения тромбоцитопении. В общих чертах тромбоцитопению можно интерпретировать как любое снижение числа тромбоцитов в крови ниже нормального уровня, характерного для здорового индивидуума.
Одним вариантом соединений формулы I являются соединения формулы Ia
в которых
n выбирают из 0, 1, 2 и 3,
m выбирают из 0, 1, 2, 3, 4 и 5,
Z выбирают из N и CR8, где R8 выбирают из группы, включающей водород, галоген, C1-С6алкил, галоген(C1-С6)алкил, причем любой алкил в составе R8 необязательно содержит метиленовую группу, замененную на атом или группу, выбранную из группы, включающей -S(O)0-2-, -С(O)-, -NR9- и -O-, где R9 выбирают из группы, включающей водород и C1-С6алкил,
R1, R2, R4 и R5 независимо выбирают из группы, включающей водород, галоген, гидрокси, нитро, -XNR9R10, C1-С6алкил, галоген(C1-С6)алкил, где Х выбирают из группы, включающей химическую связь и C1-С6алкилен, а R9 и R10 независимо выбирают из группы, включающей водород и C1-С6алкил,
R3 выбирают из группы, включающей -XCOOR9, -XCONR9R10, -NR11S(O)2R12, -S(O)2NR11R12, -NR11C(O)R12, -NR11C(O)NR11R12, -NR11C(O)C(O)OR12 и -NR11C(O)OR12, где Х выбирают из группы, включающей химическую связь и C1-С6алкилен, а R9 и R10 независимо выбирают из группы, включающей водород и C1-С6алкил,
R6 выбирают из группы, включающей водород и C1-С6алкил, и
R20 выбирают из группы, включающей водород и C1-С6алкил.
В другом варинте R6 означает фтор, а R20 выбирают из группы, включающей фтор, метил и бутил.
В еще одном варианте R3 выбирают из группы, включающей карбоксил, аминокарбонил, аминосульфонил, метилсульфониламино и амино, а R4 выбирают из группы, включающей водород, гидроксил, нитро и амино.
Предпочтительные соединения по изобретению выбирают из группы, включающей 4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]бензойную кислоту, 4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]бензамид, 4-[7-фтор-6-(4-фтор-3-метилфенил)-1Н-индол-2-ил]бензойную кислоту, 4-[7-фтор-6-(4-фтор-3-метилфенил)-1Н-индол-2-ил]бензолсульфонамид, 4-[6-(4-бутилфенил)-3-этил-7-фтор-1Н-индол-2-ил]-2-гидроксибензойную кислоту, 4-[6-(4-бутилфенил)-7-фтор-3-изопропил-1Н-индол-2-ил]-2-гидроксибензойную кислоту, 4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]-2-гидроксибензойную кислоту, 4-[6-(4-бутилфенил)-7-фтор-3-метил-1Н-индол-2-у1]-2-гидроксибензойную кислоту, 4-[6-(4-бутилфенил)-1Н-бензимидазол-2-ил]бензойную кислоту, 4-[6-(4-бутилфенил)-1Н-бензимидазол-2-ил]-2-гидроксибензойную кислоту, N-{4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]фенил}метансульфонамид, N-{4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]фенил}ацетамид, N-{4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]-2-хлорфенил}ацетамид, 4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]-2-хлорфениламин и 2-амино-4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]бензойную кислоту.
Другие предпочтительные соединения по изобретению подробно описаны в разделе Примеры и в таблицах.
Фармакология и промышленная применимость
В широком смысле тромбоцитопению можно интерпретировать как любое снижение числа тромбоцитов в крови ниже нормального уровня, характерного для здорового индивидуума. Установлено, что тромбоцитопения развивается под воздействием множества факторов, включающих, без ограничения перечисленным, лучевую терапию, химиотерапию, иммунотерапию, иммунную тромбоцитопеническую пурпуру, миелодиспластический синдром (MDS), апластическую анемию, острый миелоидный лейкоз (AML), хронический миелолейкоз (CML), вирусное инфекционное заболевание печени (включающее, без ограничения перечисленным, ВИЧ, гепатит С, парвовирус), удаление костного мозга, трансплантацию костного мозга, трансплантацию стволовых клеток, трансплантацию стволовых клеток периферической крови, дефект клеток-предшественников, полиморфизм стволовых клеток и клеток-предшественников, дефекты ТРО, нейтропению, мобилизацию, пролиферацию, активацию или дифференциацию дендритных клеток.
ТРО имеет большое терапевтическое значение при лечении пациентов с пониженным уровнем тромбоцитов. Например, от тромбоцитопении страдают пациенты, больные различными видами рака, поскольку миелодепрессантная химиотерапия или лучевая терапия, которые увеличивают риск кровотечения, часто ограничивают дозу химиотерапевтических агентов, которые необходимы для интенсивной химиотерапии, или при трансплантации костного мозга.
Соединения по настоящему изобретению можно использовать при лечении тромбоцитопении независимо от фактора или факторов, вызывающих заболевание. Соединения по настоящему изобретению можно также использовать при лечении тромбоцитопении, если фактор или факторы, вызывающие заболевание, неизвестны или еще неидентифицированы. Соединения по настоящему изобретению можно использовать в любых случаях, когда возникает опасность кровопотери или снижения числа тромбоцитов в крови, включающих, без ограничения перечисленным, хирургическую трансплантацию, хирургическое вмешательство, анестезию перед родами и операцией на кишечнике.
Поскольку тромбоциты необходимы для свертывания крови и пациент с низким уровнем тромбоцитов рискует погибнуть от внезапного кровотечения, миметики ТРО по изобретению могут найти применение при лечении различных гематологичеких нарушений, например заболеваний, главным образом, вызванных дефектами тромбоцитов.
В соответствии с вышеизложенным, настоящее изобретение также относится к способу профилактики или лечения любых заболеваний или нарушений, описанных выше, у субъекта, который нуждается в таком лечении, который заключается в том, что указанному субъекту вводят терапевтически эффективное количество (см. раздел "Способы введения и фармацевтические композиции") соединения формулы I или его фармацевтически приемлемой соли. При любом из указанных способов применения требуемая доза изменяется в зависимости от способа введения, конкретного состояния, подлежащего лечению, и требуемого результата.
Способы введения и фармацевтические композиции
В общем случае, соединения по изобретению вводят в терапевтически эффективных количествах любыми обычными и приемлемыми способами, отдельно или в комбинации с одним или более терапевтическими агентами. Терапевтически эффективное количество может изменяться в широком интервале в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности используемого соединения и других факторов. В общем случае удовлетворительные результаты достигаются при системном введении суточных доз от приблизительно 0,03 до 2,5 мг/кг массы тела. Для более крупного млекопитающего, например человека, назначаемая суточная доза составляет от приблизительно 0,5 мг до приблизительно 100 мг, которую можно вводить стандартными способами, например раздельными дозами до четырех раз в сутки или в виде формы с замедленным высвобождением. Пригодные стандартные лекарственные формы для перорального введения включают от приблизительно 1 до 50 мг активного ингредиента.
Соединения по изобретению можно вводить в виде фармацевтических композиций любым приемлемым способом, прежде всего энтеральным, например пероральным способом, например, в форме таблеток или капсул, или парентеральным способом, например, в форме инъекционных растворов или суспензий, местным способом, например, в форме лосьонов, гелей, мазей или кремов, или назальным способом, или в форме суппозиториев. Фармацевтические композиции, включающие соединение по настоящему изобретению в свободной форме или в форме фармацевтически приемлемой соли в смеси по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем, получают обычным способом с использованием процессов смешивания, гранулирования или нанесения покрытия. Например, пероральные композиции могут представлять собой таблетки или желатиновые капсулы, включающие активный ингредиент в смеси с а) разбавителями, например лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином, б) замасливателями, например диоксидом кремния, тальком, стеариновой кислотой, ее кальциевой или магниевой солью и/или полиэтиленгликолем, а таблетки могут также включать в) связующие агенты, например силикат магния/алюминия, крахмальную пасту, желатин, трагакант, метилцеллюлозу, Na-соль карбоксиметилцеллюлозы и/или поливинилпирролидон, и при необходимости г) дезинтегрирующие агенты, например крахмалы, агар, альгиновую кислоту или ее натриевую соль, или шипучие смеси, и/или д) абсорбенты, красители, ароматизаторы и подсластители. Инъекционные композиции могут представлять собой водные изотонические растворы или суспензии, а суппозитории получают из жировых эмульсий или суспензий. Композиции можно стерилизовать, и/или они могут содержать адъюванты, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, способствующие растворению агенты, соли для регуляции осмотического давления и/или буферные вещества. Дополнительно они могут также содержать другие терапевтически ценные соединения. Пригодные составы для чрескожного применения включают эффективное количество соединения по настоящему изобретению в смеси с носителем. Носитель может включать абсорбируемые фармакологически приемлемые растворители для обеспечения проницаемости через кожу пациента. Например, системы для чрескожного введения представляют собой повязку, включающую основу, резервуар, содержащий соединение необязательно в смеси с носителем, необязательно мембрану, регулирующую доставку соединения к поверхности кожи с заданной скоростью в течение продолжительного времени, и средство, обеспечивающее удерживание устройства на поверхности кожи. Можно также использовать матричные чрескожные составы. Пригодные составы для местного нанесения, например на кожу и в глаза, предпочтительно представляют собой водные растворы, мази, кремы или гели, известные в данной области. Такие составы могут содержать солюбилизирующие, стабилизирующие, тонизирующие агенты, буферные вещества и консерванты.
Соединения по изобретению можно вводить в терапевтически эффективных количествах в комбинации с одним или более терапевтическими агентами (фармацевтические комбинации). Миметики ТРО по настоящему изобретению можно также использовать для действия на клетки с целью повышения жизнеспособности или пролиферации клеток в сочетании с другими агентами, оказывающими на клетки аналогичное действие. Такие агенты включают, без ограничения перечисленным, G-CSF, GM-CSF, ТРО, M-CSF, ЕРО, Gro-beta, IL-11, SCF, лиганд FLT3, LIF, IL-3, IL-6, IL-1, прогенипоэтин, NESP, SD-01, или IL-5, или биологически активное производное любого из вышеуказанных агентов.
Установлено, что дендритные клетки человека экспрессируют рецептор ТРО и ТРО является эффективным стимулятором дендритных клеток. Миметики ТРО по настоящему изобретению можно также использовать в качестве адъювантов в составе вакцин благодаря повышению активности и подвижности дендритных клеток. Фармацевтически активные соединения по настоящему изобретению можно использовать в качестве иммунологического адъюванта в комбинации с вакциной и/или иммуномодулятором при пероральной, чрескожной или подкожной доставке благодаря повышению активности и подвижности дендритных клеток.
Установлено, что ТРО обладает широким спектром действия, который включает антиапоптотическое/повышающее жизнеспособность действие на мегакариоциты, тромбоциты и стволовые клетки и пролиферативное действие на стволовые клетки и мегакариотические клетки. Следовательно, ТРО и/или миметики ТРО по изобретению эффективно повышают уровень стволовых клеток и клеток-предшественников и при использовании ТРО в сочетании с другими цитокинами, индуцирующими дифференциацию, оказывают синергетическое действие.
Если соединения по изобретения вводят в сочетании с другими способами лечения, дозы совместно вводимых соединений изменяются в зависимости от типа совместно вводимого лекарственного средства, конкретного лекарственного средства, состояния, подлежащего лечению, и т.п.
Изобретение также относится к фармацевтическим комбинациям, например набору, включающему а) первый агент, который представляет собой соединение по изобретению, указанное выше, в свободной форме или в форме фармацевтически приемлемой соли, и б) по меньшей мере один второй агент. Набор включает инструкции по введению лекарственных средств.
Термины "совместное введение" или "комбинированное введение" или аналогичные термины, используемые в описании, означают введение выбранных терапевтических агентов одному пациенту, а также курс лечения, согласно которому агенты необязательно вводятся одновременно или одним и тем же способом.
Термин "фармацевтическая комбинация", используемый в описании заявки, означает продукт, который образуется при смешивании или комбинировании более одного активного ингредиента и включает фиксированные и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например соединение формулы I и сопутствующий агент, вводятся пациенту одновременно в форме одного продукта или дозы. Термин "нефиксированная комбинация" означает, что активные ингредиенты, например соединение формулы I и сопутствующий агент, вводятся пациенту раздельно, одновременно, совместно или последовательно, без ограничений по времени, причем такое введение обеспечивает достижение терапевтически эффективных уровней двух соединений в организме пациента. Последнее относится также к комбинированному лечению, например к введению трех или более активных ингредиентов.
Способы получения соединений по изобретению
Настоящее изобретение включает также способы получения соединений по изобретению. В описанных реакциях необходимо защищать реакционно-способные функциональные группы, например гидрокси, амино, имино, тио или карбоксигруппы, если они должны присутствовать в конечном продукте. Введение защитных групп позволяет исключить участие таких функциональных групп в проводимых реакциях. Стандартные защитные группы используются в соответствии с принятой практикой, например см. T.W.Greene и Р.G.M.Wuts, "Protective Groups in Organic Chemistry", John Wiley and Sons (1991).
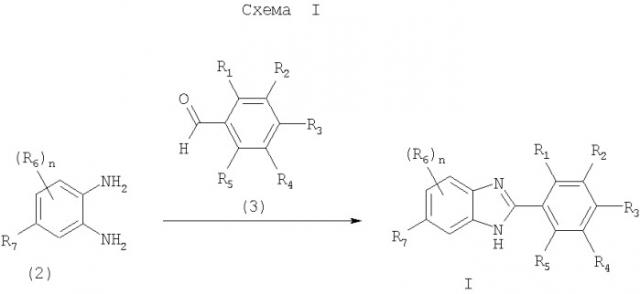
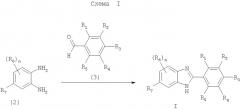
Соединения формулы I, в которых Z означает N, получают способом, показанным на схеме I.
На схеме I n и R1-R7 имеют значения, указанные в кратком описании изобретения. Соединение формулы I синтезируют по реакции соединения формулы 2 с соединением формулы 3 в присутствии гидросульфита натрия в пригодном растворителе (например, DMA и т.п.). Реакцию проводят при температуре от приблизительно 100°С до приблизительно 180°С в течение от приблизительно 24 ч до завершения реакции.
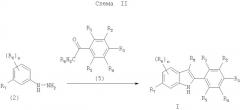
Примеры синтеза соединения формулы I, в которых Z означает CR8, получают по методике, показанной на схеме II.
На схеме II n и R1-R8 имеют значения, указанные в кратком описании изобретения. Соединение формулы I синтезируют по реакции соединения формулы 2 с соединением формулы 5 в присутствии пригодной кислоты Льюиса (например, хлорида цинка и т.п.) или протонной кислоты (например, HCl и т.п.) в пригодном растворителе (например, уксусной кислоте, этаноле и т.п.). Реакцию проводят при температуре от приблизительно 80°С до приблизительно 120°С в течение до приблизительно 72 ч, т.е. до завершения реакции.
Примеры синтеза соединения формулы I приводятся в разделе Примеры.
Дополнительные способы получения соединений по изобретению
Соединение по изобретению можно получить в виде фармацевтически приемлемой кислотно-аддитивной соли по реакции свободного основания соединения с фармацевтически приемлемой неорганической или органической кислотой. В другом варианте фармацевтически приемлемую основно-аддитивную соль соединения по изобретению можно получить по реакции свободной кислоты соединения с фармацевтически приемлемым неорганическим или органическим основанием.
В другом варианте соли соединений по изобретению можно получить с использованием солей исходных материалов или промежуточных соединений.
Свободные кислоты или свободные основания соединений по изобретению получают из соответствующих основно-аддитивной соли или кислотно-аддитивной соли соответственно. Например, соединение по изобретению в форме кислотно-аддитивной соли можно превратить в соответствующее свободное основание при обработке соответствующим основанием (например, раствором гидроксида аммония, гидроксида натрия и т.п.). Соединение по изобретению в форме основно-аддитивной соли можно превратить в соответствующую свободную кислоту при обработке соответствующей кислотой (например, соляной кислотой и т.п.).
Соединения по изобретению в неокисленной форме можно получить из N-оксидов соединений по изобретению при обработке восстанавливающим агентом (например, серой, диоксидом серы, трифенилфосфином, боргидридом лития, боргидридом натрия, трихлоридом фосфора, трибромидом фосфора или т.п.) в пригодном инертном органическом растворителе (например, ацетонитриле, этаноле, водном диоксане или т.п.) при температуре от 0°С до 80°С.
Пролекарства соединений по изобретению получают известными методами (например, см. Saulnier и др., Bioorganic and Medicinal Chemistry Letters, 4, с.1985 (1994)). Например, соответствующие пролекарства можно получить при взаимодействии немодифицированного соединения по изобретению с пригодным карбамилирующим агентом (например, 1,1-ацилоксиалкилкарбанохлоридом, пара-нитрофенилкарбонатом или т.п.).
Соединения по изобретению, содержащие защитные группы, можно получить известными методами. Подробное описание методик введения защитных групп и их удаления можно найти в монографии T.W. Greene, "Protecting Groups in Organic Chemistry", 3 изд., John Wiley и Sons, Inc., (1999).
Соединения по изобретению можно получить стандартным способом или способом по изобретению, в виде сольватов (например, гидратов). Гидраты соединений по настоящему изобретению получают стандартным способом при перекристаллизации из смеси вода/органический растворитель, такой как диоксан, тетрагидрофуран или метанол.
Соединения по изобретению можно получить в виде индивидуальных стереоизомеров при взаимодействии рацемической смеси соединения с оптически активным разделяющим агентом с образованием пары диастереоизомерных соединений, разделении диастереомеров и выделении оптически чистых энантиомеров. В то время как разделение энантиомеров проводят с использованием ковалентных диастереомерных производных соединений по изобретению, предпочтительными являются диссоциирующие комплексы (например, кристаллические диастереомерные соли). Диастереомеры обладают разными физическими свойствами (например, температурой плавления, температурой кипения, растворимостью, реакционной способностью и т.п.), и благодаря этому их можно разделить простыми методами. Диастереомеры разделяют хроматографией или предпочтительно по методике, основанной на различии в растворимости. Затем оптически чистый энантиомер выделяют с использованием разделяющего агента любым способом, исключающим рацемизацию. Более подробное описание методик, используемых для выделения стереоизомеров соединений из рацемических смесей, можно найти в монографии Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates and Resolutions", John Wiley And Sons, Inc. (1981).
В итоге, соединения формулы I можно получить способом, который заключается в том, что:
(а) проводят реакции, как показано на схемах I или II, и
(б) необязательно превращают соединение по изобретению в фармацевтически приемлемую соль,
(в) необязательно превращают соль соединения по изобретению в несолевую (свободную) форму,
(г) необязательно превращают неокисленную форму соединения по изобретению в фармацевтически приемлемый N-оксид,
д) необязательно превращают N-оксид соединения по изобретению в его неокисленную форму,
(е) необязательно выделяют индивидуальный изомер соединения по изобретению из смеси изомеров,
(ж) необязательно превращают немодифицированное соединение по изобретению в фармацевтически приемлемое пролекарство, и
(з) необязательно превращают пролекарство соединения по изобретению в немодифицированную форму.
Получение исходных материалов подробно не описано, поскольку соединения известны, или их можно получить известными методами, или, как описано ниже в разделе Примеры.
Для специалиста в данной области представляется очевидным, что вышеуказанные синтезы и модификации приводятся для иллюстрации методов получения соединений по настоящему изобретению и что их можно получить с использованием других известных методов.
Примеры
Настоящее изобретение иллюстрируется следующими примерами получения соединений формулы I, не ограничивающими его объем.
Пример 1
4-[6-(4-Бутилфенил)-7-фтор-1Н-индол-2-ил]бензойная кислота
Стадия 1
Метиловый эфир 4-(6-хлор-7-фтор-1Н-индол-2-ил)бензойной кислоты
К гидрохлориду (3-хлор-2-фторфенил)гидразина (фирма Apollo Scientific, Ltd., 221 мг, 1,12 ммоль) и метиловому эфиру 4-ацетилбензойной кислоты (200 мг, 1,12 ммоль) добавляли безводный ZnCl2 (382 мг, 2,81 ммоль) и уксусную кислоту (10 мл), реакционную смесь нагревали при 105°С в течение 48 ч. Затем смесь охлаждали до комнатной температуры, разбавляли этилацетатом, последовательно промывали Н2О (5×) и насыщенным раствором NaCl, органический слой сушили над Na2SO4, фильтровали и фильтрат концентрировалии. Неочищенный продукт очищали препаративной ОФ-ЖХ/МС, при этом получали метиловый эфир 4-(6-хлор-7-фтор-1Н-индол-2-ил)бензойной кислоты в виде твердого вещества грязно-белого цвета. МС (ES): m/z 304,0 (М+Н+).
Стадии 2 и 3
В смесь метилового эфира 4-(6-хлор-7-фтор-1Н-индол-2-ил)бензойной кислоты (37 мг, 0,122 ммоль, стадия 1), 4-н-бутилфенилбороновой кислоты (43 мг, 0,244 ммоль) и карбоната цезия (159 мг, 0,487 ммоль) в диоксане (4 мл) добавляли катализатор на основе палладия (CombiPhos-Pd6, фирма Combiphos Catalysts Inc., 3 мг), смесь продували азотом в течение 5 мин и нагревали в закрытой пробирке при 120°С в течение 7 ч. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и последовательно промывали 1н. HCl, Н2О и насыщенным раствором NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали. В полученный остаток добавляли этанол/Н2О (2 мл/1 мл), LiOH (26 мг, 0,609 ммоль) и смесь нагревали при 50°С в течение 1 ч. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и промывали 1н. HCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали препаративной ОФ-ЖХ/МС, при этом получали 4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]бензойную кислоту в виде твердого вещества белого цвета. МС (ES): m/z 388,2 (М+Н+).
1Н-ЯМР (400 МГц, ацетон-d6): δ 11,13 (ушир. s, 1H), 8,10-8,05 (m, 4H), 7,59 (d, 2H), 7,52 (d, 1H), 7,32 (d, 2H), 7,18-7,12 (m, 2H), 2,71 (t, 2H), 1,70-1,63 (m, 2H), 1,49-1,40 (m, 2H), 0,98 (t, 3H).
Пример 2
4-[6-(4-Бутилфенил)-7-фтор-1Н-индол-2-ил]бензамид
Стадия 1
Гидрохлорид (4'-бутил-2-фторбифенил-3 -ил)гидразина
Смесь диоксана (16 мл) и N-метилпирролидинона (8 мл) продували азотом в течение 15 мин для удаления следов кислорода. 3-Хлор-2-фторанилин (3 г, 20,6 ммоль) помещали в круглодонную колбу объемом 250 мл, снабженную насадкой с резьбой, позволяющей закрывать колбу через трехходовой кран, а затем добавляли 4-бутилфенилбороновую кислоту (5,5 г, 30,9 ммоль), фторид цезия (7,82 г, 51,5 ммоль) и бис(три-трет-бутилфосфино)палладий (527 мг, 1,03 ммоль). Колбу вакуумировали, заполняли азотом и закрывали. Затем колбу помещали на масляную баню, нагретую до 130°С, и перемешивали в течение 4 ч. Реакционную смесь охлаждали, фильтровали через слой целита, который промывали EtOAc. Растворители удаляли на роторном испарителе, неочищенную реакционную смесь разбавляли водой и экстрагировали EtOAc. Фазы разделяли, органический слой сушили над MgSO4, фильтровали и концентрировали. Полученное масло разбавляли диэтиловым эфиром и добавляли избыток 4 М раствора HCl в диоксане. Полученное твердое вещество отделяли, промывали диэтиловым эфиром и высушивали, при этом получали гидрохлорид 4'-бутил-2-фторбифенил-3-иламина в виде твердого вещества белого цвета. ЖХ/МС: рассч. для C16H19FN 244,3, найд. 244,2 [М+Н]+. В гидрохлорид 4'-бутил-2-фторбифенил-3-иламина (5,4 г, 0,019 моль) в конц. HCl (50 мл) при 0°С в течение 10 мин добавляли по каплям раствор нитрита натрия (1,3 г, 0,019 моль) в Н2О (20 мл). Полученный раствор перемешивали при 0°С в течение 1 ч, а затем при 0°С добавляли по каплям раствор хлорида олова (II) (13,0 г, 0,058 моль) в конц. HCl (14 мл). Смесь перемешивали в течение 15 мин, а затем фильтровали. Полученное твердое вещество промывали холодным насыщенным раствором NaCl, а затем суспендировали в 50% растворе NaOH. Полученную суспензию разбавляли Н2О и экстрагировали Et2O. Органическую фазу сушили над MgSO4, фильтровали и концентрировали. Полученный продукт растворяли в 100 мл Et2O и охлаждали до 0°С. В указанный раствор добавляли по каплям 4,0 М раствор HCl в диоксане (15 мл) и полученный осадок отделяли, при этом получали 4,58 г (81%) требуемого гидрохлорида гидразина. ЖХ/МС: рассч. для C16H20FN2 259,3, найд. 259,2.
Стадия 2
В гидрохлорид (4'-бутил-2-фторбифенил-3-ил)гидразина (90 мг, 0,306 ммоль, стадия 1) и 4-ацетилбензамид (Sigman М.Е. и др., J. Am. Chem. Soc., 110, 4297 (1958), 50 мг, 0,306 ммоль) добавляли безводный ZnCl2 (418 мг, 3,06 ммоля) и уксусную кислоту (4 мл), реакционную смесь нагревали при 105°С в течение 48 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и последовательно промывали Н2О (5×), 1н. HCl и насыщенным раствором NaCl. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали препаративной ОФ-ЖХ/МС, при этом получали 4-[6-(4-бутилфенил)-7-фтор-1Н-индол-2-ил]бензамид в виде твердого вещества бежевого цвета. МС (ES): m/z 387,2 (М+Н+).
1Н-ЯМР (400 МГц, ацетон-d6): δ 11,11 (ушир. s, 1Н), 8,08-8,01 (m, 4H), 7,59-7,43 (m, 4H), 7,38-7,29 (m, 2H), 7,18-7,12 (m, 2H), 6,65 (ушир., 1Н), 2,74-2,63 (m, 2H), 1,76-1,64 (m, 2H), 1,50-1,38 (m, 2H), 1,04-0,93 (m, 3H).
Пример 3
4-[7-Фтор-6-(4-фтор-3-метилфенил)-1Н-индол-2-ил]бензойная кислота
4-[7-Фтор-6-(4-фтор-3-метилфенил)-1Н-индол-2-ил]бензойную кислоту получали в виде твердого вещества белого цвета из соответствующих исходных материалов по методикам, описанным в примере 2. МС (ES): m/z 364,1 (М+Н+).
1Н ЯМР (400 МГц, CD3OD): δ 8,09 (d, 2H), 7,98 (d, 2H), 7,52-7,42 (m, 3H), 7,18-7,05 (m, 3H), 2,32 (s, 3H).
Пример 4
4-[7-Фтор-6-(4-фтор-3-метилфенил)-1Н-индол-2-ил]бензолсульфонамид
4-[7-Фтор-6-(4-фтор-3-метилфенил)-1Н-индол-2-ил]бензолсульфонамид получали в виде твердого вещества бежевого цвета из соответствующих исходных материалов по методикам, описанным в примере 2. МС (ES): m/z 399,1 (М+Н+).
1Н-ЯМР (400