Олигопептид, обладающий активностью трансформирующего фактора роста (tgf- ) и онкостатина m (osm) по отношению к пролиферации фибробластов
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению биологически активных веществ пептидной природы, обладающих активностью факторов роста по отношению к пролиферации фибробластов, и может быть использовано в медицине. Путем in silico конструирования получают олигопептид общей формулы: А-Х1-Х2-Х3-Х4-Х5-В, где А представляет собой F; X1 представляет собой Е, или Q, или S; Х2 представляет собой N, или Q, или А, или G; Х3 представляет собой К, или R, или Т; Х4 представляет собой К, или Е, или отсутствует, Х5 представляет собой К, или L, или отсутствует и В представляет собой ОМе - метил. Изобретение позволяет получить олигопептид, обладающий активностью трансформирующего фактора роста (TGF-β) и онкостатина М (OSM) по отношению к пролиферации фибробластов, и расширить арсенал эффективных терапевтических средств с ранозаживляющим действием, участвующих в закрытии ран при воспалении и развитии рубцов. 4 ил.
Реферат
Настоящее изобретение относится к области биоорганической химии, биохимии и медицины, а именно к биологически активным веществам пептидной природы, обладающим активностью факторов роста по отношению к пролиферации фибробластов, и может найти применение в медицине, ветеринарии, а также в экспериментальной биохимии.
Фибробласты - основная специализированная, широко распространенная в соединительной ткани клетка, которая синтезирует и секретирует основные компоненты межклеточного вещества - полисахариды, предшественники коллагена, из которых формируются коллагеновые, эластические и ретикулярные волокна. Как основная клеточная форма соединительной ткани животных и человека фибробласты образуют волокна и основное вещество этой ткани, участвуют в закрытии ран при воспалении и развитии рубцов.
Основными факторами роста, которые участвуют в пролиферации фибробластов и индуцируют синтез белков внеклеточного матрикса, являются трансформирующий фактор роста TGF-β и онкостатин М (OSM).
TGF-β - белок из семейства трансформирующих факторов роста, стимулирующий пролиферацию фибробластов, индуцирующий развитие эпителия и содействующий ангиогенезу. В исследованиях [1] показано, что даже кратковременное (30 мин) присутствие TGF-β в культуре клеток вызывает долгосрочную стимуляцию пролиферации клеток в направлении фибробластов. Это говорит о том, что TGF-β является одним из основных факторов роста, который запускает каскадную реакцию, ведущую к пролиферации фибробластов и в дальнейшем к синтезу белков внеклеточного матрикса.
Онкостатин М - цитокин, стимулирующий рост нормальных фибробластов и участвующий в регенерации ран, ограничивая тканевое поражение, регулируя экспрессию белков острой фазы и ингибиторов протеаз [2].
Задачей настоящего изобретения является расширение арсенала эффективных терапевтических средств с ранозаживляющим действием, участвующих в закрытии ран при воспалении и развитии рубцов.
Основной технический результат, который может быть получен при осуществлении настоящего изобретения, заключается в реализации данного назначения: создании олигопептидов, обладающих активностью факторов роста по отношению к пролиферации фибробластов.
В отличие от производства чистых белков (фактора роста TGF-β и онкостатина М) синтез заявляемых пептидов осуществляется по упрощенной и недорогостоящей технологии, что снижает стоимость препарата, сказывается на его доступности и, следовательно, расширяет возможности его применения.
Основной технический результат достигается за счет создания олигопептидов (ряд пептидов, близких по виду активности, различающихся только величиной активности) общей формулы:
А-Х1-Х2-Х3-Х4-Х5-В,
где
А представляет собой Phe;
Х1 представляет собой Glu, Gln или Ser;
Х2 представляет собой Asn, Gln, Ala или Gly;
Х3 представляет собой Lys, Arg или Thr;
Х4 представляет собой Lys, Glu или отсутствует,
Х5 представляет собой Lys, Leu или отсутствует и
В представляет собой ОМе,
обладающих активностью факторов роста по отношению к пролиферации фибробластов.
В формуле: Phe - фенилаланин, Glu - глутаминовая кислота, Ser - серин, Asn - аспаргин, Gln - глутамин, Gly - глицин, Lys - лизин, Arg - аргинин, Thr - треонин, Leu - лейцин, ОМе - метил. При этом размеры олигопептидов, проявляющих данную активность, варьируются от три- до пентапептидов, что объясняется оптимальностью размеров (соответствия сайту рецептора) и сохранением конформационного соответствия активному центру.
Формула заявляемых олигопептидов была выявлена по результатам компьютерного конструирования участков связывания трансформирующего фактора роста TGF-β и онкостатина М с рецепторами поверхности стволовых клеток. Компьютерное конструирование участков связывания TGF-β и OSM с их рецепторами проводили с помощью программного комплекса [3], осуществляющего компьютерное моделирование пространственной структуры белковых молекул и дизайн низкомолекулярных соединений, ответственных за биологическую функцию белка.
Нижеследующие чертежи составляют часть описания настоящего изобретения и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения. Настоящее изобретение можно лучше понять путем обращения к одному или нескольким из этих чертежей в сочетании с подробным описанием представленных здесь конкретных вариантов осуществления настоящего изобретения.
На чертежах представлены:
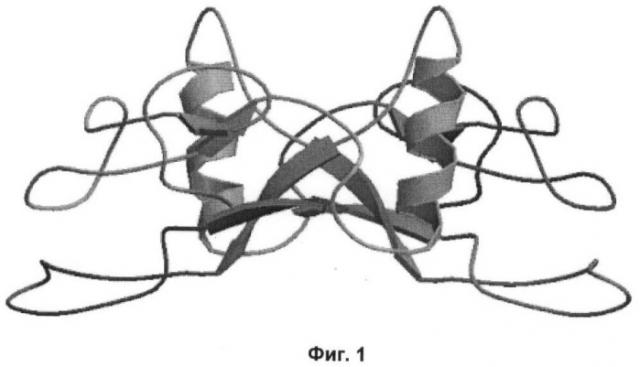
фиг.1 - пространственная структура белка TGF-β [4];
фиг.2 - пространственная структура белка TGF-β с идентифицированным функциональным сайтом (функциональный сайт выделен);
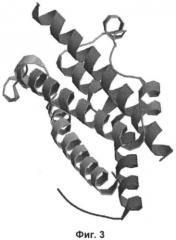
фиг.3 - пространственная структура белка OSM [5];
фиг.4 - пространственная структура белка OSM с идентифицированным функциональным сайтом (функциональный сайт выделен).
Пример 1
In silico конструирование функционального сайта TGF-β на основе пространственной структуры белка TGF-β
Для осуществления конструирования функционального сайта TGF-β использовалась компьютерная программа.
Исходными данными для работы послужили первичные и пространственные структуры белков, импортированные из банка данных Protein Data Bank [6]. В базе данных банка проводили поиск пространственной структуры TGF-β. В результате для компьютерного конструирования отобрали пространственную структуру TGF-β [4] (фиг.1).
Далее проводили компьютерное моделирование, которое позволило идентифицировать пространственно сближенные аминокислотные остатки, находящиеся на поверхности глобулы белка TGF-β и принимающие участие во взаимодействии TGF-β с его рецептором (фиг.2). На основе полученных данных спрогнозировали формулу заявляемых олигопептидов.
Пример 2
in silico конструирование функционального сайта OSM на основе пространственной структуры белка OSM
Для осуществления конструирования функционального сайта OSM использовалась компьютерная программа.
Исходными данными для работы послужили первичные и пространственные структуры белков, импортированные из банка данных Protein Data Bank [6]. В базе данных банка проводили поиск пространственной структуры OSM. В результате для компьютерного конструирования отобрали пространственную структуру OSM [5] (фиг.3).
Далее проводили компьютерное моделирование, которое позволило идентифицировать пространственно сближенные аминокислотные остатки, находящиеся на поверхности глобулы белка OSM и принимающие участие во взаимодействии OSM с его рецептором (фиг.4). На основе полученных данных спрогнозировали формулу заявляемых олигопептидов.
Идентифицированные участки связывания являются структурными аналогами эпитопов, определенных для TGF-β (см. пример 1), что подтверждает активность in silico спрогнозированных соединений по отношению к пролиферации фибробластов.
Из представленных на фиг.2 и фиг.4 данных, по результатам компьютерного моделирования можно сделать вывод, что заявляемые олигопептиды представляют собой функциональный сайт TGF-β и OSM, принимающий участие в связывании с рецепторами на поверхности стволовых клеток и стимулирующий пролиферацию фибробластов. Данное соединение может найти применение в медицине и ветеринарии в качестве средства с ранозаживляющим действием, участвующего в закрытии ран при воспалении и развитии рубцов.
Источники информации
1. Grotendorst, G.R. Combinatorial signaling pathways determine fibroblast proliferation and myofibroblast differentiation / G.R.Grotendorst, H.Rahmanie, M.R.Duncan // The FASEB Journal. - 2004. - Vol.18. - P.469-479.
2. Wahl, A.F. Oncostatin M in the anti-inflammatory response / A.F.Wahl, P.M.Wallace // Ann. Rheum. Dis. - 2001. - Vol.60, №.3. - P.75-80.
3. Шутова, И.В. Компьютерное моделирование пространственной структуры белковых молекул / И.В.Шутова, Л.М.Чемитова, В.П.Голубович // Химия, структура и функция биомолекул: Тез.докл. - Мн., 2006. - С.PR-162.
4. http://www.rcsb.org/pdb/explore.do?structureld=1KLA
5. http://www.rcsb.org/pdb/explore/explore.do?structureld=1EVS
6. http://www.rcsb.org/pdb/home/home.do
Олигопептид, обладающий активностью трансформирующего фактора роста (TGF-β) и онкостатина М (OSM) по отношению к пролиферации фибробластов, общей формулыА-Х1-Х2-Х3-Х4-Х5-В,где А представляет собой F;X1 представляет собой Е, или Q, или S;Х2 представляет собой N, или Q, или А, или G;Х3 представляет собой К, или R, или Т;Х4 представляет собой К, или Е, или отсутствует,Х5 представляет собой К, или L, или отсутствует иВ представляет собой ОМе,где F - фенилаланин, Е - глутаминовая кислота, S - серии, N - аспарагин, Q - глутамин, G - глицин, К - лизин, R - аргинин, Т - треонин, А - аланин, L - лейцин, ОМе - метил, при этом размер олигопептида варьируется от три-до пентапептида.