Рекомбинантное получение связывающих гепарин белков
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Выделяют связывающий гепарин белок из периплазмы культуры прокариотических клеток. Денатурируют выделенный связывающий гепарин белок в первом буферном растворе, содержащем хаотропное средство и восстанавливающее средство и инкубируют выделенный денатурированный связывающий гепарин белок во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, где указанное сульфатированное полианионное средство представляет собой декстрансульфат или сульфат натрия, в течение такого времени и при таких условиях, что происходит повторная укладка связывающего гепарин белка. Изобретение позволяет получать повторно уложенный связывающий гепарин белок, где имеет место приблизительно 2-5-кратное увеличение количества полученного повторно уложенного связывающего гепарин белка по сравнению с инкубацией без сульфатированного полианионного средства. 2 н. и 10 з.п. ф-лы, 13 ил., 3 табл.
Реферат
РОДСТВЕННАЯ ЗАЯВКА
По настоящей заявке испрашивается приоритет и преимущества предварительной заявки США серийный No. 60/753615, поданной 22 декабря 2005, и предварительной заявки США серийный No. 60/807432, поданной 14 июля 2006, полное содержание описаний которых приведено здесь.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам получения связывающих гепарин белков, продуцированных в культуре клеток. Изобретение относится к способам выделения и очистки повторно уложенных связывающих гепарин белков, продуцированных в прокариотических клетках-хозяевах и присутствующих в этих клетках, как правило, в периплазматическом или внутриклеточном пространстве. Связывающие гепарин белки, продуцированные в прокариотических клетках-хозяевах, можно также обнаружить в форме растворимых белков или смеси растворимых и нерастворимых белков.
УРОВЕНЬ ТЕХНИКИ
Известно, что большое множество встречающихся в природе биологически активных полипептидов связывают гепарин. Такие связывающие гепарин полипептиды включают в себя цитокины, такие как фактор тромбоцитов 4 и IL-8 (Barber et al, (1972) Biochim. Biophys. Acta. 286:312-329; Handin et al, (1976) L Biol. Chem. 251:4273-422; Loscalzo et al., (1985) Arch. Biochem. Biophys. 240:446-455; Zucker et al., (1989) Proc. Natl. Acad. Sci. USA. 86:7571-7574; Talpas et al., (1991) Biochim. Biophys. Acta. 1078:208-218; Webb et al., (1993) Proc. Natl. Acad. Sci. USA. 90:7158-7162), связывающие гепарин факторы роста (Burgess and Maciag, (1989) Annu. Rev. Biochem. 58:576-606; Klagsbrun, (1989) Prog. Growth Factor Res. 1:207-235), такие как эпидермальный фактор роста (EGF); тромбоцитарный фактор роста (PDGF); основный фактор роста фибробластов (bFGF); кислый фактор роста фибробластов (aFGF); фактор роста эндотелия сосудов (VEGF); и фактор роста гепатоцитов (HGF) (Liu et al., (1992) Gastrointest. Liver Physiol. 26:G642-G649); и селектины, такие как L-селектин, E-селектин и P-селектин (Norgard-Sumnicht et al, (1993) Science. 261:480-483). Смотри также Munoz and Linhardt., (2004) Arterioscler Thromb Vase Biol. 24:1549-1557.
В Международной Публикации No. WO 95/07097 описаны составы связывающих гепарин белков, включая связывающие гепарин факторы роста, такие как VEGF, с очищенным нативным гепарином или другими полианионными соединениями для терапевтического применения. Показано, что полученные из гепарина олигосахариды и различные другие полианионные соединения стабилизируют активную конформацию связывающих гепарин факторов роста (Barzu et al., (1989) J. Cell. Physiol. 140:538-548; Dabora et al., (1991) J. Biol. Chem. 266:23627-23640), и аффинную хроматографию с гепарином применяли в различных схемах очистки (в общем, смотри Международную Публикацию No. WO 96/02562).
Множество связывающих гепарин белков, происходящих из млекопитающих, получены посредством рекомбинантного способа и являются клинически важными (Munoz and Linhardt, (2004) Arterioscler Thromb Vase Biol. 24:1549-1557; Favard et al. (1996) Diabetes and Metabolism 22(4):268- 73; Matsuda et al., (1995) J. Biochem. 118(3):643-9: Roberts et al., (1995) Brain Research 699(1):51-61). Например, VEGF является сильным митогеном для эндотелиальных клеток сосудов. Он известен также как фактор проницаемости сосудов (VPF). Смотри Dvorak et al., (1995) Am. J. Pathol. 146: 1029-39. VEGF играет важную роль как в васкулогенезе, развитии эмбриональной сосудистой сети, так и в ангиогенезе, процессе формирования новых кровеносных сосудов из уже существующих. Смотри, например, Ferrara, (2004) Endocrine Reviews 25(4):581-611; Risau et al., (1988) Dev. Biol. 125:441-450; Zachary. (1998) Intl. J. Biochem Cell Bio 30:1169-1174; Neufeld et al., (1999) FASEB J. 13:9-22; Ferrara (1999) J. MoL Med. 77:527-543; и Ferrara and Davis-Smyth, (1997) Endocri. Rev. 18:4-25. Клинические применения VEGF включают в себя применения, где на рост нового капиллярного ложа указывают, например, как на стимулирующий заживление ран (смотри, например, Международную публикацию No. WO 91/02058; и Декларацию поверенного No. P2358R1, озаглавленную «Заживление ран», поданную 16 июня 2006 г.), для стимуляции роста и восстановления тканей, например, печени (смотри, например, WO2003/0103581), кости (смотри, например, WO2003/094617) и т.д. Смотри также Ferrara, (2004) Endocrine Reviews 25(4):581-611.
Как правило, терапевтически важные рекомбинантные белки продуцируют множество организмов-хозяев. Большинство белков можно экспрессировать в их нативной форме в эукариотических хозяевах, таких как клетки CHO. Культура клеток животных, как правило, требует продолжительных периодов роста для достижения максимальной плотности клеток и в конечном счете достигает более низкой плотности клеток, чем культуры прокариотических клеток (Cleland, J. (1993) ACS Symposium Series 526, Protein Folding: In Vivo and In Vitro, American Chemical Society). Кроме того, для культуры клеток животных часто необходима дорогая среда, содержащая компоненты для роста, которые могут мешать выделению желаемого белка. Экспрессионные системы бактериальных хозяев обеспечивают экономически эффективную альтернативу производства рекомбинантных белков в промышленном масштабе. Существует множество патентов США по общей бактериальной экспрессии рекомбинантных белков, включая патенты США No. 4565785; 4673641; 4795706; и 4710473. Главным преимуществом способа получения является возможность простого выделения продукта из компонентов клетки посредством центрифугирования или микрофильтрации. Смотри, например, Kipriyanov and Little, (1999) Molecular Biotechnology, 12: 173- 201; и Skerra and Pluckthun, (1988) Science. 240: 1038-1040.
Рекомбинантные связывающие гепарин факторы роста, такие как кислый фактор роста фибробластов, основный фактор роста фибробластов и фактор роста сосудов эндотелия, выделяли и очищали из ряда источников, включая бактерии (Salter D. H. et al., (1996) Labor. Invest. 74(2):546-556 (VEGF); Siemeister et al., (1996) Biochem. Biophys. Res. Commun. 222(2):249-55 (VEGF); Cao et al., (1996) J. Biol. Chem. 261(6):3154-62 (VEGF); Yang et al., (1994) Gaojishu Tongxun. 4:28-31 (VEGF); Anspach et al., (1995) J. Chromatogr. A 5 711(1): 129-139 (aFGF и bFGF); Gaulandris (1994) J Cell. Physiol. 161(1): 149-59 (bFGF); Estape and Rinas (1996) Biotech. Tech. 10(7):481-484 (bFGF); McDonald et al., (1995) FASEB J. 9(3):A410 (bFGF)). Однако бактериальные экспрессирующие системы, такие как E. coli, лишены клеточного аппарата для облегчения правильной повторной укладки белков и, как правило, не обеспечивают секрецию крупных белков в культуральную среду. Рекомбинантные белки, экспрессированные в бактериальных клетках-хозяевах, часто обнаруживают в виде телец включения, состоящих из плотных масс частично уложенного и неправильно уложенного восстановленного белка. В этой форме рекомбинантный белок, как правило, является неактивным. Например, преобладающая активная форма VEGF представляет собой гомодимер из двух 165-аминокислотных полипептидов (VEGF-165). В этой структуре каждая субъединица содержит 7 пар внутрицепочечных дисульфидных связей и две дополнительные пары, обеспечивающие ковалентную связь двух субъединиц (Ferrara et al., (1991) J. Cell. Biochem. 47:211-218). Нативная конформация включает в себя сильно основной домен, который, как показано, легко связывает гепарин (Ferrara et al (1991) выше). Ковалентная димеризация VEGF необходима для эффективного связывания рецептора и биологической активности (Pӧtgens et al., (1994) J. Biol. Chem. 269:32879-32885; Claffey et al., (1995) Biochim. et Biophys. Acta 1246:1-9). Бактериальный продукт потенциально содержит несколько неправильно уложенных и связанных дисульфидными связями промежуточных соединений.
Кроме того, повторная укладка часто приводит к неправильно уложенным и связанным дисульфидными связями димерам, тримерам и мультимерам. (Morris et al., (1990) Biochem. J. 268:803-806; Toren et al., (1988) Anal. Biochem., 169:287-299). Этот феномен связывания является очень распространенным во время повторной укладки белка, особенно при более высоких концентрациях белка, и, по-видимому, часто вовлекает связывание через гидрофобное взаимодействие частично уложенных промежуточных соединений (Cleland and Wang, (1990) Biochemistry. 29:11072-11078).
Неправильная укладка происходит либо в клетке в процессе ферментации, либо в ходе процедуры выделения. Белки, выделенные из периплазматического или внутриклеточного пространства, необходимо солюбилизировать и растворимый белок повторно уложить в нативное состояние. Способы для повторной укладки белков in vitro в правильную, биологически активную конформацию необходимы для получения функциональных белков. Типичная последовательная переработка белков, выделенных из телец включения, включает в себя растворение тельца включения при высокой концентрации денатурирующего средства, такого как мочевина, с последующим разбавлением денатурирующего средства, чтобы обеспечить прохождение повторной укладки (смотри патенты США No. 4512922; 4511502; и 4511503). Смотри также, например, Rudolph and Lilie, (1996) FASEB J. 10:49-56; и Fischer et al, (1993), Biotechnology and Bioengineering, 41:3-13. Считают, что такие способы выделения являются универсально применимыми, с незначительными модификациями, для выделения биологически активных рекомбинантных белков из телец включения. Эти способы применяли для связывающего гепарин белка, такого как VEGF (Siemeister et al. (1996) supra). Этими способами стараются исключить случайное дисульфидное связывание перед сворачиванием рекомбинантного белка в его биологически активную конформацию через другие стабилизирующие его силы, и они могут не исключать неправильно уложенные промежуточные соединения или не обеспечивать гомогенных популяций правильно уложенного продукта.
Обратные мицеллы или ионообменную хроматографию использовали, чтобы способствовать повторной укладке денатурированных белков посредством заключения отдельных белков в мицеллы или выделения их на смоле и затем удаления денатурирующего средства (Hagen et al., (1990) Biotechnol. Bioeng. 35:966-975; Creighton (1985) in Protein Structure Folding and Design (Oxender, D.L. Ed.) pp.249-251, New York: Alan R. Liss, Inc.). Эти способы являлись применимыми для предупреждения агрегации белка и облегчения правильной повторной укладки. Для изменения скорости или степени повторной укладки проводили конформационно-специфичную повторную укладку с лигандами и антителами к нативной структуре белка (Cleland and Wang, (1993), in Biotechnology, (Rehm H. -J., and Reed G. Eds.) pp. 528-555, New York, VCH). Например, проводили повторную укладку креатинкиназы в присутствии антител к нативной структуре (Morris et al., (1987) Biochem. J. 248:53-57). В дополнение к антителам, лиганды и кофакторы использовали для улучшения повторной укладки. Эти молекулы будут более вероятно взаимодействовать с укладываемым белком после формирования нативного белка. Таким образом, равновесие укладки можно «направлять» к нативному состоянию. Например, скорость повторной укладки феррицитохрома улучшали с помощью внешнего лиганда для аксиального положения железа гема (Brems and Stellwagon, (1983) J. Biol. Chem. 258:3655-3661). Белки шапероны также использовали, чтобы способствовать укладке белка. Смотри, например, Baneyx, (1999) Current Opinion in Biotechnology, 10:411-421.
Существует необходимость в новых и более эффективных способах укладки и/или выделения связывающих гепарин белков из культуры клетки-хозяина, например, для эффективного и экономичного получения связывающих гепарин белков в культуре бактериальных клеток, обеспечивающего исключение или снижение количества биологически неактивных промежуточных соединений и улучшение выделения высокоочищенного биологически активного правильно уложенного белка, которые в основном являются применимыми для получения белков в промышленном масштабе. Изобретение относится к этим и другим нуждам, как будет очевидно при ознакомлении со следующим описанием.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу выделения и очистки повторно уложенных связывающих гепарин белков из культуры клеток. В частности, изобретение относится к способу выделения связывающего гепарин белка из прокариотических клеток-хозяев, например бактериальных клеток. Например, способ включает в себя стадии (a) выделения нерастворимого связывающего гепарин белка из периплазматического или внутриклеточного пространства указанных бактериальных клеток; (b) солюбилизации указанного выделенного нерастворимого связывающего гепарин белка в первом буферном растворе, содержащем хаотропное средство и восстанавливающее средство, и
c) инкубации указанного солюбилизированного связывающего гепарин белка во втором буферном растворе, содержащем хаотропное средство и сульфатированное полианионное средство, в течение такого времени и в таких условиях, что происходит повторная укладка связывающего гепарин белка; и (d) выделения указанного повторно уложенного связывающего гепарин белка, где имеет место 2-10 кратное увеличение концентрации белка, выделенного посредством инкубации с сульфатированным полианионным средством, по сравнению с контролем. В одном варианте осуществления второй буферный раствор дополнительно содержит аргинин. В одном варианте осуществления второй буферный раствор дополнительно содержит цистеин или мягкое восстанавливающее средство.
В одном варианте осуществления изобретения имеет место, например, 2-8-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке, или 2-5-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке, или 3-5-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке, или 2-3-кратное увеличение концентрации белка в выделенном биологически активном повторно уложенном белке. В другом варианте осуществления изобретения имеет место, например, более чем 2,0-кратное, 2,5-кратное, 2,8-кратное, 3,0-кратное, 5-кратное, 6-кратное, 7,0-кратное, 8-кратное, 9-кратное и т.д. увеличение концентрации белка в выделенном, биологически активном, повторно уложенном белке. В одном варианте осуществления изобретения существует 3-5-кратное увеличение концентрации белка в выделенном биологически активном, повторно уложенном VEGF.
Способы по изобретению можно широко применять к связывающим гепарин белкам и особенно к связывающим гепарин факторам роста, в частности к фактору роста эндотелия сосудов (VEGF). В конкретных вариантах осуществления изобретения сульфатированное полианионное средство составляет между приблизительно 3000 и 10000 дальтон. В одном варианте осуществления сульфатированное полианионное средство, применяемое в способах получения, представляет собой декстрансульфат, сульфат натрия или гепаринсульфат. В одном аспекте декстрансульфат составляет между 3000 дальтон и 10000 дальтон.
Кроме того, изобретение относится к способам и методам очистки связывающих гепарин белков, либо отдельно, либо в сочетании с выделением связывающего гепарин белка, как описано в настоящем описании. В конкретном варианте осуществления способы очистки включают в себя контактирование указанного, повторно уложенного связывающего гепарин белка с подложкой для хроматографии на гидроксиапатите; с первой подложкой для хроматографии гидрофобного взаимодействия, с подложкой для катионной хроматографии и со второй подложкой для хроматографии гидрофобного взаимодействия, и избирательную элюцию связывающего гепарин белка с каждой подложки. В другом варианте осуществления способ очистки включает в себя контактирование указанного, повторно уложенного, связывающего гепарин белка с катионообменной подложкой; с первой подложкой для хроматографии гидрофобного взаимодействия и с подложкой для ионообменной или смешанной хроматографии, и избирательную элюцию связывающего гепарин белка с каждой подложки. Предусматривают, что стадии, в случае стадий выделения, можно проводить в любом порядке, например последовательно или с изменением порядка подложек для хроматографии. В конкретных вариантах осуществления изобретения представлены способы выделения и очистки повторно уложенных связывающих гепарин белков из культуры клеток в производственном или индустриальном масштабе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
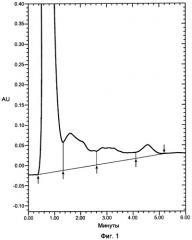
На фигуре 1 показана хроматограмма VEGF, продуцированного в бактериальном штамме W3110, нанесенного на колонку POROS HE2/M (4,6Ч100 мм, PerSeptive BioResearch Products, Cambridge, MA). Например, колонку POROS HE/2M уравновешивали в 10 мМ фосфате натрия, pH 7, содержащем 0,15 M хлорид натрия. Проводили элюцию с колонки с использованием линейного градиента 0,15-2 M хлорида натрия в 10 мМ фосфате натрия, pH 7, в течение 10 минут. Элюент мониторировали при 280 нм. Белок, выделившийся в каждом пике, соответствует VEGF, однако только пик 3 соответствует биологически активному, правильно уложенному VEGF.
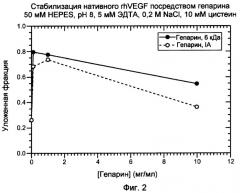
На фигуре 2 показан график, изображающий стабилизацию посредством гепарина нативного, правильно уложенного VEGF. VEGF суспендировали в 50 мМ HEPES, pH 8, содержащем 5 мМ ЭДТА, 0,2 M NaCl и 10 мМ цистеин.
На фигурах 3A-3D показаны хроматограммы VEGF, продуцированного в бактериальном штамме W3110 и инкубированного с 12 мкг/мл декстрансульфата 5000 дальтон (фигура 3A); 12 мкг/мл декстрансульфата 8000 дальтон (фигура 3B); 12 мкг/мл декстрансульфата 10000 дальтон (фигура 3C) или 25 мкг/мл гепарина (фигура 3D), 3000 дальтон и нанесенного на колонку POROS HE2/M (4,6×100 мм, PerSeptive BioResearch Products, Cambridge, MA). Например, колонку уравновешивали в 10 мМ фосфате натрия, pH 7, содержащем 0,15 M хлорид натрия. Проводили элюцию с колонки с использованием линейного градиента 0,15-2 M хлорида натрия в 10 мМ фосфате натрия, pH 7, в течение 10 минут. Элюент мониторировали при 280 нм. Белок, выделившийся в каждом пике, соответствует VEGF, однако только пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 4 показан эффект масштаба на повторную укладку VEGF.
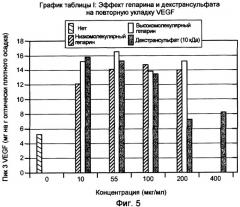
На фигуре 5 показан эффект гепарина с низкой молекулярной массой (MW) и высокой MW, и декстрансульфата, 10000 дальтон, на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 6 показан эффект сульфата натрия на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 7 показан эффект гепарина с низкой молекулярной массой (MW) и высокой MW, и декстрансульфата, 5000 дальтон, 8000 дальтон, и 10000 дальтон на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 8 показан эффект гепарина и декстрансульфата на повторную укладку VEGF. Пик 3 соответствует биологически активному, правильно уложенному VEGF.
На фигуре 9 показан эффект мочевины и DTT на экстракцию VEGF из бактериальных телец включения.
На фигуре 10 показан эффект концентрации мочевины и DTT на повторную укладку VEGF.
На фигуре 11 показана аминокислотная последовательность VEGF165 с указанными дисульфидными связями (SEQ ID NO.:1).
На фигуре 12 показан эффект присутствия заряженных аминокислот. При концентрации 0,75 М во втором буферном растворе как аргинин, так и лизин являются благоприятными, в то время как гистидин оказывает небольшой дополнительный эффект по сравнению с буферным раствором без него. Кроме того, показано, что аргинин оказывает сходный эффект в концентрациях 0,1-1 М.
На фигуре 13 показан эффект разведения в % эффективности повторной укладки, где, хотя общая концентрация VEGF становится более низкой с увеличением разведения, % эффективности повторной укладки выше для большего разведения.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
«Гепарин» (обозначаемый также как гепариновая кислота) представляет собой гетерогенную группу высоко сульфатированных, неразветвленных анионных мукополисахаридов, называемых гликозаминогликанами. Хотя могут присутствовать и другие, основными сахарами в гепарине являются: α-L-идуроновая кислота-2-сульфат, 2-дезокси-2-сульфамино-α-глюкоза-6-сульфат, β-D-глюкуроновая кислота, 2-ацетамидо-2-дезокси-α-D-глюкоза и L-идуроновая кислота. Эти и, необязательно, другие сахара соединены гликозидными связями с формированием полимеров различных размеров. Из-за присутствия его ковалентно связанных групп сульфата и карбоновой кислоты гепарин является сильно кислым. Молекулярная масса гепарина меняется от приблизительно 3000 до приблизительно 20000 дальтон, в зависимости от источника и способа определения.
Нативный гепарин является составной частью различных тканей, особенно печени и легкого, и тучных клеток в нескольких видах млекопитающих. Гепарин и соли гепарина (гепарин натрия) являются коммерчески доступными, и их преимущественно используют в качестве антикоагулянтов в различных клинических ситуациях.
«Декстрансульфат» представляет собой сульфат декстрана, принципиальная структура которого представляет собой полимер D-глюкозы. Глюкоза и, необязательно, другие сахара соединены α-D(1-6)гликозидными связями, формируя полимеры различных размеров. Из-за присутствия ковалентно связанного сульфата декстрансульфат является сильно кислым. Содержание серы, как правило, составляет не менее чем 10% и, как правило, приблизительно 15%-20%, при вплоть до 3 сульфатных групп на молекулу глюкозы. Средняя молекулярная масса декстрансульфата составляет от приблизительно 1000 до приблизительно 40000000 дальтон. Примеры декстрансульфата, применимого по изобретению, включают в себя сульфаты декстранов, полученные из таких микроорганизмов, как Leuconostoc mesenteroides и L. dextranicum.
«Полианионное средство», как применяют в объеме изобретения, предназначено для описания коммерчески доступных очищенных препаратов и соединений нативного гепарина, способных связываться со связывающими гепарин белками, включая другие «полианионные средства», такие как сульфат натрия, гепаринсульфат, гепарансульфат, пентозан(поли)сульфат, декстран, декстрансульфат, гиалуроновая кислота, хондроитин, хондроитинсульфат, дерматансульфат и кератансульфат. Особенно применимым в контексте изобретения является «сульфатированное полианионное средство», например, такое как сульфатное производное полисахарида, такое как гепаринсульфат, декстрансульфат, сульфаты циклодекстрина, продуцируемые микроорганизмами, такими как Bacillus macerans, описанные в патенте США No. 5314872, также как сульфаты других глюканов, такие как β-1,3-глюкансульфаты, где β-1,3-глюкан продуцируют микроорганизмы, принадлежащие к роду Alcaligenes или Agrobacterium, и хондроитинсульфат, также как сульфатированные фрагменты гепарина.
Вышеупомянутые средства, как правило, являются доступными и известными специалисту в данной области. Например, сульфатированные фрагменты гепарина можно получить из библиотеки полученных из гепарина олигосахаридов, фракционированных посредством гель-проникающей хроматографии. Получение аффинно- фракционированных, полученных из гепарина олигосахаридов, опубликовано Ishihara et al., (1993) J. Biol. Chem., 268:4675-4683. Эти олигосахариды получили из коммерческого свиного гепарина с последующей частичной деполимеризацией азотистой кислотой, восстановлением боргидридом натрия и фракционированием гель-проникающей хроматографией. Полученные пулы ди-, тетра-, гекса-, окта- и декасахаридов последовательно наносили на аффинную колонку с рекомбинантным bFGF человека, ковалентно присоединенным к SEPHAROSE™ 4B, и далее фракционировали на подпулы на основе их элюции с колонки под действием градиентов хлорида натрия. В результате этого получили пять пулов, обозначенных Hexa-1 - Hexa-5, структуры и виды биологической активности которых дополнительно исследовали. Структура Hexa-5C и его спектр ЯМР при 500-MHz показаны на фигуре 4 из Tyrell et al., (1993) J. Biol. Chem. 268:4684-4689. Этот гексасахарид обладает структурой [IdoA(2-OSO3)α1-4GlcNSO3(6-OSO3)α1-4]2IdoA(2-OSO3)α1-4AManR(6-OSO3). Все полученные из гепарина олигосахариды, обсуждаемые выше, также как другие гепарин-подобные олигосахариды являются подходящими, и их можно использовать согласно изобретению. В одном варианте осуществления изобретения используют гексасахариды и полисахариды из гепарина с более высоким размером единицы (например гепта-, окта-, нона- и декасахариды). Более того, успешно используют полученные из гепарина или гепарин-подобные олигосахариды с более высоким отрицательным суммарным зарядом, например, из-за высокой степени сульфатирования.
Термин «связывающий гепарин белок» или «HPB», как применяют здесь, относится к полипептиду, способному связывать гепарин (как определено здесь выше). Определение относится к зрелой, пре-, пре-про-, и про-формам нативных и полученных рекомбинантным способом связывающих гепарин белков. Типичными примерами связывающих гепарин белков являются «связывающие гепарин факторы роста», включая в качестве неограничивающих примеров эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), основный фактор роста фибробластов (bFGF), кислый фактор роста фибробластов (aFGF), фактор роста эндотелия сосудов (VEGF), фактор роста гепатоцитов (HGF) (известный также как рассеивающий фактор, SF) и фактор роста нервов (NGF), IL-8 и т.д.
Как применяют здесь, «фактор роста эндотелия сосудов», или «VEGF», относится к фактору роста млекопитающих, первоначально полученному из фолликулярных клеток бычьего гипофиза, обладающему аминокислотной последовательностью, описанной в Castor, C. W., et al., (1991) Methods in Enzymol. 198:391-405, вместе с его функциональными производными, обладающими качественной биологической активностью соответствующего нативного VEGF, включая, в качестве неограничивающих примеров, аминокислотную последовательность VEGF, как опубликовано в Houck et al., (1991) MoL Endocrin. 5:1806-1814. Смотри также Leung et al. (1989) Science. 246:1306 и Robinson & Stringer, (2001) Journal of Cell Science. 144(5):853-865, патент США No. 5332671. Преобладающая форма VEGF представляет собой гомодимер из 165 аминокислот, обладающий шестнадцатью остатками цистеина, формирующими 7 внутримолекулярных дисульфидных связей и две межмолекулярные дисульфидные связи. Альтернативный сплайсинг вовлечен в формирование множества полипептидов VEGF человека, состоящих из 121, 145, 165, 189 и 206 аминокислот, однако вариант VEGF121 не обладает связывающим гепарин доменом из других вариантов и, таким образом, не подпадает под определение связывающего гепарин белка, указанное здесь. Все изоформы VEGF разделяют общий N-концевой домен, но различаются по длине C-концевой части молекулы. Предпочтительная активная форма VEGF, VEGF165 обладает дисульфидными связями между аминокислотными остатками Cys26-Cys68; Cys57-Cys104; Cys61-Cys102; Cys117-Cys135; Cys120-Cys137; Cys139-Cys158; Cys146-Cys160 в каждом мономере. Смотри фигуру 11. Смотри также, например, Keck et al., (1997) Archives of Biochemistry and Biophysics 344(1): 103-113. Молекула VEGF165 состоит из двух доменов: N-концевого связывающего рецептор домена (гомодимер со связанными дисульфидными связями аминокислотами 1-110) и C-концевого связывающего гепарин домена (остатки 111-165). Смотри, например, Keyt et al., (1996) J1 Biol. Chem.. 271(13):7788-7795. В конкретных вариантах осуществления изобретения выделенный и очищенный VEGF165 не является гликозилированным по остатку 75 (Asn). Смотри, например, Yang et al., (1998) Journal of Pharm. & Experimental Therapeutics, 284: 103-110. В конкретных вариантах осуществления изобретения выделенный и очищенный VEGF165 является по существу не дезамидированным по остатку Asn10. В конкретных вариантах осуществления изобретения выделенный и очищенный VEGF165 представляет собой смесь дезамидированного (по остатку Asn10) и недезамидированного белка, как правило, при большей части белка являющейся недезамидированной. Поскольку VEGF165 представляет собой гомодимер, дезамидирование может происходить на одной или обеих полипептидных цепях.
Как применяют здесь, «правильно уложенный» или «биологически активный» VEGF, или другой HBP и т.п., относится к молекуле с биологически активной конформацией. Специалисту в данной области понятно, что неправильно уложенные и связанные дисульфидными связями промежуточные соединения могут обладать биологической активностью. В таком случае правильно уложенный или биологически активный VEGF или HBP соответствует природному характеру укладки VEGF (описанному выше) или другого HBP. Например, правильно уложенный VEGF обладает указанными выше дисульфидными парами, в дополнение к двум межмолекулярным дисульфидным связям в димерной молекуле, однако культура бактериальных клеток может продуцировать другие промежуточные соединения (Фигура 1 и 3A-3D). В случае правильно уложенного VEGF существуют две межмолекулярные дисульфидные связи между теми же самыми остатками, Cys51 и Cys60, каждого мономера. Смотри, например, патент WO98/16551. Виды биологической активности VEGF включают в себя в качестве неограничивающих примеров, например, стимуляцию проницаемости сосудов, стимуляцию роста эндотелиальных клеток сосудов, связывание с рецептором VEGF, связывание и передачу сигнала через рецептор VEGF (смотри, например, Keyt et al., (1996) Journal of Biological Chemistry, 271(10):5638-5646), включая ангиогенез и т.д.
Термины «очищенный» или «чистый HBP» и т.п. относятся к материалу, свободному от веществ, в норме сопровождающих его, как обнаружено при его рекомбинантной продукции, и особенно в культуре прокариотических или бактериальных клеток. Таким образом, термины относятся к рекомбинантному HBP, свободному от загрязняющей ДНК, белков клетки-хозяина или других молекул, связанных с ним в окружении in situ. Термины относятся к степени чистоты, а именно по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 98% или более.
Термины «тельца включения» или «оптически плотные тельца» относятся к плотным внутриклеточным массам агрегированного интересующего полипептида, составляющим значительную часть общего белка клетки, включая все компоненты клетки. В некоторых случаях, но не во всех случаях, эти агрегаты полипептида можно распознать как яркие пятна, видимые внутри внутреннего пространства клеток под фазово-контрастным микроскопом при увеличениях ниже 1000-кратного.
Как применяют здесь, термин «неправильно уложенный» белок относится к преципитированным или агрегированным полипептидам, содержащимся внутри оптически плотных телец. Как применяют здесь, «нерастворимый» или «неправильно уложенный» VEGF, или другой HBP относится к преципитированному или агрегированному VEGF, содержащемуся внутри периплазмы или внутриклеточного пространства прокариотических клеток-хозяев, или другим образом связанному с прокариотической клеткой-хозяином, и принимающему биологически неактивную конформацию с несовпадающими или несформированными дисульфидными связями. Нерастворимый HBP, как правило, но необязательно, содержится в оптически плотных тельцах, т.е. может быть или не быть видимым под фазово-контрастным микроскопом.
Как применяют здесь, «хаотропное средство» относится к соединению, которое, в соответствующей концентрации в водном растворе, является способным изменять пространственную конфигурацию или конформацию полипептидов посредством изменения их поверхности, так что придает полипептиду растворимость в водной среде. Изменения могут происходить посредством изменения, например, состояния гидратации, окружения растворителя или взаимодействия растворитель-поверхность. Концентрация хаотропного средства будет напрямую влиять на его силу и эффективность. Сильный денатурирующий хаотропный раствор содержит хаотропное средство в больших концентрациях, которые в растворе будут эффективно разворачивать присутствующий в растворе полипептид, эффективно удаляя вторичную структуру белков. Разворачивание будет относительно обширным, но обратимым. Умеренный денатурирующий хаотропный раствор содержит хаотропное средство, которое, в достаточных концентрациях в растворе, позволяет частичную укладку полипептида от какой-либо искаженной конформации, которую полипептид принял, через промежуточные соединения, растворимые в растворе, в пространственную конформацию, в которой он находится при действии в своей активной форме в эндогенных или гомологичных физиологических условиях. Примеры хаотропных средств включают в себя гидрохлорид гуанидина, мочевину и гидроксиды, такие как гидроксид натрия или калия. Хаотропные средства включают в себя сочетание этих реагентов, такое как смесь гидроксида с мочевиной или гидрохлоридом гуанидина.
Как применяют здесь, «восстанавливающее средство» относится к соединению, которое, в подходящей концентрации в водном растворе, поддерживает свободные сульфгидрильные группы, так что химически разрушает внутри- или межмолекулярные дисульфидные связи. Репрезентативные примеры подходящих восстанавливающих средств включают в себя дитиотреитол (DTT), дитиоэритрит (DTE), бета-меркаптоэтанол (BME), цистеин, цистеамин, тиогликолят, глутатион, трис[2-карбоксиэтил]фосфин (TCEP) и боргидрид натрия.
Как применяют здесь, «буферный раствор» относится к раствору, устойчивому к изменению pH из-за действия его компонентов - конъюгатов кислота-щелочь.
«Бактерии» для целей здесь включают в себя эубактерии и архебактерии. В конкретных вариантах осуществления изобретения, эубактерии, включая грамположительные и грамотрицательные бактерии, используют в методах и способах, описанных здесь. В одном варианте осуществления изобретения используют грамотрицательные бактерии, например, Enterobacteriaceae. Примеры бактерий, принадлежащих к Enterobacteriaceae, включают в себя Escherichia, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, Serratia и Shigella. Другие типы подходящих бактерий включают в себя Azotobacter, Pseudomonas, Rhizobia, Vitreoscilla и Paracoccus. В одном варианте осуществления изобретения используют E. coli. Подходящие хозяева E. coli включают в себя E. coli W3110 (ATCC 27325), E. coli 294 (ATCC 31446), E. coli B и E. coli X1776 (ATCC 31537). Эти примеры являются иллюстративными, а не ограничивающими, и одним из примеров является W3110. Можно использовать также мутантные клетки любой из вышеупомянутых бактерий. Конечно, является необходимым выбрать подходящие бактерии, принимая во внимание способность к репликации репликона в клетках бактерии. Например, виды E. coli, Serratia, или Salmonella можно соответствующим образом использовать в качестве хозяина при использовании хорошо известных плазмид, таких как pBR322, pBR325, pACYC177 или pKN410, для предоставления репликона. Смотри далее ниже соответствующие примеры подходящих бактериальных клеток-хозяев.
Как применяют здесь, выражения «клетка», «линия клеток», «штамм» и «культура клеток» используют взаимозаменяемо, и все такие определения включают в себя потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают в себя первичную рассматриваемую клетку и происходящие из нее культуры, независимо от числа пересевов. Понятно также, что все потомство может не являться точно идентичным по содержанию ДНК из-за намеренных или случайных мутаций. Включено мутантное потомство, обладающее той же самой функцией или биологической активностью, по какой проводили скрининг исходных трансформированных клеток. Где подразумевают отличные определения, это будет ясно из контекста.
Как применяют здесь, «полипептид» в основном относится к пептидам и белкам из любого клеточного источника, обладающим более чем приблизительно десятью аминокислотами. «Гетерологичные» полипептиды представляют собой полипептиды, чужие для применяемой клетки-хозяина, такие как белок человека, продуцируемый E. coli. В то время как гетерологичный полипептид может являться прокариотическим или эукариотическим, предпочтительно, он является эукариотическим, более предпочтительно, относящимся к млекопитающим, и наиболее предпочтительно, к человеку. В конкретных вариантах осуществления изобретения он представляет собой полученный рекомбинантным способом, или рекомбинантный полипептид.
Связывающие гепарин белки
Выделение связывающего гепарин белка
Нерастворимый, неправильно уложенный связывающий гепарин белок (HBP) выделяют из прокариотических клеток-хозяев, экспрессирующих белок, посредством любого из множества общепринятых в данной области способов. Например, нерастворимый HBP выделяют в подходящем буфере для выделения посредством подвергания клеток воздействию буфера подходящей для солюбилизации большинства белков хозяина ионной силы, в котором, однако, рассматриваемый белок является по существу нерастворимым, или посредством разрушения клеток, так чтобы высвободить тельца включения или белок из периплазматического или внутриклеточного пространства и сделать их доступными для выделения, например, посредством центрифугирования. Этот способ является хорошо известным и описан, например, в патенте США No. 4511503. Kleid et al., описывающем очистку оптически плотных телец посредством гомогенизации с последующим центрифугированием (Kleid et al., (1984) in Developments in Industrial Microbiology, (Society for Industrial Microbiology, Arlington, VA) 25:217-235). Смотри также, например, Fischer et al., (1993) Biotechnology and Bioengineering 41:3-13.
В патенте США No. 5410026 описан типичный способ для выделения белка из телец включения, и его можно суммировать следующим образом. Прокариотические клетки суспендируют в подходящем буфере. Как правило, буфер состоит из забуферивающего средства, пригодного для забуферивания при pH между 5 и 9, или при приблизительно 6-8, и соли. Любая подходящая соль, включая NaCl, является применимой для поддержания подх