Генный кластер, участвующий в биосинтезе сафрацина, и его применение в генной инженерии
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биотехнологии и может быть использовано в медико-биологической промышленности при производстве антимикробных и противоопухолевых препаратов. Выделен фрагмент геномной ДНК Pseudomonas fluorescens А2-2, включающий полноразмерный генный кластер биосинтеза сафрацина (А и В), при исследовании которого установлено наличие нескольких ОРС, организованных в два оперона: sacABCDEFGH и sacIJ. Путем экспрессии нуклеиновой кислоты, включающей полный генный кластер сафрацина, в гетерологичной системе получены рекомбинантные формы природных сафрацинов А и В. В результате удаления или нарушения функционирования отдельных генов, входящих в состав оперонов, и применения полученных модифицированных форм нуклеиновой кислоты в технологии рекомбинантных ДНК синтезированы аналоги сафрацина, которые могут быть использованы в качестве антимикробных или противоопухолевых средств, а также в синтезе эктеинасцидиновых соединений. 13 н. и 7 з.п. ф-лы, 9 ил.
Реферат
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к генному кластеру, отвечающему за биосинтез сафрацина, к его применению в генной инженерии и к новым сафрацинам, получаемым путем коррекции механизмов биосинтеза.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
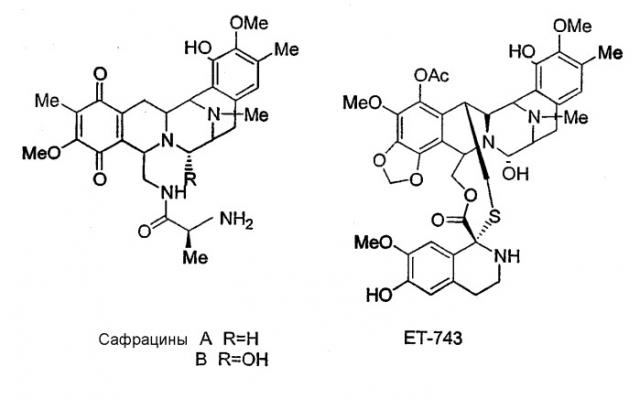
Сафрацины, представляющие собой семейство новых соединений с широким спектром мощной антибактериальной активности, были обнаружены в культуральном бульоне Pseudomonas sp. Сафрацины встречаются в двух штаммах Pseudomonas sp., Pseudomonas fluorescens A2-2, выделенного из образца почвы, собранного в Тагавагуне, Фукуока, Япония (Ikeda et al., J. Antibiotics 1983, 36, 1279-1283; WO 82 00146 и JP 58113192), и в штамме Pseudomonas fluorescens SC 12695, выделенного из образцов воды, взятых из канала Раритан-Делаваре возле Нью-Джерси (Meyers et al., J. Antibiot. 1983, 36(2), 190-193). Сафрацины A и В, продуцируемые Pseudomonas fluorescens А2-2, были исследованы в отношении их воздействия на различные линии опухолевых клеток и было обнаружено, что они кроме антибактериальной активности обладают противоопухолевой активностью:
В результате структурного сходства между сафрацином В и ЕТ-743 с помощью сафрацина возможно осуществлять полусинтез высокоперспективного мощного нового противоопухолевого средства ЕТ-743, выделенного из оболочечного морского организма Еcteinascidia turbinata, который в настоящее время проходит II фазу клинических испытаний в Европе и США. Полусинтез ЕТ-743 был осуществлен с использованием сафрацина В в качестве исходного соединения (Cuevas et al., Organic Lett. 2000, 10, 2545-2548; WO 00 69862 и WO 01 87895).
Альтернативный способ получения сафрацинов или их структурных аналогов химическим синтезом посредством воздействия на гены, осуществляющие контроль вторичного метаболизма, является весьма перспективными и с помощью него можно получать эти соединения биосинтетическим путем. Кроме того, благодаря структуре сафрацина можно осуществлять комбинаторный биосинтез.
В связи с тем, что сафрацины имеют структуру комплекса и его получение из Pseudomonas fluorescens А2-2 ограничено, было бы весьма желательно изучить генетическую основу их синтеза с тем, чтобы создать способы воздействия на них заданным образом. Это могло бы увеличить количество продуцируемых сафрацинов, поскольку природные штаммы, продуцирующие сафрацин, обычно дают лишь небольшие концентрации вторичных метаболитов, представляющих интерес. Такие способы также могут обеспечить продукцию сафрацинов у тех хозяинов, которые не продуцируют такие соединения. Кроме того, генетическое воздействие может использоваться для комбинаторного создания новых аналогов сафрацина, которые могут обладать улучшенными свойствами и которые могут использоваться в полусинтезе новых эктеинасцидиновых соединений.
Однако успех биосинтетического подхода главным образом зависит от доступности новых генетических систем и от генов, кодирующих новые ферменты с соответствующей активностью. Изучение генного кластера сафрацина вносит вклад в основные положения комбинаторного биосинтеза за счет расширения спектра генов, которые уникальным образом ассоциированы с биосинтезом сафрацина, что приведет к возможному получению новых предшественников и сафрацинов путем комбинаторного биосинтеза.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящее время можено идентифицировать и клонировать гены биосинтеза сафрацина, создав генетическую базу для улучшения, а также воздействия заданным образом на продуктивность Pseudomonas sp. и используя генетические методы синтеза аналогов сафрацина. Кроме того, эти гены кодируют ферменты, которые вовлечены в процессы биосинтеза, приводя к образованию структур, таких как предшественники сафрацина, которые могут сформировать базу комбинаторной химии для получения большого разнообразия соединений. Эти соединения могут быть подвергнуты скринингу на наличие большого диапазона биологической активности, включая противораковую активность.
В этой связи, в первом аспекте настоящее изобретение относится к нуклеиновой кислоте, соответственно к выделенной нуклеиновой кислоте, которая включает последовательность ДНК (включая ее мутации или варианты), которая кодирует нерибосомальные пептидсинтетазы, ответственные за биосинтез сафрацинов. Настоящее изобретение относится к генному кластеру, соответственно к выделенному генному кластеру с открытыми рамками считывания, кодирующими полипептиды, которые относятся к сборке молекулы сафрацина.
В одном из аспектов настоящее изобретение относится к композиции, включающей по меньшей мере одну последовательность нуклеиновой кислоты, соответственно к выделенной молекуле нуклеиновой кислоты, которая кодирует по меньшей мере один полипептид, катализирующий по меньшей мере одну стадию биосинтеза сафрацинов. В композиции могут присутствовать две или более такие последовательности нуклеиновой кислоты. Изобретение также относится к ДНК или соответствующей молекуле РНК.
В частности, настоящее изобретение относится к последовательности нуклеиновой кислоты, соответственно к выделенной последовательности нуклеиновой кислоты, из генного кластера сафрацина, включающего указанную последовательность нуклеиновой кислоты, часть или части указанной последовательности нуклеиновой кислоты, где указанные часть или части кодируют полипептид или полипептиды, или биологически активный фрагмент полипептида или полипептидов, к последовательности одноцепочечной нуклеиновой кислоты, полученной из указанной последовательности нуклеиновой кислоты, или к последовательности одноцепочечной нуклеиновой кислоты, выделенной из части или частей указанной последовательности нуклеиновой кислоты, или к последовательности двуцепочечной нуклеиновой кислоты, полученной из последовательности одноцепочечной нуклеиновой кислоты (такой как кДНК из мРНК). Последовательность нуклеиновой кислоты может представлять ДНК или РНК.
Более конкретно настоящее изобретение относится к последовательности нуклеиновой кислоты, соответственно к выделенной последовательности нуклеиновой кислоты, которая включает или содержит по меньшей мере SEQ ID 1, ее варианты или части, или по меньшей мере один из генов sacA, sacB, sacC, sacC, sacD, sacE, sacF, sacG, sacH, sacH, sacI, sacJ, orf1, orf2, orf3 или orf4, включая их варианты или части. Длина частей может составлять по меньшей мере 10, 15, 20, 25, 50, 100, 1000, 2500, 5000, 10000, 20000, 25000 или более нуклеотидов. Обычно длина этих частей находится в диапазоне от 100 до 5000 или от 100 до 2500 нуклеотидов и обладает биологической активностью.
Мутанты или варианты включают полинуклеотидные молекулы, в которых по меньшей мере один нуклеотидный остаток изменен, замещен, удален или введен. Также возможны множественные изменения различных нуклеотидов в 1, 2, 3, 4, 5, 10, 15, 25, 50, 100, 200, 500 или более положениях. Также возможны вырожденные варианты, которые кодируют один и тот же полипептид, а также невырожденные варианты, которые кодируют разные полипептиды. Часть, мутант или вариант последовательности нуклеиновой кислоты соответственно кодирует полипептид, который сохраняет биологическую активность соответствующего полипептида, кодируемого любой из открытых рамок считывания генного кластера сафрацина. Также возможны аллельные формы и полиморфизмы.
Настоящее изобретение также относится к последовательности выделенной нуклеиновой кислоты, способной гибридизоваться в жестких условиях с последовательностью нуклеиновой кислоты по настоящему изобретению. Особенно предпочтительной является гибридизация с последовательностью нуклеиновой кислоты по настоящему изобретению, имеющей транслируемую длину.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей полипептид, который по меньшей мере на 30%, предпочтительно на 50%, предпочтительно на 60%, более предпочтительно на 70%, в частности на 80%, 90%, 95% или более идентичен по аминокислотной последовательности полипептиду, кодируемому любой из открытых рамок считывания генного кластера сафрацина sacA - sacJ и оrf1 - orf4 (SEQ ID 1 и гены, кодируемые в SEQ ID 1) или кодируемому их вариантом или частью. Полипептид при этом сохраняет биологическую активность соответствующего полипептида, кодируемого любой из открытых рамок считывания генного кластера сафрацина.
В частности, настоящее изобретение относится к последовательности выделенной нуклеиновой кислоты, кодирующей любой белок SacA, SacB, SacC, SacD, SacE, SacF, SacG, SacH, SacI, SacJ, Orf1, Orf2, Orf3 или Orf4 (SEQ ID 2-15) и к ее вариантам, мутантам или частям.
В одном из аспектов последовательность выделенной нуклеиновой кислоты по настоящему изобретению кодирует пептидсинтетазу, L-Tyr производное гидроксилазы, L-Tyr производное метилазы, L-Tyr О-метилазу, метилтрансферазу или монооксигеназу, или белок резистентности к сафрацину.
Настоящее изобретение также относится к зонду для гибридизации, который представляет собой последовательность нуклеиновой кислоты, определенную выше, или ее часть. Зонды соответствующим образом включают последовательность из 5, 10, 15, 20, 25, 30, 40, 50, 60 или более нуклеотидных остатков. Предпочтительными являются последовательности с длиной от 25 до 60. Настоящее изобретение также относится к применению определенного выше зонда для обнаружения гена сафрацина или эктеинасцидина. В частности, данный ген используется для обнаружения генов в Ecteinascidia turbinata.
В родственном аспекте настоящее изобретение относится к полипептиду, кодируемому последовательностью нуклеиновой кислоты, определенной выше. Предусматривается полная последовательность, вариант, мутант или фрагмент полипептидов.
В другом аспекте настоящее изобретение относится к вектору, предпочтительно к вектору экспрессии, предпочтительно к космиде, содержащему последовательность нуклеиновой кислоты, кодирующую белок или биологически активный фрагмент белка, где указанная нуклеиновая кислота определена выше.
В другом аспекте настоящее изобретение относится к клетке-хозяину, трансформированной одной или более последовательностями нуклеиновой кислоты, определенными выше, или вектором, вектором экспрессии или космидой, определенной выше. Предпочтительную клетку-хозяина трансформируют экзогенной нуклеиновой кислотой, содержащей генный кластер, который кодирует полипептиды, достаточные для обеспечения сборки сафрацина или аналога сафрацина. Предпочтительно клетка-хозяин представляет собой микроорганизм, более предпочтительно бактерию.
Настоящее изобретение также относится к рекомбинантной бактериальной клетке-хозяину, в которой по меньшей мере часть последовательности нуклеиновой кислоты, определенной выше, разрушается с образованием рекомбинантной клетки-хозяина, которая продуцирует измененные уровни сафрацинового соединения или аналога сафрацина, по сравнению с соответствующей нерекомбинантной бактериальной клеткой-хозяином.
Настоящее изобретение также относится к способу получения сафрацинового соединения или аналога сафрацина, который заключается в ферментации в условиях и в среде, подходящих для продукции такого соединения или аналога, организма, такого как Pseudomonas sp., в котором повышается количество генов/кластера сафрацина, кодирующих полипептиды, достаточные для осуществления сборки сафрацина или аналогов сафрацина.
Настоящее изобретение также относится к способу получения сафрацинового соединения или аналога сафрацина, который заключается в ферментации в условиях или в среде, подходящих для получения такого соединения или аналога, организма, такого как Pseudomonas sp., в котором экспрессия генов, кодирующих полипептиды, достаточная для осуществления сборки сафрацина или аналогов сафрацина, модулируется путем воздействия или замещения одного или более генов или последовательностей, ответственных за регуляцию такой экспрессии. Предпочтительно экспрессия генов при этом повышается.
Настоящее изобретение также относится к применению композиции, содержащей по меньшей мере одну выделенную последовательность нуклеиновой кислоты, определенную выше, или ее модификацию, для комбинаторного биосинтеза нерибосомальных пептидов, дикетопиперазиновых колец и сафрацинов.
В частности, настоящий способ включает взаимодействие соединения, которое является субстратом полипептида, кодируемого одной или несколькими открытыми рамками считывания генного кластера биосинтеза сафрацина, определенного выше, с полипептидом, кодируемым одной или несколькими открытыми рамками считывания генного кластера биосинтеза сафрацина, при этом полипептид химически модифицирует это соединение.
В еще одном варианте настоящее изобретение также относится к способу получения сафрацина или аналога сафрацина. Этот способ включает получение микроорганизма, трансформированного экзогенной нуклеиновой кислотой, содержащей генный кластер сафрацина, который кодирует полипептиды, достаточные для осуществления сборки указанного сафрацина или аналога сафрацина; культивирование бактерий в условиях, при которых возможен биосинтез сафрацина или аналога сафрацина; и к выделению указанного сафрацина или аналога сафрацина из указанной клетки.
Настоящее изобретение также относится к любому соединению-предшественнику P2, P14, их аналогам и производным и к их применению в комбинаторном биосинтезе нерибосомальных белков, дикетопиперазиновых колец и сафрацинов.
Кроме того, настоящее изобретение также относится к новым сафрацинам, полученным путем выключения генов сафрацина P19B, P22A, P22В, D и Е, и к их применению в качестве антимикробных или противоопухолевых средств, а также к их применению в синтезе эктеинасцидиновых соединений.
Настоящее изобретение также относится к новым сафрацинам, полученным путем направленного биосинтеза, определенного выше, и к их применению в качестве антимикробных или противоопухолевых средств, а также к их применению в синтезе эктеинасцидиновых соединений. В частности, изобретение также относится к сафрацин-B-этокси или сафрацин-А-этокси и к их применению.
В одном из аспектов настоящее изобретение относится к получению структур, близких к сафрацинам и эктеинасцидинам, которые не могут быть получены химическим путем или это получение затруднено. Еще один аспект относится к использованию знаний, позволяющих осуществить биосинтез эктеинасцидинов в Ecteinascidia turbinata, например, c использованием этих последовательностей или их частей в качестве зондов в указанном организме или предполагаемом симбионте.
В основном настоящее изобретение открывает широкие возможности и позволяет получать эктеинасцидины с помощью генной инженерии.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1: Структурная организация хромосомного участка ДНК, клонированного в космиду pL30p. Показан участок ДНК P. fluorescens A2-2, содержащий генный кластер сафрацина. На чертеже показаны и sacABCDEFGH, и sacIJ, генные опероны и модулярная организация пептидсинтетаз, полученная на основе sacA, sacB и sacC. Указываются следующие домены: С - конденсация; Т - тиолирование; А - аденилирование и Re - редуктаза. Показано также расположение других генов, имеющихся в космиде pL30p (orf1 - orf4), а также их предполагаемые функции.
Фиг.2: Консервативные ядерные мотивы среди NRPS. Консервативные аминокислотные последовательности в белках SacA, SacB и SacC и их сравнение с гомологичными последовательностями из Myxococcus xanthus DM50415.
Фиг.3: Механизм биосинтеза NRPS, предлагаемый для образования дипептида Ala-Gly. Стадия a*: аденилирование Ala; b*: перенос на 4'-фосфопантетеиниловое плечо; c*: перенос к сайту ожидания/элонгации; d*: аденилирование Gly; e*: перенос на 4'-фосфопантетеиниловое плечо; f*: конденсация элонгируемой цепи на 4'-фосфопантетеиниловом плече со стартерной цепью на сайте ожидания/элонгации; g*: дипептид Ala-Gly, присоединенный к фосфопантетеиниловому плечу SacA и h*: перенос удлиненной цепи к следующему сайту ожидания/элонгации.
Фиг.4: Перекрестный эксперимент: А. Схема фрагментов ДНК А2-2, клонированных в вектор pBBR1-MCS2, и продукты, полученные в гетерологичном хозяине. B. Параметры ВЭЖХ сафрацина, продуцируемого в штамме дикого типа, в сравнении с sacF мутантом. Добавление предшественника Р2 к мутанту sacF при условии, что оба находятся в транс-положении и был использован синтетический метод, приводит к образованию сафрацина B. SfcA - сафрацин A и SfcB - сафрацин B.
Фиг.5: Схема механизма биосинтеза сафрацина и промежуточных продуктов биосинтеза. Отдельные ферментативные стадии указаны сплошными стрелками, а реакции с множественными стадиями указаны прерывистыми стрелками.
Фиг.6: Разрушение гена сафрацина и полученные соединения. А. Разрушение гена и молекул предшественника, синтезированных с использованием сконструированных мутантов. Гены, помеченные звездочкой, не принадлежат к сафрациновому кластеру. Было показано, что инактивация генов orf1, orf2, orf3 и orf4 не влияет на продукцию сафрацина. B. Параметры ВЭЖХ сафрацина, продуцируемого в штамме дикого типа, и в мутантах sacA, sacI и sacJ. Показаны структуры различных полученных молекул.
Фиг.7: Структура различных молекул, полученных при разрушении гена. Инактивация белка SacJ (a) приводит к образованию молекул P22B, P22A и Р19, тогда как разрушение гена sacI (b) дает только соединение P19. Разрушение sacI в сочетании с восстановленной экспрессией sacJ дает два новых сафрацина: сафрацин D (возможный предшественник в полусинтезе ET-729) и сафрацин Е (с).
Фиг.8: Добавление специфически разработанных "неприродных" предшественников (Р3). Химическая структура двух молекул, полученных при добавлении Р3 соединения к мутанту sacF.
Фиг.9: Схема процесса разрушения гена путем простой рекомбинации с использованием фрагмента гомологичной ДНК, клонированного в pK18:MOB (плазмида, интегрированная в Pseudomonas).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Нерибосомальные пептидсинтетазы (NRPS) представляют собой ферменты, отвечающие за биосинтез семейства соединений, которое охватывает большое количество структурно и функционально различных природных продуктов. Так, например, пептидов с биологической активностью, которая обеспечивает структурный каркас соединений с разнообразной биологической активностью, таких как антибиотики, противовирусные, противоопухолевые и иммуносупрессорные соединения (Zuber et al., Biotechnology of Antibiotics 1997 (W. Strohl, ed.), 187-216 Marcel Dekker, Inc., N.Y; Мarahiel et al., Chem. Rev. 1997, 97, 2651-2673).
Несмотря на структурное различие, большая часть этих биологически активных пептидов имеет общий механизм биосинтеза. В соответствии с этой моделью образование пептидной связи происходит на мультиферментных комплексах, разработанных пептидсинтетазах, на которых аминокислотные субстраты активируются за счет гидролиза АТФ до соответствующего аденилата. Полученный нестабильный промежуточный продукт затем переносится на другой сайт мультиферментного комплекса, где он связывается в виде сложного тиоэфира с цистеаминовой группой фермент-связанного 4'-фосфопантетенинилового (4'-РР) кофактора. На этой стадии тиол-активированные субстраты могут модифицироваться, например эпимеризироваться или N-метилироваться. Тиоэтерифицированные аминокислотные субстраты затем объединяются с образованием пептидного продукта через постадийную элонгацию в серии реакций транспептидации. При таком временном размещении пептидсинтетаз модули, по-видимому, действуют независимо друг от друга, но они действуют сообща и катализируют образование соответствующих пептидных связей (Stachelhaus et al., Science 1995, 269, 69-72; Stachelhaus et al., Сhem. Biol, 1996, 3, 913-921). Общая схема нерибосомального биосинтеза пептидов подробно описана в литературе (Marahiel et al., Chem. Rev. 1997, 97, 2651-2673; Konz and Marahiel, Chem. and Biol. 1999, 6, R39-R48; Moffit and Neilan, FEMS Microbiol. Letters 2000, 191, 159-167).
Было клонировано большое количество бактериальных оперонов и генов грибов, кодирующих пептидсинтетазы, которые были недавно клонированы, секвенированы и частично охарактеризованы, что дало ценную информацию об архитектуре молекулы (Marahiel et al., Chem. and Biol. 1997, 4, 561-567). Использовали различные подходы клонирования, включая исследование библиотек экспрессии антителами, возникающими в ответ на пептидсинтетазы, комплементацию дефицитных мутантов и использование олигонуклеотидов, сконструированных на основе аминокислотных последовательностей фрагментов пептидсинтетазы.
Анализ первичной структуры этих генов показал наличие явных гомологичных доменов размером примерно 600 аминокислот. Эти специфические функциональные домены состоят по меньшей мере из шести высококонсервативных последовательностей с длиной от трех до восьми аминокислот, порядок следования которых и расположение во всех известных доменах очень сходен (Kusard and Marahiel, Peptide Research, 1994, 7, 238-241). Использование вырожденных олигонуклеотидов, полученных из консервативных участков, дает возможность идентификации и клонирования пептидсинтетаз из геномных ДНК путем использования методики полимеразно-цепьевой реакции (ПЦР) (Kusard and Marahiel, Peptide Research, 1994, 7, 238-241; Borchert et al., FEMS Microbiol Letters 1992, 92, 175-180).
Структура сафрацина предполагает, что это соединение синтезируется по механизму NRPS. Клонирование и экспрессия нерибосомальных пептидсинтетаз и ассоцированных «хвостовых» ферментов из кластера сафрацина Pseudomonas fluorescens A2-2 могло бы позволить продукцию неограниченного количества сафрацина. Кроме того, клонированные гены могли бы использоваться для создания комбинаторными методами новых аналогов сарфацина, которые могут обладать улучшенными свойствами и которые могут использоваться в полусинтезе новых эктеинасцидинов. Кроме того, клонирование и экспрессия генного кластера сафрацина в гетерологичных системах или сочетание генного кластера сафрацина с другими генами в системе NRPS может привести к созданию новых лекарственных средств с улучшенной активностью.
Настоящее изобретение относится, в частности, к последовательности ДНК, кодирующей NRPS, которая ответственна за биосинтез сафрацина, например синтетаз сафрацина. Авторы описали участок длиной 26705 пн (SEQ ID No. 1) из генома Pseudomonas fluorescens A2-2, клонированного в космиде pL30P, и показали путем экспериментов с выключением генов и гетерологичной экспрессии, что этот участок ответственен за биосинтез сафрацина. Авторы экспрессировали космиду pL30P в двух штаммах Pseudomonas sp., которые не продуцируют сафрацин, и в результате осуществили продукцию сафрацина A и B на уровнях до 22% в случае Pseudomonas fluorescens (CECT 378), и 2% в случае Pseudomonas aerugenosa (CECT 110) по сравнению с продукцией P. fluorescens A2-2. Предсказанные аминокислотные последовательности различных белков, кодируемых этой последовательностью ДНК, показаны в последовательностях SEQ ID No. 2 - SEQ ID No. 15 соответственно.
Выделенный из P. fluorescens A2-2 генный кластер биосинтеза сафрацина характеризуется наличием нескольких открытых рамок считывания (OРС), которые организованы в два различных оперона (фиг.1), в оперон с восемью генами (sacABCDEFGH) и оперон с двумя генами (sacIJ), которым предшествуют достаточно консервативные участки предположительных перекрывающихся промоторов. Генный кластер биосинтеза сафрацина присутствует лишь в одной копии генома P. fluorescens A2-2.
Полученные авторами результаты указывают на то, что оперон из восьми генов возможно отвечает за биосинтез каркаса сафрацина, а оперон из двух генов возможно ответственен за создание на финальном этапе «хвостового» участка в молекулах сафрацина.
В опероне sacABCDEFGH установленные аминокислотные последовательности, кодируемые sacA, sacB и sacC, очень сходны с генными продуктами NRPS. В пределах установленных аминокислотных последовательностей SacA, SacB и SacC на каждой из ОРС идентифицирован один пептидсинтетазный модуль.
Первым удивительным свойством белков сафрациновых NRPS является то, что среди известных активных сайтов и коровых участков пептидсинтетаз (Konz and Marahiel, Chem. and Biol. 1999, 6, R39-R48) первый коровый участок является слабо консервативным во всех трех пептидсинтетазах: SacA, SacB и SacC (фиг.2). Другие пять коровых участков являются достаточно консервативными в трех генах сафрациновых NRPS. Биологическое значение первого корового участка (LKAGA) не известно, но ядерные последовательности SGT(ST)TGxPKG (Gocht and Marahiel, J. Bacteriol. 1994, 176, 2654-266; Konz and Marahiel, Chem. and Biol. 1999, 6, R39-R48), TGD (Gocht and Marahiel, J. Bacteriol. 1994, 176, 2654-2662; Konz and Marahiel, 1999) и KIRGxRIEL (Pavela-Vrancic et al., J. Biol Chem. 1994, 269, 14962-14966; Konz and Marahiel, Chem. and Biol. 1999, 6, R39-R48) могут быть предназначены для связывания АТФ и гидролиза. Остаток серина в коровой последовательности LGGxS может быть представлен как сайт образования сложного тиоэфира (D'Souza et al., J. Bacteriol. 1993, 175, 3502-3510; Vollenbroich et al., FEBS Lett. 1993, 325(3), 220-4; Konz and Marahiel, Chem. and Biol. 1999, 6, R39-R48) и связывания 4'-фосфопантетеина (Stein et al., FEBS Lett. 1994, 340, 39-44; Konz and Marahiel, Chem. and Biol. 1999, 6, R39-R48). Эти результаты наряду с тем фактом, что сафрацин, по всей видимости, синтезируется из аминокислот, поддерживает гипотезу о том, что образование нерибосомальной пептидной связи через механизм участия тио-содержащей матрицы происходит в процессе пути биосинтеза сафрацина и что sacA, sacB и sacC кодируют соответствующие пептидсинтетазы. В соответствии с этим механизмом аминокислоты активируются как аминоациладенилаты в результате гидролиза АТФ и затем ковалентно связываются с ферментом через карбоксил-тиоэфирные связи. Затем на последующих стадиях происходит транспептидация и образование пептидной связи.
Во-вторых, удивительно, что полученные авторами данные четко указывают на то, что в системе синтетаз сафрацина не сохраняется правило колинеарности, в соответствии с которым порядок модулей аминокислотного связывания по хромосоме соответствует порядку аминокислот в пептиде. В соответствии с информацией, имеющейся в базе данных по гомологии последовательностей, а также по гомологии сафрациновых и сафрамициновых структур, SacA отвечает за распознавание и активацию остатка Gly, а SacВ и SacС отвечают за распознавание и активацию двух производных L-Tyr, которые включаются в сафрациновый каркас, тогда как предполагаемый ген Ala-NRPS может отсутствовать в генном кластере сафрацина. В нескольких нерибосомальных генных кластерах пептидсинтетаз, например, пути биосинтеза пристамицина (Crecy-Lagard et al., J. of Вacteriol. 1997, 179(3), 705-713) и фосфинотрицинового трипептида (Schwartz et al,. Appl Environ Microbiol 1996, 62, 570-577), первый NRPS расположен не рядом со вторым геном NRPS. Конкретно в пути биосинтеза пристамицина первый структурный ген (snbA) и второй структурный ген (snbC) находятся на расстоянии 130 т.п.н. Такая ситуация не наблюдается в генном кластере сафрацина, для которого по результатам гетерологичной экспрессии с использованием космиды pL30P четко видно отсутствие NRPS гена, поскольку происходит гетерологичная продукция сафрацина.
В-третьих, даже если вопрос о механизме, посредством которого образуется дипептид Ala-Gly, остается открытым, присутствие sacA за пределами С домена на аминоконце первого гена NRPS позволяет предположить, что данный ген будет действовать в системе бифункциональной активации аденилирования. Авторы полагают, что Ala сначала может быть внесен на фосфопантетеиниловое «плечо» SacA (фиг.3a* и b*) перед переносом в положение ожидания, домен конденсации, расположенный на N-конце SacA (фиг.3с*). Затем Gly аденилат вносится на то же самое фосфопантетеиниловое плечо (фиг.3d* и e*), расположенное в сайте элонгации, и происходит элонгация (фиг.3f*). Плечо первого модуля будет на данном этапе нести дипептид Ala-Gly (фиг.3g*). Авторы полагают, что этот/такой дипептид будет затем перенесен в положение ожидания второго фосфопантетеинилового плеча (фиг.3h*), расположенное в SacB, для продолжения синтеза на основном каркасе сафрацинового тетрапептида. В альтернативном механизме биосинтеза дипептид Ala-Gly может непосредственно вводиться в SacA. В этом случае дипептид может был образован в результате активности представителей семейства высокоактивных пептидилтрансферазных рибозимов (Sun et al., Chem. and Biol. 2002, 9, 619-626) или в результате активности ферментов бактериального протеолиза.
И, в-четвертых, хотя в случае большинства прокариотических пептидсинтетаз фосфоэстеразный фрагмент, который, скорее всего, ответственен за высвобождение зрелой пептидной цепи из ферментного комплекса, сливается с С-терминальным концом последнего модуля связывания аминокислоты (Marahiel et al, Chem. Rev. 1997, 97, 2651-2673), в случае сафрациновых синтетаз ТЕ домен отсутствует. Вероятно, в пути синтеза сафрацина после прохождения последней стадии элонгации тетрапептид может высвобождаться по альтернативному подходу осуществления терминации синтеза пептидной цепи, что также происходит при синтезе сафрамицина (Pospiech et al., Microbiol. 1996, 142, 741-746). В рамках данного конкретного подхода процесс терминации катализируется доменом редуктазы на карбокситерминальном конце SacC пептидсинтетазы, которая катализирует восстановительное расщепление связанной ацильной группы, присоединенной к Т-домену, с высвобождением линейного альдегида.
Перекрестные эксперименты авторов показали, что последние две аминокислоты, введенные в сафрациновую молекулу, представляют собой два производных L-Tyr, называемых Р2 (3-гидрокси-5-метил-О-метилтирозин) (фиг.4, 5), вместо двух L-Tyr, как предполагалось в случае синтеза сафрамицина. Во-первых, продукты двух генов (sacF и sacG), аналогичные бактериальным метилтрансферазам, как было показано, участвуют в O-, C-метилировании L-Tyr с образованием P14 (3-метил-О-метилтирозин), предшественника Р2. Возможный механизм может быть основан на том, что сначала происходит О-метилирование, а затем осуществляется С-метилирование аминокислотного производного. Во-вторых, Р2, субстрат для пептидсинтетаз SacB и SacC образуется при гидроксилировании P14 под действием SacD (фиг.4, 5):
| C11H15NO3 Точная масса: 209,11Мол. масса: 209,24,С - 63,14; H - 7,23; N - 6,69;O - 22,94 | C11H15NO4 Точная масса: 225,10Мол. масса: 225,24,С - 58,66; H - 6,71; N - 6,22; O - 28,41 |
| Р-14 | Р-2 |
Кроме генов, участвующих в биосинтезе сафрацина, в опероне sacABCDЕFGH были также обнаружены два гена sacE и sacH с неизвестной функцией и вовлеченные в механизм устойчивости к сафрацину соответственно. Авторы показали, что sacH ген кодирует белок, который в случае гетерологичной экспрессии в других штаммах Pseudomonas генерирует выраженное повышение резистентности к сафрацину B. Предполагают, что SacH является трансмембранным доменом, который трансформирует C21-OH группу сафрацина B в C21-H группу с образованием сафрацина A, соединения с меньшей антибиотической и противоопухолевой активностью. И наконец, даже несмотря на то, что все еще неизвестны возможные функции SacE, было обнаружено, что гомологи этого гена близки к различным вторичным метаболитам в биосинтетической цепи генного кластера в геномах некоторых микроорганизмов, что позволяет предположить наличие консервативной функции данных генов в образовании или регуляции вторичных метаболитов.
В опероне sacIJ установленные аминокислотные последовательности, кодируемые sacI и sacJ, в высокой степени сходны с генными продуктами метилтрансферазы и гидроксилазы/монооксигеназы соответственно. Данные, полученные авторами, показывают, что SacI представляет собой фермент, ответственный за N-метилирование, присутствующее в сафрациновой структуре, и что SacJ представляет собой белок, который дополнительно гидроксилирует на одном из производных L-Tyr в тетрапептиде, с образованием хиноновой структуры, присутствующей во всех сафрациновых молекулах. N-метилирование представляет собой одну из модификаций пептидов, синтезируемых по нерибосомальному механизму, которые вносят значительный вклад в их биологическую активность. За исключением сафрамицина (Pospiech et al., Microbiol. 1996, 142, 741-746), который продуцируют бактерии и который N-метилируется, все известные N-метилированные нерибосомальные белки продуцируются грибами или актиномицетами и в большинстве случаев за такое N-метилирование отвечает домен, который находится в нерибосомальной пептидсинтетазе (см. табл.I).
| Таблица I | |||||
| Краткое описание генов биосинтеза сафрацина и генов устойчивости, идентифицированных в космиде pL30P | |||||
| Наименование ОРС | Белок | Предполагаемая функция | Положение стартера стоп-пн | Аминокис-лоты | Молекулярная масса |
| sacA | SacA | пептидсинтетаза | 3052-6063 | 1004 | 110,4 |
| sacB | SacB | пептидсинтетаза | 6068-9268 | 1063 | 117,5 |
| sacC | SacC | пептидсинтетаза | 9275-13570 | 1432 | 157,3 |
| sacD | SacD | L-Tyr-производное гидроксилазы | 13602-14651 | 350 | 39,2 |
| sacE | SacE | неизвестная | 14719-14901 | 61 | 6,7 |
| sacF | SacF | L-Tyr-производное метилазы | 14962-16026 | 355 | 39,8 |
| sacG | SacG | L-Tyr О-метилаза | 16115-17155 | 347 | 38,3 |
| sacH | SacH | Белок резистентности | 17244-17783 | 180 | 19,6 |
| sacI | SacI | Метилтрансфераза | 2513-1854 | 220 | 24,2 |
| sacJ | SacJ | монооксигеназа | 1861-355 | 509 | 55,3 |
На фиг.5 показан вероятный путь синтеза сафрацина, где указаны специфические аминокислотные субстраты, использующиеся в каждой реакции конденсации, и различные ферменты, активность которых необходима после конденсации.
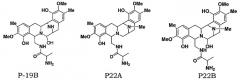
Для дальнейшей оценки роли генов биосинтеза сафрацина авторами были сконструированы мутанты с выключением каждого из генов в кластере сафрацина (фиг.6). Разрушение генов NRPS (sacA, sacB и sacC), а также sacD, sacF и sacG, приводит к получению мутантов, не продуцирующих сафрацин и Р2. Полученные авторами результаты указывают на то, что гены из sacА-sacH являются частью одного и того же генетического оперона. В результате разрушения генов sacI и sacJ образуются три новые молекулы: P19B, Р22A и P22B (фиг.6):
Продукция P22A и P22B (фиг.7а*) sacJ мутантом указывает на то, что роль SacJ заключается в осуществлении дополнительного гидроксилирования в левых производных L-Tyr аминокислоты сафрацина, вовлеченных в хиноновое кольцо. Образование sacI мутантом Р19В (фиг.7 b*) молекулы, подобной сафрацину, в которой отсутствует N-метилирование и хиноновое кольцо, подтверждает тот факт, что SacI является N-метилтрансферазой и дает основание полагать, что sacIJ является опероном, участвующим в транскрипции. Образование Р19В мутантом sacJ (фиг.7а*) также дает основание предположить, что N-метилирование, вероятно, происходит после образования хинонового кольца. Даже несмотря на то, что указанные новые структуры не обладают интересующей антимикробной активностью в отношении B. subtilis или не оказывают высокого цитотоксического воздействия на раковые клетки, они могут служить в качестве новых предшественников для полусинтеза новых активных молекул. Что касается структурной активности, наблюдение что Р19В, Р22А и Р22В теряют свою активность, позволяет полагать, что отсутствие хинонового кольца в сафрациновой структуре непосредственно связано с потерей активности молекул семейства сафрацинов.
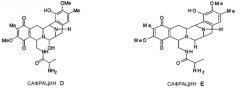
Разрушение sacl гена с последующим восстановлением экспрессии гена sacJ приводит к образованию двух новых сафрацинов. Два полученные антибиотика с уровнями продукции такими же высокими, как и в случае продуцирования сафрацина А/сафрацина В в штамме дикого типа, были названы сафрацин D и сафрацин Е (фиг.7 с*):
Сафрацин D и сафрацин Е представляют собой молекулы, подобные сафрацину В и сафрацину А соответственно, в которых отсутствует N-метилирование. Было показано, что и сафрацин D и сафрацин Е обладают такой же антибактериальной и противоопухолевой активностью, что и сафрацин В и сафрацин А соответственно. Сафрацин D, кроме высокой антибактериальной и противоопухолевой активности, обладает свойствами, позволяющими использовать его в полусинтезе эктеинасцидина ЕТ-789, мощного противоопухолевого средства, а также в полусинтезе новых эктеинасцидинов.
Возни