Средство гемореологическое, снижающее инсулинорезистентность и восстанавливающее толерантность организма к глюкозе, и фармацевтическая композиция на его основе
Иллюстрации
Показать всеНастоящее изобретение относится к применению дигидрохлорида 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а] бензимидазола в качестве соединения, подавляющего агрегацию эритроцитов и снижающего вязкость крови, а также снижающего инсулинорезистентность и восстанавливающего толерантность организма к глюкозе. Также изобретение относится к фармацевтической композиции на основе указанного дигидрохлорида. Технический результат: изучены новые возможности указанного соединения. 2 н. и 1 з.п. ф-лы, 9 ил., 9 табл.
Реферат
Изобретение относится к фармакологии, а именно к биологически активным веществам и композициям, обладающим одновременно гемореологическими свойствами и свойствами снижать инсулинорезистентность и восстанавливать толерантность организма к глюкозе, которые могут быть использованы при создании препаратов, снижающих инсулинорезистентность и подавляющих агрегацию эритроцитов. Данное сочетание двух видов активности чрезвычайно важно, так как при сахарном диабете на ранних стадиях развития отмечается нарушение микроциркуляции, проявление синдрома повышенной вязкости крови и развития сладж синдрома (Дедов И.И., Фадеев В.В. Введение в диабетологию. - М., 1998. - 199 с.).
Известно, что при сахарном диабете 2 типа ведущим механизмом развития заболевания является снижение чувствительности организма к инсулину - синдром инсулинорезистентности (Балаболкин М.И., Клебанова Е.М., Креминская В.М. Лечение сахарного диабета и его осложнений. Руководство для врачей. - М.: Медицина, 2005, с.18-21). При этом происходит существенное изменение тромбогенного потенциала крови и ее гемореологических свойств. Так повышается способность тромбоцитов к агрегации, что и определяет высокую способность к тромбообразованию (повышается тромбогенный потенциал крови). Кроме того, повышается способность эритроцитов к агрегации с развитием сладж синдрома, в конечном итоге проявляющегося увеличением вязкости крови и нарушением микроциркуляции (Балаболкин М.И., Клебанова Е.М., Креминская В.М. Лечение сахарного диабета и его осложнений. Руководство для врачей. - М.: Медицина, 2005, с.283).
Существует ряд синтетических гипогликемических препаратов, снижающих инсулинорезистентность, восстанавливающих толерантность организма к углеводам и предназначенных для лечения сахарного диабета при пероральном применении. Все эти препараты делятся на две основные группы: бигуаниды и производные сульфонилмочевины.
Наиболее близким по выполнению и достигаемому результату является диабетон (гликлазид) 1-(3-азабицикло[3,3,0]октил-3)-3-(пара-толилсульфонил) мочевина (М.Д. Машковский. - Лекарственные средства. - 15-е изд., перераб., исп.и доп.- М.: Новая волна, 2006. - С.561.), разработанный фирмой «Сервье» (Франция). Действие его связано главным образом с восстановлением физиологического профиля продукции инсулина, снижением инсулинорезистентности и снижением агрегации тромбоцитов. Этот препарат уже длительное время используется при сахарном диабете 2 типа не только для сахароснижающего эффекта, но и для стабилизации тромбогенного потенциала крови и гемореологии. Так гликлазид снижает способность тромбоцитов к агрегации, нормализует нарушенный фибринолитический потенциал сосудистой стенки и процесс фибринолиза, замедленный при сахарном диабете. Гликлазид как сахароснижающее средство начинает действовать через 1 час после приема, максимум эффекта наблюдается между 4-м и 8-м часом, продолжительность действия немного меньше 20 часов. Ангиопротективное влияние проявляется лишь после 3-х месяцев лечения и еще более отчетливо через 6-12 месяцев.
Таким образом, применяемые в настоящее время в клинической практике гипогликемические препараты, сочетающие сахароснижающий эффект с микроваскулярным действием, не являются совершенными, так как у некоторых из них ангиопротективное влияние проявляется только после 3-12 месяцев после начала приема (гликлазид) (Балаболкин М.Н., Клебанова Е.М., Креминская В.М. - Лечение сахарного диабета и его осложнений. - М.: ОАО «Издательство «Медицина», 2005. - С.167-177). Поэтому потребность в препаратах, сочетающих сахароснижающий эффект с ангиопротективным действием, но более эффективных, чем уже применяемые в клинической практике, весьма велика, и создание лекарственных средств с подобным оригинальным механизмом действия является актуальным.
Техническим результатом изобретения является повышение эффективности гемореологического действия (способности снижать повышенную вязкость крови и агрегацию эритроцитов), а также проявление свойства снижения инсулинорезистентности и восстановления толерантности организма к глюкозе при сахарном диабете, преддиабете, синдроме инсулинорезистентности и ожирении.
Технический результат достигается дигидрохлоридом 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола (I):
Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола известен как соединение, обладающее гипогликемической (сахаропонижающей) и антиагрегантной активностью (способностью к снижению тромбогенного потенциала крови, т.е. снижению вероятности образования тромбов в кровеносном русле) (Anisimova V.A., Levchenko M.V., Korochina T.B., Spasov A.A., Kovalev S.G., Dudchenko G.P. Fr.Pat. 2691462 (1995), Bull., 95/23; EP 0571253. Ковалев Г.В., Спасов A.A., Анисимова В.А., Вдовина Г.П., Ковалев С.Г., Балаболкин М.И., Мамаева Г.Г., Дудченко Г.П., Левченко М.В. Пат. РФ №206148 (1996); бюл. №20). У соединения выявлена дополнительно гемореологическая активность (способность снижать повышенную вязкость крови, агрегацию эритроцитов и в конечном итоге приводить к восстановлению микроциркуляции), а также активность, снижающая инсулинорезистентность и восстанавливающая толерантность организма к глюкозе при сахарном диабете, преддиабете, синдроме инсулинорезистентности и ожирении.
Технический результат достигается также фармацевтической композицией при следующем соотношении ингредиентов, вес.%:
| дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола | 20-92 |
| крахмал и/или поливинилпирролидон М.м 7800-35000 (ПВП), | |
| и/или натрий карбоксиметилцеллюлоза (NаКМЦ) | |
| или оксипропилметилцеллюлоза (ОПМЦ) | 7-40 |
| кальция и/или магния стеараты | 0,3-1,0 |
| микрокристаллическая целлюлоза (мкц) и/или лактоза | остальное (до 100) |
Крахмал и/или поливинилпирролидон, NаКМЦ, ОПМЦ, мкц, лактозу использовали в качестве наполнителя и связывающего компонента гранул, кальция и/или магния стеарат - в качестве смазывающего антифрикционного компонента (Чуешев В.И., Чернов Н.Е., Хохлова Л.Н. и др. Промышленная технология лекарств, Харьков, Издательство НФАУ МКТ-книга, 2002, т.2, с.330-334). В то же время поливинилпирролидон, NaKМЦ, ОПМЦ и микрокристаллическая целлюлоза использовалась для пролонгирования действия субстанции (Чуешев В.И., Чернов Н.Е., Хохлова Л.Н. и др. Промышленная технология лекарств, Харьков, Издательство НФАУ МКТ-книга, 2002, т.2, с.352-355).
Фармацевтическую композицию получают следующим образом: для этого активное вещество дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола смешивают с рассчитанным количеством лактозы до получения однородной массы, затем увлажняют водным раствором связующего вещества: крахмала, и/или ПВП, и/или (NAKMЦ), и/или ОПМЦ, гранулируют, получая гранулы до 2 мм, сушат при температуре не более 100 градусов, гранулируют, получая гранулы не более 1 мм. Полученные гранулы опудривают антифрикционными веществами: кальция и/или магния стеаратами и мкц. Полученную смесь помещают в твердые желатиновые капсулы с крышечкой или прессуют таблетки массой от 0,1-0,5 г.
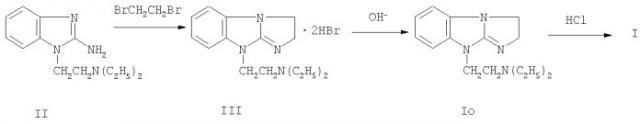
Способ получения соединения I заключается в конденсации 2-амино-1-диэтиламиноэтилбензимидазола II с избытком дибромэтана, выделении из образующегося в результате реакции дигидробромида 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола III основания Io действием щелочного агента и последующем переводе последнего в дигидрохлорид I обычными приемами, например действием раствора HCl.
Ниже приведен пример получения соединения I.
Пример 1. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а] бензимидазола (I).
Перемешиваемую суспензию 69,6 г (0,3 моль) 2-амино-1-диэтиламиноэтилбензимидазола (II) в 104 мл (1,2 моль) дибромэтана нагревают 30 мин при 140-145°С. Добавляют 80 мл ДМФА и нагревают смесь еще 10-15 мин. Охлаждают до 20-25°С, осадок отфильтровывают, промывают ДМФА и ацетоном, получая 106 г дигидробромида III (84%). Последний растворяют в 230 мл воды и подщелачивают 40%-ным раствором едкого натра до рН 10. Выделяющееся на поверхности светло-желтое масло (основание Tо) экстрагируют толуолом. Толуольную вытяжку промывают водой и сушат. Толуольный раствор подкисляют добавлением насыщенного раствора хлористого водорода в 2-пропаноле до рН 1. Выделившийся тяжелый бесцветный осадок дигидрохлорида I через 4-5 ч отфильтровывают, промывают ацетоном и высушивают при 100-110°С до постоянного веса. Выход 75 г (90,9%, считая на дигидробромид III, и 75%, считая на исходный амин II). Очищают технический «диабенол» до фармакопейной чистоты перекристаллизацией из 2-пропанола. Т.пл. 258-259°С. Найдено, %: С 54,4; Н 7,2; Cl 21,2; N 16,8. C15H22N4·2HCl. Вычислено, %: С 54,4; Н 7,3; Cl 21,4; N 16,9. УФ-спектр (0,0025%-ный раствор дигидрохлорида I в 95%-ном EtOH), λmax, нм: 217±2, 279±2 и плечо при (282-286)±2. ИК-спектр (ваз. масло) соединения I, см-1: 1665 (C=N). Спектр ЯМР 1Н (D2O), внутренний стандарт - ГМДС, м.д.: 1,29 (6Н, т, 2СН3), 3,35 (4Н, к, 2СН2), 3,69 (2Н, т, CH2N), 4,41 (4Н, с, внутрицикл. (СН2)2), 4,62 (2Н, т, NCH2), 7,41 (4Н, м, аромат. Н).
Реакцию с дибромэтаном можно проводить и в других растворителях, например ксилол, диоксан, диэтиленгликоль, диэтоксиэтан, бензонитрил, пропиленкарбонат, диметилсульфоксид, диметилформамид, однако лучшие результаты все же получены при проведении реакции в избытке дибромэтана.
Ниже приведены примеры получения композиции.
Пример 2. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а] бензимидазола (0,1 г) увлажняют 0,02 г NAKMЦ в виде раствора, гранулируют, сушат, гранулируют и просеивают через сито с диаметром отверстий не более 1 мм. Полученную массу опудривают 0,001 г кальция стеарата с размером частиц не более 0,16 мм и прессуют таблетки на таблеточном прессе.
Пример 3. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола (0,15 г) увлажняют 0,04 г ОПМЦ в виде раствора, гранулируют, сушат, гранулируют и просеивают через сито с диаметром отверстий не более 1 мм. Полученную массу опудривают 0,007 г кальция стеарата с размером частиц не более 0,16 мм и прессуют таблетки на таблеточном прессе.
Пример 4. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]-бензимидазола (0,1 г) смешивают с 0,355 г лактозы, увлажняют 0,04 г ПВП в виде раствора, гранулируют, сушат, гранулируют и просеивают через сито с диаметром отверстий не более 1 мм. Полученную массу опудривают 0,005 г кальция стеарата с размером частиц не более 0,16 мм и прессуют таблетки на таблеточном прессе.
Пример 5. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]-бензимидазола (0,1 г) увлажняют 0,07 г крахмала в виде клейстера, гранулируют, сушат, гранулируют и просеивают через сито с диаметром отверстий не более 2 мм. Полученную массу опудривают 0,004 г магния стеаратом с размером частиц не более 0,16 мм и прессуют таблетки на таблеточном прессе.
Пример 6. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]-бензимидазола (0,15 г) увлажняют 0,06 г ОПМЦ в виде раствора, гранулируют, сушат, гранулируют и просеивают через сито с диаметром отверстий не более 1 мм. Полученную массу опудривают 0,004 г магния стеарата с размером частиц не более 0,16 мм, фасуют и упаковывают в желатиновые капсулы с крышечкой.
Пример 7. Дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]-бензимидазола (0,1 г) увлажняют 0,009 г ПВП в виде раствора, гранулируют, сушат, гранулируют и просеивают через сито с диаметром отверстий не более 1 мм, смешивают с 0,09 г мкц до получения однородной смеси. Полученную массу опудривают 0,0017 г магния стеарата с размером частиц не более 0,16 мм, фасуют и упаковывают в желатиновые капсулы с крышечкой. Все полученные таблетки и капсулы дигидрохлорида 9-диэтиламиноэтил-2,3-дигидроимидазо-[1,2-а]бензимидазола удовлетворяют требованиям ГФ XI издания. Эти данные представлены в табл.1.
| Таблица 1 | |||||
| Показатели качества гранулятов, таблеток и капсул препарата на основе дигидрохлорида 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола, приготовленных с различными вспомогательными веществами | |||||
| Состав | Сыпучесть, г/с | Сила выталкивания, Н | Механическая прочность | Распадаемость, с | |
| сжатие, Н | истирание, % | ||||
| 2 | 6,25±0,23 | 130 | 76,82±1,56 | 99,1±0,4 | 294±19 |
| 3 | 5,63±0,17 | 288 | 82,57±1,92 | 99,3±0,7 | 210±18 |
| 4 | 5,41±0,15 | 171 | 62,93±1,97 | 98,7±0,5 | 222±29 |
| 5 | 6,20±0,34 | 190 | 82,57±2,72 | 99,1±0,6 | 480±11 |
| 6 | 6,39±0,35 | - | - | - | 666±7 |
| 7 | 5,87±0,19 | - | 597±18 |
Предлагаемое соотношение действующих и вспомогательных веществ является оптимальным, обеспечивает получение качественных таблетированных и капсулированных лекарственных препаратов соединения I и достижение необходимого терапевтического эффекта.
Изучение биодоступности фармацевтической композиции
Исследование биодоступности фармацевтической композиции - в соответствии с «Методическими рекомендациями по доклиническому изучению фармакокинетики лекарственных средств» (Фирсов А.А. Методические указания по проведению доклинических исследований фармакокинетики фармакологических веществ и лекарственных средств / А.А.Фирсов, В.П.Жердев и др. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ: под общ. ред. Р.У.Хабриева. - 2-изд., перераб. и доп. - М.: ОАО «Издательство «Медицина», 2005. - С.217-229).
Эксперименты по изучению фармакокинетики субстанции препарата I и ее фармацевтической композиции с ПВП были выполнены на 100 белых беспородных крысах-самцах массой 160-200 г. Субстанцию и композицию вводили зондом внутрижелудочно в дозе 25 мг/кг (из расчета на субстанцию). Взятие проб крови проводили через 0,5; 1; 2; 3 и 5 часов и мочи через 1, 2, 3, 4, 6, 8, 12, 25, 36,48, 60 и 72 часа после введения изучаемого соединения или композиции. Сбор мочи осуществляли в метаболических камерах «Termoplast» (Италия). Кровь стабилизировали 5% раствором цитрата натрия.
Содержание соединения I определяли методом ВЭЖХ на жидкостном хроматографе «HEWLETT PACKARD» (США) серии 1050 с колонкой той же фирмы размером 100×2,1 мм, с сорбентом Hypersil MOS 5 мкм, при помощи элюента, содержащего 30% ацетатного буфера с рН 5.0 и 70% ацетонитрила, со скоростью потока 1 мл/мин, давлением 135 bar и чувствительностью 0,01 AU. Детектирование проводили на УФ-детекторе при длине волны 280 nm. При этих условиях время удержания препарата I - 5 минут. Чувствительность 100 нг/мл. Извлечение данного препарата проводили из цельной крови при экстракции ацетонитрилом в соотношении 1:1. Пробы центрифугировали 15 мин при 3000 об/мин. Концентрацию препарата I определяли с помощью калибровочного графика.
Фармакокинетические параметры рассчитывали методом статистических моментов (Пиотровский В.К. Метод статистических моментов и интегральные модельно независимые параметры фармакокинетики. - Фармакология и токсикология. - 1986. - №5. - т.49. - с.118-127).
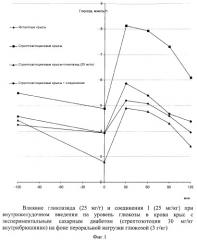
Фармакокинетическая кривая (фиг.1) при изучении композиции имеет аналогичный вид по сравнению с кинетикой кривой при введении субстанции соединения I с той лишь разницей, что снижение концентрации происходит не к 3-му, а к 5-му часу. Следует отметить, что при введении субстанции соединения I несколько быстрее достигается максимальная концентрация в крови.
Таким образом, при введении композиции наблюдается увеличение циркуляции соединения I в крови крыс, сопровождающееся увеличением периода полувыведения, временем пребывания молекулы соединения I в организме (MRT) и снижением общего клиренса на 21,4%. Фармакокинетические параметры субстанции I и композиции препарата представлены в табл.2. Относительная биодоступность композиции по отношению к раствору субстанции составляет 127,02%.
Таким образом, можно сделать вывод о биоэквивалентности композиции препарата по отношению к субстанции соединения I и пролонгации терапевтического эффекта этого соединения, связанной с уменьшением клиренса и увеличением периода его полувыведения.
| Таблица 2 | |||||
| Фармакокинетические параметры субстанции соединения и композиции (при пероральном введении в дозе 25 мг/кг) | |||||
| AUC, (мкг/мл) час | , час | Kel, час-1 | Cl, мл/час | MRT, час | |
| Субстанция соединения I | 10,29 | 1,58 | 0,44 | 2,43 | 2,33 |
| Композиция | 13,07 | 1,63 | 0,42 | 1,91 | 3,03 |
При исследовании экскреции соединения I через почки (фиг.2) было отмечено повышение его концентрации в моче со 2-го по 5-й час до максимума, а затем снижение концентрации к 12-му часу после введения субстанции I и к 24-му часу после введения композиции.
При исследовании экскреции соединения с мочой оценивали почечный клиренс (ClR), определяемый отношением кумулятивной экскреции препарата I с мочой к AUC препарата в крови.
Установлено, что почечный клиренс композиции препарата I был ниже данного показателя субстанции I на 26,9% (ClR субст.=2,91 мл/час, ClR лек. формы.=2,91 мл/час).
Таким образом, и по скорости выведения соединения с мочой можно сделать вывод о пролонгации его содержания в организме (при введении в виде композиции) вследствие уменьшения интенсивности выведения через почки.
Фармакологические свойства заявленного соединения
Данное соединение (I) снижает инсулинорезистентность и, тем самым, восстанавливает толерантность организма к глюкозе, подавляет агрегацию эритроцитов и, тем самым, снижает вязкость крови.
1. Влияние соединения на инсулинорезистентность определяли по изменению толерантности животных к глюкозе (пероральная глюкозная нагрузка) (Функциональные методы исследования в эндокринологии / З.И.Цюхно [и др.]. - Киев: Здоровье, 1981. - 240 с.) при:
- латентной форме стрептозотоцинового диабета (преддиабет);
- экспериментальном ожирении;
- экзогенной гиперинсулинемии (инсулинорезистентность)
и по взаимодействию с экзогенным инсулином на собаках с удаленной поджелудочной железой.
2. Влияние соединения на гемореологические свойства крови изучались в опытах при стрептозотоциновом диабете:
- по изменению вязкости крови;
- по подавлению агрегации эритроцитов, вызванной алциановым голубым.
Влияние соединения I на толерантность к глюкозе при латентной форме стрептозотоцинового диабета (преддиабет)
Действие соединения I на содержание глюкозы в крови животных с синдромом измененной толерантности к глюкозе исследовали на животных с латентной формой стрептозотоцинового диабета. Латентную форму стрептозотоцинового диабета воспроизводили по Колесник Ю.М. (Колесник Ю.М. Состояние островкового аппарата поджелудочной железы при экспериментальном сахарном диабете. - Архив патологии. - 1992. - T.54. - 12. - c.24-27) на белых беспородных крысах массой 160-220 г при внутрибрюшинном введении свежеприготовленного на цитратном буфере стрептозотоцина (Sigma) в дозе 30 мг/кг. Не ранее чем через три дня проводили отбор животных с нарушенной толерантностью к глюкозе. Пероральный глюкозотолерантный тест проводили по утрам после ночного (в течение 10-14 ч) голодания животных при интрагастральном введении раствора глюкозы в дозе 3 г/кг. Содержание глюкозы в крови крыс определяли глюкозооксидазным методом, используя наборы Био-Ла-Тест (Чехия, Лахема диагностика). При изучении антигипергликемических эффектов на модели нарушенной толерантности к углеводам у животных с латентной формой стрептозотоцинового диабета предполагалось уточнить влияние вещества на динамику секреции гормона (инсулин). Изучаемое соединение I и препарат сравнения с комбинированным механизмом действия - гликлазид (с выраженным панкреотропным действием) животные получали внутрижелудочно за 2 часа до начала эксперимента в дозах 25 и 50 мг/кг соответственно. По истечении данного времени им перорально вводили раствор глюкозы (3 г/кг) и в течение последующих 2 часов наблюдали за динамикой изменений глюкозы в крови. Для более объективной оценки изменения показателей глюкозной нагрузки считали показатели площади под кривой динамики изменения глюкозы в крови по А.В.Древаль (2005) (Древаль А.В. Анализ результатов перорального нагрузочного теста глюкозой с помощью простой математической модели / А.В.Древаль // Лаб. дело. - 1985. - №12. - С.737-741).
Активность соединений оценивали, принимая во внимание их гипогликемическую активность у животных с латентной формой стрептозотоцинового диабета и фиксируя антигипергликемический эффект исследуемых веществ у этих же животных после пероральной нагрузки глюкозой. Результаты исследования представлены на фиг.1 и в табл.3. Исходное содержание глюкозы у крыс, получавших различные исследуемые вещества, колебалось в пределах от 4,43±0,28 до 5,50±0,29 ммоль/л.
Однако следует отметить, что все животные, которые были взяты в эксперимент, прошли предварительную индивидуальную диагностику (пероральный нагрузочный тест глюкозой). По результатам ее в исследовании были использованы только крысы с нарушенной толерантностью к углеводам. Через два часа после начала эксперимента у животных всех групп, в том числе и контрольных, наблюдалось снижение глюкозы, однако у контрольных крыс эти изменения были статистически не значимы. Вещество I, подобно препарату сравнения гликлазиду, оказывало статистически значимое (Р<0,05) гипогликемическое действие. На фоне экзогенной гипергликемии в группе животных, получавших гликлазид и соединение I, было отмечено достоверное по абсолютным значениям, по сравнению с контрольными животными, снижение уровня глюкозы. Следует отметить, что уменьшение прироста глюкозы в крови в процентах относительно начала проведения глюкозотолерантного теста было зафиксировано у животных, которым вводили гликлазид только через час после углеводной нагрузки. В течение первых 30 минут процентный прирост глюкозы у животных этой группы не отличался от контрольных крыс, получавших растворитель веществ. В то время как соединение I уже на 30 минуте достоверно (Р<0,05) замедляло темпы прироста глюкозы в крови подопытных крыс. По показателям изменения площади под кривой глюкозной нагрузки соединение I превосходило препарат сравнения гликлазид.
| Таблица 3 | ||||||||
| Влияние гликлазида и соединения I при внутрижелудочном введении на уровень глюкозы в крови крыс с экспериментальным сахарным диабетом (стрептозотоцин 30 мг/кг внутрибрюшинно) на фоне пероральной нагрузки глюкозой (3 г/кг) (М±m) | ||||||||
| Исследуемые группы | Ед. изм. | Интервалы времени (мин) | Площадь под кривой (у.е.) | |||||
| -120 | 0 | 30 | 60 | 90 | 120 | |||
| Содержание глюкозы в крови | ||||||||
| Интактные крысы (контр. 1) | мМ | 4,25±0,14 | 3.93±0,08 | 5,19±0,12 | 5,07±0,20 | 4,58±0,15 | 3,95±0,12 | 504,61 |
| % | -7,5 | +32,1 | +29,0 | +16,5 | +0,5 | |||
| Диабет (контр.2) | мМ | 5,50±0,29 | 4,87±0,22 | 8,13±0,38 | 7,93±0,43 | 7,31±0,40 | 6,09±0,26 | 792,28 |
| % к К1 | +29,4 * | +23,9* | +56,6* | +56,4* | +59,6* | +54,1* | ||
| % | -11,4 | +66,9 | +62,8 | +50,1 | +25,1 | |||
| Диабет + Гликлазид (25 мг/кг) | мМ | 4,43±0,28 | 2,78±0,05 | 4,93±0,22 | 4,76±0,14 | 4,31±0,07 | 3,40±0,04 | 595,83 |
| % | -37,2** | +77,34 | +71,22+ | +55,04+ | +22,25+ | |||
| Диабет + соедине-ние I(25 мг/кг) | мМ | 4,57+0,17 | 3,93±0,13 | 5,87±0,29 | 5,40±0,35 | 4,67±0,26 | 4,37±0,23 | 543,75 |
| % | -14,1** | +49,4+ | +37,4+ | +18,8+ | +11,2+ | |||
| * - изменения достоверны по сравнению с контролем 1 (Р<0,05)+ - изменения достоверны по сравнению с контролем 2 (Р<0,05)** - изменения достоверны по сравнению с исходными данными (Р<0,05) |
По результатам проведенных исследований можно утверждать, что соединение I улучшает сниженные показатели толерантности к глюкозе.
Исследования на животных с экспериментальным ожирением
Ожирение моделировали у старых крыс самцов (возраст 2 года, массой до начала эксперимента 290-350 г), находящихся более трех месяцев на субкалорийной диете с повышенным содержанием жиров (более 80% от общей калорийности рациона и углеводами с высоким гликемическим инсулином. В течение указанного периода животных не ограничивали в пище. В исследование отбирали животных с нарушенной толерантностью к глюкозе и сниженной чувствительностью к инсулину (по пробе Химсворда). Пероральный глюкозотолерантный тест проводили по утрам после ночного (в течение 10-14 ч) голодания животных при интрагастральном введении раствора глюкозы в дозе 3 г/кг. Содержание глюкозы в крови крыс определяли глюкозооксидазным методом, используя наборы Био-Ла-Тест (Чехия, Лахема диагностика).
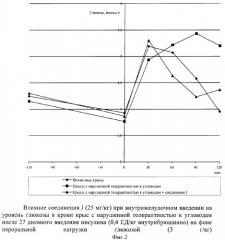
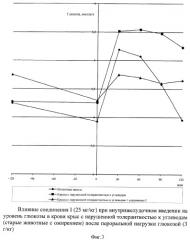
Животных с ожирением, у которых диагностировали нарушение толерантности к углеводам и синдром инсулинрезистентности, делили на две группы, одна из которых служила контролем, а животным другой вводили исследуемое вещество и наблюдали за изменениями уровня глюкозы в течение двух часов до глюкозной нагрузки и двух часов после нее. Результаты исследования гипо- и антигипергликемического действия изучаемого соединения I представлены на фиг.2 и в табл.4.
Соединение I через 2 часа после введения оказывало гипогликемическое действие в пределах 10%. После нагрузки глюкозой тенденция к снижению уровня глюкозы сохранилась. Следует отметить, что антигипергликемический эффект, наблюдаемый на протяжении всего эксперимента, был стабильным. Достоверные отличия по сравнению с животными контрольной группы наблюдались после 30 минуты перорально введенной глюкозы.
| Таблица 4 | |||||||
| Влияние соединения I (25 мг/кг) при внутрижелудочном введении на уровень глюкозы в крови крыс с нарушенной толерантностью к углеводам и инсулинорезистентностью на фоне пероральной нагрузки глюкозой (3 г/кг) (М±m) | |||||||
| Исследуемые группы | Ед. изм. | Интервалы времени (мин) | |||||
| -120 | 0 | 30 | 60 | 90 | 120 | ||
| Содержание глюкозы в крови | |||||||
| Интактные крысы (контроль 1) | мМ | 4,25±0,14 | 3,93±0,08 | 5,19±0,12 | 5,07±0,20 | 4,58±0,15 | 3,95±0,12 |
| % | -7,5 | +32,1 | +29,0 | +16,5 | +0,5 | ||
| Крысы с нарушенной толерантностью к углеводам (контроль 2) | мМ | 4,15±0,11 | 3,77±0,21 | 4,93±0,21 | 5,22±0,24 | 5,43±0,33 | 5,20±0,15 |
| % | -9,2 | +30,8 | +38,5 | +44,0 | +37,9 | ||
| % к К1 | -2,4 | -4,1 | -5,3 | +2,9 | +18,6* | +31,6* | |
| Крысы с нарушенной толерантностью к углеводам + соединение I (25 мг/кг) | мМ | 4,30±0,17 | 3,87±0,07 | 5,30±0,15 | 4,63±0,19 | 4,23±0,19 | 4,37±0,09 |
| % | -10,0 | +37,0 | +19,6 | +9,3+ | +12,9+ | ||
| * - изменения достоверны по сравнению с контролем 1 (Р<0,05)+ - изменения достоверны по сравнению с контролем 2 (Р<0,05) |
Оценка эффективности соединения I у крыс с экзогенной гиперинсулинемией (модель инсулинорезистентности)
Синдром инсулинорезистентности воспроизводили по методу Гордиенко О.Е. с соавторами (Гордиенко О.Е., Мертвецов Н.П., Салганик Р.И. Нарушение толерантности к глюкозе у крыс при длительном введении инсулина - Проблемы эндокринологии. - 1973. - Т.19. - №6. - С.83-91) на белых беспородных крысах массой 160-220 г. Животным на протяжении 27 дней ежедневно подкожно вводили протамин-цинк-инсулин (Elli-Zilly, США) из расчета 2 ЕД/животное. Для исследования отбирали животных с нарушенной толерантностью к глюкозе. Инсулинорезистентность определяли, используя пробу Химсворда (Цюхно З.И., Славнов В.И., Панченко Н.И. и др. Функциональные методы исследования в эндокринологии, Киев: Здоровье. - 1981. - 240 с.). Пероральный глюкозотолерантный тест проводили по утрам после ночного (в течение 10-14 ч) голодания животных при интрагастральном введении раствора глюкозы в дозе 3 г/кг. Содержание глюкозы в крови крыс определяли глюкозооксидазным методом, используя наборы Био-Ла-Тест (Чехия, Лахема диагностика).
Животных с нарушенной толерантностью к углеводам (по результатам проведения глюкозотолерантного теста) и синдромом инсулинрезистентности (диагностика с использованием пробы Химсворда) делили на две группы: первой вводили однократно перорально исследуемое соединение, второй группе - растворитель изучаемого вещества. За динамикой изменений уровня глюкозы в крови начинали наблюдать через 2 часа после введения соединений, а затем на фоне перорального глюкозотолерантного теста глюкозой еще в течение последующих двух часов, отбирая пробы крови через каждые 30 минут.
Результаты по изучению влияния соединения на уровень глюкозы в крови крыс с нарушенной толерантностью к углеводам после длительного введения инсулина представлены на фиг.3 и в табл.5.
По исходному содержанию глюкозы контрольные животные и крысы, получавшие исследуемое вещество, практически не различались (4,15±0,11 ммоль/л, 4,30±0,17 ммоль/л соответственно). При анализе проб крови, которые отбирали через 2 часа после начала эксперимента и через 30 минут после введения глюкозы, достоверных различий у животных контрольной (-9,16% и +18,8%) и опытной групп (-10,0% и +23,26%) также не было обнаружено. Однако по истечение следующих 30 минут было отмечено антигипергликемическое действие соединения I, которое носило достоверный характер (Р<0,05). Прирост глюкозы снизился в 2 раза по сравнению с группой контрольных крыс. Между 60 и 90 минутами эффект продолжал нарастать и к полутора часам после моделирования гипергликемии достигал всего +9,30% против +44,03% в контроле (Р<0,05). К 120 минуте, что соответствовало 4 часу эксперимента, уровень глюкозы стал несколько повышаться, однако разница между приростом глюкозы, в процентном выражении, в группе животных, получавших препарат I, и контрольных крыс по-прежнему оставалась в пределах 60% (Р<0,05). Значения концентрации глюкозы у животных, получавших вещество, практически приблизились к исходным данным, в то время как у крыс контрольной группы превышали на 25% содержание глюкозы, отмеченное в начале эксперимента.
Таким образом, антигипергликемический эффект подтверждает присутствие у вещества I помимо панкреотропного действия, которое не может быть реализовано на данной экспериментальной модели, экстрапанкреатических эффектов.
| Таблица 5 | |||||||
| Влияние соединения I (25 мг/кг) при внутрижелудочном введении на уровень глюкозы в крови крыс с нарушенной толерантностью к углеводам (старые животные с ожирением) после пероральной нагрузки глюкозой (3 г/кг) (М±m) | |||||||
| Исследуемые группы | Ед. изм. | Интервалы времени (мин) | |||||
| -120 | 0 | 30 | 60 | 90 | 120 | ||
| Содержание глюкозы в крови | |||||||
| Интактные крысы (контроль 1) | мМ | 4,25±0,14 | 3,93±0,08 | 5,19±0,12 | 5,07±0,20 | 4,58±0,15 | 3,95±0,12 |
| % | -7,5 | +32,1 | +29,0 | +16,5 | +0,5 | ||
| Крысы с нарушенной толерантностью к углеводам (контроль 2) | мМ | 4,27±0,22 | 4,26±0,29 | 5,51±0,35 | 5,54±0,32 | 5,47±0,37 | 5,23±0,36 |
| % | -0,2 | +29,3 | +30,1 | +28,4 | +22,8 | ||
| % к К1 | +0,5 | +8,4 | +6,2 | +9,3 | +19,4* | +32,4* | |
| Крысы с нарушенной толерантностью к углеводам + соединение I (25 мг/кг) | мМ | 4,75±0,15 | 4,30±0,12 | 4,75±0,25 | 4,70±0,10 | 4,60±0,10 | 4,65±0,25 |
| % | -9,5 | +10,5 | +9,3+ | +7,0+ | +8,1 | ||
| * - изменения достоверны по сравнению с контролем 1 (Р<0,05)+ - изменения достоверны по сравнению с контролем 2 (Р<0,05) |
Влияние соединения I на сахароснижающее действие экзогенно введенного инсулина
Одним из косвенных показателей повышения чувствительности тканей организма к инсулину может быть влияние новых веществ на выраженность гипогликемического действия инсулина в опытах на животных с удаленной поджелудочной железой по схеме В.A.Houssay (1960).
Опыты проводили на 5-ти панкреатэктомированных собаках массой 8,6-11,5 кг. Удаление поджелудочной железы проводили под гексеналовым наркозом (50 мг/кг внутрибрюшинно) в асептических условиях. Исследование проводили на 3-4 день после операции, когда содержание глюкозы достигло 23-26 ммоль/л. К этому времени животные худели, у них развивалась полиурия, полидипсия, полифагия, т.е. клинические признаки, характерные для тяжелой формы сахарного диабета, основной причиной развития которого является дефицит инсулина. Влияние соединения I на сахароснижающий эффект инсулина проводили в три этапа.
1. Изучали влияние соединения I на глюкозу крови у панкреатэктомированных собак. Исследуемое вещество I вводили животным однократно внутривенно в дозе 5 мг/кг. Сахароснижающее действие соединения изучали на протяжении 6 часов. Пробы крови забирали через каждый час.
2. Изучали сахароснижающее действие инсулина для инъекций (Минмедпром, Московский эндокринный завод), введенного многократно внутривенно в дозе 0,04 ЕД/кг в течение 3-х часов с 30-минутными интервалами.
3. Изучали влияние инсулина в комплексе с соединением I на содержание глюкозы крови. Вещество в дозе 5 мг/кг вводили внутривенно с первой порцией инсулина. Наблюдение за содержанием глюкозы в крови опытных животных продолжали до исчезновения гипогликемического эффекта. Пробы крови отбирали через каждый час на протяжении всего эксперимента. Обобщенные данные по влиянию инсулина и вещества I, введенным отдельно, и инсулина, введенного в комплексе с соединением I, на концентрацию глюкозы в крови панкреатэктомированных собак приведены на фиг.4.
Соединение не влияло на содержание глюкозы в крови у собак с удаленной поджелудочной железой. Так, изменения концентрации глюкозы колебались в пределах 2,7-4,6% и были статистически не достоверны. После введения инсулина панкреатэктомированным собакам через час гормон снизил содержание глюкозы в крови на 23%. Гипогликемический эффект продолжал нарастать и через 2 часа был максимально выражен, содержание глюкозы в крови собак к этому времени равнялось 16,6 ммоль/л вместо исходных 23,2 ммоль/л, что соответствовало снижению глюкозы в крови опытных животных на 28%. На 3-м часу эксперимента у 3-х из 5-ти собак глюкоза в крови удерживалась на этом уровне, однако (по обобщенным данным) прослеживалась тенденция к ее стабилизации, которая наблюдалась в последующее время. Между 5-м и 6-м часом эксперимента концентрация глюкозы в крови достигла исходного уровня, а через 6 часов у 3-х собак даже несколько превысила концентрацию глюкозы, которая отмечалась в крови животных до начала эксперимента. При совместном введении инсулина для инъекций с соединением I концентрация глюкозы в крови собак через час снизилась на 23%, что соответствовало гипогликемическому эффекту инсулина. Ко 2-му часу эксперимента наблюдалось усиление сахароснижающего действия инсулина, которое к 3-му часу после введения стало статистически значимым. Максимальное снижение глюкозы на 46% отмечалось к 4-5 часу наблюдения. Гипогликемическое действие инсулина, введенного в комплексе с соединением I в 2,7 раза превысило сахароснижающий эффект, который наблюдался при введении одного инсулина. Через 6 часов концентрация глюкозы в крови начала повышаться и к 9-му часу эксперимента содержание глюкозы в крови нормализовалось.
Таким образом, снижение уровня глюкозы в крови панкреатэктомированных собак под влиянием инсулина, введенного вместе с соединением, было более интенсивным и длительным, чем при применении одного инсулина.
Проведенные исследования дают основание сделать заключение, что изучаемое вещество повышает чувствительность тканей к действию инсулина.
Таким образом, на основании проведенных исследований можно сделать вывод о том, что изучаемое соединение I снижает инсулинорезистентность тканей организма и восстанавливает толерантность организма к углеводам в условиях патологии углеводного обмена. Вероятно, выявленный эффект соединения I связан с его свойством повышать чувствительность тканей организма к действию инсулина.
Гемореологические свойства заявленного соединения I
Гемореологические изменения оценивали по двум важным показателям - вязкость крови и способность эритроцитов к агрегации, индуцированной алциановым голубым в условиях экспериментальной патологии - стрептозото