15 -замещенные стероиды с избирательной эстрогенной активностью
Иллюстрации
Показать всеИзобретение описывает 15β-замещенное производное эстрадиола, обладающее селективной эстрогенной активностью. Предпочтительным соединением является 7α-этил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триен-20-ин-3,17β-диол. Соединения могут использоваться в лечении или профилактике заболеваний или физиологических состояний, связанных с рецепторами эстрогена. 3 н. и 8 з.п. ф-лы, 2 табл.
Реферат
Данное изобретение относится к 15β-замещенному стероидному соединению, имеющему избирательную эстрогенную активность, фармацевтической композиции данного соединения, его использованию в лечении, а также использованию при производстве лекарственных препаратов для лечения или профилактики заболеваний, связанных с рецепторами эстрогена, или регуляции, лечения или профилактики других физиологических состояний, связанных с рецепторами эстрогена.
В течение многих лет соединения, имеющие сродство к рецепторам эстрогена, широко использовались в лечении широкого спектра состояний. Так как рецепторы эстрогена широко представлены во многих тканях, терапевтическое значение их лигандов очень велико. В частности, данные соединения активно используются как контрацептивы, а также для профилактики и лечения:
- климактерических синдромов: приливов, потливости, перепадов настроения;
- потери костной массы в результате остеопороза, остеоартрита, гипо- и гиперкальцемии, болезни Педжета, остеомаляции, множественных миелом;
- переломов костей;
- недержания мочи, атрофии мочеполовых путей, вагинальной и кожной атрофии, угрей, меланом, гирсутизма;
- доброкачественных опухолей груди, рака груди, гинекомастии;
- сердечно-сосудистых заболеваний, повышенного уровня холестерина, повышенного уровня липопротеинов высокой плотности, нарушений свертываемости крови, рестенозе, пролиферации гладкомышечных клеток стенок сосудов.
Однако несмотря на то что подобные соединения (в особенности стероиды) уже давно доступны для облегчения процессов, связанных с рецепторами эстрогена, до сих пор существует потребность в экономичных, эффективных и безопасных лекарственных средствах.
Соединения, обладающие эстрогенной активностью, в настоящее время используются у женщин для лечения пери- и/или постменопаузных (климактерических) синдромов, а также остеопороза. Однако для нерожавших женщин подобные неселективные эстрогены (например, конъюгированный эстроген лошади, 17β-эстрадиол, 17α-этинил-17β-эстрадиол) не могут быть рекомендованы для долговременной терапии (более 3 месяцев), поскольку повышают уровень пролиферации эндометрия (изменения, аналогичные фолликулярной фазе цикла), приводя к кровотечениям, гиперплазии эндометрия и/или раку эндометрия. Общепринятая клиническая практика заключается в сочетании этих неселективных эстрогенов с прогестагенными соединениями - эта процедура, как известно, позволяет уменьшить стимуляцию эндометрия и изменить его состояние с подобного фолликулярной фазе на подобное лютеиновой фазе цикла и/или атрофическое. К сожалению, введение прогестагенных соединений в эту терапию увеличивает риск развития рака груди, что было продемонстрировано в недавних исследованиях, проведенных организацией "Программа Здоровья женщин" (Women's Health Initiative). (Writing Group for the Women's Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from The Women's Health Initiative randomized controlled trial. JAMA 2002; 288:321-333.)
Благодаря открытию двух различных подтипов рецепторов эстрогена, названных α и β, в настоящее время существует возможность разработки лигандов, избирательно взаимодействующих с подтипами рецепторов эстрогена. Поскольку подтипы рецепторов различаются по представленности в различных тканях организма, подобные селективные соединения могут обеспечить эффективное лечение или профилактику состояний, связанных с рецепторами эстрогена, с минимальными побочными эффектами.
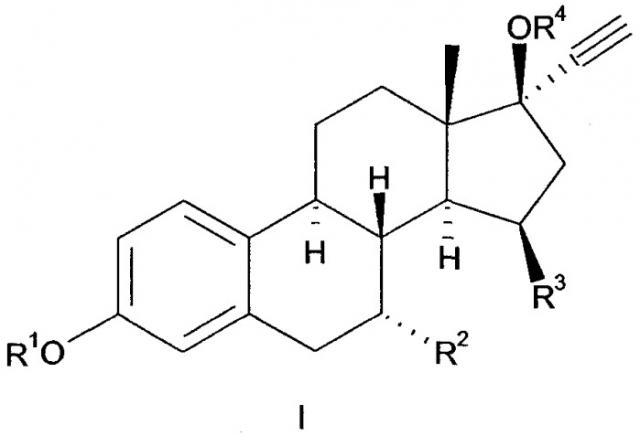
К настоящему моменту установлено, что ряд 15β-замещенных производных эстрадиола являются эффективными стероидами, обладающими высоким уровнем функциональной селективности по отношению к α-подтипу рецепторов эстрогена. Данное изобретение представляет собой соединение, имеющее общую Формулу 1.
где R1 - H, C1-5 алкил, C1-12 ацил, ди-(C1-5 алкил)аминокарбонил, (С1-5 алкил)оксикарбонил или сульфамоил,
R2 - H, C1-3 алкил, C2-3 алкенил или C2-3 алкинил, каждый из которых может быть замещен галогеном,
R3 - C1-2 алкил, этенил или этинил, каждый из которых может быть замещен галогеном, и
R4 - H или C1-12 ацил.
Стероиды, в которых R1 и/или R4 отличны от водорода, являются так называемыми пролекарствами (предшественниками лекарственных средств).
Термин C1-5 алкил, использованный в Формуле I, обозначает разветвленную или неразветвленную алкильную группу, имеющую 1-5 атомов углерода. Примеры: метил, этил, изопропил, третичный бутил и пентил. Аналогично, термины C1-3 алкил, C1-2 алкил обозначают разветвленную или неразветвленную алкильную группу, имеющую 1-3 или 1-2 атома углерода соответственно.
Термин C2-3 алкенил обозначает разветвленную или неразветвленную алкенильную группу, имеющую 2-3 атома углерода. Примеры таких групп включают: этенил, пропен-2-ил.
Термин C2-3 алкинил обозначает алкинильную группу, имеющую 2-3 атома углерода и одну тройную связь. Примеры таких групп включают: этинил, пропинил.
Термин C1-12 ацил обозначает ацильную группу, полученную из карбоновых кислот, имеющих 1-12 атомов углерода. Ацильная группа может содержать углеводород, который может быть разветвленным, неразветвленным, насыщенным или ненасыщенным. Примеры таких групп включают: формил, ацетил, пропаноил, пропеноил, пивалоил, гептаноил, деканоил, ундеканоил. Термин C1-12 ацил также включает группы, полученные из дикарбоновых кислот, такие как гемималоил, гемисукциноил, гемиглутароил.
Примером ди-(C1-5 алкил)аминокарбонила является диметилкабамоил.
Примером ди-(C1-5 алкил)оксикарбонила является этоксикарбонил.
Галогеном могут быть один или более атомов галогена, таких как хлор или фтор.
В одном из вариантов осуществления данного изобретения: R2 - C1-3 алкил, С2-3 алкенил или С2-3 алкинил, каждый из которых может быть замещен галогеном.
В другом варианте воплощения: R1 и R4 - атомы водорода.
В другом варианте воплощения: R1 - Н, R2 - Н, C1-3 алкил, С2-3 алкенил или С2-3 алкинил, R3 - C1-2 алкил, этенил или этинил и R4 - Н.
В другом варианте воплощения: R1 - Н, R2 - Н, C1-3 алкил, факультативно замещенный галогеном, R3 - C1-2 алкил, факультативно замещенный галогеном, и R4 - Н.
В другом варианте воплощения: R1 - Н, R2 - Н или C1-3 алкил, R3 - C1-2 алкил и R4 - Н.
В другом варианте воплощения: R1 - Н, R2 - Н или C1-2 алкил, R3 - метил и R4 - Н.
Еще один вариант строения: 7α-этил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триен-20-ин-3,17β-диол.
В другом варианте воплощения: R1 - Н, C1-5 алкил или C1-12 ацил, R2 - Н или C1-3 алкил, R3 - C1-2 алкил и R4 - Н или C1-12 ацил.
В другом варианте воплощения: R1 - Н, C1-5 алкил или C1-12 ацил, R2 - C1-3 алкил, R3 - метил и R4 - Н или C1-12 ацил.
В другом варианте воплощения: R1 - Н, C1-5 алкил или C1-12 ацил, R2 - этил, R3 - метил и R4 - Н или C1-12 ацил.
В другом варианте воплощения: R1 - Н или C1-12 ацил, R2 - Н или C1-3 алкил, R3 - C1-2 алкил и R4 - Н или C1-12 ацил.
В другом варианте воплощения: R1 - Н или C1-12 ацил, R2 - Н или C1-3 алкил, R3 - метил и R4 - Н или C1-12 ацил.
В другом варианте воплощения: R1 - Н или C1-12 ацил, R2 - этил, R3 - метил и R4 - Н или C1-12 ацил.
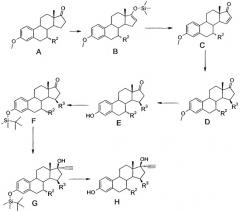
Описываемое соединение может быть синтезировано в соответствии с методами, хорошо известными в технике общей органической химии и, особенно, химии стероидов. См., например: Fried, J. and Edwards, J.A., 'Organic Reactions in Steroid Chemistry', Volumes I and II, van Nostrand Reinhold Company, New York, 1972; and C. Djerassi, 'Steroid Reactions,' Holden-Day, Inc., San Francisco, 1963. Общие методики синтеза, используемые для получения соединения, описаны ниже в примерах и отражены в Схеме I. Специалист в данной области легко может внести изменения в данную схему.
Схема 1
.
Субстрат А - исходный материал для методики синтеза, показанной на Схеме I, - синтезируется в 4 этапа. Во-первых, сопряженное добавление органометаллических реагентов (например, купратов) к С17-замещенному эстра-4,6-диен-3-ону приводит к получению 7α-замещенного эстр-4-ен-3-она. Небольшие количества получаемых 7β-изомеров могут быть легко удалены с помощью хроматографии или кристаллизации на этой стадии синтеза или иногда на более поздних этапах. 7α-замещенные эстреноны легко ароматизируются с использованием, например, процедуры галогенирования/дегалогенирования в 7α-эстроны, которые после алкилирования в положении С3 и удаления защитной группы в положении С17 образуют субстрат А.
α,β-ненасыщенный кетон С получают в результате окисления силиленольного эфира В с использованием, например, диацетата палладия. Проводимая реакция присоединения по Михаэлю с веществом С и использованием органометаллических реагентов, например диалкил купрата, обеспечивает получение аддукта D. Метилэстрон D после удаления защиты с, например, трифтордиметилсульфидборатным комплексом превращается в фенол Е, в который снова вводят защитную группу, получая, например, силил-эфир F. Добавление, например, ацетилинида лития к кетону F приводит к получению аддукта G, который после удаления силил-эфира с использованием, например, тетрабутилфторида аммония образует требуемый продукт Н.
Пролекарства соединений G и H производные с свободными гидроксильными группами легко получаются с использованием таких известных в технологии реакций, как, например, ацилирование с использованием хлорангидридов карбоновых кислот в присутствии основания или ацилирование с использованием карбоновых кислот в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид и т.д., с последующим удалением защитной силил-эфирной группировки в случае соединения G.
Соединения Формулы I, имеющие группы, описанные в формуле изобретения 1, в которых R1 и R4 - атомы водорода, имеют стабильно более высокую селективность к подтипу α рецепторов эстрогена в сочетании с высокой эффективностью действия на этот подтип рецепторов, то есть эффективностью, равной или большей, чем 1,0% (относительно 17β-эстрадиола, который имеет EC50 приблизительно 4х10-11 М и, по определению, 100% эффективность действия). Такое соединение является агонистом α-рецепторов и как минимум в 10 раз менее эффективным в отношении β-рецепторов эстрогена с эффективностью, равной или меньшей 60% максимальной активации, индуцируемой 17β-эстрадиолом. Это выражается в высокой функциональной селективности для α-рецепторов эстрогена, т.е. селективной активации α-рецепторов при отсутствии или только частичной активации β-рецепторов эстрогена.
Стероиды Формулы I, где R1 и R4 не являются (является) атомами водорода - пролекарства, необязательно отвечающие приведенным выше свойствам. Данные вещества в результате метаболических процессов в организме превращаются в соединения, в которых R1 и R4 - атомы водорода и которые отвечают приведенным выше характеристикам.
Более того, селективные эстрогеновые лиганды данного изобретения, к удивлению, не вызывают повышения уровня пролиферации эндометрия (изменений, аналогичных фолликулярной фазе цикла) и, таким образом, могут быть использованы для (длительного) лечения и/или предотвращения пери- и/или постменопаузных (климактерических) состояний и остеопороза без добавления прогестагенных компонентов.
Селективная активация рецепторов эстрогена представленными в данном изобретении соединениями делает их профиль подходящим для применения в терапии.
Далее в данном изобретении рассматривается применение соединений, отвечающих Формуле I, для производства лекарственных средств, используемых для лечения и профилактики заболеваний, связанных с рецепторами эстрогена, или регуляции, лечения или предотвращения развития других физиологических состояний, связанных с рецепторами эстрогена.
Следующий аспект изобретения касается использования соединений, отвечающих Формуле I, для производства лекарственных средств для гормональной заместительной терапии или гормонального лечения. Такое использование является особенно подходящим для женщин с проявлениями пери- и/или постменопаузных (климактерических) синдромов и остеопороза.
Следующий аспект изобретения касается использования соединений, отвечающих Формуле I, для производства лекарственных средств для контрацепции. Данные соединения могут быть использованы в подобных целях как часть медикаментозного курса, включающего также соответствующие количества прогестагена. Подобные схемы хорошо известны в области контрацепции.
Применение соединений, соответствующих изобретению, наиболее успешно достигает цели при получении лекарственных форм соответствующей дозировки. Данное изобретение также касается фармацевтического состава или дозированных форм, сочетающих соединение по изобретению, смешанное с (а) фармацевтически приемлемым(и) наполнителем(ями), такими, как описано в Gennaro et al., Remmington: The Science and Practice of Pharmacy 20th Edition, Lippincott, Williams and Wilkins, 2000; см. особенно часть 5: фармацевтическое производство. Подходящие наполнители описаны, например, в Handbook of Pharmaceutical Excipients, 2nd Edition; Editors A. Wade and P.J. Weller, American Pharmaceutical Association, Washington. Смесь соединения, соответствующего данному изобретению, и (а) фармацевтически приемлемых наполнителей может быть переведена в твердую форму, такую как таблетки или капсулы, или свечи. При использовании фармацевтически приемлемых жидкостей данное соединение может применяться в виде растворов для инъекций, суспензий, эмульсий или как спрей, например как спрей для носовой или ротовой полости. Для производства дозированных форм, таких как таблетки, подходит использование добавок, наполнителей, красителей, полимерных связующих и т.д. В целом может быть использована любая фармацевтически приемлемая добавка. Соединения по изобретению могут быть включены в состав имплантантов, вагинальных колец, пластырей, гелей или любых других средств с немедленным и/или замедленным высвобождением.
Подходящие наполнители, используемые в производстве или применении фармацевтических композиций, включают лактозу, крахмал, целлюлозу и т.п., их производные, а также смеси вышеуказанных ингредиентов в соответствующих количествах.
Дозировки данного соединения являются незначительными для эстрогеновых соединений, т.е. в пределах от 0,01 до 100 мг, в частности - от 0,1 до 10 мг разового введения.
Данное изобретение иллюстрировано следующими примерами:
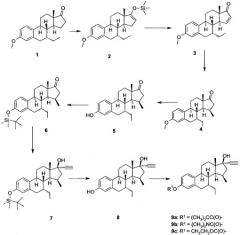
Схема II
Пример 1
Получение 7α-этил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триен-20-ине-3,17β-диола (8) (см. Схему 2).
Получение 7α-этил-3-метокси-эстра-1,3,5(10),15-тетраен-17-она (3).
7α-Этил-3-метоксиэстрон 1 был получен из 17β-17-(ацетилокси)-эстра-4,6-диен-3-она и этил магний бромида методом, аналогичным описанному в EP 0869132 А1 (см. Пример 1 и Схему 1, соединения 1-5).
Раствор 7α-этил-3-метоксиэстрона 1 (1 г) в тетрагидрофуране (ТГФ) (3) добавляли при -60°С по каплям к раствору ЛДА (диизопропиламида лития) [полученной при добавлении 1,6 М раствора н-BuLi в гептане (4,7 мл) при -50°С к диизопропиламину (2,1 мл) в ТГФ (15 мл)]. Смесь перемешивали в течение Ѕ часа при -60°С, после чего добавляли триметилсилил хлорид (2 мл). Реакционную смесь нагревали до 0°С в течение Ѕ часа, после чего выливали в 10% водный раствор NH4Cl (100 мл) и экстрагировали с этилацетатом. Промывка, сушка (с Na2SO4) и последующая концентрация обеспечивали получение неочищенного силиленолата 2 (1,1 г), который был использован на дальнейших стадиях без дополнительной очистки.
К раствору неочищенного силиленоэфира 2 (1,1 г) в ацетонитриле (15 мл) добавляли Pd(OAc)2 (750 мл). Смесь нагревали с обратным холодильником в течение 15 минут. Затем добавляли воду и этилацетат, органическую смесь фильтровали через Celite и продукт экстрагировали в этилацетат. Отделенный таким образом органический материал очищали на коротких кварцевых колонках, элюировали смесью гептан/этилацетат, для получения соединения 3 в виде бесцветного масла. Rf (1) 0,47, Rf (2) 0,80, Rf (3) 0,46, состав элюэнта: гептан/этилацетат - 8/2. ЯМР (CDCI3), δ 7,58 (1H), 7,21 (1H), 6,74 (1H), 6,66 (1H), 3,79 (3H, CH3O), 1,11 (с,3H, 18-CH3), 1,00 (т,3H, этил).
Получение 7α-этил-15β-метил-3-метокси-эстра-1,3,5(10)-триен-17-она (4)
К раствору вещества 3 в сухом ТГФ (5 мл) добавляли безводный Cu(OАc)2 (100 мг). Смесь перемешивали в течение 2-х минут при -70°С, после чего по каплям добавляли метилмагний хлорид (1М в ТГФ, 5 мл). Реакционную смесь нагревали до 0°С в течение Ѕ часа и гасили добавлением 10% водного раствора NH4Cl. Продукт экстрагировали этилацетатом и затем очищали хроматографией на силикагеле с использованием смеси гептан/этилацетат в качестве элюанта для получения соединения 4 в виде белого твердого вещества (280 мг), Тпл 120-122°С, ЯМР (CDCI3) δ 7,22 (1H), 6,73 (1H), 6,65 (1H), 3,79 (1H), 1,20 (3H,с,18CH3), 0,98, 0,96 (6H, 2т,7α и 15β этил).
Получение 7α-этил-15β-метил-3-[(триметилсилил)окси]-эстра-1,3,5(10)-триен-17-она (6)
К раствору соединения 4 (270 мг) в дихлорметане (1 мл) добавляли BF3 ДМС комплекс (800 мкл). Смесь перемешивали в течение 1,5 часов и затем выливали в ледяную воду, после чего проводили экстракцию этилацетатом. Полученный таким образом осадок растирали со смесью эфир/гептан (1/1) для получения соединения 5 (250 мг) в виде светло-розового аморфного твердого вещества; Rf 0,27 (гептан/этилацетат 8/2). Вещество растворяли в ДМФ (3 мл), затем последовательно добавляли имидазол (300 мг) и трет-бутилдиметилсилил хлорид. Реакцию гасили добавлением ледяной воды, после чего проводили экстракцию продукта этилацетатом. После хроматографического разделения, проводимого на коротких кварцевых колонках (гептан/этилацетат 9/1), получали соединение 6 (220 мг) в виде плотного бесцветного масла; Rf 0,60 (гептан/этилацетат 8/2). ЯМР (CDCI3) δ 7,12(1H), 6,62 (1H), 6,18 (1H), 1,03 (с, 3H, 18-CH3), 0,98 (с, 9H, трет-бутилсилил), 0,97, 0,95 (2т, 6H, 7α и 15β этил), 0,20 (с, 6H, CH3-силилэфир).
Получение 7α-этил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триен-20-ине-3,17β-диола (8)
Раствор Li-ацетилида получали, добавляя по каплям н-бутил-литий (1,6 М в гексане, 5 мл) к 1,2-дибромэтену (300 мл) в сухом ТГФ (6 мл) при -60°С. После перемешивания в течение 20 минут, добавляли раствор соединения 6 (220 мг) в THF (2 мл), охлаждающее устройство удаляли и реакционную смесь перемешивали в течение 1 часа при 0°С. Затем добавляли 5% NH4Cl (50 мл), после чего проводили экстракцию этилацетатом. При пропускании через короткие кварцевые колонки (элюировали смесью гептан/этилацетат 8/2) получали соединение 7 в виде белой пены по существу в чистом виде; Rf 0,28 (гептан/этилацетат 8/2), Rf исходного материала 0,48. ЯМР (CDCI3) δ 7,14 (1H), 6,62 (1H), 6,57 (1H, 2,60, ацетилен), 0,99 (с, 12H, 18-CH3 и трет-бутилсилил), 0,95 и 0,86 (2xт, 3H, этил), 0,20 (с, 6H, диметилсилил).
К раствору соединения 7 (180 мг) в ТГФ (1 мл) добавляли TBAF (1М в THF, 0,7 мл). Смесь перемешивали в течение 15 минут и затем выливали в 10% водный раствор NH4Cl (20 мл). Продукт экстрагировали этилацетатом и пропускали через короткую кварцевую колонку с использованием в качестве элюента смеси гептан/этилацетат 7/3 для получения соединения 8 (120 мг) в виде аморфного вещества. ЯМР (ДМСО D6) δ 8,89 (с, фенольная OH), 7,08 (1H), 6,5 (1H), 6,43 (1H), 5,34 (с,1H, 17-OH), 0,84 (с, 3H, 18-CH3), 0,80 и 0,90 (2xт, 6H, 15β и 7α - этил).
Пример 2
Получение 3-пивалоилокси-7α-этил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триен-20-ине-17β-ола (9а)
Соединение 8 (300 мг) растворяли в пиридине (10 мл). Пивалоилхлорид (1,5 эквивалента) добавляли по каплям. После 2 часов реакцию гасили добавлением воды. Реакционную смесь концентрировали, повторно растворяли в этилацетате и экстрагировали водным растровом бикарбоната натрия и водой. Органическую фазу высушивали (Na2SO4) и концентрировали. Осадок очищали с помощью хроматографии на кварцевых колонках (гептан-этилацетат (1:0 -> 4:1) для получения чистого вещества 9а (347 мг). ЯМР (CDCI3) δ 1,35 (с, 9H, пивалоил), 1,08 (д, 3H, 15β-Me), 1,02 (с, 3H, 18-Me), 0,94 (т, 3H, 7-этил).
Соединение 9b (289 мг; ЯМР (CDCI3) δ 3,0 и 3,08 (2xс, 6H, NMe2) 1,08 (д, 3H, 15β-Me), 1,02 (с, 3H, 18-Me), 0,93 (т, 3H, 7-этил)) и 9с (283 мг; ЯМР (CDCI3) δ 4,32 (кв, 2H, OCH2CH3), 1,38 (д, 3H, OCH2CH3), 1,08 (д, 3H, 15β-Me), 1,02 (с, 3H, 18-Me), 0,93 (т, 3H, 7-этил)) получали сходным образом, но с использованием N,N-диметилкарбомоилхлорида и этилоксикарбонилхлорида соответственно.
Пример 3
Для характеристики соединений как агонистов рецепторов эстрогена были проведены in vitro биологические пробы на линии клеток яичника китайского хомячка (CHO), несущей ген рецептора эстрогена человека подтипа α (hERα) или β (hERβ) промотор окситоцина крысы (RO) и репортерный ген люциферазы (LUC). Активность тестируемых соединений по опосредованной рецепторами эстрогена типа α или β трансактивации синтеза фермента люциферазы, т.е. трансактивации эстрогеновыми агонистами, выражается в виде отношения (в процентах) к EC50 стандартного эстрогена 17β-эстрадиола (активность тестируемого соединения = (EC50 17β-эстрадиола/ EC50 тестируемого соединения) х 100%). Эффективность, т.е. величина максимальной активации рецептора соединением, выражается в виде отношения (в процентах) к максимальной активации, вызываемой стандартным эстрогеном 17β-эстрадиолом (эффективность тестируемого соединения = (максимальная активация тестируемым соединением/ максимальная активация 17β-эстрадиолом) х 100%). Более подробное описание методики см. в De Gooyer M.E., Deckers G.H., Schoonen W.G.E.J., Verheul H.A.M. and Kloosterboer H.J., Steroids, Vol. 68, 2003, pp.21-30.
Селективность Erα/Erβ определяется как отношение Erα-активности к Erβ-активности. Соединения по изобретению являются агонистами α-рецепторов эстрогена с активностью, равной или большей 1% (по отношению к 17β-эстрадиолу), и в 10 раз меньшей активностью в отношении β-рецепторов эстрогена (Erα/Erβ селективность равна или превышает 10) и/или являются частичными агонистами β-рецепторов эстрогена с эффективностью, равной или меньшей 60% от максимальной активации, вызываемой 17β-эстрадиолом.
Гистопатологическое исследование проводили на тканях матки яванского макака после 8 недель перорального приема тестируемых соединений (по 4 животных в каждой их тестируемых групп). Вещество сравнения Х вводили по 40 мкг/кг/день, вещество сравнения У - по 200 мкг и соединения 8 - по 40 и 200 мкг/кг. Были исследованы следующие морфологические характеристики, с помощью прокраски гематоксилином/эозином, на основании данных о состоянии матки яванского макака в определенные фазы менструального цикла.
А. Изменения, подобные таковым, фолликулярной фазы:
- свободная строма эндометрия
- прямые железы эндометрия
- гипертрофия эпителия эндометрия
- гипертрофия миометрия
- ранний ангиогенез (прорастание или ранняя пролиферация)
- базальная секреция
Б. Изменения, подобные таковым, лютеиновой фазы:
- псевдодецидуальные увеличенные клетки стромы
- извитые железы эндометрия
- поздний ангиогенез (образование спиральных артерий)
- секреция в полость матки
- люминальная секреция
В. Эндометрий овариэктомированных животных или нестимулированный (атрофический) эндометрий
- компактная строма эндометрия
- атрофия эпителия эндометрия
- атрофия желез эндометрия
- атрофия эпителия миометрия
Выраженность вышеупомянутых признаков оценивали по следующей классификационной шкале:
- степень 0: признаки отсутствуют
- степень 1: минимальные, очень небольшое количество, очень маленький размер
- степень 2: небольшие, небольшое количество, небольшой размер
- степень 3: средние, среднее количество, средний размер
- степень 4: заметные, много, крупные
- степень 5: массивное, очень большое количество, очень большой размер.
Данная оценка была проведена для всех животных. Затем для каждого признака было рассчитано среднее значение для тестируемой группы. В итоге среднее значение для каждой категории, подобной атрофической, фолликулярной или лютеиновой фазам, было рассчитано из средних для каждого признака. С точки зрения сохранности эндометрия исследуемое соединение имеет более благоприятные характеристики в отношении индукции меньшего количества изменений, характерных для фолликулярной фазы, и большего количества изменений, характерных для лютеиновой фазы и/или атрофического эндометрия.
Данные для Соединения 8 и для Состояний сравнения Х (17α-этинил-17β-эстрадиола, Формула I, где R1-R4 - атомы водорода) и У (17β-эстрадиола) приведены в Таблице 1 (in vitro данные, полученные на культуре клеток) и в Таблице 2 (in vivo данные).
| Таблица 1 | ||||
| Соединение | ERα-активность (%) | ERβ-активность (%) | ERβ-эффективность (%) | ERα/Erβ-селективность (активность) |
| 8 | 23,45 | 1,54 | 40 | 15,2 |
| Х | 102,8 | 20,70 | 104 | 5,0 |
| У | 100,0 | 100,0 | 100 | 1,0 |
Результаты, приведенные в Таблице 1, демонстрируют, что патентуемые соединения изобретения имеют стабильно большую селективность к эстрогеновым рецепторам подтипа α, а также проявляют высокую активность, опосредованную эстрогеновыми рецепторами подтипа α, т.е. селективно активируют α-рецепторы эстрогена, не активируя или только частично активируя β-рецепторы эстрогена. Соединение 8 имеет эстрогеновую α-рецепторную активность, равную 23,45%, и в 15,2 раз большую селективность к эстрогеновым α-рецепторам, чем к эстрогеновым β-рецепторам, и является частичным агонистом эстрогеновых β-рецепторов с эффективностью, равной 40%. Близкородственные соединения 17α-этинил-17β-эстрадиол (Соединение Х) и 17β-эстрадиол (Соединение У) демонстрируют равное сродство (предпочтение) к обоим подтипам эстрогеновых рецепторов и являются полными агонистами эстрогеновых β-рецепторов.
| Таблица 2 | |||
| Соединение | Состояние эндометрия яванского макака (баллы) | ||
| Фолликулярный | Лютеиновый | Атрофический | |
| 8: 40 мкг/кг | 0,0 | 0,0 | 3,0 |
| 8: 200 мкг/кг | 0,5 | 0,2 | 2,3 |
| Х: 40 мкг/кг | 2,8 | 0,4 | 0 |
| У: 200 мкг/кг | 3,6 | 0,2 | 0 |
Благоприятное состояние сохранности эндометрия для патентуемых соединений изобретения является неожиданным, поскольку оба близкородственных соединения 17α-этинил-17β-эстрадиол и 17β-эстрадиол стимулируют эндометрий, что видно из Таблицы 2, где приведены четкие характеристики индукции изменений, соответствующих фолликулярной фазе, при наличии минимальных изменений, соответствующих лютеиновой фазе, и, соответственно, без атрофии эндометрия.
Пример 4
Половое поведение самок крыс является гормонально зависимым. У эстроген-стимулированных самок крыс прогестерон значительно увеличивает половое поведение или реакции лордоза. Однако прогестерон неактивен, в том числе в отношении реакций лордоза, у овариэктомированных и не получавших эстроген самок (см. также J.B. Becker, S.M. Breedlove and D. Crews (Eds.) Behavioral Endocrinology, 1992, pp. 82-84).
Способность тестируемых соединений стимулировать прогестерон-индуцированные реакции лордоза у овариэктомированных самок крыс была использована для демонстрации эстрогенной активности данных соединений in vivo при пероральном введении. В течение трех дней самки крыс получали тестируемые соединения, после чего на четвертый день им давали прогестаген. Половое поведение самок крыс исследовали через четыре часа после получения прогестерона в присутствии самцов крыс, регистрируя количество реакций лордоза в течение 10 минут.
Для всех пролекарств типа Соединения 8, где R1 является пивалоилом (Соединение 9а), диметилкарбамоилом (Соединение 9b) или этоксикарбонилом (Соединение 9с), было продемонстрировано, что они являются активными эстрогеновыми соединениями при оральном введении в дозе 1 мг/кг.
1. 15β-замещенное стероидное соединение формулы I гдеR1-H (8), C1-12ацил (9а), ди-(С1-5алкил)аминокарбонил (9b), (С1-5алкил) оксикарбонил (9 с),R2- H, С1-3алкил (8),R3- С1-2алкил, иR4- H.
2. Соединения по п.1, отличающиеся тем, что R1- атом водорода, а R2- этил.
3. Соединения по п.1, отличающиеся тем, что R1- C1-12ацил, ди-(C1-5алкил)аминокарбонил, (С1-5алкил)оксикарбонил.
4. Соединение по п.1, отличающееся тем, что представляет собой 7α-этил-15β-метил-19-нор-17α-прегна-1,3,5(10)-триен-20-ин-3,17β-диол.
5. Фармацевтическая композиция, обладающая избирательной эстрогенной активностью, включающая соединение по любому из пп.1-4, и фармацевтически приемлемый носитель.
6. Соединение по любому из пп.1-4 для использования в лечении или профилактике заболеваний или физиологических состояний, связанных с рецепторами эстрогена.
7. Применение соединения по любому из пп.1-4 для получения лекарственных средств для лечения или профилактики заболеваний, связанных с рецепторами эстрогена, или регуляции, лечения или профилактики физиологических процессов, связанных с эстрогеновыми рецепторами.
8. Применение по п.7 для производства лекарственных средств для гормональной терапии.
9. Применение по п.8, отличающееся тем, что гормональная терапия применяется при климактерических синдромах.
10. Применение по п.8, отличающееся тем, что гормональная терапия применяется при остеопорозе.
11. Применение по п.8 для производства лекарственных средств для контрацепции.