Способы лечения эндобронхиальных заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к пульмонологии. Изобретение содержит два варианта осуществления способа. Оба его варианта включают введение в эндобронхиальную систему пациента сухого порошкового аэрозольного препарата тобрамицина. В первом варианте одна доза содержит от 90 до 130 мг тобрамицина или его фармацевтически приемлемой соли. Одну дозу на первом лечебном этапе вводят от одного до трех раз в день. Длительность первого лечебного этапа от 20 до 36 дней. Во втором варианте одна доза содержит от 110 до 115 мг тобрамицина. Эту лечебную дозу на первом лечебном этапе вводят дважды в день. Первый лечебный этап длится 28 дней. За лечебным этапом следует второй нелечебный этап. Нелечебный этап длится от 26 до 30 дней. В этот этап в эндобронхиальную систему больного не вводят никакого антибиотика. Затем первый и второй лечебные этапы повторяют. Способ обеспечивает достижение необходимого фармакологического эффекта введением меньшей дозы сухого порошка тобрамицина в более короткие сроки при лечении синегнойной инфекции у больных кистозным фиброзом. 2 н. и 22 з.п. ф-лы, 11 табл., 4 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому и усовершенствованному способу лечения легко передающихся эндобронхиальных инфекций сухими порошковыми препаратами на базе аминогликозидных антибиотиков, таких как тобрамицин.
ПРЕДПОСЫЛКИ ДЛЯ СОЗДАНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Кистозный фиброз (КФ) - наиболее распространенное генетическое заболевание в США и Северной Европе, ведущее к уменьшению продолжительности жизни, в США им болеет примерно 30000 человек (Cunningham, J.C. et al., "An Introduction to Cystic Fibrosis for Patients and Families" 5th ed., Bethesda: Cystic Fibrosis Foundation (2003)) и примерно столько же человек в Западной Европе. Генным нарушением в этом аутосомном рецессивном заболевании является мутация в гене КФ трансмембранного транспортного регулятора (CFTR), который зашифрован в белке хлорного канала (Collins, F.S., "Cystic Fibrosis Molecular Biology and Therapeutic Implications," Science 256: 774-779 (1992)). Люди с кистозным фиброзом обычно страдают от хронических эндобронхиальных инфекций, синуситов, мальабсорбции, вызванной панкреатической недостаточностью, повышенным выделением солей при потении, обструктивными гепатобилиарными заболеваниями и снижением фертильности. (FitzSimmons, S.С. "The Changing Epidemiology of Cystic Fibrosis," J Pediatr 122: 1-9 (1993)). Респираторные заболевания являются главной причиной заболеваемости и 90% смертей у людей с кистозным фиброзом (Cystic Fibrosis Foundation, Cystic Fibrosis Foundation Patient Registry 2003 Annual Data Report, Bethesda, MD: Cystic Fibrosis Foundation, (2004); Davis, P.B. et al., "Cystic fibrosis," Amer J. Respir Crit Care Med 154(5): 1229-56 (1996)). Легочная функция (измеряемая через объем воздуха при форсированном выдохе за 1 секунду (ОФВ1 должн., в %1)) является значимым показателем выживаемости при кистозном фиброзе. Двухлетняя выживаемость для группы людей с кистозным фиброзом уменьшается вдвое с каждым 10%-ным уменьшением ОФВ1 должн., а у людей с ОФВ1 на 30% ниже, чем ОФВ1 должн., двухлетняя выживаемость составляет меньше 50% (Kerem, E. et al., "Prediction of Mortality in Patients with Cystic Fibrosis," N Engl J Med 326: 1187-1191 (1992)). Коэффициенты снижения легочной функции неодинаковы как у разных людей, так и в течение жизни одного индивида. Ретроспективные лонгитюдные исследования показывают, что скорость ухудшения состояния варьируется в диапазоне от менее 2% от ОФВ1 должн. за год до более 9% от ОФВ1 должн. за год, с абсолютной скоростью ухудшения состояния, строго привязанной к возрасту на момент смерти (Corey, M. et al., "Longitudinal Analysis of Pulmonary Function Decline in Patients with Cystic Fibrosis," J Pediatr 131 (6): 809-1 (1997)).
Пациенты с кистозным фиброзом страдают от истончения слизистой, вызванного нарушением эпителиального транспорта ионов, что ведет к снижению защитной функции легких и приводит к повышению восприимчивости к ранним эндобронхиальным инфекциям с бактериями Staphylococcus aureus (Золотистый Стафилококк), Haemophilus influenzae (Гемофильная инфекция) и Р.Aeruginosa (Синегнойная Палочка). Большинство обследованных пациентов с диагнозом «кистозный фиброз» в период полового созревания уже имеют бактерию Р. Aeruginosa в мокроте. (Cystic Fibrosis Foundation Patient Registry 2003 Annual Data Report (2004)). Хронические эндобронхиальные инфекции, особенно синегнойные, провоцируют стойкие воспалительные реакции дыхательных путей, что ускоряет прогрессирующее обструктивное заболевание, отличительным признаком которого является диффузный бронхоэктаз (Davis, Р.В. et al. (1996), supra; Winnie, G.B. et al., "Respiratory Tract Colonization with Pseudomonas aeruginosa in Cystic Fibrosis: Correlations Between AxAi-P seudomonas aeruginosa Antibody Levels And Pulmonary Function," Pediatr Pulmonol 10:92-100 (1991); Ballman, M. et al. "Long Term Follow Up of Changes in FEV1 and Treatment Intensity During Pseudomonas Aeruginosa Colonisation in Patients with Cystic Fibrosis," Thorax 53:732-737 (1998); Pamukcu, A. et al., "Effects of Pseudomonas aeruginosa Colonization on Lung Function and Anthropometric Variables in Children with Cystic Fibrosis," Pediatr Pulmonol 19:10-15 (1995)). О связи между развитием хронической эндобронхиальной синегнойной инфекции, воспалением легких, снижением функции легких и окончательной смертью можно предположить, судя по значительному снижению выживаемости, сопутствующему хронической синегнойной инфекцией (Henry, R.L. et al., "Mucoid Pseudomonas aeruginosa is a Marker of Poor Survival in Cystic Fibrosis," Pediatr Pulmonol 12(3): 158-61 (1992)) и по значительным корреляциям между ранним развитием хронической синегнойной инфекции и детской смертности (Demko, CA. et al., "Gender Differences in Cystic Fibrosis: Pseudomonas aeruginosa Infection," J Clin Epidemiol 48:1041-1049 (1995)). Было доказано, что продолжительное применение терапии, подавляющее либо бактериальную флору в легких (MacLusky, LB. et al, "Long-term Effects of Inhaled Tobramycin in Patients with Cystic Fibrosis Colonized with Pseudomonas aeruginosa " Pediatr Pulmonol 7(1):42-8 (1989)), либо последующее воспаление легких (Konstan, M. W. et al., "Effect of high-dose Ibuprofen in Patients with Cystic Fibrosis," N Engl J Med 332(13): 848-54 (1995)), приводит к снижению скорости разрушения легких у зараженных пациентов.
Традиционно при эндобронхиальных синегнойных заболеваниях стандартной терапией служил прием парентеральных антисинегнойных антибиотиков, обычно включающих аминогликозиды, в течение 14-21 дня. Однако парентеральные аминогликозиды, будучи сильно полярными веществами, с трудом проникают в полость бронхов. Чтобы достичь адекватной концентрации лекарства в месте локализации инфекции при парентеральном введении, необходимо обеспечить такой уровень его содержания в сыворотке, при котором повышаются нефротоксичность, вестибулярная токсичность и ототоксичность ("American Academy of Otolaryngology. Guide for the evaluation of hearing handicap," JAMA 241(19):2055-9 (1979); Brummett, R.E., "Drug-induced ototoxicity," Drugs. 19:412-28 (1980)).
Ингаляционное введение аминогликозидов представляет собой привлекательную альтернативу, т.к. обеспечивает высокую концентрацию антибиотиков прямо в месте локализации инфекции в полости бронхов и минимизирует при этом систематическое бионакопление. (Touw, DJ. et al., "Inhalation of Antibiotics in' Cystic Fibrosis," Eur Respir J 8:1594-604 (1995); Rosenfeld, M. et al., "Aerosolized Antibiotics for Bacterial Lower Airway Infections: Principles, Efficacy, and Pitfalls," Clinical Pulmonary Medicine 4(2):101-12 (1997)).
На настоящий момент стандартным лекарством, применяемым для лечения синегнойных инфекций у пациентов с кистозным фиброзом, является ингаляционный раствор тобрамицина TOBI®, изготовляемый по удобной и стойкой формуле тобрамицина, не содержащей консервантов (раствор в пропорции 60 мг/мл тобрамицина в 5 миллилитрах 25%-го физиологического раствора), и предназначенный для введения через струйный небулайзер (распылитель), разработанный PathoGenesis Corporation, Seattle, Wash, (сейчас Chiron Corporation, Emeryville, Calif). Сочетание 5 мл дозы ТРИ (300 мг тобрамицина), принимаемой дважды в день, с компрессорной системой PARI LC PLUS/PulmoAide было одобрено федеральным агентством по лекарственным средствам (FDA) на основании заявки на новые средства (NDA 50-753, декабрь 1997) в качестве продолжительной дробной терапии для лечения синегнойной инфекции у пациентов с кистозным фиброзом и остается стандартом в этой области. Процесс ингаляции одной 300 мг дозы ТРИ (в такой дозировке ТРИ представлен в продаже) может занять 20 минут без учета времени, требующегося для установки и прочистки распылителя. Аэрозольное введение 5 мл дозы препарата, содержащего 300 мг тобрамицина в 25%-ном физиологическом растворе, для подавления синегнойной инфекции в полость бронхов больного описано в патенте США №5508269, который включен в полном объеме в описание настоящей заявки в качестве ссылки.
Тобрамицин - это аминогликозидный антибиотик, который продуцируется актиномицетами (Streptomyces tenebrarius). Низкие концентрации тобрамицина (<4 мкг/мл) эффективно подавляют рост многих грамнегативных бактерий и при определенных условиях могут обладать бактерицидным действием. Тобрамицин плохо абсорбируется поверхностями слизистых оболочек. Традиционно для тобрамицина требуется парентеральное введение. Кроме того, активность тобрамицина снижается при наличии гнойной мокроты: высокая концентрации двувалентных катионов, кислая среда, повышенная ионная сила, макромолекулы, обеспечивающие связь с лекарством, - все это вместе взятое препятствует действию тобрамицина. По оценкам исследователей, для преодоления этих сдерживающих эффектов необходимо в пять или десять раз увеличить концентрацию тобрамицина в мокроте (Levy, J. et al., "Bioactivity of Gentamicin in Purulent Sputum from Patients with Cystic Fibrosis or Bronchiectasis: Comparison with Activity in Serum," J Infect Dis 148(6): 1069-76 (1983)).
Эффективность доставки слабоабсорбируемого антибиотика тобрамицина в дыхательные пути пациентов с кистозным фиброзом путем впрыскивания аэрозоля была тщательно задокументирована. В значительной мере целью этой работы было лечение хронических легочных инфекций с Р. Aeruginosa (синегнойной палочкой) у пациентов с кистозным фиброзом. К примеру, многоцентровое, двойное слепое, плацебо-контролируемое, перекрестное исследование применения 600 мг аэрозольного тобрамицина (за три приема) для лечения эндобронхиальных инфекций Р.Aeruginosa (синегнойной палочкой), в котором принял участие 71 пациент с кистозным фиброзом, продемонстрировало значительное снижение в мокроте этого болезнетворного организма и одновременное улучшение результатов спирометрии в лечебной группе. Обнаружение следов Р.Aeruginosa (синегнойной палочки) с высокой устойчивостью к тобрамицину (определенной через минимальную ингибирующую концентрацию МИК>128 мкг/мл) сравнивалось для плацебо и лечебной групп. Присутствие в мокроте грамотрицательных бактерий, отличных от Р.Aeruginosa (синегнойной палочки) и устойчивых к тобрамицину, отмечалось с одинаковой частотой как при введении тобрамицина, так и при введении плацебо. (Ramsey, В. et al., "Response to Letter to the Editor: Aerosolized Tobramycin in Patients with Cystic Fibrosis," N Engl J Med 329: 1660 (1993)).
Хотя такая схема приема лекарственного средства и была признана в равной мере безопасной и эффективной, она является дорогой и неудобной. Анализ МИК для Р.aeruginosa, выделенных из начальных мокротных культур пациентов Children's Hospital CF Center, Seattle, Wash., в 1993, показал, что 90% выделений имеют МИК<16 мкг/мл и 98% всех выделений имеют МИК<128 мкг/мл. Этот осмотр предполагает, что достижение в мокроте концентраций тобрамицина в 128 мкг/мл должно позволить эффективно лечить эндобронхиальные заболевания у пациентов с кистозным фиброзом. (Levy, J. et al., "Bioactivity of Gentamicin in Purulent Sputum from Patients with Cystic Fibrosis or Bronchiectasis: Comparison with Activity in Serum," J Infect Dis 148(6); 1069-76 (1983)).
Рандомизированное перекрестное исследование сравнивало эффективность разных ингаляторов, доставлящих тобрамицин, путем измерения пиков в концентрации тобрамицина в образцах мокроты, полученных спустя десять минут после завершения введения дозы аэрозоля. В исследовании использовался раствор тобрамицина для ингаляции TOBI®, PathoGenesis Corporation, Seattle, Wash, (сейчас Chiron Corporation, Emeryville, Calif), содержащий тобрамицин в пропорции 60 мг/мл в 5 мл 25% физиологического раствора, с использованием струйного небулайзера PARI® LC, PARI Respiratory Equipment, Inc., Richmond, Va. Было показано, что данная система доставки лекарства дает среднее значение концентрации тобрамицина в мокроте при 678.8 мкг/г (s.d. 661.0 мкг/г) и медианное значение концентрации при 433.0 мкг/г. Только у 13% пациентов уровень концентрации в мокроте оказался меньше <128 мкг/г. У 87% больных концентрация составила >128 мкг/г (Eisenberg, J. et al., "A Comparison of Peak Sputum Tobramycin Concentration in Patients With Cystic Fibrosis Using Jet and Ultrasonic Nebulizer Systems. Aerosolized Tobramycin Study Group," Chest III (4):955-962 (1997)). Недавно струйный небулайзер PARI® LC был усовершенствован за счет клапана одностороннего действия и переименован в PARI® LC PLUS. Благодаря одностороннему клапану устройство PARI® LC PLUS характеризуется лучшей способностью доставки лекарства, нежели струйный небулайзер PARI® LC; односоронний клапан снижает вероятность случайной утечки и позволяет использовать фильтр выдоха. Опыт показал, что среднее значение концентрации тобрамицина в мокроте, достигаемое при использовании струйного небулайзера PARI LC PLUS, значительно выше, чем то же значение при использовании струйного небулайзера PARI®LC, что описано у Eisenberg и др. (1997, см. выше).
Далее, имеются два отчета о двух сопровождаемых плацебо-контролем, мультицентровых, рандомизированных, двойных слепых клинических исследованиях продолжительного применения жидкого аэрозоля тобрамицина путем вдыхания пациентами с кистозным фиброзом с синегнойной инфекцией, представленных в статье Ramsey, В.W. et al., "Intermittent Administration of Inhaled Tobramycin in Patients with Cystic Fibrosis. Cystic Fibrosis Inhaled Tobramycin Study Group." N. Engl. J. Med. 340(1):23-30 (1999). В этих исследованиях пятьсот двадцать субъектов случайным образом получали или 300 мг тобрамицина для ингаляции или плацебо дважды в день в течение 28 дней, с последующими 28 днями без изучаемого лекарства. Субъекты продолжали прием лекарства или плацебо в течение трех циклов «принятия/непринятия» в общей сложности 24 недели. Среди эффективных переменных было содержание Р.Aeruginosa в мокроте. Для пациентов, которых лечили тобрамицином, снижение концентрации Р.aeruginosa с нулевой недели по двадцатую составило в среднем 0,8 log 10. Для сравнения, пациенты, получавшие плацебо, имели прирост в 0,3 log 10 (Р<0,001). Для пациентов, которых лечили тобрамицином, снижение концентрации Р.aeruginosa с нулевой недели по четвертую составило в среднем 1,9 log10. Для сравнения пациенты, получавшие плацебо, не показали никаких изменений (Р<0,001).
В патенте США №6890907 и опубликованной в США заявке на патент 2003/0143162 А1 говорится о том, что пациенты, страдающие от эндобронхиальной инфекции, могут быть эффективно вылечены с помощью ингаляции пациентам дозы, составляющей 4,0 мл (или меньше) распыляемого жидкого аэрозоля, содержащего от примерно 60 до примерно 200 мг/мл аминогликозидного антибиотика, такого как тобрамицин, в физиологически приемлемом носителе, за время, меньшее чем примерно 10 минут. Более эффективное введение аминогликозидного препарата позволяет вводить меньшее количество жидкого аминогликозида по сравнению со стандартным режимом введения за меньшее время, что снижает стоимость лечения и расход лекарства. Более того, было показано, что препараты, содержащие минимальное и уже эффективное количество аминогликозида, заключенного в малом объеме физиологически приемлемого раствора, снижают раздражение легких после ингаляции аминогликозидного состава.
Вдобавок к вдыхаемым антибиотикам, таким как имеющийся в продаже продукт TOBI®, существует разнообразное число других терапий хронических заболеваний, регулярно назначаемых для снижения разрушительных циклов закупорки, заражения или воспаления в легких с КФ. Интенсивная Терапия Очистки Дыхательных путей (Reisman, JJ. et al. 5 "Role of conventional physiotherapy in cystic fibrosis," J Pediatr 113(4):632-6 (1988)), вдыхаемые бронхорасширители (Konig P et al., "Short-term and Long-term Effects of Albuterol Aerosol Therapy in Cystic Fibrosis: A Preliminary Report," Pediatr Pulmonol 20(4): 205-14 (1995)) и муколитические средства, такие как дорназа альфа (рекомбинантная человеческая дезоксирибонуклеаза I) (rhDNase; Fuchs, HJ. et al., "Effect of Aerosolized Recombinant Human DNase on Exacerbations of Respiratory Symptoms and on Pulmonary Function in Patients with Cystic Fibrosis. The Pulmozyme Study Group," N Engl J Med 331(10):637-42 (1994)) - их прописывают на постоянной основе, создавая потенциал для успешного лечения тех инфекций, которым подвержены люди с КФ. Было показано, что строгое соблюдение способа лечения является значительной проблемой для людей с КФ (Conway, S.P. et al., "Compliance with treatment in adult patients with cystic fibrosis," Thorax 51(1):29-33 (1996)) и что несоблюдение правил лечения может меняться в зависимости от специфики лечения (Abbott J et al., "Treatment Compliance in Adults with Cystic Fibrosis," Thorax 49(2): 115-20 (1994)).
Как сказано выше, коммерчески доступный жидкий аэрозоль раствора тобрамицин TOBI® для ингаляции доказал высокую эффективность при лечении синегнойной инфекции у пациентов с КФ. Учитывая необходимость соблюдения правил для обеспечения защиты легочной функции у пациентов с КФ, усовершенствования в существующих способах лечения, которые снижают время введения лекарства или делают для пациентов лечение более удобным, будут способствовать добросовестности пациента и выразятся в росте терапевтического эффекта. Согласно сказанному, существует потребность в новых и усовершенствованных способах и приспособлениях для введения пациенту аминогликозидного антибиотика при ингаляции, снижении сложности введения, увеличении добросовестности пациента и, в итоге, росте эффективности терапии в форме ингаляций.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает способ лечения больных с эндобронхиальной инфекцией, включающий прописывание больному сухого порошкового аэрозольного препарата, содержащего от 90 до 130 мг аминогликозидного антибиотика, для применения от одного до трех раз в день на первом этапе лечения от 20 до 36 дней. В практическом применении изобретения за первым лечебным этапом может следовать второй нелечебный этап, когда больному не вводятся никакие аминогликозидные антибиотики. При лечении вирулентных инфекций больному прописывается цикл, включающий первый лечебный этап с аминогликозидным лечением, и следующий за ним нелечебный этап, когда больному не вводятся никакие аминогликозидные антибиотики. Этот цикл может быть повторен два и большее число раз до тех пор, пока не будет достигнут желаемый бактериальный эффект. В случае хронических инфекций, таких как инфекции, возникающие у больных кистозным фиброзом, первый и второй лечебные этапы могут повторяться множество раз в ходе оказания медицинской помощи пациенту.
Способ лечения полезен для лечения любой эндобронхиальной инфекции, чувствительной к аминогликозидному антибиотику, такой как синегнойная эндобронхиальная инфекция, связанная с кистозным фиброзом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Дальнейшие аспекты и многие имеющиеся преимущества настоящего изобретения будут оценены и в то же время лучше поняты при обращении к следующему детальному описанию, сопровождаемому чертежами, где изображено следующее.
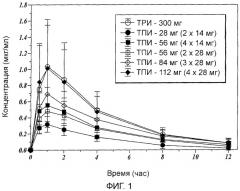
Фиг.1 показывает среднее значение концентрации тобрамицина в сыворотке у субъектов в различные моменты после введения определенных доз ТПИ и ТРИ.
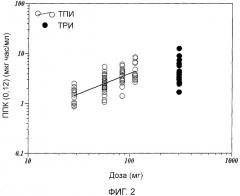
Фиг.2 показывает зависимости площади под кривой (ППК/AUC) (0,12) от дозировок тобрамицинового порошка для ингаляции (ТПИ) и тобрамицинового раствора для ингаляции (ТРИ).
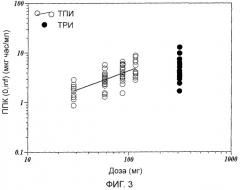
Фиг.3 показывает зависимости ППК (0,∞) от дозировок ТПИ и ТРИ.
Фиг.4 показывает среднее значение концентрации тобрамицина в мокроте субъектов, принявших определенные дозы ТРИ и ТПИ.
Детальное описание технического результата
Если нет специального указания, все термины, используемые здесь, имеют те же значения, какие они будут иметь для любого профессионала в области настоящего изобретения. Здесь используются следующие сокращения:
Английская аббревиатура - (русская аббревиатура) - значение
АЕ - НЯ - нежелательное явление
ALT - АЛТ - аланиновая аминотрансфераза
AUC - ППК - площадь под кривой
BID - (-) - дважды в день
BUN-АМК азот мочевины крови
CaCl2 - (-) - хлорид кальция
CF - КФ - кистозный фиброз
CFC - ХФУ - хлорофторуглерод
Cmax - (-) - максимальная концентрация
CFTR - (-) - cystic fibrosis transmembrane conductance regulator (трансмембранный транспортный регулятор кистозного фиброза)
DPI - СПИ - сухой порошковый ингалятор
DSPC - (-) - 1,2-дистеароил-сн-глицеро-3-фосфохолин
FDA - (-) - United States Food and Drug Administration (Федеральное управление по лекарственным средствам)
FEV1 - ОФВ1 - объем форсированного выдоха за 1 секунду
FVC - ФЖЕЛ - форсированная жизненная емкость легких
PEV25-75 - СОС25-75 средняя скорость воздушного потока между 25 и 75% ФЖЕЛ
НРМС - ГПМЦ - 2-гидроксилпропилметилцеллюлоза
IRB - (-) - Institutional Review Board (Институтский наблюдательный совет)
IVRS - СИРО - Система Интерактивного Речевого Ответа
MedDRA - (-) - Medical Dictionary for Regulatory Activities (стандартизированная международная терминология)
MIC - МИК - минимальная ингибиторная концентрация
Р.aeruginosa - (-) - Pseudomonas aeruginosa (Синегнойная палочка)
PFOB - (-) - perfluorooctyl bromide (перфтороктил-бромид)
QPIT - (-) - quantitative pilocarpine iontophoresis test (количественный поликарпиновый ионтофорезный тест)
SAE - СНЯ - серьезные нежелательные явления
tmax - (-)- время достижения максимальной концентрации
TOBI® - ТРИ - 300 мг томбрамициновый раствор для ингаляции, корпорация Chiron, Эмервиль, Калифорния
TIP - ТПИ - Томбрамициновый порошок для ингаляции
С одной стороны, настоящее изобретение представляет собой способ лечения больных с эндобронхиальными инфекциями, включающий прописывание больному сухого порошкового аэрозольного препарата, содержащего от 90 до 130 мг аминогликозидного антибиотика, для применения от одного до трех раз в день на первом этапе лечения от 20 до 36 дней. В практическом применении изобретения за первым лечебным этапом может следовать второй нелечебный этап, когда больному не вводятся никакие аминогликозидные антибиотики. При лечении вирулентных инфекций больному прописывается цикл, включающий первый лечебный этап с аминогликозидным лечением, и следующий за ним нелечебный этап, когда больному не вводятся никакие аминогликозидные антибиотики. Этот цикл может быть повторен два и большее число раз до тех пор, пока не будет достигнут желаемый бактериальный эффект. В случае хронических инфекций, таких как инфекции, возникающие у больных кистозным фиброзом, первый и второй лечебные этапы могут повторяться множество раз в ходе оказания медицинской помощи пациенту.
С другой стороны, данное изобретение представляет собой использование аминогликозидного антибиотика в приготовлении лекарства для лечения больных с эндобронхиальными инфекциями, предписывая введение в эндобронхиальную систему пациента на первом лечебном этапе сухого порошкового аэрозольного препарата, содержащего от 90 до 130 мг аминогликозидного антибиотика, - от одного до трех раз в день на первом лечебном этапе от 20 до 36 дней. В практической реализации данной стороны изобретения, первый лечебный этап может быть аналогично продолжен вторым «нелечебным» этапом, когда больному не вводят никакие аминогликозидные антибиотики, кроме того, первый и второй этапы лечения могут быть повторены в соответствии с тем, как уже было описано.
Способ данной стороны изобретения включает этап назначения лекарства субъекту (человеку или животному), в случае необходимости его применения, вводящегося способом ингаляции в виде терапевтически эффективного количества аэрозольного порошка, содержащего от 20% по весу до 90% по весу антибиотика, где порошок имеет физиологически приемлемый состав, то есть содержит частицы, где по крайней мере 50% частиц имеют аэродинамический диаметр в пределах от 1 мкм до 5 мкм.
Термин «эндобронхиальная инфекция» используется в отношении бактериальной инфекции, локализованной в области бронхов. Примерами эндобронхиальных инфекций, с которыми можно бороться, используя настоящее изобретение, являются инфекции грамотрицательных бактерий, таких как Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae, Burkholderia cepacia, Stenotrophomonas maltophilia и Alcaligenes xiloxidants. Настоящее изобретение может быть использовано, к примеру, для лечения людей, страдающих от эндобронхиальных инфекций, связанных с кистозным фиброзом, таких как, к примеру, синегнойная инфекция.
Аминогликозидные антибиотики, полезные в применении изобретения, включают, к примеру, гентамицин, амикацин, канамицин, стрептомицин, неомицин, нетилмицин, парамеции и тобрамицин. Предпочтительным на данный момент аминогликозидным антибиотиком для использования в практическом применении данного изобретения является тобрамицин. Аминогликозидный антибиотик обычно прописывается в форме фармацевтически приемлемой соли (то есть сульфата, цитрата, аскорбата, глюконата, карбоната, тартрата, сукцината, ацетата или фосфата) или сложного эфира.
При применении данного препарата аэрозольный порошок вдыхается субъектом (человеком или животным) и таким образом проникает в легкие субъекта (человека или животного). Аэрозольный порошок состоит из частиц, содержащих аминогликозидный антибиотик. Было установлено, что аэрозольные порошки (содержащие аминогликозидный антибиотик), где по крайней мере 50% частиц имеют аэродинамический диаметр в диапазоне от 1 мкм до 5 мкм, эффективно проникают в легкие субъекта (человека или животного), тем самым эффективно доставляя аминогликозидный антибиотик в легкие субъекта. Например, некоторые аэрозольные порошки (содержащие аминогликозидный антибиотик) в практическом применении настоящего изобретения состоят из частиц, где по крайней мере 60% частиц, или по крайней мере 70% частиц, или по крайней мере 80% частиц, или по крайней мере 90% частиц, или по крайней мере 95% частиц имеют аэродинамический диаметр в диапазоне от 1 мкм до 5 мкм.
Термин «аэродинамический диаметр» относится к диаметру сферы единичной плотности, имеющей ту же конечную скорость осаждения, что и рассматриваемая частица (см. "Aerosol Measurement: Principles, Techniques and Applications". Edited by Klaus Willeke and Paul A.Baron. Van Nostrand Reinhold, New York, 1993). Аэродинамический диаметр используется, например, для предположения, где такая частица осядет в респираторном тракте.
«Срединный массовый аэродинамический диаметр» (аббревиатура СМАД) есть мера аэродинамического размера распыляемой частицы. Распределение по аэродинамическим размерам характеризует оседание аэрозоля при ингаляции и равно диаметру сферы единичной плотности, имеющей обычно ту же скорость осаждения в воздухе, что и частица. Когда наблюдается нормальное логарифмическое распределение по аэродинамическим размерам, то может быть определен срединный массовый аэродинамический диаметр (СМАД). В данном контексте СМАД относится к середине диапазона значений или к медиане по распределению размеров аэродинамических частиц в аэрозольном порошке, определяемым каскадными импакциями Андерсона.
Каскадные импакторы включают серии экранов с уменьшающимся размером пор. Экран задерживает частицы, движущиеся внутри струи, которые проходят через импактор. Количество отсеянного материала (частиц, имеющих размеры меньше нужного диапазона), которое задержано на каждом экране, может быть определено при смывании его с экрана и взвешивании смытого материала. Примеры каскадных импакторов и их использование описаны в 601 Главе (Аэрозоли) в Pharmacopoeia of the United States (26th Revision), упомянутая часть из которой приводится здесь со ссылкой.
Порошковые аминогликозидные препараты-антибиотики, полезные в практическом использовании настоящего изобретения, обычно содержат менее чем 15% по весу влаги, обычно ниже примерно 11% по весу влаги и предпочтительно менее примерно 8% по весу влаги.
В практическом применении данного изобретения пациенту, страдающему от эндобронхиальной инфекции, прописывается для ингаляций терапевтически эффективное количество аэрозольного порошка, содержащего аминогликозидный антибиотик. Терапевтически эффективное количество аэрозольного порошка содержит достаточно аминогликозидного антибиотика для полного или частичного препятствия росту болезнетворных бактерий в легких пациента. Например, выведены терапевтически эффективные дозы для аминогликозидного тобрамицина при предписании пациентам употреблять его от одного до трех раз ежедневно, предпочтительно употребление препарата дважды в день. Содержание тобрамицина в аэрозоли порошкового препарата должно составлять от примерно 90 до 130 мг, более предпочтительно от примерно 100 до 120 мг и наиболее предпочтительно от примерно 110 мг до примерно 115 мг (где вес определяется как вес свободного основания без учета возможно присутствующих противоионов).
Дозу принимаемого аминогликозида, такого как тобрамицин, можно вводить с помощью самостоятельного контейнера, содержащего разовую дозу, либо с помощью нескольких отдельных контейнеров, содержащих разовые дозы для последовательного введения в зависимости от типа устройства, используемого для доставки антибиотика. К примеру, вводимая доза аминогликозида может быть разделена на несколько разовых доз в количестве от двух до шести, более предпочтительно от трех до пяти доз и еще предпочтительнее на четыре дозы. В одном из репрезентативных результатов доза лекарства, содержащая 112 мг тобрамицина, (где вес определяется как вес свободного основания без учета возможно присутствующих противоионов) разделена на четыре отдельные №2 ГПМЦ капсулы с тобрамицином в виде свободного основания весом 27 мг на капсулу.
Сухие порошковые аэрозольные составы вводятся пациенту на первом этапе, длящемся от 20 до 36 дней, предпочтительнее от 26 до 30 дней и даже более предпочтительно около 28 дней. За первым лечебным этапом следует второй нелечебный этап, когда больному не вводятся никакие аминогликозидные антибиотики. Согласно одному из аспектов изобретения, второй нелечебный этап длится от примерно 20 до примерно 36 дней, предпочтительнее от примерно 26 до примерно 30 дней и наиболее предпочтительно около 28 дней.
В одном из репрезентативных результатов описанные в изобретении способы применяются для лечения пациентов с КФ, страдающих хронической синегнойной инфекцией. По данному аспекту изобретение предлагает лечение пациентов с КФ, страдающих от эндобронхиальной инфекции, согласно которому пациенту прописывают прием сухого порошкового аэрозоля, содержащего от 110 до 115 мг антибиотика тобрамицина, дважды в день на первом, 28-дневном, этапе лечения, с последующим нелечебным этапом от 26 до 30 дней, когда больному не вводятся никакие аминогликозидные антибиотики, а затем повторение первого и второго этапов лечения. Согласно данному аспекту изобретения, дозировка тобрамицина в 110-115 мг для последующего введения может быть разделена на разовые дозы в количестве от трех до пяти, предпочтительнее на четыре единичные дозы. Поскольку больные КФ склонны к заражению хронической синегнойной инфекцией, цикл лечения из двух этапов - первого лечебного этапа и следующего за ним второго нелечебного этапа - можно повторять множество раз на протяжении неопределенно долгого времени для долгосрочной терапии эндобронхиальных инфекций у пациентов с КФ.
Аэрозольный порошок обычно содержит от 20% (по весу) до 90% (по весу) аминогликозидного антибиотика. Соответственно, в некоторых реализациях данного изобретения, аэрозольный порошок содержит от 30% (по весу) до 80% (по весу) аминогликозидного антибиотика. В некоторых реализациях аэрозольный порошок содержит от 40% (по весу) до 70% (по весу) аминогликозидного антибиотика. В соответствии с этим, процентное содержание (по весу) аминогликозидного антибиотика соответствует количеству свободного антибиотика, без учета веса возможно присутствующих противоионов.
Аэрозольные порошки, обычно, но не обязательно, используемые в изобретении, включают, по крайней мере, один физиологически приемлемый носитель. Для примера, аэрозольный порошок может включать один или большее число добавок-наполнителей и/или любой другой компонент, который увеличивает эффективность аминогликозидного антибиотика. Такие добавки-наполнители могут просто выполнять функцию агентов-наполнителей, когда необходимо снизить концентрацию активного вещества в порошке, принимаемом пациентом. Также добавки могут служить улучшению диспергирования порошка в порошковом распыляющем устройстве с тем, чтобы обеспечить большую эффективность и воспроизводимость доставки активного вещества и улучшить физико-механические характеристики активных веществ (например, сыпучесть и прочность), обеспечивающие легкость изготовления и заправки порошков. В особенности, добавки-наполнители часто могут служить для улучшения физической и химической стабильности аминогликозида, минимизируя остаточную влажность и препятствуя ее росту, и увеличивая размер частицы, степень агрегации, поверхностные свойства (например, шероховатость), простоту ингаляции, и точность попадания нужных частиц в полость легких.
Фармацевтические наполнители и добавки, используемые в аминогликозидных составах, используются и при практическом применении данного изобретения. Они включают (но не ограничиваются только ими) следующие компоненты: протеины, пептиды, аминокислоты, липиды, полимеры и углеводороды (например, сахарозы, включая моносахариды, ди-, три-, терра- и олигосахариды; производные от сахарозы, такие как альдитолы, альдоновые кислоты, этерифицированные сахарозы; и полисахариды или сахарные полимеры), которые могут присутствовать как по отдельности, так и в различных сочетаниях. К примеру, протеиновые добавки включают сывороточный альбумин, такой как человеческий сывороточный альбумин (ЧСА), рекомбинантный человеческий альбумин (рЧА), желатин и казеин. Характерные аминокислотные/пептидные компоненты, которые также могут выполнять функцию буферной емкости, включают аланин, глицин, аргинин, бетаин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, цистеин, лизин, лейцин, пролин, изолейцин, валин, метионин, фенилаланин и аспартам, хотя аргинин менее предпочтителен. Также подходят для использования в данном изобретении такие полиаминокислоты из типичных аминокислот, как ди-лейцин, и три-лейцин.
Углеводородные наполнители (карбогидраты), которые могут быть использованы в изобретении, включают, для примера, моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, Д-манноза и сорбоза; дисахариды, такие как лактоза, сахароза, треголоза, целлобиоза; полисахариды, такие как раффиноза, мелезитоза, мальтодекстрины, декстрины и крахмал; и альдитолы, такие как маннитол, ксилитол, мальтитол, лактитол, ксилитол сорбитол (глюкитол) и мионозит.
Аминогликозидный состав может так же включать буфер или вещества, регулирующие рН; обычно в качестве буфера берется соль, приготовленная из органической кислоты или основания. Типичные буферы включают соли органических кислот, таких как соли лимонной кислоты, аскорбиновой кислоты, глюконовой кислоты, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты, фталевой кислоты; трис, трометанин гидрохлорид, и фосфатные буферы.
Кроме того, аминогликозидные смеси, полезные в практическом использовании настоящего изобретения, могут включать полимерные наполнители/добавки, такие как полифенилпирролидоны, гидроксипропилметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, фиколл (полимерный сахар), декстран, декстраты (например, циклодекстрин, такой как дигидроксипропил-β-циклодекстрин, оксиэтиловый крахмал), полиэтиленгликоли, пектин, соли (например, хлорид натрия, т.е. поваренная соль), антиоксиданты, антистатические агенты, сурфактанты (например, полисорбаты, такие как "TWEEN 20" и "TWEEN 80", лецитин, олеиновая кислота, бензалконий хлорид и сложный эфир сорбитана), липиды (например, фосфолипиды, жирные кислоты), стероиды (например, холестерол) и хелатообразующие агенты (например, этилендиаминтетрауксусная кислота, ЭДТК). Другие примеры фармацевтических наполнителей и/или добавок, годящихся к использованию в аминогликозидных смесях, перечислены в статьях "Remington: The Science & Practice of Pharmacy" (Ремингтон: Наука и Практика Фармакологии), 19th ed., Williams & Williams, (1995), "Physician's Desk Reference", 52nd ed., Medical Economics, Montvale, NJ. (1998), данные из которых приведены здесь со ссылкой.
На данный момент наиболее предпочтительна комбинация наполнителей из лецитина и хлористого кальция (хлорида кальция). Лецитин - член фосфатидилхолиновой группы природных фосфолипидов, которые действуют как сурфактанты в легких млекопитающих (включая человека).
Аминогликозидные составы, полезные в практическом использовании настоящего изобретения, могут включать диспергирующие добавки для улучшения внутренних свойств диспергирования аминогликозидных порошков. Подходящие вещества описаны в заявках РСТ WO 95/31479, WO 96/32096 и WO 96/32149, приведенных здесь со ссылкой в полном объеме. Как в них указано, подходящие вещества включают растворимые водой полипептиды и гидрофобные аминокислоты, такие как триптофан, лейцин, фенилаланин и глицин. Согласно данному изобретению, лейцин и три-лейцин наиболее предпочтительны для использования.
Твердотельная форма, образованная аминогликозидом и наполнителем, придает стабильность окружению аминогликозида. Стабилизирующая форма может быть кристаллом, аморфным стеклом или смесью двух этих форм. Для аминогликозидных сухих порошковых препаратов, которые существенно аморфны, предпочтительна температура фазового перехода для стекла (Тс) выше примерно 35°С, предпочтительнее 45°С и еще более предпочтительно свыше 55°С. Желательно, чтобы температура была выше температуры хранения, по крайней мере, на 20°С. Согласно предпочтительному окружению, аминогликозидные смеси включают фосфолипид как твердотельную форму, что описано в WO 99/16419 и WO 01/85136 и приведено здесь со ссылкой в полном объеме.
Как сказано выше, сухие порошковые аминогликозидные смеси могут быть приготовлены путем распылительной сушки при таких условиях, которые ведут к образованию преимущественно аморфных стеклянных или преимущественно кристаллических биоактивных порошков. Распылительная сушка аминогликозидного растворенного препарата полностью разработана и, для примера, в целом описана в "Sp