Гранулы, содержащие парацетамол, нпвс и сахароспирт, полученные экструзией расплава
Иллюстрации
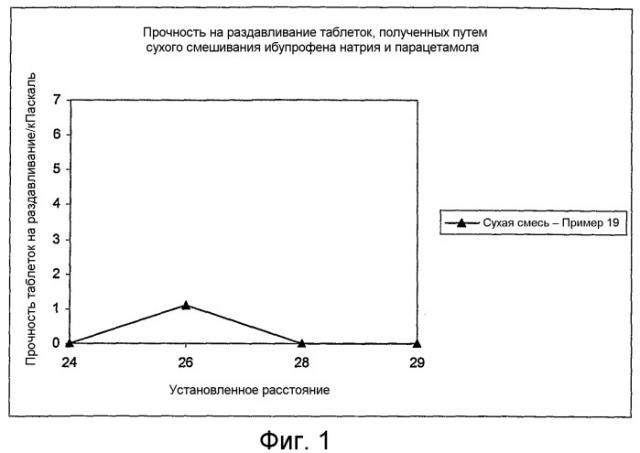
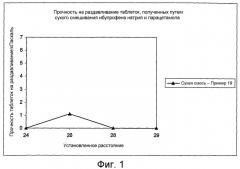
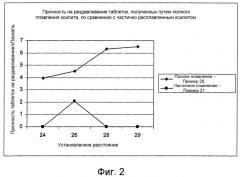
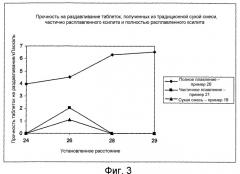
Показать всеФармацевтическая композиция содержит гранулированный компонент, включающий множество затвердевших расплавленных гранул сахароспирта, содержащего включенные в него соль нестероидного противовоспалительного средства (соль НПВС) и парацетамол. Массовое соотношение соли НПВС к парацетамолу составляет от 1:5 до 3:1. Фармацевтическая композиция предназначена для лечения боли и/или воспаления и/или лихорадки при кашле, простуде, гриппе, мигрени, головной боли, ревматической боли, суставной боли, мышечной боли и/или невралгии. Фармацевтическая композиция по изобретению содержит минимальное количество наполнителей для таблетирования, проявляет улучшенные показатели сыпучести и не имеет тенденции к прилипанию к штампам станка для таблетирования. 3 н. и 35 з.п. ф-лы, 3 ил., 4 табл.
Реферат
Настоящее изобретение относится к композициям, содержащим нестероидное противовоспалительное средство, к способам их получения и применения.
Нестероидные противовоспалительные средства (НПВС) представляют собой широко применяемый класс лекарственных средств. Они являются хорошо определенной группой соединений и включают фенилпропионовые кислоты, такие как ибупрофен, напроксен, кетопрофен и флурбипрофен. Они применяются в первую очередь для лечения одного или более из следующих нарушений боли, воспаления и лихорадки, например, ревматоидного артрита, анкилозирующего спондилита, остеоартрита, послеоперационной боли, послеродовой боли и травм мягких тканей.
НПВС обычно представляют собой кислые и по существу нерастворимые лекарства. Их удобно вводить как пероральную фармацевтическую композицию в форме таблеток. Таким образом, для сочетания с НПВС должны быть выбраны фармацевтически приемлемые наполнители, с которыми НПВС совместимо и с которыми оно может составляться в таблетки, имеющие удовлетворительную прочность, и быстро высвобождать лекарство в организме, так чтобы оно было доступно для всасывания.
Основным выходом в связи с указанными здесь нарушениями является улучшение скорости начала действия НПВС, особенно при лечении боли. Считается, что при быстром разрыхлении состава лекарство высвобождается в кровь быстро, приводя к более быстрому наступлению терапевтического эффекта по сравнению со стандартной дозированной формой. Соответственно, желательно получить твердую дозированную форму для перорального введения, адаптированную к быстрому разрыхлению в желудочно-кишечном тракте. Однако, так как многие НПВС являются кислыми лекарствами, соответственно, всасывание может представлять собой проблему в кислых условиях, существующих в желудке. Более того, хотя в литературе предлагается много составов, адаптированных для быстрого разрыхления, основная проблема существует для ибупрофена и других НПВС, так как может существовать необходимость их введения в относительно высоких дозах, например, до 800 мг на единицу дозы. Таким образом, существует проблема обеспечения дозированной формой, которая включает НПВС совместно с наполнителями, пригодными для получения в единицу дозированной формы в виде таблетки, а также с наполнителями, пригодными для гарантированного быстрого разрыхления, но не делающими таблетку слишком большой для употребления больным или не способными производиться в соответствии со стандартными широкомасштабными способами производства. Более того, твердая дозированная форма должна быть достаточно твердой для противостояния строгим условиям способа производства (например, встречающимся на стадии покрытия пленкой в перфорированном крутящемся барабане и упаковывании и т.д.), но должна иметь подходящие характеристики разрыхления для обеспечения быстрого высвобождения лекарства из состава, а также подходящие характеристики растворения. Другой существенной проблемой, которая должна быть преодолена, является гарантия того, что композиция способна прессоваться в стандартном станке для таблетирования без приклеивания к штампу станка для таблетирования.
В этой связи в WO 01/41733 (The Boots Company PLC) раскрывается, что если разрыхляющий агент включают в расплавленное НПВС и немедленно объединяют с ним и затем охлаждают и размалывают с получением гранул, то получают композицию, пригодную для таблетирования с минимумом наполнителей для таблетирования и обладающую благоприятными свойствами таблетирования, разрыхления и растворения, если в нее включен диоксид кремния.
Другой альтернативный подход к увеличению биодоступности НПВС заключается во введении НПВС в форме соли, так как такие соли обычно более растворимы, чем соответствующая свободная кислота. В этой связи в германской патентной заявке 3922441A сделана попытка улучшить таблетируемость композиций ибупрофена и раскрыто, что это может быть достигнуто путем превращения ибупрофена полностью или частично в его кальциевую соль и применения этого для таблетирования. Указывается, что композиции могут необязательно содержать ибупрофен, S(+)-ибупрофен или их аммонийные, натриевые или калиевые соли. Кальциевая соль и необязательные другие активные агенты ибупрофена могут быть включены в таблетку в виде отдельно получаемых соединений, или соли могут быть образованы in-situ в течение способа получения таблеток путем реакции ибупрофена (кислого лекарства) с раствором или суспензией реагента, включающего один или более из CaO, Ca(OH)2, CaCO3, NaOH, KOH, NH4OH, Na2CO3, NaHCO3, K2CO3, KHCO3, (NH4)2CO3, NH4HCO3 (в количестве от 25% до 110% от эквивалентного количества ибупрофена). Полученную смесь затем гранулируют, сушат, если это уместно, и затем таблетируют после необязательного включения других наполнителей. В описании комментируется, что в зависимости от пропорций других солей, применяемых с кальциевой солью, аммоний и щелочные соли улучшают растворимость композиций, содержащих кальциевую соль, и таким образом контролируют биодоступность, но они увеличивают также гигроскопичность и липкость.
Это особая проблема, связанная с обработкой НПВС в форме соли, так как эти материалы обычно являются плохо прессуемыми. Соответственно, НПВС в форме солей по сравнению с формой свободной кислоты являются хлопьевидными, мягкими и липкими материалами, и они не приспособлены для составления в единицу лекарственной формы, так как их особенно трудно прессовать по сравнению с соответствующей свободной кислотой. Следовательно, НПВС в форме солей могут прилипать к штампам станка для таблетирования. Более того, НПВС в форме солей обычно трудно предварительно гранулировать перед прессованием с другими наполнителями в таблетки. Именно поэтому необходимо подвергать соль НПВС стадии первоначальной обработки, такой как процесс грануляции, для того чтобы сформировать удовлетворительные таблетки. В частности, соли аммония и щелочных металлов НПВС, таких как производные пропионовой кислоты, т.е. ибупрофен, известны как липкие, гигроскопичные и плохо прессуемые вещества. Натриевая соль ибупрофена из-за ее воскообразной природы рассматривается как исключительно плохо прессуемая и также как имеющая низкую способность к грануляции. Это представляет собой одну из главных причин того, почему в настоящее время доступно очень мало таблеток, содержащих натриевую соль ибупрофена.
Далее, еще может быть желательным предложить композицию, которая включает дополнительный анальгезирующий активный агент в дополнение к НПВС, т.е. сочетанный продукт. Одним таким анальгезирующим агентом, который сочетается с НПВС, является ацетаминофен (известный также как парацетамол), который проявляет анальгезирующие (купирование лихорадки) и жаропонижающие (купирование лихорадки) свойства, но по существу не оказывает противовоспалительного действия. Такие продукты среди прочего крайне эффективны для лечения боли и лихорадки, т.е. головной боли, мышечной и суставной боли, боли в спине, кашля, простуды и гриппа. Обычно НПВС в таком сочетанном продукте находится в форме свободной кислоты, так как в равной степени к ним применимы проблемы, связанные с солями НПВС для перорального введения, как обсуждалось выше. Кроме того, существуют дополнительные проблемы, связанные с получением пероральной дозированной формы (т.е. таблетки), содержащей парацетамол.
В частности, парацетамол представляет собой мелкозернистый мягкий порошок, и как таковой он не приспособлен для прямого прессования в таблетки. Таким образом, необходимо предварительно обрабатывать парацетамол перед прессованием его в твердую дозированную форму. Обычно парацетамол подвергают процессу влажного гранулирования с получением гранулированной формы парацетамола, которую затем смешивают с дополнительными агентами для таблетирования и полученную смесь прессуют для формирования таблеток. Альтернативно, прямые прессованные формы парацетамола, которые обычно подвергаются процессу предварительной обработки, могут быть получены от специальных поставщиков. Эти требования предварительной обработки обычно увеличивают сложность и цену, связанные со способами получения твердых дозированных форм парацетамола. Более того, парацетамол обычно вводят в относительно высоких дозах, например до 500 мг на единицу дозы. Таким образом, существует также проблема получения дозированной формы, которая содержит парацетамол совместно с наполнителями, пригодными для составления таблетки в дозированную форму, и также с наполнителями, пригодными для обеспечения быстрого разрыхления, но не делающими таблетку слишком большой для употребления больным или не способными производиться в соответствии со стандартными широкомасштабными способами производства. Соответственно, эта проблема обычно усиливается, когда парацетамол объединяют с другим фармацевтически активным агентом (т.е. НПВС), который также может быть введен в относительно высокой дозе.
В настоящее время авторами обнаружено, что если смеси, включающей расплавленные сахароспирт, содержащий НПВС в форме соли (обозначаемое как соль НПВС) и содержащийся в нем парацетамол, дают затвердеть и формируют в виде гранул, то получается композиция, пригодная для таблетирования с минимальным количеством наполнителей для таблетирования и обладающая благоприятными свойствами таблетирования, разрыхления и растворения.
Таким образом, в первом аспекте в настоящем изобретении предлагается фармацевтическая композиция, содержащая гранулированный компонент, включающий множество затвердевших расплавленных гранул сахароспирта, имеющего содержащиеся в нем соль нестероидного противовоспалительного средства (соль НПВС) и парацетамол.
Неожиданно фармацевтическая композиция обычно проявляет улучшенные показатели сыпучести и является менее хлопьевидной/липкой, чем сама соль НПВС. Удобно, что гранулированная композиция подходит для составления в твердую дозированную форму, так как ее легче прессовать и она не имеет тенденции к прилипанию к штампам станка для таблетирования. Более того, производительность процесса прессования существенно повышается по сравнению с применяемым необработанным парацетамолом или/и самой солью НПВС. Более того, обычно не является необходимым предварительная обработка соли НПВС и парацетамола (т.е. применение процесса гранулирования для улучшения их сыпучести) перед образованием фармацевтической композиции по настоящему изобретению. Соответственно, соли НПВС и парацетамол, применяемые для получения фармацевтической композиции по настоящему изобретению, могут быть взяты прямо без предварительной обработки из массового способа получения.
Дополнительные преимущества фармацевтической композиции лежат в относительно малом количестве дополнительных наполнителей для таблетирования, необходимых для получения дозированной формы, в частности, твердой дозированной формы для перорального введения, что таким образом позволяет получать более мелкие единицы дозированной формы, имеющие относительно высокую концентрацию НПВС и парацетамола, увеличивая тем самым соответствие требованиям больного.
Неожиданно было обнаружено, что фармацевтические составы, полученные из фармацевтической композиции по настоящему изобретению, обладают ценными разрыхляющими свойствами. Более того, результаты растворения таких составов показывают неожиданно высокий уровень НПВС и парацетамола, растворенных в водной среде после относительно коротких периодов времени.
Таким образом, фармацевтическая композиция по настоящему изобретению обычно создает преимущества в обработке солей НПВС и парацетамола, улучшенное соответствие требованиям больного, улучшенные свойства разрыхления и растворения и снижение суммарной цены таблеток, полученных из солей НПВС и парацетамола.
При получении фармацевтической композиции сахароспирт плавят. Таким образом, термины «расплав» и «расплавленный» означают, что сахароспирт должен быть расплавлен, по меньшей мере, частично в процессе составления гранулированной композиции. Предпочтительно, чтобы сахароспирт был полностью расплавлен в процессе получения фармацевтической композиции.
Соответственно, когда сахароспирт расплавлен, образуется жидкость. Соль НПВС можно частично растворить в расплавленном сахароспирте; однако основная часть соли НПВС обычно диспергируется в расплавленном сахароспирте. Обычно, как описано здесь далее, соль НПВС имеет точку плавления существенно выше точки плавления сахароспирта, и соль НПВС не плавится в процессе образования фармацевтической композиции по настоящему изобретению. Парацетамол имеет точку плавления от 169 до 172°С и в зависимости от конкретного применяемого сахароспирта и условий проведения процесса парацетамол может частично или полностью плавиться в процессе образования фармацевтической композиции. Предпочтительно, чтобы конкретный сахароспирт и условия проведения процесса выбирались так, чтобы парацетамол существенно не плавился в процессе образования фармацевтической композиции. Соответственно, парацетамол может частично растворяться в расплавленном сахароспирте; однако основная часть парацетамола обычно диспергируется в расплавленном сахароспирте. Таким образом, сахароспирт плавится и обычно обволакивает соль НПВС и парацетамол, а также другие необязательные наполнители, присутствующие в фармацевтической композиции. При охлаждении расплавленного сахароспирта, смеси соли НПВС и парацетамола образуется аморфная твердая фаза (т.е. стекловидная некристаллическая структура), которая может быть непосредственно перемолота в гранулу, которая подходит для прессования в фармацевтическую дозированную форму с минимумом наполнителей для таблетирования. Другими словами, сахароспирт, по меньшей мере, частично теряет свою кристаллическую структуру и действует в качестве носителя для соли НПВС и парацетамола. Предпочтительно, чтобы при полном расплавлении сахароспирта, при охлаждении он образовывал единую непрерывную фазу, а именно - единую непрерывную аморфную твердую фазу, т.е. весь сахароспирт был по существу аморфным и он не прерывался сахароспиртом, имеющим определенную кристаллическую структуру.
Неожиданно, если сахароспирт полностью расплавлен в процессе получения фармацевтической композиции, то затвердевшие расплавленные гранулы обычно проявляют улучшенные показатели сыпучести и их обычно легче прессовать по сравнению с затвердевшими расплавленными гранулами, образованными с помощью частично расплавленного сахароспирта. В целом, затвердевшие расплавленные гранулы, образованные с помощью полностью расплавленного сахароспирта, обычно легче обрабатывать, например, они не имеют тенденции к прилипанию к штампам станка для таблетирования по сравнению с затвердевшими расплавленными гранулами, образованными с помощью частично расплавленного сахароспирта. Соответственно, производительность и эффективность последующих стадий обработки (т.е. процесса таблетирования) может быть значительно увеличена с помощью применения затвердевших расплавленных гранул, когда сахароспирт полностью расплавлен.
Более того, твердые дозированные формы, в частности таблетки, полученные из затвердевших расплавленных гранул, когда сахароспирт полностью расплавлен, обычно более тверды и жестки, чем соответствующие твердые дозированные формы, полученные из затвердевших расплавленных гранул, когда сахароспирт расплавлен частично. В целом, твердые дозированные формы, в частности таблетки, полученные из затвердевших расплавленных гранул, когда сахароспирт полностью расплавлен, обычно более подходят для противостояния дополнительным строгим условиям способа производства (т.е. покрытию пленкой или покрытию сахаром) по сравнению с твердыми дозированными формами, образованными с помощью частично расплавленного сахароспирта.
Соответственно, если сахароспирт полностью расплавлен в процессе получения фармацевтической композиции, то фармацевтическая композиция может проявлять улучшенный профиль растворения по сравнению с сопоставимой фармацевтической композицией, образованной с помощью частично расплавленного сахароспирта. В этой связи фармацевтические композиции, которые содержат сахароспирт в виде единой непрерывной аморфной фазы, могут высвобождать более высокую концентрацию соли НПВС и/или парацетамола в водную среду в течение относительно короткого периода времени по сравнению с сопоставимой фармацевтической композицией, которая включает сахароспирт в полностью кристаллической форме или частично в кристаллической форме.
Соль НПВС и парацетамол могут объединяться с расплавленным сахароспиртом либо перед плавлением сахароспирта, либо после процесса плавления, тем самым формируя расплавленную смесь, включающую расплавленный сахароспирт, имеющий содержащиеся в нем соль НПВС и парацетамол. Предпочтительно, чтобы как соль НПВС, так и парацетамол объединялись с сахароспиртом перед плавлением сахароспирта (т.е. образуется сухая смесь сахароспирта, соли НПВС и парацетамола и затем сахароспирт плавится). Соль НПВС обычно нерастворима в расплавленном сахароспирте и обычно образуется дисперсия соли НПВС с расплавленной жидкостью. Обычно, как описывается здесь далее, соль НПВС имеет точку плавления значительно более высокую, чем точка плавления сахароспирта, и соль НПВС не плавится в процессе образования фармацевтической композиции по настоящему изобретению. Предпочтительно, чтобы с помощью подходящего выбора сахароспирта и условий получения парацетамол не плавился в процессе получения фармацевтической композиции. В целом это позволяет осуществлять обработку соли НПВС и парацетамола при относительно низких температурах, тем самым по существу сводя к минимуму и/или предотвращая разрушение соли НПВС и парацетамола.
Предпочтительно, чтобы расплавленная смесь соли НПВС, парацетамола и расплавленного сахароспирта смешивалась так, чтобы соль НПВС и любые другие необязательные наполнители для таблетирования, присутствующие в фармацевтической композиции, обычно однородно диспергировались в расплавленном сахароспирте. Таким образом продуцируется однородная смесь. Смеси дают охладиться с помощью способов, обсуждаемых здесь далее, до тех пор, пока не образуется твердое вещество. По мере охлаждения смеси она становится вязкой. Затвердевшая смесь затем формуется в расплавленные гранулы. Таким образом, применяемый здесь термин «затвердевшие расплавленные гранулы» обозначает гранулы, полученные с помощью объединения расплавленного сахароспирта с солью НПВС и парацетамолом, необязательно с другими наполнителями для таблетирования, охлаждения до температуры ниже точки плавления сахароспирта и формования твердой массы в гранулы. Фармацевтическая композиция включает множество таких гранул.
Таким образом, затвердевшие расплавленные гранулы могут быть получены с помощью полностью или частично расплавленного сахароспирта. В соответствии с предпочтительным аспектом настоящего изобретения затвердевшие расплавленные гранулы получают с помощью полностью расплавленного сахароспирта.
Расплаву дают затвердевать любым способом, признающимся как подходящий. Это включает как быстрое охлаждение, так и медленное охлаждение. Предпочтительно, чтобы расплав охлаждали быстро (т.е. закаливали), как здесь описано. Обычно это позволяет расплавленному сахароспирту образовывать единую непрерывную аморфную фазу. Например, расплаву можно дать охлаждаться в охлажденном сосуде. Расплав может быть вылит на охлажденные лотки, которые могут быть неподвижными или постоянно двигающимися. Неподвижные лотки могут быть помещены в холодильные комнаты. Двигающиеся лотки или ленты могут иметь дополнительные охлаждающие средства, такие как охлажденная вода. Охлажденный расплав образует твердое вещество и его можно соскрести с ленты или собрать при его падении с одного конца постоянно движущейся ленты.
Затвердевший расплав сахароспирта, включающий соль НПВС и парацетамол, может быть сформирован в гранулы с помощью множества способов. Например, он может быть разбит на гранулы. Он может быть размолот и/или просеян. Его можно также пропускать через устройство для распыления, такое как колонна для распыления или гранулятор для распыления, в которых расплавленный материал распыляется из отверстия в потоке охлажденного воздуха, позволяющем застывать/затвердевать, и затем собирается. Если расплав экструдируется, экструдат может быть охлажден и затем разбит на куски подходящего размера с последующим перемалыванием или просеиванием. Альтернативно, экструдат может быть экструдирован через отверстия и расколот в гранулы подходящего размера для таблетирования. При получении гранулированной композиции сахароспирт плавят. В условиях прессования сахароспирт может быть расплавлен при температуре ниже его нормальной точки плавления. Плавление может быть осуществлено в соответствии с известными способами, включая, например, нагревание в сосуде до температуры выше точки плавления сахароспирта или с помощью экструдирования в экструдере с нагреванием. Максимальная температура определяется стабильностью расплавленного сахароспирта и объединенных с ним ингредиентов. Обычно чем выше температура, тем более быстро сахароспирт будет плавиться, хотя это должно быть сбалансировано энергией входа, требуемой для нагревания сахароспирта. Для наибольшей эффективности обычно предусматривается, что сахароспирт будет нагреваться не более чем на 30°С, предпочтительно на 10-30°С выше свой точки плавления для поддержания минимальной цены энергии. Хотя обычно используемые температуры зависят, среди прочего, от конкретного применяемого сахароспирта, как здесь определяется, предпочтительный диапазон нагревания составляет от 80 до 180°С, более предпочтительно от 90 до 170°С, еще предпочтительнее от 100 до 160°С, наиболее предпочтительно от 110 до 150°С. Если сахароспирт экструдируется, обычно экструдер нагревают до данной температуры. Кроме того, работа с сахароспиртом с помощью экструдера с червячной конфигурацией также должна внести вклад в плавление сахароспирта, тем самым снижая требование к применяемой его внешней температуре. Соответственно, барабан экструдера может быть нагрет до температуры, меньшей, чем точка плавления сахароспирта. Например, нормальная точка плавления ксилита составляет от 95 до 97°С, однако в условиях силы/давления (таких, с которыми можно столкнуться в экструдере или сходном устройстве для обработки) применяемое внешнее нагревание, необходимое для плавления сахароспирта, может быть существенно снижено за счет механического нагревания, создающегося в результате интенсивного перемешивающего действия в экструдере. Обычно предусматривается, что экструдер будет нагреваться до температуры, не менее, чем на 25°С ниже точки плавления сахароспирта, предпочтительно в диапазоне от 20°С ниже точки плавления сахароспирта до 30°С выше точки плавления сахароспирта, более предпочтительно до температуры в диапазоне 20°С по каждую сторону точки плавления сахароспирта. Некоторые экструдеры позволяют нагревать различные области до различных температур в экструдере. Эти температуры могут быть выбраны по желанию для обеспечения полного плавления сахароспирта.
Соответственно, сахароспирт представляет собой форму твердого вещества при комнатной температуре (т.е. от 20 до 25°С) и стандартном атмосферном давлении. Под термином «сахароспирт» заявители подразумевают результирующий спирт, образованный путем восстановления соответствующих моно- и/или полисахаридов. Типичные сахаридные материалы включают сахара, такие как декстроза и мальтоза, например D-сорбит, который может быть образован с помощью восстановления глюкозы. Такие сахароспирты обычно обозначаются как «алдиолы», так как они могут быть образованы путем восстановления альдегида и кетогруппы соответствующих альдо- и кетосахаров соответственно.
Предпочтительно, чтобы сахароспирт был получен в результате восстановления моносахарида или дисахарида. Более предпочтительно, чтобы сахароспирт был получен в результате восстановления моносахарида.
Предпочтительно, чтобы сахароспирты, получаемые в результате восстановления дисахаридов, включали мальтит (т.пл. от 149 до 152°С), изомальт (т.пл. от 145 до 150°С) и лактит (т.пл. от 95 до 98°С), из которых предпочтительными являются мальтит и лактит.
Предпочтительно, чтобы сахароспирты, происходящие в результате восстановления моносахаридов, включали D-сорбит (т.пл. от 98 до 100°С), ксилит (т.пл. от 95 до 97°С), адонит (т.пл. от 102 до 104°С), арабит (т.пл. от 101 до 104°С), маннит (т.пл. от 167 до 170°С), дулцит (т.пл. от 188 до 191°С) и мезо-эритрит (т.пл. от 120 до 123°С). Более предпочтительные сахароспирты, получаемые в результате восстановления моносахаридов, включают D-сорбит, ксилит, адонит, арабит и мезо-эритрит. Наиболее предпочтительные сахароспирты, получаемые в результате восстановления моносахаридов, включают D-сорбит и ксилит, особенно ксилит.
Предпочтительные рабочие температуры для плавления указанных выше сахароспиртов, предпочтительно с помощью способа экструзии расплава, как здесь определяется, составляют приблизительно от 10 до 30°С выше точки плавления конкретного сахароспирта, так чтобы сахароспирт полностью плавился. Таким образом, предпочтительными рабочими температурами являются следующие: сорбит между приблизительно 108°С и приблизительно 132°С, ксилит между приблизительно 102°С и приблизительно 127°С, адонит между приблизительно 112°С и приблизительно 134°С, арабит между приблизительно 111°С и приблизительно 134°С, маннит между приблизительно 177°С и приблизительно 200°С, мезо-эритрит между приблизительно 130°С и приблизительно 153°С, лактит между приблизительно 105°С и приблизительно 128°С, мальтит между приблизительно 159°С и приблизительно 182°С и изомальт между приблизительно 155°С и приблизительно 180°С.
Хотя смесь сахароспиртов, как здесь определяется, может быть использована для образования фармацевтической композиции, предпочтительно применяют только один сахароспирт. Таким образом, в предпочтительном осуществлении фармацевтической композиции сахароспирт предпочтительно состоит по существу из D-сорбита или ксилита, особенно только ксилита.
Предпочтительно, сахароспирт имеет точку плавления, ниже или равную 180°С, более предпочтительно, ниже или равную 170°С, даже более предпочтительно, ниже или равную 150°С, наиболее предпочтительно, ниже или равную 120°С.
Предпочтительно, сахароспирт имеет точку плавления выше или равную 50°С, более предпочтительно выше или равную 70°С, наиболее предпочтительно выше или равную 90°С.
Сахароспирт обычно имеет точку плавления, которая меньше, чем точка плавления соли НПВС. Предпочтительно точка плавления сахароспирта находится, по меньшей мере, на 40°С, более предпочтительно, по меньшей мере, на 60°С, даже более предпочтительно, по меньшей мере, на 80°С, наиболее предпочтительно, приблизительно на 100°С меньше, чем точка плавления соли НПВС.
Сахароспирт обычно имеет точку плавления, которая ниже, чем точка плавления парацетамола. Соответственно, парацетамол не плавится в процессе образования фармацевтической композиции. Предпочтительно точка плавления сахароспирта находится, по меньшей мере, на 40°С, более предпочтительно, по меньшей мере, на 50°С, даже более предпочтительно, по меньшей мере, на 60°С, наиболее предпочтительно, приблизительно на 70°С ниже, чем точка плавления парацетамола.
В целом расплавленные гранулы могут быть образованы при температурах, по существу меньших, чем точка плавления соли НПВС и парацетамола. Другими словами, расплавленная смесь, включающая расплавленный сахароспирт, соль НПВС и парацетамол, образуется с помощью применения нагревания при температуре, которая достаточна для плавления сахароспирта, но не для плавления соли НПВС и парацетамола. Выгодно, что такие условия обработки обычно сводят к минимуму или предотвращают деградацию соли НПВС и парацетамола.
Предпочтительно, чтобы сахароспирт присутствовал в количестве, меньшем или равном 25% от массы, более предпочтительно меньшем или равном 20% от массы, более предпочтительно меньшем или равном 15% от массы, даже более предпочтительно меньшем или равном 10% от массы гранулированного компонента фармацевтической композиции. Предпочтительно, чтобы сахароспирт присутствовал в количестве, большем или равном 1% от массы, более предпочтительно большем или равном 4% от массы, наиболее предпочтительно большем или равном приблизительно 5% от массы гранулированного компонента фармацевтической композиции.
Предпочтительно, чтобы сахароспирт присутствовал в количестве, меньшем или равном 25% от массы, более предпочтительно меньшем или равном 20% от массы, даже более предпочтительно меньшем или равном 15% от массы, наиболее предпочтительно меньшем или равном 10% от массы на основе суммарной массы фармацевтической композиции. Предпочтительно, чтобы сахароспирт присутствовал в количестве, большем или равном 1% от массы, более предпочтительно большим или равном 4% от массы, наиболее предпочтительно большим или равном приблизительно 5% от массы на основе суммарной массы фармацевтической композиции.
В изобретении предоставляется состав гранулированной композиции, включающей разнообразные соли НПВС, в частности НПВС, которые предпочтительно ингибируют Cox-1. Подходящие типы НПВС, которые предпочтительно ингибируют Cox-1, могут быть выбраны из следующих категорий:
(1) производные пропионовой кислоты;
(2) производные уксусной кислоты;
(3) производные фенамовой кислоты;
(4) производные бифенилкарбоновой кислоты;
(5) оксикамы.
Подходящие производные пропионовой кислоты для применения здесь включают, но не ограничиваются этим, ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрозин, прапопрофен, миропрофен, тиоксапрофен, супрофен, альминопрофен, тиапрофеновую кислоту, флупрофен и буклозовую кислоту. Предпочтительные представители группы пропионовой кислоты включают ибупрофен, напроксен, флурбипрофен, фенопрофен, кетопрофен и фенбуфен, особенно ибупрофен.
Подходящие производные уксусной кислоты для применения здесь включают, но не ограничиваются этим, индометацин, сулиндак, толметин, зомепирак, диклофенак, фенклофенак, алклофенак, ибуфенак, изоксепак, фурофенак, тиопинак, зидометацин, ацеметацин, фентиазак, клиданак и оксипинак. Предпочтительные представители группы уксусной кислоты включают толметин натрия, зомепинак натрия, сулиндак и индометацин.
Подходящие производные фенамовой кислоты для применения здесь включают, но не ограничиваются этим, мефенамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту, нифлумовую кислоту и толфенамовую кислоту. Предпочтительные члены группы фенамовой кислоты включают мефенамовую кислоту и меклофенамовую кислоту.
Подходящие производные бифенилкарбоновой кислоты для применения здесь включают, но не ограничиваются этим, дифлунизал и флуфенизал.
Оксикамы для применения здесь включают, но не ограничиваются этим, пироксикам, судоксикан, изоксикам. Предпочтительным членом этой группы является пироксикам.
Соответственно, НПВС для применения в настоящем изобретении обычно проявляют изомерию. Соответственно, все стереоизомеры, диастереоизомеры, энантиомеры и их смеси, включая рацемические смеси НПВС, охватываются объемом настоящего изобретения.
Крайне благоприятным классом солей НПВС являются соли производных пропионовых кислот.
Предпочтительные соли производных пропионовых кислот, особенно соли 2-арилпропионовой кислоты, включают соли напроксена, флурбипрофена, ибупрофена и кетопрофена, особенно их рацемические смеси и S(+)-энантиомеры. Более предпочтительные соли 2-арилпропионовой кислоты включают соли флурбипрофена и ибупрофена, особенно их рацемические смеси и S(+)-энантиомеры. Даже более предпочтительные соли 2-арилпропионовой кислоты включают соли рацемического флурбипрофена и соли рацемического ибупрофена, особенно соли рацемического ибупрофена.
НПВС, применяемое в настоящем изобретении, находится в форме соли. Репрезентативные примеры солей включают: соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли магния или кальция; соли металлов, например соли алюминия; соли аминокислот, например соли лизина или аргинина; или соли аминов, например соль меглумина.
Предпочтительные соли включают соли щелочных металлов, соли щелочно-земельных металлов, соли аминов и соли аминокислот. Более предпочтительные соли включают соли щелочных металлов, соли аминов и соли аминокислот. Наиболее предпочтительные соли включают соли щелочных металлов, в частности соли натрия или калия, особенно соль натрия.
Соответственно, в высокой степени предпочтительная соль НПВС для применения в настоящем изобретении представляет собой натриевую соль рацемического ибупрофена или натриевую соль S(+)-ибупрофена. Наиболее предпочтительно, чтобы соль НПВС включала натриевую соль рацемического ибупрофена.
Соответственно, гранулированная композиция может включать одну или более различных солей НПВС, как определено здесь. Предпочтительно, однако, чтобы гранулированная композиция содержала одну соль НПВС. Наиболее предпочтительно, чтобы гранулированная композиция включала одну соль НПВС в одной энантиомерной форме или в виде рацемической смеси, т.е. только S(+)-ибупрофен или только рацемический ибупрофен. Более того, как описывается здесь далее, фармацевтическая композиция может содержать один или более дополнительных фармацевтически активных агентов в дополнение к соли НПВС и парацетамолу. Однако наиболее предпочтительная фармацевтическая композиция по настоящему изобретению содержит соли НПВС и парацетамол как единственные фармацевтически активные агенты, наиболее предпочтительно, одну соль НПВС, как здесь определено, и парацетамол.
Соль НПВС может быть в безводной или гидратированной форме. Предпочтительно, чтобы соль НПВС была в гидратированной форме. В этой связи дигидрат натриевой соли рацемического ибупрофена представляет собой особенно предпочтительную соль НПВС.
Соли НПВС обычно имеют точку плавления между приблизительно 150°С и приблизительно 270°С, предпочтительно между приблизительно 170°С и приблизительно 260°С. В этой связи дигидрат натриевой соли ибупрофена имеет точку плавления приблизительно 200°С, натриевая соль напроксена имеет точку плавления приблизительно от 250 до 251°С и лизинат ибупрофена имеет точку плавления приблизительно от 177 до 180°С.
Пропорция соли НПВС в фармацевтической композиции должна зависеть от желаемой дозы для терапевтического эффекта. Лекарства с низкими дозами, такие как соли флурбипрофена и кетопрофена, могут составлять настолько мало, как 10% от массы гранулированного компонента, для обеспечения того, чтобы фармацевтическая дозированная форма (т.е. таблетка), получаемая из композиции, не была слишком маленькой. Однако предпочтительная черта изобретения состоит в том, что высокая доза солей НПВС, таких как соли ибупрофена, может быть составлена в более мелкие единицы дозированных форм. Соответственно, соль НПВС обычно составляет величину, большую или равную 20% от массы, предпочтительно большую или равную 25% от массы, более предпочтительно большую или равную 30% от массы гранулированного компонента фармацевтической композиции. Соответственно, соль НПВС обычно составляет величину, меньшую или равную 60% от массы, более предпочтительно меньшую или равную 50% от массы, наиболее предпочтительно меньшую или равную 45% от массы гранулированного компонента фармацевтической композиции.
Предпочтительно, соль НПВС присутствует в количестве, большем или равном 20% от массы, более предпочтительно большем или равном 25% от массы, даже более предпочтительно большем или равном 30% от массы на основе суммарной массы