Глазной имплантат, изготавливаемый способом двойной экструзии
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к офтальмологии. Изобретение характеризует изготовление биодеградируемых имплантатов путем двойной экструзии, подходящих по размеру для имплантации в глазничную область, чтобы, по меньшей мере, 75% частиц активного агента имели диаметр менее 10 или 20 микрон, и способ лечения патологического состояния глаза с помощью изготовленного биодеградируемого имплантата. Имплантаты изготовлены из смеси СМГК с гидрофильными и гидрофобными концами. Изобретение обеспечивает доставку активных агентов в глазничную область без высвобождения с резким выбросом. 2 н. и 12 з.п. ф-лы, 10 табл., 17 ил.
Реферат
Перекрестная ссылка
Данная заявка является частичным продолжением заявки на патент США № 10/340237, поданной 9 января 2003 г., полное содержание которой включено в данную заявку посредством ссылки.
Предшествующий уровень техники
Настоящее изобретение относится к имплантатам и способам лечения патологических состояний глаз. В частности, настоящее изобретение относится к имплантатам и способам лечения патологических состояний глаз посредством имплантации в глазничную область или сайт биодеградируемого имплантата, содержащего активный агент и биодеградируемую полимерную матрицу, где имплантат изготавливается способом двойной экструзии. Биодеградируемые имплантаты по настоящему изобретению имеют варьируемые и сниженные скорости высвобождения для обеспечения улучшенной кинетики высвобождения одного или нескольких активных (терапевтических) агентов в течение определенного периода времени.
Патологическое состояние глаза может включать заболевание, недомогание или состояние, поражающее глаз или затрагивающее глаз, либо его часть, либо область глаза. В общем, глаз включает глазное яблоко и ткани, а также жидкости, содержащиеся в глазном яблоке, окологлазные мышцы (такие как косые и прямые мышцы), а также участок глазного нерва, находящийся внутри или прилегающий к глазному яблоку. Состоянием, затрагивающим переднюю область глаза, является болезнь, недомогание или состояние, поражающее или затрагивающее переднюю (т.е. фронтальную область глаза) область глаза или его сайт, например окологлазная мышца, веко, ткани глазного яблока или жидкость, находящаяся перед задней стенкой оболочки хрусталика, а также ресничная мышца. Таким образом, состояния, затрагивающие переднюю область глаза, в первую очередь поражают или затрагивают конъюнктиву, роговицу, переднюю камеру, радужку, заднюю камеру (позади сетчатки, но спереди задней стенки оболочки хрусталика), хрусталик или оболочку хрусталика, а также кровеносные сосуды, нервы, которые васкуляризуют или иннервируют переднюю область глаза или ее участок. Состоянием, затрагивающим заднюю область глаза, является болезнь, недомогание или состояние, которое в первую очередь поражает или затрагивает заднюю область глаза или ее участок, например сосудистую оболочку глаза или склеру (в заднем положении по отношению к проекции через заднюю стенку оболочки хрусталика), стекловидное тело, камеру стекловидного тела, сетчатку, зрительный нерв (т.е. диск зрительного нерва), а также кровеносные сосуды и нервы, которые васкуляризуют или иннервируют заднюю область глаза либо ее участок.
Так, состоянием, затрагивающим заднюю область глаза, может являться заболевание, недомогание или состояние, такое как, например, дегенерация желтого пятна сетчатки (такая как неэкссудативная возрастная дегенерация желтого пятна сетчатки и экссудативная возрастная дегенерация желтого пятна сетчатки); хориоизадная неоваскуляризация; острая нейроретинопатия желтого пятна сетчатки, отек сетчатки (например, кистоидный отек желтого пятна сетчатки и диабетический отек сетчатки); болезнь Бехчета, заболевания сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию); артериальная закупорка сосудов сетчатки, закупорка центральной вены сетчатки; увеит; отслойка сетчатки; травмы глаза, поражающие заднюю область глаза или область глаза в целом; состояние, затрагивающее заднюю область глаза, вызванное или явившиеся следствием действия лазера; состояния, затрагивающие заднюю область глаза, вызванные или явившиеся следствием фототерапии; фотокоагуляция; лучевая ретинопатия; заболевания эпиретинальной мембраны; закупорка венозных сосудов сетчатки; передняя ишемическая зрительная невропатия; неретинопатическая диабетическая ретинальная дисфункция, пигментная дегенерация сетчатки и глаукома. Глаукома может рассматриваться как состояние, затрагивающее заднюю область глаза, поскольку задачей терапии является предотвращение или снижение вероятности потери зрения вследствие повреждения или гибели клеток сетчатки или клеток зрительного нерва (т.е. нейропротективное действие).
Состоянием, затрагивающим переднюю часть глаза, может являться заболевание, недомогание или состояние, такое как, например, афакия; артифакия; астигматизм; блефароспазм; катаракта; заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язва роговицы; синдром сухих глаз; заболевания века; заболевания слезного аппарата; закупорка слезных каналов; миопия; старческая заднозоркость; нарушения функции зрачка и косоглазие. Глаукома также может рассматриваться как состояние, затрагивающее переднюю область глаза, поскольку клинической целью лечения глаукомы может являться понижение давления водосодержащей жидкости в передней камере глаза (т.е. понижение внутриглазного давления).
Настоящее изобретение направлено и связано с имплантатом и способами лечения патологических состояний глаза, таких как состояния, затрагивающие переднюю или заднюю область глаза, либо состояний глаза, которые можно характеризовать как затрагивающие переднюю, так и заднюю области глаза.
Терапевтические соединения, пригодные для лечения состояний глаза, могут включать активные агенты, например, с антиопухолевой, антиангиогенезной, киназно-ингибирующей, холиноблокирующей, антиадренергической и/или противовоспалительной активностью.
Дегенерация желтого пятна сетчатки, такая как возрастная дегенерация желтого пятна (ВДЖП), является основной причиной слепоты во всем мире. Установлено, что тринадцать миллионов американцев имеют симптомы дегенерации желтого пятна. Дегенерация желтого пятна приводит к разрушению пятна, светочувствительной части сетчатки, ответственной за четкую, направленную видимость, необходимую для чтения или вождения. Особенно травмируется центральное зрение. Диагностируют или сухую (атрофическую) дегенерацию желтого пятна, или влажную (экссудативную). Сухая форма дегенерации желтого пятна более распространена, чем влажная, и около 90% пациентам с ВДЖП был поставлен диагноз сухая ВДЖП. Влажная форма заболевания, как правило, приводит к более серьезной потере зрения. Дегенерация желтого пятна вызывает постепенную или внезапную безболезненную потерю зрения. Причины возникновения дегенерации желтого пятна не ясны. Сухая форма ВДЖП может быть следствием старения и истончения тканей желтого пятна, отложения пигментов в желтом пятне, либо комбинации этих двух процессов. При влажной ВДЖП под сетчаткой растут новые кровеносные сосуды, выделяющие кровь и жидкость. Эти выделения вызывают смерть клеток сетчатки и порождают слепые пятна в центральном зрении.
Отек желтого пятна (ОЖП) может привести к опуханию пятна. Отек вызывают выделения жидкости из кровеносных сосудов сетчатки. Кровь просачивается из слабых стенок сосудов в очень маленькую область пятна, достигая светового конуса и нервных окончаний, которые детектируют цвет и от которых зависит дневное зрение. В области центрального зрения возникает размытость в центре или только по краям. Потеря зрения может прогрессировать в течение нескольких месяцев. Закупорка кровеносных сосудов сетчатки, воспаление глаза, возрастная дегенерация желтого пятна - все эти заболевания связаны с отеком пятна. Желтое пятно также может быть повреждено из-за опухоли вследствие экстракции катаракты. Симптомы ОЖП включают размытое центральное зрение, искаженное видение, видение с розовым оттенком, а также светочувствительность. Причинами возникновения ОЖП могут быть закупорка венозных сосудов сетчатки, дегенерация желтого пятна, диабетическая утечка желтого пятна, воспаление глаза, идиопатическая центральная серозная хориопатия, передний или задний увеит, задний циклит, пигментная дегенерация сетчатки, лучевая ретинопатия, задняя отслойка стекловидного тела, образование эпиретинальной оболочки, идиопатическая юкстафовеальная телеангиэктазия сетчатки, Nd:YАG (иттрий-аллюминий-галлий) капсулотомия или иридотомия. Некоторые пациенты с ОЖП могут в течение некоторого времени местно применять адреналин или аналоги простагландина для глаукомы. Основной способ лечения ОЖП обычно заключается в местном применении противовоспалительных капель.
Отек желтого пятна обычно представляет собой неспецифичный ответ сетчатки на различные повреждения. Он связан с различными заболеваниями, включая увеит, аномалии сосудистой системы сетчатки (диабетическая ретинопатия и болезнь закупорки кровеносных сосудов сетчатки), последствия операций катаракты (кистоидный отек желтого пятна после катаракты), эпиретинальную мембрану желтого пятна, а также наследственную или приобретенную дистрофию сетчатки. Отек пятна включает разрыв внутреннего гемато-ретинального барьера на уровне капиллярного эндотелия, приводящий к аномальной проницаемости сосудов сетчатки и просачиванию в примыкающие к сетчатке ткани. Желтое пятно становится плотнее вследствие накапливания жидкости, приводя к существенным нарушениям в зрительной активности (Ahmed I, Ai E. Macular disorders: cystoid macular oedema. In: Yanoff M, duker JS, eds. Ophthalmology. London: Mosby; 1999:34; Dick J, Jampol LM, Haller JA. Macular edema. In: Ryan S, Schachat AP, eds. Retina. 3rd ed. St. Louis, МО: CV Mosby; 2001, v.2, Section 2 chap. 57:967-979).
Отек сетчатки может возникать в результате заболеваний, приводящих к накоплению повреждений в течение нескольких лет, таких как диабетическая ретинопатия, либо в результате более серьезных явлений, таких как закупорка центральной вены сетчатки или закупорка ответвлений кровеносных сосудов сетчатки.
В некоторых случаях отек желтого пятна проходит самопроизвольно или после короткого лечения. Выбор способа лечения отека желтого пятна зависит от причины и тяжести состояния. В настоящий момент не существует утвержденных фармакологических способов лечения отека желтого пятна. Было показано, что фокальная/рассеянная лазерная фотокоагуляция является эффективной для предотвращения умеренного снижения зрения вследствие отека желтого пятна, обусловленного диабетической ретинопатией (Akduman L, Olk RS. The early treatment diabetic retinopathy study. In: Kertes PS, Conway MD, eds. Clinical trials in ophthalmology: a summary and practice guide. Baltimore, MD: Lippincott Williams&Wilkins; 1998:15-35; Frank RN. Etiologic mechanisms in diabetic retinopathy. In: Ryan S, Schachat AP, eds. Retina. 3rd ed. St. Louis, МО: CV Mosby; 2001, v.2, section 2, chap. 71:1259-1294). Фотокоагуляция аргоновым лазером увеличивает вероятность улучшения зрения у пациентов с отеком желтого пятна, обусловленным закупоркой ответвлений кровеносных сосудов (ЗОКС) (Orth D. The branch vein occlusion study. In: Kertes P, Conway M, eds. Clinical trials in ophthalmology: a summary and practice guide. Baltimore, MD: Lippincott Williams&Wilkins; 1998:113-127; Fekrat S, Finkelstein D. The Central Vein Occlusion Study. In: Kertes PS, Conway MD, eds. Clinical trials in ophthalmology: a summury and practice guide. Baltimore, MD: Lippincott Williams&Wilkins; 1998:129-143), но не улучшает зрение у пациентов с отеком желтого пятна, обусловленным закупоркой центральной вены сетчатки (ЗЦВС) (Fekrat and Finkelstein 1998, выше; Clakson JG. Central retinal vein occlusion. In: Ryan S, Schachat AP, eds. Retina. 3rd ed. St. Louis, МО: CV Mosby; 2001, v.2, chap. 75:1368-1375). Эффективные способы лечения ЗЦВС в настоящее время не известны.
Можно использовать противовоспалительные агенты (т.е. иммунодепрессанты) для лечения патологических состояний глаза, таких как состояния, затрагивающие заднюю область глаза, которые включают воспалительные процессы, например увеит или отек желтого пятна. Так, для лечения увеита можно применять глюкокортикоиды местно или перорально. Основной проблемой местного или перорального введения лекарства является неспособность лекарства обеспечить соответствующую (т.е. терапевтической) концентрацию внутри глаза. См., например, Bloch-Michel E. (1992). Opening address: intermediate uveitis, In Intermediate Uveitis, Dev. Ophthalmol, W.R.F. Böke et al. editors., Basel: Karger, 23:1-2; Pinar, V., et al. (1997). Intraocular inflammation and uveitis" In Basic and Clinical Science Course. Section 9 (1997-1998) San Francisco: American Academy of Ophthalmolgy, pp. 57-80, 102-103, 152-156; Böke, W. (1992). Clinical picture of intermediate uveitis, In IntermediateUveitis, Dev. Ophthalmol. W.R.F. Böke et al. editors., Basel: Karger, 23:20-7; and Cheng C-K et al. (1995). Intravitreal sustained-release dextramethasone device in the treatment of experimental uveitis, Invest. Ophthalmol. Vis. Sci. 36:442-53.
Для лечения увеита может производиться системное введение глюкокортикоидов отдельно или в добавление к местному применению глюкокортикоидов. Однако продолжительное действие стероидов с высокой концентрацией в плазме (введение 1 мг/кг/день в течение 2-3 недель) часто является необходимым для того, чтобы достигнуть терапевтического уровня содержания лекарства в глазу.
К сожалению, эти уровни высокой концентрации лекарства в плазме часто приводят к системным побочным эффектам, таким как гипертензия, гипергликемия, повышенная восприимчивость к инфекциям, язвенная болезнь, психоз и другие осложнения. Cheng C-K et al. (1995). Intravitreal sustained-release dextramethasone device in the treatment of experimental uveitis, Invest. Ophthalmol. Vis. Sci. 36:442-53; Schwartz, B. (1966). The response of ocular pressure to corticosteroids, Ophthalmol. Clin. North Am. 6:929-89; Skalka, H.W. et al. (1980). Effect of corticosteroids on cataract formation, Arch Ophtalmol. 98:1773-7; and Renfro, L. et al. 91992). Ocular effects of topical and systemic steroids, Dermathologic Clinics 10:505-12.
Кроме того, доставка терапевтического количества активного агента в глаз может быть сложной задачей, а иногда и невозможной, для лекарств с коротким периодом полураспада в плазме, поскольку действие лекарства на внутриглазные ткани ограничено. Поэтому более эффективным путем доставки лекарства для лечения состояний, затрагивающих заднюю область глаза, является помещение лекарства прямо в глаз, например, непосредственно в стекловидное тело. Maurice, D.M. (19983). Micropharmaceutics of the eye, Ocular Inflammation Ther. 1:97-102; Lee, V.H.L et al. (1989). Dug delivery to the posterior segment" Chapter 25 In Retina. Т.Е. Ogden and A.P. Schachat eds., St. louis: CV Mosby, Vol.1, pp.483-98; and Olsen, T.W. et al. (1995). Human scleral permeability: effects of age, cryotherapy, transscleral diode laser, and surgical thinning, Invest. Ophthalmol. Vis. Sci. 36:1893-1903.
Такие способы, как инъекции лекарства в стекловидное тело, дают многообещающие результаты, но из-за короткого времени полураспада активных агентов, например глюкокортикоидов (около 3 часов), инъекции в стекловидное тело следует часто повторять для поддержания терапевтического уровня лекарства. В свою очередь, этот многократно повторяемый процесс увеличивает возможность возникновения побочных эффектов, таких как отслоение сетчатки, эндофтальмит и катаракта. Maurice, D. М. (1983). Micropharmaceutics of the eye, Ocular Inflammation Ther. 1:97-102; Olsen, T.W. et al. (1995). Human scleral permeability: effects of age, cryotherapy, transscleral diode laser, and surgical thinning, Invest. Ophthalmol. Vis. 36:1893-1903; and Kwak, H.W. and D'Amico, D.J. (1992). Evaluation of the retinal toxicity and pharmacokinetics of dexamethasone after intravitreal injection, Arch. Ophthalmol. 110:259-66.
Кроме того, лечение глюкокортикоидами местным, системным или периокулярным введением должно проводиться под тщательным наблюдением из-за токсичности и долговременных побочных эффектов, связанных с хроническими осложнениями вследствие системного действия лекарства. Rao, N.A. et al. (1997). Intraocular inflammation and uveitis, In Basic and Clinical Science Course. Section 9 (1997-1998) San Francisco: American Academy of Ophthalmology, pp.57-80, 102-103, 152-156; Schwartz, В. (1966). The response of ocular pressure to corticosteroids, Ophthalmol Clin North Am 6:929-89; Skalka, H.W. and Pichal, J.T. (1980). Effect of corticosteroids on cataract formation, Arch Ophthalmol 98:1773-7; Renfro, L. and Snow, J.S. (1992). Ocular effects of topical and systemic steroids, Dermatologic Clinics 10:505-12; Bodor, N et al. (1992). A comparison of intraocular pressure elevating activity of loteprednol etabonate and dexamethasone in rabbits, Current Eye Reserch 11:525-30.
В патенте США 6,217,895 рассматривается способ введения кортикостероидов в заднюю область глаза, но в нем не раскрыты биодеградируемые имплантаты.
В патенте США 5,501,856 раскрываются фармацевтические препараты с контролируемым высвобождением для внутриглазных имплантатов, применяемых во внутренней области глаза после хирургического вмешательства в случаях заболеваний сетчатки/стекловидного тела или в случае глаукомы.
В патенте США 5,869,079 раскрыта комбинация гидрофильных и гидрофобных элементов в биодеградируемом имплантате с продолжительным высвобождением, а также описан имплантат из сополимера молочной и гликолевой кислот (СМГК), содержащий дексаметазон. Как показало исследование кинетики высвобождения in vitro, описанный имплантат, содержащий 100-120 мкг 50:50 СМГК/дексаметазона, не показал значимого высвобождения лекарства до начала четвертой недели, и ситуация изменилась только лишь после добавления в состав агента, усиливающего высвобождение, такого как ГПМЦ (гидроксипропилметилцеллюлоза).
В патенте США 5,824,072 раскрыты имплантаты для введения в супрахориоидальную область глаза или бессосудистый участок глаза, а также описан имплантат из метилцеллюлозы (т.е. не являющийся биодеградируемым), содержащий дексаметазон. В WO 95/13765 раскрыты имплантаты, содержащие активные агенты, для введения в супрахориоидальную или бессосудистую область глаза в терапевтических целях.
В патенте США 4,997,652 и 5,164,188 раскрыты биодеградируемые глазные имплантаты, содержащие лекарство в микрокапсулах, а также описаны микрокапсулы для имплантации в заднюю область глаза, включающие сукцинат гидрокортизона.
В патенте США 5,164,188 раскрыты агенты в виде микрокапсул для введения в супрахориоидальную область глаза, а также описано размещение микрокапсул и дисков, содержащих гидрокортизон, в ресничный кружок. В патенте США 5,443,505 и 5,766,242 раскрыты имплантаты, содержащие активные агенты, для введения в супрахориоидальную или бессосудистую области глаза, а также описано размещение микрокапсул и дисков, содержащих гидрокортизон, в ресничный кружок.
Zhou с соавторами описали имплантат, содержащий несколько лекарств, включая 5-фторуридин, триамцинолон, а также рекомбинантный активатор плазминогена ткани человека, для внутриглазной терапии полиферативной витреоретинопатии (ПВР). Zhou Т., et al. (1998). Development of a multiple-drug delivery implant for intraocular management of proliferative vitreoretinopathy, Journal of Controlled Release 55:281-295.
В патенте США 6,046,187 рассматриваются способы и композиции для модулирования местного обезболивающего посредством введения одного или нескольких глюкокортикоидных агентов до, одновременно или после введения местного обезболивающего пациенту.
В патенте США 3,986,510 рассматриваются вкладыши для глаз, имеющие один или несколько внутренних резервуаров для лекарственной композиции, заключенных внутри биодеградируемого материала, контролирующего степень высвобождения лекарства, размера, подходящего для введения и удерживания этих вкладышей в «глазном мешочке», который определен как пространство, ограниченное поверхностью конъюнктивы склеры глазного яблока и соединительной оболочкой века, либо для размещения вкладышей над областью роговицы глаза.
В патенте США 6,369,116 рассматриваются имплантаты с модификатором высвобождения, введенные в склеральный лоскут.
В патенте ЕР 654256 рассматривается применение после хирургической операции на стекловидном теле тампонов для склеры для закупоривания надрезов.
В патенте США 4,863,457 рассматривается применение биодеградируемых имплантатов для предотвращения осложнений при фильтрационной хирургии глаукомы посредством размещения имплантата либо в подконъюнктивальной области между мембраной конъюнктивы, покрывающей конъюнктиву, и склерой, расположенной ниже, либо помещением имплантата непосредственно в склеру, в частично утолщенный склеральный лоскут.
В патенте ЕР 488401 рассматриваются внутриглазные имплантаты, изготовленные из определенного полимера молочной кислоты, для применения во внутренней части глаза после хирургического вмешательства в случаях заболеваний сетчатки/стекловидного тела или в случае глаукомы.
В патенте ЕР 430539 рассматривается применение биодеградируемых имплантатов, введенных в супрахориоидальную область.
В патенте США 6,726,918 рассматриваются имплантаты для лечения воспалений, обусловленных патологическими состояниями глаза.
Известно, что составы СМГК биодеградируемых полимеров, содержащих активный агент, обычно характеризуются сигмоидальной кривой высвобождения (которая изображается как зависимость процента высвобожденного активного агента от времени), то есть после относительно долгого начального периода задержки (первая фаза высвобождения), когда высвобождается совсем небольшое количество активного агента, далее следует значительный подъем кривой, когда высвобождается наибольшее количество активного агента (вторая фаза высвобождения), затем следует почти горизонтальный участок кривой (третья фаза высвобождения), когда высвобождение лекарства достигает плато.
Одной из альтернатив введения лекарств посредством инъекций в стекловидное тело является помещение биодеградируемых имплантатов под склерой или в подконъюнктивальное или супрахориоидальное пространство, как описано в патенте США 4,863,457 Lee; заявках WO 95/13765 Wong et al.,; WO 00/37056 Wong et al.; ЕР 430,539 Wong; Gould et al. Can. J. Ophthalmol., 29(4):168-171 (1994); а также Apel et al., Curr. Eye Res. 14:659-667 (1995).
Кроме того, контролируемое высвобождение лекарства из СМГК в стекловидное тело было раскрыто Ohtori et al. в патенте США 5,501,856, а также Ogura в патенте ЕР 654,256.
Последние научные исследования показали, что СМГК без концевых функциональных групп распадаются быстрее, чем с концевыми функциональными группами (Park et al. Control. Rel. 55:181-191 (1998); Tracy et al., Biomaterials 20:1057-1062 (1999); и Jong et al., Polymer 42:2795-2802 (2001). Таким образом, созданы имплантаты, содержащие смеси СМГК с концевыми функциональными группами и без таковых, для модулирования высвобождения лекарства. Например, в патенте США 6,217,911 Vaughn et al. ('911) и в патенте США 6,309,669 Setterstrom et al. ('699) раскрыта доставка лекарства из смеси СМГК с концевыми функциональными группами и без них, для сокращения начального внезапного высвобождения лекарств. В '911 патенте композицию для доставки нестероидных противовоспалительных лекарств из микросфер СМГК получают способом экстракции растворителем или способом упаривания растворителя в течение периода от 24 часов до 2 месяцев. В патенте '699 раскрыта композиция для доставки различных фармацевтических препаратов из СМГК микрокапсул в течение 1-100 дней. Микросферы или микрокапсулы из СМГК вводятся перорально или в виде водной инъекции. Как отмечено выше, пероральное введение обеспечивает недостаточное распределение лекарства в глазничной области. Кроме того, следует избегать применения водных лекарственных композиций для инъекций (для инъекций в глазничную область), поскольку глаз представляет собой закрытое пространство (ограниченный объем) с точно поддерживаемым диапазоном внутриглазного давления. Инъекционное введение может увеличить внутриглазной объем до предела, когда внутриглазное давление станет патологическим.
Сильные кортикостероиды, такие как дексаметазон, подавляют воспаление, тормозя отек, отложение фибрина, прорыв капилляров и фагоцитарную миграцию, все основные факторы реакции на воспаление. Кортикостероиды предотвращают высвобождение простагландинов, некоторые из них определены как медиаторы кистоидного отека желтого пятна (Leopold IH. Nonsteroidal and steroidal anti-inflammatory agents. In: Sears M, Tarkkanen A, eds. Surgical pharmacology of the eye. New York, NY: Raven Press; 1985:83-133; Tennant JL. Cystoid maculopathy: 125 prostaglandins in ophthalmology. In: Emery JM, ed. Current concepts in cataract surgery: selected proceedings of the fifth biennial cataract surgical congress, Section 3. St. Louis, МО: CV Mosby; 1978:360-362). Кроме того, было показано, что кортикостероиды, включая дексаметазон, ингибируют экспрессию васкулярного эндотелиального фактора роста (ВЭФР), цитокина, являющегося сильным стимулятор проницаемости сосудов (Nauck M, Karakiulakis G, Perruchoud АР, Papakonstantinou E, Roth M. Corticosteroids inhibit the expression of the vascular endothelial growth factor gene in human vascular smooth muscle cells. Eur J Pharmacol 1998; 341:309-315).
На настоящий момент применение дексаметазона доступными способами введения принесло лишь ограниченный успех в лечении заболеваний сетчатки, включая отек желтого пятна, большей частью вследствие невозможности доставить и поддержать соответствующее количество лекарства в заднюю область глаза, избегая при этом последствий, связанных с токсичностью. После местного введения дексаметазона только около 1% достигает передней области, и только некоторая часть этого количества попадает в заднюю область (Lee VHL, Pince KJ, Frambach DA, Martini B. Drug delivery to the posterior segment. In: Ogden ТЕ, Schachat AP, eds. Retina. St. Louis, МО: CV Mosby, 1989, chap 25:483-498). Хотя инъекции дексаметазона в стекловидное тело применяются, действие лекарства очень коротко, поскольку время полураспада лекарства внутри глаза составляет примерно 3 часа (Peyman GA, Herbst R. Bacterial endophthalmitis. Arch Ophthalmol 1974; 91:416-418). Инъекции дексаметазона в окологлазную область или заднюю область под тенонову оболочку также обладают очень непродолжительным лечебным эффектом (Riordan-Eva P, Lightman S. Orbital floor steroid injections in the treatment of uveitis. Eye 1994; 8 (Pt 1):66-69; Jennings T, Rusin M, Tessler H, Cunha-Vaz J. Posterior sub-Tenon's injections of corticosteroids in uveitits patients with cystoid macular edema. Jpn J Ophthalmol 1988:32:385-391).
Неблагоприятные эффекты, перечисленные для известных офтальмологических препаратов, содержащих дексаметазон, включают: повышенное глазное давление, глаукома, образование задней субкапсулярной катаракты, а также вторичные патогенные глазные инфекции, включая простой герпес (Lee et al. 1989 выше; Skalka HW, Prchal JT. Effect of corticosteroids on cataract formation. Arch Ophthalmol 1980; 98:1773-1777; Renfro L, SnowJS. Ocular effedts of topical and systemic steroids. Dermatol Clin 1992; 10(3):505-512; Physician's Desk Reference, 2003). Системное введение доз также связано с дополнительными опасными побочными эффектами, включая гипертензию, гипергликемии, повышенную восприимчивость к инфекциям, а также язвенную болезнь (Physician's Desk reference, 2003).
Доставляя лекарство непосредственно в полость стекловидного тела, можно избежать осложнений, связанных с гематоофтальмическим барьером, и достигнуть терапевтического уровня содержания лекарства с минимальным риском возникновения системной токсичности (Lee et al., 1989 выше). Такой путь введения обычно приводит к короткому периоду полураспада, за исключением случаев, когда лекарство можно доставить, используя состав, способный обеспечить продолжительное высвобождение.
В результате, биодеградируемые имплантаты для доставки терапевтического агента в глазничную область могут обеспечить существенную медицинскую пользу для пациентов, страдающих от различных заболеваний глаз.
Графические материалы
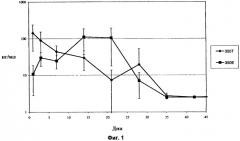
Фиг.1 показывает концентрацию дексаметазона in vivo в стекловидном теле глаза кролика в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона.
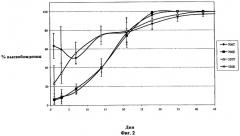
Фиг.2 показывает суммарное процентное высвобождение дексаметазона in vivo в стекловидном теле глаза кролика в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона и 700 мкг дексаметазона.
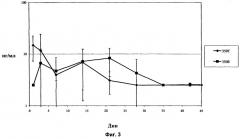
Фиг.3 показывает концентрацию дексаметазона в водянистой жидкости глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона.
Фиг.4 показывает концентрацию дексаметазона в плазме (из образца крови кролика) in vivo в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона.
Фиг.5 показывает концентрацию дексаметазона в стекловидном теле глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 700 мкг дексаметазона.
Фиг.6 показывает концентрацию дексаметазона в водянистой влаге глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 700 мкг дексаметазона.
Фиг.7 показывает концентрацию дексаметазона в плазме (из образца крови кролика) in vivo в течение 42-дневного периода после имплантации в заднюю область глаза кролика спрессованных и экструдированных биодеградируемых имплантатов, содержащих 700 мкг дексаметазона.
Фиг.8 показывает концентрацию дексаметазона в стекловидном теле глаза кролика in vivo в течение 42-дневного периода после имплантации в заднюю область глаза спрессованных и экструдированных биодеградируемых имплантатов, содержащих 350 мкг дексаметазона и 700 мкг дексаметазона.
Фиг.9 показывает суммарное процентное высвобождение дексаметазона in vitro в физиологическом растворе при температуре 37°С из имплантатов, имеющих массовое соотношение дексаметазона и СМГК 60:40, с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 40:0 (312-140-2), с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 30:10 (312-140-4), с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 20:20 (312-140-3) и с массовым соотношением СМГК с гидрофобными концами и гидрофильными концами 0:40 (312-140-1).
На Фиг.10 приведено сравнение суммарного процентного высвобождения дексаметазона in vitro в физиологическом растворе при температуре 37°С для шести партий спрессованных имплантатов, содержащих около 60 мас.% дексаметазона, 30 мас.% СМГК с гидрофильными концами и 10 мас.% СМГК с гидрофобными концами.
Фиг.11 представляет собой технологическую схему, иллюстрирующую способ производства таблеток, способы однократный и двойной экструзии для производства глазных имплантатов, без ограничения объема изобретения.
Фиг.12 представляет собой график, показывающий суммарное количество дексаметазона, высвобожденного in vitro в течение некоторого времени из глазных имплантатов, произведенных способом либо таблетирования, либо однократной экструзии.
Фиг.13 представляет собой фотографии сканирующей электронной микроскопии СДЛДЗО имплантатов, изготовленных способом таблетирования и способом однократной экструзией.
Фиг.14 демонстрирует два графика, сравнивающие варьирование %ОЗ (-% общего дексаметазона) от партии к партии и в пределах одной партии имплантатов, изготовленных как из неизмельченных, так и из измельченных СМГК.
Фиг.15 представляет собой график, показывающий высвобождение in vitro дексаметазона из СДЛДЗО имплантатов, изготовленных как способом однократной, так и способом двойной экструзии.
Фиг.16 представляет собой технологическую схему, иллюстрирующую производство глазных имплантатов способом двойной экструзии, без ограничения объема настоящего изобретения.
Фиг.17 вид в боковом срезе аппликатора для имплантации глазного имплантата, без ограничения объема настоящего изобретения.
Краткое изложение сущности изобретения
Определения
Следующие термины, использующиеся в тексте настоящей заявки, имеют следующие значения:
«Примерно» означает примерно или почти и в контексте числовых значений или диапазонов, приведенных здесь, означает ±10% от числового значения или диапазона, перечисленного либо заявленного.
«Активный агент» и «лекарство» используются здесь взаимозаменяемо и означают любую субстанцию, применяемую для лечения патологических состояний глаз.
«Биодеградируемый полимер» означает полимер, деградирующий in vivo, и деградация полимера со временем является необходимым условием для достижения кинетики высвобождения активного агента по настоящему изобретению. Так, гидрогели, такие как метилцеллюлоза, в которых лекарство высвобождается посредством набухания полимера, особенно исключаются из термина «биодеградируемый (биоразлагающийся) полимер». Слова «биодеградируемый» и «биоразлагающийся» являются синонимичными и используются здесь взаимозаменяемо.
«Концентрационный эквивалент дексаметазона» или «эквивалент дексаметазона» означает концентрацию активного агента, такого как стероидный противовоспалительный агент, необходимую для достижения примерно такой же эффективности in vivo, какую обеспечивает индивидуальная доза дексаметазона. Например, гидрокортизон примерно в двадцать пять раз менее эффективный по сравнению с дексаметазоном, и поэтому доза 25 мг гидрокортизона будет эквивалентна дозе 1 мг дексаметазона. Специалисты в данной области могут определить концентрационный эквивалент дексаметазона для индивидуального стероидного противовоспалительного агента с помощью нескольких стандартных тестов, известных из уровня техники. Относительную эффективность некоторых кортикостреоидов можно обнаружить, например, у Gilman A.G. et al., eds. (1990). Goodman and Gilman's: The Pharmacological Basis of Therapeutics. 8th Edition, Pergamon Press: New York, p.1447.
«Суммарный профиль высвобождения» означает суммарный общий процент активного агента, высвобожденного имплантатом в область или часть глаза in vivo или в специфичную среду для высвобождения in vitro в течение некоторого времени.
«Глаукома» означает первичную, вторичную и/или наследственную глаукому. Первичная глаукома может включать открытоугольную или закрытоугольную глаукому. Вторичная глаукома может возникать как следствие различных состояний, таких как травмы, воспаления, сосудистые заболевания и диабет.
«Опосредованное воспалением» в отношении патологических состояний глаз означает любое состояние глаза, которое может возникнуть вследствие лечения противовоспалительным агентом, включая увеит, отек желтого пятна, острую дегенерацию желтого пятна, отслоение сетчатки, глазные опухоли, грибковые или вирусные инфекции, многоочаговый хориоидит, диабетический увеит, пролиферативную витреоретинопатию (ПВР), симпатическую офтальмию, синдром Фогта-Койанаги-Харада (ФКХ), гистоплазмоз и увеальную диффузию, но не ограничиваясь ими.
«Травма» или «повреждение» являются взаимозаменяемыми и относятся к клеточным и морфологическим проявлениям и симптомам, возникающим в результате состояний, опосредованных воспалительными процессами, такими как воспаление.
«Измерение при бесконечно убывающих условиях in vitro» означает анализы по измерению высвобождения лекарства in vitro, когда эксперимент выполняют таким образом, что концентрация лекарства в рецепторной среде никогда не превышает 5% от насыщения. Примеры подходящих анализов можно найти, например, в USP 23; NF 18 (1995) pp.1790-1798.
«Состояние глаза» означает заболевание, недомогание или состояние, поражающее или затрагивающее глаз либо одну из частей или областей глаза, например болезнь сетчатки. Глаз включает глазное яблоко, ткани и жидкости, содержащиеся в глазном яблоке, окологлазные мышцы (например, косая и прямая мышцы), а также участок зрительного нерва, находящийся или примыкающий к глазному яблоку. «Состояние глаза» является синонимичным понятию «патологическое состояние глаза».
«Множество» означает два или больше.
«Состояние, затрагивающее заднюю область глаза» означает болезнь, недомогание или состояние, поражающее или затрагивающее заднюю область глаза или ее участок, такую как сосудистая оболочка или склера (в заднем положении по отношению к проекции через заднюю стенку оболочки хрусталика), стекловидное тело, камеру стекловидного тела, сетчатку, зрительный нерв (т.е. диск зрительного нерва), а также кровеносные сосуды и нервы, которые васкуляризуют или иннервируют заднюю область глаза либо ее участок.
«Стероидный противовоспалительный агент» и «глюкокортикоид» являются здесь взаимозаменяемыми и означают стероидные агенты, соединения или лекарства, снижающие воспаление, при введении с терапевтически эффективным уровнем.
«По существу» в отношении профиля высвобождения или характеристик высвобождения активного агента из биодеградируемого имплантата, как, например, в выражении «по существу в продолжительном темпе» о скорости высвобождения активного агента из имплантата, означает, что скорость высвобождения (т.е. количество высвобожденного активного агента в единицу времени) не изменяется более чем 100% и предпочтительно, не изменяется более чем на 50% в течение выбранного промежутка времени (т.е. нескольких дней). «По существу» в отношении гомогенизации, смешивания или диспергирования активного агента в полимере, например, в выражении «по существу гомогенно диспергированный» означает отсутствие или почти полное отсутствие частиц (т.е. скоплений) активного агента в подобном гомогенном распределении.
«Подходящий для введения (или имплантации) в глазничную область или участок» по отношению к имплантату означает, что имплантат имеет размер (габариты), позволяющие его вводить или имплантировать без чрезмерного повреждения тканей и без создания чрезмерных помех имеющемуся зрению пациента, которому был введен или имплантирован имплантат.
«Терапевтический уровень» или «терапевтическое количество» означает количество или концентрацию активного агента, которое следует местно доставить в глазничную область, безопасное для лечения состояний глаза, предназначенное для уменьшения или предотвращения возникновения симптомов глазных состояний.
Значения аббревиатур, используемых в тексте