Гранулы, содержащие нпвлс и сахарный спирт, изготовленные экструзией из расплава
Иллюстрации
Показать всеФармацевтическая композиция содержит гранулированный компонент, включающий множество отвержденных полученных из расплава гранул сахарного спирта, содержащего соль нестероидного противовоспалительного лекарственного средства (соль НПВЛС). Фармацевтическая композиция предназначена для лечения боли и/или воспаления и/или лихорадочного состояния при кашле, простуде, гриппе, мигрени, головной боли, ревматической боли, артритной боли, мышечной боли и/или невралгии. Фармацевтическая композиция по изобретению содержит минимум эксципиентов для таблетирования, имеет улучшенные характеристики текучести, является менее липкой, чем сама соль НПВЛС и обладает предпочтительными свойствами таблетирования, распадаемости и растворения. 3 н. и 36 з.п. ф-лы, 3 ил., 3 табл.
Реферат
Настоящее изобретение относится к композициям, содержащим нестероидное противовоспалительное лекарственное средство, к способам их изготовления и применению.
Нестероидные противовоспалительные лекарственные средства [НПВЛС - NSAID(s)] представляют собой широко применяемый класс лекарственных средств. Они представляют собой хорошо определенную группу соединений и включают в себя фенилпропионовые кислоты, такие как ибупрофен, напроксен, кетопрофен и флурбипрофен. Преимущественно их используют для лечения одного или более из следующих состояний: боли, воспаления и лихорадочного состояния, например, для лечения ревматоидного артрита, анкилозирующего спондилита, послеоперационной боли, послеродовой боли и повреждений мягких тканей.
НПВЛС обычно представляют собой кислые и практически нерастворимые лекарственные средства. Их удобно вводить как фармацевтическую композицию для перорального введения в форме таблеток. Таким образом, для комбинации с НПВЛС необходимо выбирать фармацевтически приемлемые эксципиенты, с которыми НПВЛС является совместимым и с которыми оно может формировать таблетки, имеющие удовлетворительную твердость, а также быстро высвобождает лекарственное средство в организме, в результате чего оно доступно для всасывания.
Главной задачей в связи с состояниями, перечисленными выше, является улучшение начала действия НПВЛС, особенно при лечении боли. Полагают, что быстрый распад композиции высвобождает лекарственное средство в организме, что вскоре приводит к более быстрому началу терапевтического действия, по сравнению с обычной лекарственной формой. Соответственно, желательным является изготовление твердой дозированной формы для перорального введения, адаптированной для быстрого распада в желудочно-кишечном тракте. Однако, поскольку многие из НПВЛС представляют собой кислые лекарственные средства, соответственно, всасывание может представлять собой проблему в кислых условиях желудка. Помимо этого, несмотря на то, что в литературе предложено множество композиций, адаптированных для быстрого распада, главная проблема касается ибупрофена и других НПВЛС, поскольку может быть необходимым их введение в относительно высоких дозах, например, до 800 мг на единичную дозу. Таким образом, существует проблема изготовления дозированной формы, которая содержит НПВЛС вместе с эксципиентами, пригодными для изготовления таблетки, а также с эксципиентами, гарантирующими быстрый распад; но чтобы при этом таблетка не была слишком большой для потребления пациентом или чтобы ее возможно было изготавливать в соответствии со стандартными процессами производства в промышленных масштабах. Кроме того, твердая дозированная форма должна быть достаточно твердой, чтобы противостоять жестким условиям процесса производства (например, условиям, которые имеют место на стадии нанесения пленочного покрытия в перфорированном вращающемся барабане и упаковки), но также должная иметь подходящие характеристики распадаемости, чтобы гарантировать быстрое высвобождение дозированного средства из композиции, а также подходящие характеристики растворимости. Другой важной проблемой, которую необходимо решать, являются гарантии того, что композицию можно подвергать прессованию с использованием стандартного таблетировочного оборудования, без налипания на штампы таблетировочной машины.
Что касается данного вопроса, WO 01/41733, поданная Boots Company PLC, описывает, что если разрыхлитель инкорпорируют в расплавленное НПВЛС и тщательно с ним смешивают, а затем охлаждают и размалывают с получением гранул, получают композицию, поддающуюся таблетированию при минимуме эксципиентов для таблетирования и обладающую выгодными свойствами таблетирования, распадаемости и растворения, если в нее инкорпорирован диоксид кремния.
Еще одним альтернативным подходом к повышению биодоступности НПВЛС является введение НПВЛС в форме соли, поскольку указанные соли обычно являются более растворимыми, чем соответствующая свободная кислота. Что касается данного вопроса, патентная заявка Германии 3922441А предпринимает попытки улучшить пригодность к таблетированию композиций ибупрофена и описывает, что данной цели можно добиться путем полного или частичного превращения ибупрофена в его кальциевую соль и использования последней для таблетирования. Говорится о том, что композиции могут, необязательно, содержать ибупрофен, S(+)-ибупрофен или их аммониевые, натриевые или калиевые соли. Кальциевую соль и, необязательно, другие активные соединения ибупрофена могут быть включены в таблетку в качестве отдельно полученных соединений, или соли могут быть получены in situ во время изготовления таблетки, через взаимодействие ибупрофена (кислого лекарственного средства) и раствора или суспензии реактива, содержащего один или более из CaO, Ca(OH)2, CaCO3, NaOH, KOH, NH4OH, Na2CO3, NaHCO3, K2CO3, KHCO3, (NH4)2CO3, NH4HCO3 (в количестве от 25% до 110% от эквивалентного количества ибупрофена). Полученную смесь затем гранулируют, сушат, если это необходимо, а затем таблетируют после необязательного добавления других эксципиентов. Описание комментирует, что, в зависимости от пропорций других солей, используемых с кальциевой солью, аммониевые и щелочные соли улучшают растворимость содержащих кальциевую соль композиций и, таким образом, контролируют биодоступность, но они также повышают гигроскопичность и липкость.
Существует особая проблема, связанная с обработкой НПВЛС в форме соли, поскольку указанные материалы обычно плохо поддаются прессованию. Обычно НПВЛС в форме солей по сравнению с формой свободной кислоты являются хлопьевидными, мягкими и липкими материалами, и они не подходят для изготовления дозированной формы, поскольку их особенно трудно прессовать по сравнению с соответствующей свободной кислотой. Как следствие, НПВЛС в форме солей могут налипать на штампы таблетировочной машины. Кроме того, НПВЛС в форме солей обычно плохо поддаются предварительному гранулированию до прессования с другими эксципиентами в таблетки. Таким образом, обычно необходимо подвергать соль НПВЛС стадии первоначальной обработки, такой как процесс гранулирования, с целью формирования таблеток удовлетворительного качества. В частности, соли НПВЛС с аммонием и щелочными металлами, такими как производные пропионовой кислоты, т.е. ибупрофен, известны как липкие, гигроскопичные и плохо поддающиеся прессованию вещества. Натриевая соль ибупрофена, в силу ее воскообразной природы, считается исключительно плохо поддающейся прессованию, а также имеющей низкую способность к гранулированию. Это является одной из главных причин, по которым в настоящее время имеется весьма незначительное количество таблеток, содержащих натриевую соль ибупрофена.
В настоящее время заявители установили, что, если смесь, содержащую расплавленный сахарный спирт и НПВЛС в форме соли (называемое солью НПВЛС), отверждают и гранулируют, то получают композицию, поддающуюся таблетированию с минимумом таблетировочных эксципиентов и обладающую предпочтительными свойствами таблетирования, распадаемости и растворения.
Таким образом, согласно первой особенности, настоящее изобретение относится к фармацевтической композиции, содержащей гранулированный компонент, состоящий из множества полученных из расплава отвержденных гранул сахарного спирта, содержащих соль нестероидного противовоспалительного лекарственного средства (соль НПВЛС).
Неожиданно оказалось, что фармацевтическая композиция обычно имеет улучшенные характеристики текучести и является менее хлопьевидной/липкой, чем сама соль НПВЛС. Таким образом, гранулированная композиция является подходящей для изготовления твердых лекарственных форм, поскольку она легче поддается прессованию и не имеет тенденции налипать на штампы таблетировочной машины. Соответственно, производительность процесса таблетирования значительно возрастает по сравнению с использованием только натриевой соли ибупрофена. Кроме того, обычно не возникает необходимости в предварительной обработке соли НПВЛС (т.е., в использовании процесса гранулирования для улучшения ее текучести) перед изготовлением фармацевтической композиции по настоящему изобретению. Соответственно, соли НПВЛС, используемые для изготовления фармацевтической композиции по настоящему изобретению, можно брать непосредственно, без предварительной обработки, из процесса производства массы материала.
Другие преимущества фармацевтической композиции заключаются в относительно малом количестве дополнительных эксципиентов для таблетирования, необходимых для изготовления дозированной формы, в частности, твердой дозированной формы для перорального введения, что позволяет изготавливать лекарственные формы меньших размеров с относительно высокой концентрацией НПВЛС, обеспечивая, таким образом, улучшение соблюдения пациентами режима и схемы лечения.
Неожиданно было установлено, что фармацевтические препараты, изготовленные из фармацевтической композиции по настоящему изобретению, обладают полезными свойствами распадаемости. Кроме того, результаты растворения указанных препаратов обычно демонстрируют неожиданно высокий уровень НПВЛС, растворенного в водной среде, через относительно короткие периоды времени.
Таким образом, фармацевтическая композиция по настоящему изобретению обычно обеспечивает преимущества при обработке солей НПВЛС, улучшение соблюдения пациентами режима и схемы лечения, улучшение свойств распадаемости и растворения и уменьшение общих затрат на изготовление таблеток с использованием солей НПВЛС.
При изготовлении фармацевтической композиции сахарный спирт расплавляют. Таким образом, термины «расплавлять» и «расплавленный» означают, что сахарный спирт должен расплавиться, по меньшей мере, частично, во время изготовления гранулированной композиции. Предпочтительно, сахарный спирт полностью расплавляют во время изготовления фармацевтической композиции.
Соответственно, когда сахарный спирт расплавляется, образуется жидкость. Соль НПВЛС может частично растворяться в расплавленном сахарном спирте; однако, основная часть соли НПВЛС обычно диспергируется в расплавленном сахарном спирте. Соответственно, сахарный спирт расплавляется и обволакивает соль НПВЛС и другие необязательные нерастворимые эксципиенты, присутствующие в фармацевтической композиции. После охлаждения смеси расплавленного сахарного спирта и соли НПВЛС образуется аморфная (т.е., стекловидная некристаллическая структура) твердая фаза, которую можно непосредственно размалывать до гранул, которые являются пригодными для прессования в фармацевтическую дозированную форму с минимумом эксципиентов для таблетирования. Иными словами, сахарный спирт, по крайней мере, частично, утрачивает свою кристалличность и действует как носитель для соли НПВЛС. Предпочтительно, когда сахарный спирт полностью расплавлен, после охлаждения он образует однородную непрерывную фазу, а именно, однородную непрерывную аморфную твердую фазу, т.е. весь сахарный спирт является, в сущности, аморфным, и однородность фазы не нарушается сахарным спиртом, имеющим упорядоченную кристаллическую структуру.
Неожиданно было установлено, что, если сахарный спирт полностью расплавлен во время изготовления фармацевтической композиции, то отвержденные полученные из расплава гранулы обычно демонстрируют улучшенные характеристики текучести, и обычно их легче прессовать, чем сравнимые отвержденные полученные из расплава гранулы, полученные частичным расплавлением сахарного спирта. Отвержденные полученные из расплава гранулы, полученные полным расплавлением сахарного спирта, обычно легче обрабатывать, например, они не имеют тенденции налипания на штампы таблетировочной машины, по сравнению с отвержденными, полученными из расплава, гранулами, полученными частичным расплавлением сахарного спирта. Соответственно, производительность и эффективность последующих стадий обработки (т.е. процесса таблетирования) могут значительно возрастать при использовании отвержденных полученных из расплава гранул, в случае, если сахарный спирт полностью расплавлен.
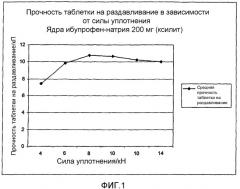
Кроме того, твердые дозированные формы, в частности таблетки, изготовленные из отвержденных полученных из расплава гранул, в случае, когда сахарный спирт полностью расплавлен, обычно являются более прочными и твердыми, чем соответствующие твердые лекарственные формы, изготовленные из отвержденных полученных из расплава гранул, в случае, когда сахарный спирт расплавлен частично. Удобно, что твердые дозированные формы, в частности, таблетки, изготовленные из отвержденных полученных из расплава гранул, в случае, когда сахарный спирт полностью расплавлен, обычно лучше противостоят дальнейшим жестким условиям производственного процесса (т.е. нанесению пленочного или сахарного покрытия), по сравнению с твердыми дозированными формами, изготовленными с использованием частичного расплавления сахарного спирта.
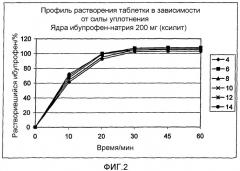
Кроме того, профиль растворения в водной среде таблеток, изготовленных из отвержденных, полученных из расплава гранул, в случае, когда сахарный спирт полностью расплавлен, обычно не зависит от давления прессования, прилагаемого для формирования таблеток. Таким образом, можно удобно изготавливать прочные таблетки, имеющие желательные характеристики растворения.
Соответственно, если сахарный спирт полностью расплавлен во время изготовления фармацевтической композиции, то фармацевтическая композиция обычно демонстрирует улучшенный профиль растворения, чем у сравнимой фармацевтической композиции, изготовленной с использованием частичного расплавления сахарного спирта. В этом отношении, фармацевтические композиции, которые содержат сахарный спирт в виде однородной непрерывной аморфной фазы, обычно высвобождают более высокую концентрацию соли НПВЛС в водной среде через относительно короткий период времени, по сравнению со сравнимыми фармацевтическими композициями, в которых по крайней мере часть сахарного спирта или весь сахарный спирт находится в кристаллической форме.
Соль НПВЛС можно объединять с расплавленным сахарным спиртом как до расплавления сахарного спирта, так и после процесса плавления, получая, таким образом, полученную из расплава смесь, содержащую расплавленный сахарный спирт с заключенной в нем солью НПВЛС. Предпочтительно, соль НПВЛС объединяют с сахарным спиртом до расплавления сахарного спирта. Соль НПВЛС обычно не растворяется в расплаве сахарного спирта, и обычно наблюдается образование дисперсии соли НПВЛС в жидком расплаве. Обычно, как описано далее в настоящем документе, соль НПВЛС имеет гораздо более высокую температуру плавления, чем сахарный спирт, и соль НПВЛС не плавится во время изготовления фармацевтической композиции по настоящему изобретению. Соответственно, это позволяет обрабатывать соль НПВЛС при относительно низких температурах, что значительно минимизирует и/или предотвращает разложение соли НПВЛС.
Предпочтительно, полученную из расплава смесь соли НПВЛС и расплавленного сахарного спирта смешивают таким образом, что соль НПВЛС и любые другие необязательные эксципиенты для таблетирования, присутствующие в фармацевтической композиции, обычно однородно диспергируются в расплавленном сахарном спирте. Таким образом, получают однородную смесь. Смесь охлаждают способами, описанными далее в настоящем документе, до образования твердого вещества. По мере охлаждения смесь становится более вязкой. Из отвержденной смеси затем изготавливают полученные из расплава гранулы. Таким образом, используемый в настоящем документе термин «отвержденные, полученные из расплава гранулы» означает гранулы, изготовленные объединением расплавленного сахарного спирта и соли НПВЛС, необязательно, с другими эксципиентами для таблетирования, охлаждением до температуры ниже температуры плавления сахарного спирта и изготовлением гранул из твердой массы. Фармацевтическая композиция содержит множество указанных гранул.
Таким образом, отвержденные полученные из расплава гранулы можно изготавливать с использованием полного или частичного расплавления сахарного спирта. Согласно предпочтительной особенности настоящего изобретения отвержденные полученные из расплава гранулы изготавливают с использованием полного расплавления сахарного спирта.
Расплав отверждают любым удобным способом. Расплав включает как быстрое, так и медленное охлаждение. Предпочтительно, расплав охлаждают быстро (т.е. гасят), как описано в настоящем документе. Обычно это позволяет расплавленному сахарному спирту образовывать однородную непрерывную аморфную фазу. Например, расплав можно охлаждать в охлаждающем сосуде. Расплав можно выливать на охлаждающие поддоны, которые могут являться неподвижными или непрерывно движущимися. Неподвижные поддоны можно помещать в охлаждающие камеры. Движущиеся поддоны или ленточные конвейеры могут иметь дополнительные охлаждающие средства, такие как охлажденная вода. Охлажденный расплав образует твердое вещество, и его можно соскабливать с ленточного конвейера или собирать после падения с конца непрерывно движущегося ленточного конвейера.
Из отвержденного расплава сахарного спирта, заключающего в себе соль НПВЛС, можно изготавливать гранулы многими способами. Например, его можно измельчать на гранулы. Его можно размалывать и/или просеивать. Его можно также пропускать через распыляющее устройство, такое как колонна для распылительной сушки или распыляющий гранулятор, в котором расплавленный материал распыляют из отверстия в поток охлажденного воздуха, охлаждают/отверждают, а затем собирают. Если расплав экструдируют, экструдат можно охлаждать, а затем дробить на кусочки подходящего размера, с последующим размалыванием и/или просеиванием. Альтернативно, экструдат можно экструдировать через отверстия и резать на гранулы подходящие для таблетирования.
При изготовлении гранулированной композиции сахарный спирт расплавляют. При повышенном давлении сахарный спирт можно расплавить при температуре ниже его нормальной температуры плавления. Плавление можно осуществлять известными способами, включая, например, нагревание сосуда до температуры, превышающей температуру плавления сахарного спирта, или экструзию с использованием нагретого экструдера. Максимальная температура определяется стабильностью расплавленного сахарного спирта и объединенных с ним ингредиентов. Обычно, чем выше температура, тем быстрее плавится сахарный спирт, хотя это должно быть сбалансировано поступлением энергии, требующейся для нагревания сахарного спирта. Для наибольшей эффективности обычно предусматривают нагревание сахарного спирта до температуры, превышающей его температуру плавления не более чем на 30°С, предпочтительно, на 10-30°С, чтобы свести к минимуму затраты энергии. Несмотря на то, что обычные рабочие температуры зависят, среди прочего, от конкретного сахарного спирта, используемого как описано в настоящем документе, предпочтительные пределы нагревания составляют от 80 до 180°С, более предпочтительно, от 90 до 170°С, еще более предпочтительно, от 100 до 160°С, наиболее предпочтительно, от 110 до 150°С. Если сахарный спирт экструдируют, обычно экструдер нагревают до указанной температуры. Помимо этого, работа, прилагаемая к сахарному спирту конфигурацией винтовой линии экструдера, также будет вносить свой вклад в плавление сахарного спирта, понижая, таким образом, температуру, которую требуется приложить извне. Соответственно, цилиндр экструдера можно нагревать до температуры ниже температуры плавления сахарного спирта. Например, нормальная температура плавления ксилита составляет от 95 до 97°С, однако, в условиях приложения силы/давления (с которыми можно столкнуться в экструдере или сходном обрабатывающем устройстве) тепло, прилагаемое извне, необходимое для расплавления сахарного спирта, можно значительно уменьшить, благодаря механическому теплу, вырабатываемому при интенсивном перемешивании внутри экструдера. Обычно предусматривают, что экструдер будут нагревать до температуры, не менее чем на 25°С ниже температуры плавления сахарного спирта, предпочтительно, в пределах от 20°С ниже температуры плавления сахарного спирта до 30°С выше температуры плавления сахарного спирта, более предпочтительно, до температуры в пределах 20°С от каждой границы температуры плавления сахарного спирта. Некоторые экструдеры позволяют нагревать различные зоны до различных температур. Указанные температуры можно подбирать, как описано, таким образом, чтобы гарантировать полное расплавление сахарного спирта.
Соответственно, сахарный спирт находится в твердом состоянии при комнатной температуре (т.е. от 20 до 25°С) и нормальном атмосферном давлении. Под термином «сахарный спирт» заявители подразумевают спирт, который получается в результате восстановления соответствующих моно- и/или полисахаридов. Обычные сахаридные материалы включают сахара, такие как декстроза и мальтоза, например, D-сорбит, который можно получать восстановлением глюкозы. Указанные сахарные спирты обычно называют «альдитами», поскольку их можно получать восстановлением альдегида и кетогруппы соответствующих сахаров альдозы и кетозы соответственно.
Предпочтительно, сахарный спирт получают восстановлением моносахарида или дисахарида. Более предпочтительно, сахарный спирт получают восстановлением моносахарида.
Предпочтительные сахарные спирты, получаемые восстановлением дисахаридов, включают мальтит (т.пл. от 149 до 152°С), изомальт (т.пл. от 145 до 150°С) и лактит (т.пл. от 95 до 98°С), из которых предпочтительными являются мальтит и лактит.
Предпочтительные сахарные спирты, получаемые восстановлением моносахаридов, включают D-сорбит (т.пл. от 98 до 100°С), ксилит (т.пл. от 95 до 97°С), адонит (т.пл. от 102 до 104°С), арабит (т.пл. от 101 до 104°С), маннит (т.пл. от 167 до 170°С), дульцит (т.пл. от 188 до 191°С) и мезоэритрит (т.пл. от 120 до 123°С). Более предпочтительные сахарные спирты, получаемые восстановлением моносахаридов, включают D-сорбит, ксилит, адонит, арабит и мезоэритрит. Наиболее предпочтительные сахарные спирты, получаемые восстановлением моносахаридов, включают D-сорбит и ксилит, особенно ксилит.
Предпочтительные рабочие температуры для плавления указанных выше сахарных спиртов, предпочтительно, с использованием способа экструзии из расплава, приблизительно от 10° до 30°С выше температуры плавления конкретного сахарного спирта, поэтому сахарный спирт расплавляется полностью. Таким образом, предпочтительными являются следующие рабочие температуры: сорбит, приблизительно от 108°С до 132°С; ксилит, приблизительно от 102°С до 127°С; адонит, приблизительно от 112°С до 134°С; арабит, приблизительно от 111°С до 134°С; маннит, приблизительно от 177°С до 200°С; мезоэритрит, приблизительно от 130°С до 153°С; лактит, приблизительно от 105°С до 128°С; мальтит, приблизительно от 159°С до 182°С и изомальт, приблизительно от 155°С до 180°С.
Несмотря на то, что для изготовления фармацевтической композиции можно использовать смесь сахарных спиртов, описанных в настоящем документе, предпочтительно, используют только один сахарный спирт. Таким образом, в предпочтительном варианте фармацевтической композиции сахарный спирт предпочтительно состоит, преимущественно, из D-сорбита или ксилита, особенно, преимущественно, только из ксилита.
Предпочтительно, сахарный спирт имеет температуру плавления менее или равную 180°С, более предпочтительно, менее или равную 170°С, еще более предпочтительно, менее или равную 150°С, наиболее предпочтительно, менее или равную 120°С.
Предпочтительно, сахарный спирт имеет температуру плавления более или равную 50°С, более предпочтительно, более или равную 70°С, наиболее предпочтительно, более или равную 90°С.
Обычно сахарный спирт имеет температуру плавления, которая ниже температуры плавления соли НПВЛС. Предпочтительно, температура плавления сахарного спирта по меньшей мере на 40°С, более предпочтительно, по меньшей мере на 60°С, еще более предпочтительно, по меньшей мере на 80°С, наиболее предпочтительно, по меньшей мере приблизительно на 100°С, ниже температуры плавления соли НПВЛС. Полученные из расплава гранулы можно удобно формировать при температурах, которые значительно ниже температуры плавления соли НПВЛС. Иными словами, полученную из расплава смесь, содержащую расплавленный сахарный спирт и соль НПВЛС, формируют нагреванием до температуры, которая является достаточной для расплавления сахарного спирта, но не расплавляет соль НПВЛС. Выгодно, что указанные рабочие параметры обычно сводят к минимуму или предотвращают разложение соли НПВЛС.
Предпочтительно, сахарный спирт присутствует в количестве менее или равном 30 мас.%, более предпочтительно, менее или равном 26 мас.%, более предпочтительно, менее или равном 20 мас.%, еще более предпочтительно, менее или равном 15 мас.%, от гранулированного компонента фармацевтической композиции. Предпочтительно, сахарный спирт присутствует в количестве более или равном 1 мас.%, более предпочтительно, более или равном 5 мас.%, наиболее предпочтительно, более или равном 7 мас.%, от гранулированного компонента фармацевтической композиции.
Предпочтительно, сахарный спирт присутствует в количестве менее или равном 26 мас.%, более предпочтительно, менее или равном 20 мас.%, еще более предпочтительно, менее или равном 15 мас.%, наиболее предпочтительно, менее или равном 10 мас.%, от общей массы фармацевтической композиции. Предпочтительно, сахарный спирт присутствует в количестве более или равном 1 мас.%, более предпочтительно, более или равном 5 мас.%, наиболее предпочтительно, более или равном 7 мас.%, от общей массы фармацевтической композиции.
Изобретение позволяет изготавливать гранулированную композицию, содержащую ряд солей НПВЛС, в частности, НПВЛС, которые предпочтительно ингибируют Сох-1.
Подходящие типы НПВЛС, которые предпочтительно ингибируют Сох-1, можно выбрать из следующих категорий:
(1) производные пропионовой кислоты;
(2) производные уксусной кислоты;
(3) производные фенамовой кислоты;
(4) производные бифенилкарбоновой кислоты;
(5) оксикамы.
Подходящие производные пропионовой кислоты для использования по настоящему изобретению включают, без ограничения, ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, фенбуфен, кетопрофен, индопрофен, пирпрофен, карпрофен, оксапрозин, прапопрофен, миропрофен, тиоксапрофен, супрофен, альминопрофен, тиапрофеновую кислоту, флурпрофен и bucloxic кислоту (4-(4-циклогексил-3 хлорфенил)-4-оксомаслянная кислота (C16H19ClO3)). Предпочтительные члены группы пропионовой кислоты включают ибупрофен, напроксен, флурбипрофен, фенопрофен, кетопрофен и фенбуфен, особенно, ибупрофен.
Подходящие производные уксусной кислоты для использования по настоящему изобретению включают, без ограничения, индометацин, сулиндак, толметин, зомепирак, диклофенак, фенхлофенак, альхлофенак, ибуфенак, изоксепак, фурофенак, тиопинак, зидометацин, ацеметацин, фентиазак, клиданак и оксипинак. Предпочтительные члены группы уксусной кислоты включают толметин-натрий, зомепинак-натрий, сулиндак и индометацин.
Производные фенамовой кислоты для использования по настоящему изобретению включают, без ограничения, мефенамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту, нифлумовую кислоту и толфенамовую кислоту. Предпочтительные члены группы фенамовой кислоты включают мефенамовую кислоту и меклофенамовую кислоту.
Производные бифенилкарбоновой кислоты для использования по настоящему изобретению включают, без ограничения, дифлунизал и флуфенизал.
Оксикамы для использования по настоящему изобретению включают, без ограничения, пироксикам, судоксикан, изоксикам. Предпочтительным членом данной группы является пироксикам.
Соответственно, НПВЛС для использования по настоящему изобретению обычно обладают изомерией. Соответственно все стереоизомеры, диастереоизомеры, энантиомеры и смеси, следовательно, включая рацемические смеси, НПВЛС входят в объем настоящего изобретения.
Весьма предпочтительным классом солей НПВЛС являются соли производных пропионовой кислоты.
Предпочтительные соли производных пропионовой кислоты, особенно, соли 2-арилпропионовой кислоты, включают соли напроксена, флурбипрофена, ибупрофена и кетопрофена, особенно их рацемические смеси и S(+)-энантиомеры. Более предпочтительные соли 2-арилпропионовой кислоты включают соли флурбипрофена и ибупрофена, особенно, их рацемические смеси и S(+)-энантиомеры. Еще более предпочтительные соли 2-арилпропионовой кислоты включают соли рацемического флурбипрофена и соли рацемического ибупрофена, особенно, соли рацемического ибупрофена.
НПВЛС, используемое в настоящем изобретении, находится в форме соли. Иллюстративные примеры солей включают: соли щелочных металлов, например, соли натрия или калия; соли щелочноземельных металлов, например, соли магния или кальция; соли металлов, например, соли алюминия; аминокислотные соли, например, соли лизина или аргинина; или соли аминов, например, соль меглумина.
Предпочтительные соли включают соли щелочных металлов, соли щелочноземельных металлов, соли аминов и аминокислотные соли. Более предпочтительные соли включают соли щелочных металлов, соли аминов и аминокислотные соли. Наиболее предпочтительные соли включают соли щелочных металлов, особенно, соли натрия или калия, особенно, соль натрия.
Соответственно, весьма предпочтительной солью НПВЛС для использования по настоящему изобретению является натриевая соль рацемического ибупрофена или натриевая соль S(+)-ибупрофена. Наиболее предпочтительно, соль НПВЛС включает натриевую соль рацемического ибупрофена.
Соответственно, гранулированная композиция может содержать одну или более различных солей НПВЛС, определенных в настоящем документе. Предпочтительно, однако, гранулированная композиция содержит одну соль НПВЛС. Наиболее предпочтительно, гранулированная композиция содержит одну соль НПВЛС в единственной энантиомерной форме или в форме рацемической смеси, т.е. только S(+)-ибупрофен или только рацемический ибупрофен. Кроме того, как описано далее в настоящем документе, фармацевтическая композиция может содержать один или более дополнительных фармацевтически активных агентов, помимо соли НПВЛС. Однако весьма предпочтительная фармацевтическая композиция по настоящему изобретению включает соли НПВЛС в качестве единственного фармацевтически активного агента, наиболее предпочтительно, одной соли НПВЛС, как описано в настоящем документе.
Соль НПВЛС может находиться в безводной или гидратированной форме. Предпочтительно, соль НПВЛС находится в гидратированной форме. В этом отношении, дигидрат натриевой соли рацемического ибупрофена представляет собой особенно предпочтительную соль НПВЛС.
Соли НПВЛС обычно имеют температуру плавления приблизительно от 150°С до 270°С, предпочтительно, приблизительно от 170°С до 260°С. В этом отношении, дигидрат ибупрофен-натрия имеет температуру плавления приблизительно 200°С, напроксен-натрий имеет температуру плавления приблизительно от 250 до 251°С, и ибупрофена лизинат имеет температуру плавления приблизительно от 177 до 180°С.
Доля соли НПВЛС в фармацевтической композиции будет зависеть от дозы, желательной для получения терапевтического эффекта. Лекарственные средства, применяемые в низких дозах, такие как соли флурбипрофена и кетопрофена, могут составлять всего 20 мас.% (например, от 20 до 70%) от массы гранулированного компонента фармацевтической композиции, чтобы фармацевтическая дозированная форма (т.е. таблетка), изготовленная из композиции, не была слишком маленькой. Однако предпочтительным признаком изобретения является то, что из солей НПВЛС, применяемых в высоких дозах, таких как соли ибупрофена, можно изготавливать дозированные формы меньших размеров. Соответственно, соль НПВЛС обычно составляет количество, превышающее или равное 60 мас.%, предпочтительно, превышающее или равное 65 мас.%, более предпочтительно, превышающее или равное 70 мас.%, от массы гранулированного компонента фармацевтической композиции. Соответственно соль НПВЛС обычно составляет количество, менее или равное 99 мас.%, предпочтительно, менее или равное 95 мас.%, более предпочтительно, менее или равное 90 мас.%, наиболее предпочтительно, менее или равное 85 мас.%, от массы гранулированного компонента фармацевтической композиции.
Предпочтительно, соль НПВЛС присутствует в количестве, превышающем или равном 55 мас.%, более предпочтительно, превышающем или равном 60 мас.%, еще более предпочтительно, превышающем или равном 65 мас.%, наиболее предпочтительно, превышающем или равном 70 мас.%, от общей массы фармацевтической композиции по настоящему изобретению.
Предпочтительно, соль НПВЛС присутствует в количестве, менее или равном 90 мас.%, более предпочтительно, менее или равном 85 мас.%, наиболее предпочтительно, менее или равном 80 мас.%, от общей массы фармацевтической композиции по настоящему изобретению.
Предпочтительно, соотношение масс соли НПВЛС и сахарного спирта в гранулированном компоненте фармацевтической композиции составляет от 20:1 до 2:1, более предпочтительно, от 15:1 до 5:1, наиболее предпочтительно, от 12:1 до 7:1.
Предпочтительно, соотношение масс соли НПВЛС и сахарного спирта в фармацевтической композиции составляет от 20:1 до 2:1, более предпочтительно, от 15:1 до 5:1, наиболее предпочтительно, от 12:1 до 8:1.
Предпочтительно, фармацевтическая композиция дополнительно содержит один или более разрыхлителей. Разрыхлитель может присутствовать в гранулированном компоненте и/или присутствовать в качестве экстрагранулярного компонента. Предпочтительно, разрыхлитель присутствует внутри гранулированного компонента, еще более предпочтительно, разрыхлитель присутствует только внутри гранулированного компонента. Если разрыхлитель инкорпорирован в расплавленный сахарный спирт с заключенной в нем солью НПВЛС и перемешан с ним до однородности, смесь охлаждают и размалывают с получением гранул, получают фармацевтическую композицию, поддающуюся таблетированию при минимуме эксципиентов для таблетирования и обладающую выгодными свойствами таблетирования, распадаемости и растворения. Разрыхлитель обладает свойством вызывать распад твердой дозированной формы, такой как таблетка, изготовленной из фармацевтической композиции, в условиях, которые имеют место в желудочно-кишечном тракте. Примеры разрыхлителей включают один или более их пшеничного крахмала, кукурузного крахмала, картофельного крахмала, гликолята натрий-крахмала, низкозамещенной гидроксипропилцеллюлозы, альгиновой кислоты, сшитого поливинилпирролидона, силиката магний-алюминия и натрий-кроскармеллозы. Предпочтительными разрыхлителями являются такие агенты, которые набухают при воздействии воды, что вызывает выталкивание ингредиентов фармацевтической композиции наружу, в водную разлагающую среду. Предпочтительные разрыхлители включают один или более из натрий-кроскармеллозы и гликолята натрий-крахмала, особенно натрий-кроскармеллозу.
Предпочтительно, разрыхлитель присутствует в количестве менее или равном 25 мас.%, более предпочтительно, менее или равном 20 мас.%, еще более предпочтительно, менее или равном 15 мас.%, от массы гранулированного компонента фармацевтической композиции. Предпочтительно, разрыхлитель присутствует в количестве, превышающем или равном 1 мас.%, более предпочтительно, превышающем или равном 5 мас.%, наиболее предпочтительно, превышающем или равном 8 мас.%, от массы гранулированного компонента фармацевтической композиции.
Предпочтительно, разрыхлитель присутствует в количестве менее или равном 20 мас.%, более предпочтительно, менее или равном 15 мас.%, наиболее предпочтительно, менее или равном 10 мас.%, от общей массы фармацевтической композиции. Предпочтительно, разрыхлитель присутствует в количестве, превыша