Жидкие депо-препараты
Иллюстрации
Показать всеИзобретение относится к составам, образующим in vivo биологически активную депо-композицию, которые содержат маловязкие нежидкокристаллические смеси диацилглицерина, токоферола, фосфатидилхолина и кислородсодержащего органического растворителя, где биоактивный агент растворен или диспергирован в данной смеси, и где составы образуют жидкокристаллическую фазовую структуру при контакте с жидкостью тела. Указанные составы пригодны для получения парентеральных, непарентеральных и местных депо-композиций для замедленного высвобождения активных агентов. Изобретение относится также к способу получения и применению составов по изобретению и к способу доставки активного агента. Составы по изобретению обеспечивают пролонгированное контролируемое высвобождение активного агента в отсутствие эффектов «взрыва» или «задержки» при начальном высвобождении. 7 н. и 27 з.п. ф-лы, 8 ил., 20 табл.
Реферат
Настоящее изобретение относится к предшественникам препаратов (препаратам-предшественникам) для образования in situ липидных композиций с контролируемым высвобождением. В частности, данное изобретение относится к препаратам-предшественникам в форме маловязких смесей (таких как молекулярные растворы) амфифильных компонентов и по меньшей мере одного биоактивного агента, которые претерпевают по меньшей мере один фазовой переход под действием водных жидкостей, таких как жидкости тела, с образованием, таким образом, матрицы с контролируемым высвобождением, которая возможно является биоадгезивной.
Многие биоактивные агенты, включая лекарственные средства, питательные вещества, витамины и так далее, имеют "функциональное окно". То есть существует интервал концентраций, в котором можно наблюдать, что эти агенты обеспечивают некоторый биологический эффект. Когда концентрация в соответствующей части тела (например, местно или как это демонстрирует концентрация в сыворотке) падает ниже определенного уровня, данному агенту не может быть приписан полезный эффект. Аналогично, обычно существует верхний уровень концентрации, выше которого при увеличении концентрации не получают дополнительной пользы. В некоторых случаях увеличение концентрации выше конкретного уровня приводит к нежелательным или даже опасным эффектам.
Некоторые биоактивные агенты имеют длительный период биологического полувыведения и/или широкое функциональное окно и, таким образом, их можно вводить периодически, поддерживая функциональную биологическую концентрацию на протяжении значительного промежутка времени (например, от 6 часов до нескольких суток). В других случаях скорость клиренса является высокой и/или функциональное окно является узким и, таким образом, для того, чтобы поддерживать биологическую концентрацию в рамках этого окна, требуются регулярные (или даже непрерывные) дозы малых количеств. Это может быть особенно затруднительным, когда желательными являются непероральные пути введения (например, парентеральное введение). Кроме того, в некоторых случаях, таких как подборка имплантов (например, заместителей суставов или пероральных имплантов), область желательного действия может оставаться недоступной для повторного введения. В таких случаях одиночное введение должно обеспечивать терапевтический уровень активного агента на протяжении всего промежутка времени, когда требуется эта активность.
Использовались и предлагались различные способы замедленного высвобождения биологически активных агентов. Такие способы включают перорально вводимые композиции с медленным высвобождением, такие как покрытые таблетки, препараты, предназначенные для постепенного поглощения, такие как чрескожные пластыри и импланты с медленным высвобождением, такие как "палочки", имплантированные под кожу.
Один способ, посредством которого предлагается осуществить постепенное высвобождение биоактивного агента, представляет собой так называемую "депо"-инъекцию. В этом способе биоактивный агент готовят в виде препарата с носителями, обеспечивающими постепенное высвобождение активного агента в течение периода продолжительностью несколько часов или суток. Они часто основаны на разрушающейся матрице, которая постепенно диспергируется в теле с высвобождением активного агента.
Наиболее распространенный из общепризнанных способов депо-инъекции основан на полимерной депо-системе. Обычно она представляет собой биоразлагаемый полимер, такой как поли(молочная кислота) (PLA) и/или поли(сополимер молочной и гликолевой кислоты) (PLGA), и может находиться в форме раствора в органическом растворителе, пред-полимера, смешанного с инициатором, инкапсулированных полимерных частиц или полимерных микросфер. Полимер или полимерные частицы удерживают активный агент и постепенно разрушаются, высвобождая данный агент посредством медленной диффузии и/или по мере поглощения матрицы. Примеры таких систем включают системы, описанные в US 4938763, US 5480656 и US 6113943, и могут приводить к доставке активных агентов на протяжении промежутка времени вплоть до нескольких месяцев. Эти системы, однако, имеют ряд ограничений, включая сложность изготовления и трудность стерилизации (особенно микросфер). Также заметным недостатком является местное раздражение, вызываемое молочной и/или гликолевой кислотой при высвобождении в месте инъекции. Также часто требуется довольно сложная процедура приготовления инъекционной дозы из предшествующего порошка.
С точки зрения доставки лекарственного средства, недостатком полимерных депо-композиций также является допустимость только относительно низких загрузок лекарства и наличие профиля высвобождения "взрыв/задержка". Природа полимерной матрицы, особенно когда ее применяют в виде раствора пред-полимера, вызывает начальный взрыв высвобождения лекарственного средства при первом введении композиции. После этого следует период медленного высвобождения, по мере того как начинается разрушение матрицы, с последующим в конце увеличением скорости высвобождения до желательного замедленного профиля. Такой профиль высвобождения с взрывом/задержкой может приводить к тому, что до достижения поддерживаемой функциональной концентрации концентрация активного агента in vivo непосредственно после введения "взрывается" до значений выше функционального окна, затем на протяжении лаг-периода понижается до значений ниже нижнего значения функционального окна. С функциональной и токсикологической точки зрения очевидно, что такой профиль высвобождения с взрывом/задержкой является нежелательным и может быть опасным. Он также может ограничивать равновесную концентрацию, которую можно обеспечить, из-за угрозы побочных эффектов в точке "пика".
Предпринимались попытки исследовать предыдущие депо-системы с точки зрения проблемы взрывного высвобождения. В частности, предлагалось применение гидролизованной полимолочной кислоты и включение блок-сополимеров полимолочной кислоты-полиэтиленгликоля с получением полимерной системы со "слабым взрывом", описанной в US 6113943 и US 6630115. Эти системы обеспечивают улучшенные профили, но эффект взрыв/задержка сохраняется, и они не решают других вопросов, таких как раздражение, вызванное применением полимеров, дающих кислые продукты разрушения.
Одна альтернатива более традиционным депо-системам на основе полимеров предложена в US 5807573. Там предложена основанная на липидах система диацилглицерина, фосфолипида и, возможно, воды, глицерина, этиленгликоля или пропиленгликоля, образующая систему введения в обращенной мицеллярной фазе "L1" или в кубической жидкокристаллической фазе. Так как эта депо-система образована физиологически хорошо переносимыми диацилглицеринами и фосфолипидами и не дает продуктов разрушения полимерных систем в виде молочной кислоты или гликолевой кислоты, у этой системы имеется меньшая тенденция инициировать воспаление в месте инъекции. Жидкокристаллические фазы, однако, имеют высокую вязкость, и фаза L2 также может быть слишком вязкой для легкости применения. Авторы US 5807573 также не дают какой-либо in vivo оценки профиля высвобождения данного препарата и, таким образом, не ясно, обеспечивается "взрывной" профиль или нет.
Применение неламеллярных фазовых структур (таких как жидкокристаллические фазы) в доставке биоактивных агентов в настоящее время является достаточно традиционным. Такие структуры образуются, когда амфифильное соединение подвергают воздействию растворителя, так как амфифил имеет как полярные, так и неполярные группы, которые группируются с образованием полярных и неполярных участков. Эти участки могут эффективно солюбилизировать как полярные, так и неполярные соединения. Кроме того, многие структуры, образованные амфифилами в полярных и/или неполярных растворителях, имеют очень значительную площадь полярной/неполярной границы, на которой могут быть адсорбированы и стабилизированы другие амфифильные соединения. Амфифилы также можно вводить в композицию для защиты активных агентов, по меньшей мере до некоторой степени, от агрессивных биологических сред, включая ферменты, и обеспечивая, таким образом, полезный контроль стабильности и высвобождения активного агента.
Образование неламеллярных участков на фазовых диаграммах амфифил/вода, амфифил/масло и амфифил/масло/вода является хорошо известным явлением. Такие фазы включают жидкокристаллические фазы, такие как кубическую Р, кубическую D, кубическую G и гексагональную фазу, которые на молекулярном уровне представляют собой жидкость, но демонстрируют в значительной степени дальный порядок, и фазу L3, которая содержит множественно взаимосвязанную непрерывную в обоих направлениях сеть двухслойных пластов, являющихся неламеллярными, но не имеют дальнего порядка жидкокристаллических фаз. В зависимости от кривизны их амфифильных пластов эти фазы можно описать как нормальные (средняя кривизна в направлении неполярного участка) или обращенные (средняя кривизна в направлении полярного участка).
Неламеллярные жидкокристаллические и L3-фазы являются термодинамически устойчивыми системами. То есть они не являются просто метастабильным состоянием, которое будет разделяться и/или преобразовываться в слои, ламеллярные фазы и тому подобное, а представляют собой стабильную термодинамическую форму смеси липид/растворитель.
Наряду с тем, что эффективность известных липидных депо-препаратов высока, существуют некоторые аспекты, в которых их эффективность меньше идеальной. В частности, предложенные кубические жидкокристаллические фазы являются относительно вязкими по природе. Это делает введение стандартным шприцем затруднительным и, возможно, болезненным для пациента и делает невозможной стерилизацию посредством фильтрации, так как данная композиция не может пройти через необходимую мелкопористую мембрану. В результате, композиции необходимо готовить в высокостерильных условиях, что увеличивает сложность изготовления. Когда используются фазы L2, они обычно имеют более низкую вязкость, но все же могут вызывать трудности при введении и обеспечивают доступ только к малому участку фазовой диаграммы. В частности, растворители, используемые в известных липидных препаратах, оказывают только ограниченный эффект в снижении вязкости смеси. Например, вода будет индуцировать образование высоковязкой жидкокристаллической фазы, а такие растворители как глицерин и гликоли имеют высокую вязкость и не обеспечивают какого-либо значительного полезного снижения вязкости композиции. Гликоли обычно также являются токсичными и плохо переносимыми in vivo и могут вызывать раздражение при местном применении.
Кроме того, известные липидные композиции в фазе L2 с низким содержанием растворителя могут поддерживать только относительно низкий уровень многих биоактивных агентов из-за их ограниченной растворимости в компонентах смеси в отсутствии воды. В присутствии воды, однако, данные препараты принимают вид высоковязкой кубической жидкокристаллической фазы. Было бы очень полезным предложение депо-системы, которую можно было бы инъецировать с низкой вязкостью и которая обеспечила бы высвобождение требуемой концентрации биоактивного агента с использованием меньшего объема депо-композиции.
Известные липидные депо-композиции также имеют практический доступ только к определенным фазовым структурам и композициям, потому что другие смеси или являются слишком высоковязкими для введения (например, смеси с высокими концентрациями фосфолипидов) или подвержены риску разделения на две или более отдельные фазы (такие как фаза L2 в равновесии с фазой, обогащенной фосфолипидом). В частности, концентрации фосфолипидов выше 50% недостижимы известными способами, и из фазовой диаграммы, показанной в US 5807573, очевидно, что желательная кубическая фаза стабильна при не более чем 40% фосфолипида. В результате, на практике было невозможно предложить депо-композиции с высокой концентрацией фосфолипидов или имеющие гексагональную жидкокристаллическую фазовую структуру.
Авторы настоящего изобретения теперь установили, что путем получения препарата-предшественника, содержащего определенные амфифильные компоненты, по меньшей мере один биоактивный агент и биологически приемлемый растворитель, особенно в маловязкой фазе, такой как молекулярный раствор, можно получить препарат-предшественник, разрешающий многие недостатки предыдущих депо-препаратов. В частности, данный препарат-предшественник является простым в изготовлении, может быть подвергнут стерильной фильтрации, имеет низкую вязкость (делающую возможным легкое и менее болезненное введение), позволяет включить высокий уровень биоактивного агента (позволяя, таким образом, использовать меньшее количество композиции) и/или образует in vivo требуемую неламеллярную депо-композицию, имеющую контролируемый "взрывной" или "невзрывной" профиль высвобождения. Данные композиции также образованы из веществ, которые являются нетоксичными, биоприемлемыми и биоразлагаемыми. Кроме того, данный препарат-предшественник подходит для образования депо-композиций после парентерального введения и также после непарентерального (например, местного) введения в полости тела и/или на поверхности тела, или куда-либо в другое место.
В первом аспекте настоящего изобретения, таким образом, предложен препарат-предшественник, содержащий маловязкую смесь:
а) по меньшей мере одного нейтрального диациллипида и/или токоферола;
б) по меньшей мере одного фосфолипида;
в) по меньшей мере одного биосовместимого (предпочтительно кислородсодержащего) органического растворителя;
где по меньшей мере один биоактивный агент растворен или диспергирован в маловязкой смеси, и где препарат-предшественник образует или способен образовывать по меньшей мере одну жидкокристаллическую фазовую структуру при контакте с водной жидкостью.
В общем случае, водной жидкостью будет жидкость тела, такая как жидкость с поверхности слизистой оболочки, слезы, пот, слюна, желудочно-кишечная жидкость, внесосудистая жидкость, внеклеточная жидкость, интерстициальная жидкость или плазма, и данный препарат-предшественник будет образовывать жидкокристаллическую фазовую структуру при контакте с поверхностью тела, областью или полостью (например, in vivo), при контакте с водной жидкостью тела. Препарат-предшественник по изобретению перед введением обычно не будет содержать какого-либо значительного количества воды.
Во втором аспекте изобретения также предложен способ доставки биоактивного агента в организм человека или животного, не являющегося человеком (предпочтительно млекопитающего), включающий введение (предпочтительно парентерально) препарата-предшественника, содержащего маловязкую смесь:
а) по меньшей мере одного нейтрального диациллипида и/или токоферола;
б) по меньшей мере одного фосфолипида;
в) по меньшей мере одного биосовместимого (предпочтительно кислородсодержащего) органического растворителя;
и по меньшей мере одного биоактивного агента, растворенного или диспергированного в маловязкой смеси, с образованием, таким образом, по меньшей мере одной жидкокристаллической фазовой структуры при контакте с водной жидкостью in vivo после введения. Предпочтительно, препарат-предшественник, введенный таким способом, представляет собой препарат-предшественник по изобретению, как описано выше.
Способ введения, подходящий для указанного выше способа по изобретению, будет являться способом, пригодным для состояния, которое нужно лечить, и для используемого биоактивного агента. Парентеральное депо, таким образом, будет образовано посредством парентерального (например, подкожного или внутримышечного) введения, тогда как биоадгезивная непарентеральная (например, местная) депо-композиция может быть образована путем введения на поверхность кожи, слизистую оболочку и/или ногти, на глазную, назальную, оральную или внутреннюю поверхности или в полости, такие как назальная, ректальная, вагинальная или буккальная полости, периодонтальный карман, или полости, образованные после извлечения природной или имплантированной структуры, или перед введением импланта (например, сустава, стента, косметического импланта, зубного импланта, зубной пломбы или другого импланта).
В другом аспекте настоящего изобретения также предложен способ получения жидкокристаллической композиции (особенно депо-композиции), включающий воздействие на препарат-предшественник, содержащий маловязкую смесь:
а) по меньшей мере одного нейтрального диациллипида и/или токоферола;
б) по меньшей мере одного фосфолипида;
в) по меньшей мере одного биосовместимого (предпочтительно кислородсодержащего) органического растворителя;
и по меньшей мере одного биоактивного агента, растворенного или диспергированного в маловязкой смеси, водной жидкости (особенно in vivo и/или особенно жидкости тела, как указано в данном описании изобретения). Предпочтительно вводимый препарат-предшественник представляет собой препарат-предшественник по настоящему изобретению, как описано в данном описании изобретения. Воздействие жидкости "in vivo" очевидно может происходить внутри организма или полости тела или может происходить на поверхности тела, такой как поверхность кожи, в зависимости от природы композиции.
Жидкокристаллическая композиция, образующаяся таким способом, предпочтительно является биоадгезивной, как описано в данном описании изобретения.
В еще одном аспекте настоящего изобретения предложен способ получения препарата-предшественника, подходящего для введения биоактивного агента (предпочтительно млекопитающему) субъекту, причем указанный способ включает получение маловязкой смеси:
а) по меньшей мере одного нейтрального диациллипида и/или токоферола;
б) по меньшей мере одного фосфолипида;
в) по меньшей мере одного биосовместимого (предпочтительно кислородсодержащего) органического растворителя;
и растворение или диспергирование по меньшей мере одного биоактивного агента в маловязкой смеси или по меньшей мере в одном из компонентов (а), (б) или (в) перед получением маловязкой смеси. Предпочтительно препарат-предшественник, полученный таким образом, представляет собой препарат по изобретению, как описано в данном описании изобретения.
В еще одном аспекте настоящего изобретения предложено применение маловязкой смеси:
а) по меньшей мере одного нейтрального диациллипида и/или токоферола;
б) по меньшей мере одного фосфолипида;
в) по меньшей мере одного биосовместимого (предпочтительно кислородсодержащего) органического растворителя;
где по меньшей мере один биоактивный агент растворен или диспергирован в маловязкой смеси, в изготовлении препарата-предшественника для применения в замедленном введении указанного активного агента, где указанный препарат-предшественник способен образовать по меньшей мере одну жидкокристаллическую фазовую структуру при контакте с водной жидкостью.
Термин "маловязкая жидкость", при использовании в данном описании изобретения, указывает смесь, которую можно легко ввести субъекту и, в частности, легко ввести при помощи устройства из стандартного шприца и иглы. На это может указывать, например, возможность дозирования из одноразового шприца на 1 мл через иглу 22 awg (American Wire Gauge, американский сортамент проволоки) (или 23 размера) посредством ручного давления. В особенно предпочтительном воплощении маловязкая смесь должна быть смесью, способной проходить через стандартную мембрану для стерильной фильтрации, такую как фильтрующий шприц 0,22 мкм. В других предпочтительных воплощениях аналогичное функциональное определение подходящей вязкости можно определить как вязкость препарата-предшественника, который можно распылить с использованием компрессорного насоса или устройства для распыления под давлением с использованием традиционного оборудования для распыления. Типичный интервал подходящих вязкостей будет, например, от 0,1 до 5000 мПа·с, предпочтительно от 1 до 1000 мПа·с при 20°С.
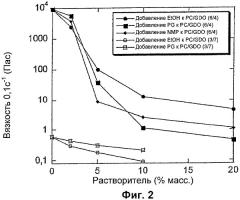
Обнаружилось, что путем добавления небольших количеств маловязкого растворителя, как указано в данном описании изобретения, можно обеспечить очень значительное изменение вязкости. Как показано на Фиг.2, например добавление только 5% растворителя может снизить вязкость в 100 раз, а добавление 10% может снизить вязкость вплоть до 10000 раз. Для того чтобы добиться такого нелинейного синергетического эффекта в снижении вязкости, важно, чтобы использовался растворитель подходящей низкой вязкости и подходящей полярности. Такие растворители включают растворители, описанные в данном описании изобретения ниже.
Особенно предпочтительными примерами маловязких смесей являются молекулярные растворы и/или изотропные фазы, такие как фазы L2 и/или L3. Как описано выше, L3 представляет собой неламеллярную фазу взаимосвязанных пластов, которые имеют некоторую фазовую структуру, но не имеют упорядоченности дальнего порядка, присущей жидкокристаллической фазе. В отличие от жидкокристаллических фаз, которые обычно являются высоковязкими, фазы L3 имеют более низкую вязкость. Очевидно, что смеси фазы L3 и молекулярного раствора и/или частиц фазы L3, суспендированных в основном объеме молекулярного раствора из одного или более компонентов, также являются подходящими. Фаза L2 представляет собой так называемую "обращенную мицеллярную" фазу или микроэмульсию. Наиболее предпочтительные маловязкие смеси представляют собой молекулярные растворы, фазы L3 и их смеси. Фазы L2 являются менее предпочтительными, за исключением набухших фаз L2, как описано ниже.
Согласно настоящему изобретению предложен препарат-предшественник, содержащий компоненты (а), (б), (в) и по меньшей мере один биоактивный агент, как указано в данном описании изобретения. Одним из значительных преимуществ препарата-предшественника по изобретению является то, что компоненты (а) и (б) можно ввести в состав в широком интервале соотношений. В частности, можно получить и использовать препараты-предшественники по настоящему изобретению, имеющие значительно более высокое отношение фосфолипида к нейтральному диациллипиду и/или токоферолу, чем это было достижимо ранее, без риска разделения фаз и/или неприемлемо высоких вязкостей в препарате-предшественнике. Массовые соотношения компонентов (а):(б), таким образом, могут быть любыми от 5:95, вплоть до 95:5. Предпочтительные соотношения обычно будут от 90:10 до 20:80 и более предпочтительно от 85:15 до 30:70. В одном предпочтительном воплощении изобретения имеет место большая доля компонента (б), чем компонента (а). То есть массовое соотношение (а):(б) составляет ниже 50:50, например от 48:52 до 2:98, предпочтительно от 40:60 до 10:90, и более предпочтительно от 35:65 до 20:80.
Количество компонента (в) в препаратах-предшественниках по изобретению будет по меньшей мере достаточно для обеспечения малой вязкости смеси (например, молекулярного раствора, см. выше) компонентов (а), (б) и (в) и будет легко определимым для любой конкретной комбинации компонентов стандартными способами. Само фазовое поведение можно проанализировать посредством таких методик как визуальное наблюдение в комбинации с поляризационной световой микроскопией, ядерным магнитным резонансом, крио-трансмиссионной электронной микроскопией (крио-ТЕМ), для поиска растворов, фаз L2 или L3 или жидкокристаллических фаз. Вязкость можно измерить непосредственно стандартными способами. Как описано выше, подходящей практической вязкостью является такая, при которой смесь может быть эффективно введена посредством шприца и, особенно, стерильно отфильтрована. Ее легко оценить, как указано в данном описании изобретения. Максимальное количество компонента (в), которое нужно включить, будет зависеть от точного применения препарата-предшественника, но обычно желательные свойства будут обеспечены любым количеством, образующим маловязкую смесь (например, молекулярный раствор, см. выше) и/или раствор с достаточно низкой вязкостью. Так как введение излишне больших количеств растворителя субъекту обычно является нежелательным, количество компонента (в) обычно будет ограничено не более чем десятикратным (например, трехкратным) превышением минимального количества, требующегося для образования маловязкой смеси, предпочтительно не более чем пятикратным, и наиболее предпочтительно не более чем двухкратным превышением этого количества. Композиция по настоящему изобретению, однако, может содержать большее количество растворителя, чем было бы приемлемым в композиции с немедленным дозированием. Это происходит потому, что процесс, посредством которого медленно высвобождаются активные агенты (например, образование оболочек жидкокристаллической фазы, как описано в данном описании изобретения), также служит для задержки выхода растворителя из композиции. В результате, растворитель высвобождается на протяжении некоторого времени (например, минут или часов), а не мгновенно, и, следовательно, может лучше переноситься организмом.
Более высокие доли растворителя также можно использовать для непарентеральных (например, местных) применений, особенно на поверхностях тела, где растворитель будет теряться путем испарения, а не поглощаться организмом. Для таких применений можно использовать количества, вплоть до 100 раз превышающие минимальное количество растворителя (например, вплоть до 95% по массе композиции, предпочтительно вплоть до 80% по массе, и более предпочтительно вплоть до 50% по массе), особенно когда желательным является очень тонкий слой образующегося непарентерального депо.
Когда композиции по изобретению готовят как (непарентеральный) препарат в виде аэрозольного спрея (например, для местной или системной доставки активного агента), композиция также может содержать пропеллент. Такие композиции также могут включать высокую долю растворителя, компонента (в), как рассмотрено выше, так как большая часть данного растворителя будет испаряться при дозировании композиции.
Подходящие пропелленты представляют собой летучие соединения, которые будут смешиваться с композицией по изобретению при давлении спреевого дозатора без образования высоковязких смесей. Очевидно, что они должны иметь приемлемую биосовместимость. Подходящие пропелленты будут легко определены простым тестированием, и примеры включают углеводороды (особенно C1-C4 углеводороды), диоксид углерода и азот. Также могут быть приемлемыми летучие фторуглеводороды, такие как HFC 134, 137а, 227еа и/или 152а.
В качестве общего руководства, масса компонента (в) обычно будет составлять примерно от 0,5 до 50% от общей массы раствора (а-б-в). Эта доля предпочтительно (особенно для инъецируемых доз) составляет от 2 до 30%, и более предпочтительно от 5 до 20% по массе.
Компонент "а", как указано в данном описании изобретения, представляет собой нейтральный липидный компонент, содержащий полярную "головную" группу, а также неполярные "хвостовые" группы. Обычно головные и хвостовые участки липида связаны сложноэфирной группировкой, но это присоединение может происходить посредством эфирной, амидной, углерод-углеродной связи или другого присоединения. Предпочтительные полярные головные группы являются неионными и включают полиолы, такие как глицерин, диглицерин, и группировки сахаров (например, на основе инозитольных и глюкозильных группировок); и сложные эфиры полиолов, такие как ацетатные или сукцинатные сложные эфиры. Предпочтительные полярные группы представляют собой глицерин и диглицерин, особенно глицерин.
В одном предпочтительном аспекте компонент (а) представляет собой диациллипид, в том смысле, что он имеет две неполярные "хвостовые" группы. Это обычно предпочтительно для применения моноацильных ("лизо") липидов, так как они обычно хуже переносятся in vivo. Две неполярные группы могут иметь одинаковое или разное число атомов углерода, и каждая из них, независимо, может быть насыщенной или ненасыщенной. Примеры неполярных групп включают С6-С32алкильные и алкенильные группы, которые обычно присутствуют в виде сложных эфиров длинноцепочечных карбоновых кислот. Их часто описывают путем указания числа атомов углерода и числа ненасыщенных связей в углеродной цепи. Таким образом, CX:Z означает углеводородную цепь, имеющую Х атомов углерода и Z ненасыщенных связей. Конкретные примеры включают капроиловые (С6:0), каприлоиловые (С8:0), каприловые (С10:0), лауроиловые (С12:0), миристоиловые (С14:0), пальмитоиловые (С16:0), фитаноиловые (С16:0), пальмитолеоиловые (С16:1), стеароиловые (С18:0), олеоиловые (С18:1), элаидоиловые (С18:1), линолеоиловые (С18:2), линоленоиловые (С18:3), арахидоноиловые (С20:4), бегеноиловые (С22:0) и лигноцероиловые (С24:9) группы. Таким образом, типичные неполярные цепи основаны на жирных кислотах природных сложноэфирных липидов, включая капроновую, каприловую, каприновую, лауриновую, миристиновую, пальмитиновую, фитановую, пальмитолиновую, стеариновую, олеиновую, элаидиновую, линолевую, линоленовую, арахидоновую, бегеновую или лигноцеровую кислоты или соответствующие спирты. Предпочтительными неполярными цепями являются пальмитиновая, стеариновая, олеиновая и линолевая кислоты, особенно олеиновая кислота.
Диациллипид, когда он используется как весь компонент "а" или его часть, может быть синтетическим или может происходить из очищенных и/или химически модифицированных природных источников, таких как растительные масла. В качестве компонента (а) можно использовать смеси любого числа диациллипидов. Наиболее предпочтительно этот компонент будет включать по меньшей мере часть диацилглицерина (DAG), особенно глицериндиолеат (GDO). В одном предпочтительном воплощении компонент (а) состоит из DAG. Это может быть один DAG или смесь DAG. Наиболее предпочтительным примером является DAG, содержащий по меньшей мере 50%, предпочтительно по меньшей мере 80%, и даже содержащий по существу 100% GDO.
Альтернативным или дополнительным наиболее предпочтительным классом соединений для применения в качестве всего компонента (а) или его части являются токоферолы. Термин "токоферол", при использовании в данном описании изобретения, означает неионный липидный токоферол, часто известный как витамин Е, и/или его любые подходящие соли и/или аналоги. Подходящими будут аналоги, обеспечивающие фазовое поведение, отсутствие токсичности и фазовый переход при воздействии водных жидкостей, характерное для композиций по настоящему изобретению. Такие аналоги обычно не будут образовывать жидкокристаллических фазовых структур в виде чистого соединение в воде. Наиболее предпочтительным токоферолом является сам токоферол, имеющий указанную ниже структуру. Очевидно что, особенно в случае, когда он очищен из природного источника, могут присутствовать небольшие доли нетокоферольного "загрязнения", но этого будет недостаточно, чтобы изменить полезное фазовое поведение или отсутствие токсичности. Обычно токоферол будет содержать не более 10% соединений - нетокоферольных аналогов, предпочтительно не более 5%, и наиболее предпочтительно не более 2% по массе.
Токоферол
В другом полезном воплощении изобретения компонент (а) состоит по существу из токоферолов, в частности из токоферола, показанного выше.
Предпочтительная комбинация составных частей компонента (а) представляет собой смесь по меньшей мере одного DAG (например, GDO) с по меньшей мере одним токоферолом. Такие смеси включают от 2:98 до 98:2 по массе токоферола:GDO, например от 10:90 до 90:10 токоферола: GDО и, особенно, от 20:80 до 80:20 этих соединений. Также подходящими являются аналогичные смеси токоферола с другими DAG.
Компонент "б" в настоящем изобретении представляет собой по меньшей мере один фосфолипид. Как и в случае с компонентом (а), этот компонент содержит полярную головную группу и по меньшей мере одну неполярную хвостовую группу. Различие между компонентами (а) и (б) принципиально лежит в полярной группе. Неполярные части, таким образом, можно подходящим образом получать из жирных кислот или соответствующих спиртов, рассмотренных выше для компонента (а). Обычно, фосфолипид будет содержать две неполярные группы, хотя одна или более чем одна составная часть этого компонента может иметь одну неполярную группировку. Когда присутствует более чем одна неполярная группа, они могут быть одинаковыми или разными.
Предпочтительные полярные "головные" группы фосфолипидов включают фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и фосфатидилинозит. Наиболее предпочтительным является фосфатидилхолин (PC). В предпочтительном воплощении компонент (б), таким образом, состоит по меньшей мере из 50% PC, предпочтительно по меньшей мере из 70% PC, и наиболее предпочтительно по меньшей мере из 80% PC. Компонент (б) может по существу состоять из PC.
Фосфолипидная часть даже более подходящим образом, чем диациллипидная часть, может происходить из природного источника. Подходящие источники фосфолипидов включают яйцо, сердце (например, коровье), мозг, печень (например, коровью) и растительные источники, включая сою. Такие источники могут обеспечить одну или более чем одну составную часть компонента (б), который может содержать любую смесь фосфолипидов.
Так как препараты-предшественники по изобретению следует вводить субъекту для контролируемого высвобождения активного агента, предпочтительно, чтобы компоненты (а) и (б) являлись биосовместимыми. В этом отношении предпочтительно использовать, например, диациллипиды и фосфолипиды, а не моноацильные (лизо) соединения. Заметным исключением из этого является токоферол, как описано выше. Хотя он и имеет только одну алкильную цепь, он не является "лизо" липидом в традиционном смысле. Природа токоферола как хорошо переносимого незаменимого витамина очевидно делает его весьма подходящим по биосовместимости.
Кроме того, наиболее предпочтительно, чтобы липиды и фосфолипиды компонентов (а) и (б) являлись встречающимися в природе (происходящими из природного источника или имеющими синтетическое происхождение). Встречающиеся в природе липиды имеют тенденцию вызывать меньшее воспаление и реакцию организма субъекта. Это не только более удобно для данного субъекта, но и может увеличивать время пребывания образующихся депо-композиций, особенно парентеральных депо, так как к месту введения рекрутируется меньшая активность иммунной системы. Однако в некоторых случаях может быть желательным включение в компоненты (а) и/или (б) доли липида, не встречающегося в природе. Это может быть, например, "эфирный липид", в котором головные и хвостовые группы связаны простой эфирной связью, а не сложноэфирной связью. Такие липиды, не встречающиеся в природе, например, можно использовать для изменения скорости разрушения образующейся депо-композиции путем приобретения большей или меньшей растворимости или уязвимости в отношении механизмов разрушения, присутствующих в сайте высвобождения активного агента. Хотя в объем настоящего изобретения попадают все соотношения, в общем случае по меньшей мере 50% каждого из компонентов (а) и (б) будут липидами, встречающимися в природе. Эта доля предпочтительно будет составлять по меньшей мере 75% и может составлять вплоть до по существу 100%.
Две особенно предпочтительные комбинации компонентов (а) и (б) представляют собой GDO с PC и токоферол с PC, особенно в интервале 30-90 мас.% GDO/токоферол, 10-60 мас.% PC и 1-30% растворителя (особенно этанола, NMP (N-метилпирролидона) и/или изопропанола).
Помимо амфифильных компонентов (а) и (б) препараты-предшественники по данному изобретению также могут содержать дополнительные амфифильные компоненты в относительно низких содержаниях. В одном воплощении изобретения препарат-предшественник содержит вплоть до 10% (по массе компонентов (а) и (б) заряженного амфифила, особенно анионного амфифила, такого как жирная кислота. Предпочтительные жирные кислоты для этой цели включают капроновую, каприловую, каприновую, лауриновую, миристиновую, пальмитиновую, фитановую, пальмитолиновую, стеариновую, олеиновую, элаидин