Активная иммунизация для создания антител к растворимому а-бета
Иллюстрации
Показать всеЗаявленная группа изобретений относится к медицине, а именно к неврологии, и может быть использована для профилактики и лечения болезни Альцгеймера. Способы по изобретению заключаются во введении фрагмента Аβ16-23, имеющего аминокислотную последовательность KLVFFAED из 16-23 остатков SEQ ID NO:1. Также изобретение касается фрагмента Аβ16-23 и содержащей его фармацевтической композиции. Использование изобретения позволяет осуществлять профилактику и лечение болезни Альцгеймера за счет ингибирования формирования амилоидных отложений в мозге. 4 н. и 68 з.п. ф-лы, 2 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области иммунологии и медицины.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Болезнь Альцгеймера (AD от англ. Alzheimer's Disease) представляет собой прогрессирующее заболевание, приводящее к сенильной деменции. См. главным образом Selkoe, TINS 16, 403-409 (1993); Hardy et al., WO 92/13069; Selkoe, J. Neuropathol. Exp. Neurol. 53, 438-447 (1994); Duffet al., Nature 373, 476-477 (1995); Games et al., Nature 373, 523 (1995). В общих чертах, существует два варианта данной болезни: с поздним дебютом, когда заболевание проявляется в старческом возрасте (65 + лет), и с ранним дебютом, при котором болезнь развивается в пресенильном периоде, то есть между 35 и 60 годами. При обоих вариантах заболевания патологическая основа одинакова, но в случае более раннего начала изменения часто являются более грубыми и распространенными. Для заболевания характерно, по крайней мере, два типа повреждений головного мозга, сенильные бляшки и нейрофибриллярные сплетения. Сенильные бляшки представляют собой участки дезорганизованного нейропиля вплоть до 150 мкм в диаметре с внеклеточными отложениями амилоида в центре, которые видны на срезах ткани головного мозга при микроскопии. Нейрофибриллярные сплетения представляют собой внутриклеточные отложения микротрубочек, ассоциированных с тау-протеином, состоящих из двух нитей, сплетенных между собой попарно.
Основным компонентом бляшек является пептид, называемый Аβ пептидом или β-амидоидом. Аβ пептид представляет собой внутренний фрагмент размером 39-43 аминокислот белка-предшественника, называемого белком предшественником амилоида (АРР от англ. Amyloid Precursor Protein). Несколько мутаций белка АРР, предположительно, связаны с развитием болезни Альцгеймера. См., например, Goate et al., Nature 349, 704) (1991) (валин717 на изолейцин); Chartier Harlan et al., Nature 353, 844 (1991) (валин717 на глицин); Murrell et al., Science 254, 97 (1991) (валин717 на фенилаланин); Mullan et al., Nature Genet. 1, 345 (1992) (двойная мутация, приводящая к замене пары лизин595 - метионин596 на пару аспарагин595 - лейцин596). Считается, что такие мутации вызывают болезнь Альцгеймера, поскольку они приводят к усиленному или неправильному процессингу АРР в Аβ, в особенности процессингу АРР с образованием повышенного количества длинной формы Аβ (то есть Аβ1-42 и Аβ1-43). Считается, что мутации в других генах, например генах презенилина, PS1 и PS2, непосредственно влияют на процессинг АРР с образованием повышенного количества длинной формы Аβ (см. Hardy, TINS 20, 154 (1997)). Эти наблюдения свидетельствуют о том, что Аβ, в особенности его длинная форма, является причиной развития болезни Альцгеймера.
Иммунизация трансгенных мышей моделей AD иммуногенами, насыщенными β-амилоидным пептидом (Аβ), приводила к антительному ответу, который ингибирует формирование амилоидных бляшек в головном мозге мышей или приводит к их рассасыванию (Schenk et al., (1999) Nature 400, 173-177; Janus et al., (2000) Nature 408, 979-982, Morgan et al. (2002) Nature 408, 982-985, Sigurdsson et al., (2001) Am. J. Pathol. 159, 439-447, 1-4)). Введенные пассивно готовые антитела к Аβ приводили к таким же эффектам. Было сделано предположение о том, что основным механизмом очищения ткани головного мозга от существующих амилоидных бляшек является опосредованный антителами, Fc-зависимый фагоцитоз клетками микроглии и/или макрофагами (Bard et al., (2000) Nat. Med., 6, 916-919)). Это предположение основано на том, что определенные антитела к Аβ, введенные на периферии, достигают ЦНС трансгенной мыши, связываются с амилоидными бляшками и индуцируют их рассасывание. Также была отмечена сильная корелляция между антителами, которые оказывались эффективными in vivo, и в исследованиях ех vivo, проводившихся на срезах головного мозга PDAPP или людей, пораженных болезнью Альцгеймера, для измерения рассасывающей активности антител. В исследованиях ех vivo показано, что в рассасывании бляшек задействованы Fc-рецепторы клеток микроглии. Однако также было замечено, что эффективность антител может быть также достигнута in vivo с помощью механизмов, независимых от Fc взаимодействий (Bacskai et al., (2002) J. Neurosci. 22, 7873-7878). Сообщалось, что антитело, направленное против срединного участка Аβ, которое не может распознавать амилоидные бляшки, связывает растворимый Аβ и уменьшает отложение бляшек (DeMattos et al., (2001) Proc. Natl. Acad. Sci. USA, 98, 8850-8855). Сообщалось, что кратковременное лечение этим антителом приводило к улучшению у пациентов способности к распознаванию, не влияя на амилоидную нагрузку (Dotart et al., (2002) Nat. Neurosci., 5, 452-457).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
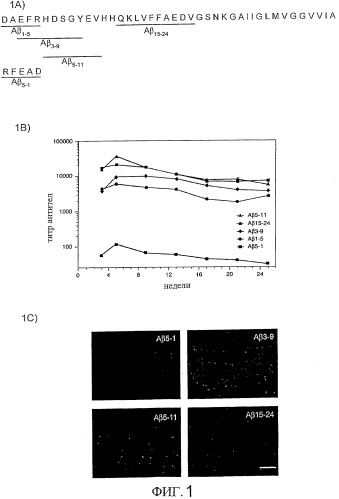
Фиг.1А-С. Антитела, полученные путем иммунизации мышей N-концевыми фрагментами Аβ, связываются с амилоидными бляшками. Фиг.А1. Для иммунизации PDAPP мышей использовали пептиды, включающие различные домены Aβ1-42 (SEQ ID NO:1) (синтетические пептиды, смежные с Т-клеточным эпитопом, происходящие из овальбумина). В качестве негативного контроля использовали реверсемер Аβ5-1 (SEQ ID NO:2). Фиг.1В. Титры в ELISA против агрегированного Aβ1-42 были значительно выше на всем протяжении исследования в группах Аβ5-11 и Аβ15-24, по сравнению с группой Аβ1-5 (1:14, 457, р<0.01 и 1:12, 257, р<0.05 против 1:3, 647 соответственно; ANOVA с последующим post hoc тестом Тукея). Фиг.1C. Нефиксированные криостатические срезы головного мозга необработанных PDAPP мышей обработали сывороткой мышей, иммунизированных Аβ5-1, Аβ3-9, Аβ5-11 или Аβ15-24 (титры нормализовали до 1:1000 для окрашивания). Антитела к Аβ15-24 не связывались с амилоидными бляшками. Единица шкалы соответствовала 500 мкм.
Фиг.2А-С. Захват растворимого Aβ1-42 антителами не ассоциировался с уменьшением амилоидной нагрузки или невритической патологии. Фиг.2А. Оценивали способность сывороток мышей, иммунизированных фрагментами Aβ, захватывать радиоактивно меченный растворимый Aβ1-42 в радиоиммунологическом анализе. Сыворотки всех животных, иммунизированных Аβ15-24, обладали способностью захватывать растворимый Aβ1-42 (один образец сыворотки имел титр выше чем 1:1,350, точный титр не был определен), в сравнении с 27% захвата в группе Аβ1-5 и 3% захвата в группе Аβ3-9. Фиг.2В-С. Амилоидную нагрузку (Фиг.2В) и невритическую патологию (Фиг.2С) оценивали с помощью анализа изображений при микроскопии в темном поле. Результаты выражали в средних процентах по группе Aβ5-1 (в качестве негативного контроля использовали реверсемерный пептид). Группу Аβ5-11 исследовали при отдельном содержании от других групп, но в тесной взаимосвязи с той же самой группой негативного контроля в качестве внутреннего стандарта сравнения (второй набор реверсемеров Аβ5-1). Амилоидная нагрузка значительно уменьшалась в группах Аβ1-5, Аβ3-9 и Аβ5-11 (р<0.001). Стрелки соответствуют средним значениям и пунктирные горизонтальные линии обозначают контрольный уровень. Невритическая нагрузка была существенно изменена при иммунизации групп Аβ3-9 и Аβ5-11 (р<0.05). Ни одна из конечных точек не была существенно изменена при иммунизации группы Аβ15-24. Статистический анализ осуществляли по среднему квадратичному отклонению (для нормализации непараметрических отклонений) и анализировали методом ANOVA. Тест Дюннетта затем использовали для сравнения групп Аβ1-5, Аβ3-9, Aβ15-24 с контролем Аβ5-1, а тест Манна-Уитнея - для группы Аβ5-11 и соответствующего реверсемерного контроля Аβ5-1.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие положения
Данное изобретение относится к способу предупреждения, эффективной профилактики или лечения заболевания, связанного с отложением амилоида, заключающемуся в использовании фрагментов центральных или С-концевых участков Аβ. Эти фрагменты могут индуцировать образование поликлональной смеси антител, которые специфично связывают растворимый Аβ без связывания с амилоидными бляшками. Антитела могут ингибировать формирование амилоидных отложений Аβ из растворимого Аβ в головном мозге пациента, обеспечивая тем самым профилактику и лечение заболевания. Предпочтительными иммуногенами являются 15-24 фрагменты А-бета и субфрагменты 5-10 их смежных аминокислот, поскольку они обладают способностью генерировать высокий титр антител.
Определения
С целью классификации аминокислотных замен на консервативные и неконсервативные, аминокислоты сгруппированы следующим образом: Группа I (гидрофобные боковые цепи): норлейцин, мет, ала, вал, лей, иле; Группа II (нейтральные гидрофильные боковые цепи): цис, сер, тре; Группа III (кислые боковые цепи): асп, глу; Группа IV (основные боковые цепи): асн, глн, гис, лиз, арг; Группа V (остатки, влияющие на ориентацию цепи): глу, про, и Группа VI (ароматические боковые цепи): три, тир, фен. Консервативные замены включают замены между аминокислотами одного класса. Неконсервативные замены представляют собой замены аминокислот одного класса на аминокислоты другого класса.
Термин "все-D" относится к пептидам, имеющим ≥75%, ≥80%, ≥90%, ≥95% и 100% аминокислот в D-конфигурации.
Термин "агент" используется для описания соединения, которое обладает или может обладать фармакологической активностью. К агентам относятся соединения, известные как лекарственные средства, соединения с доказанной фармакологической активностью, но чья терапевтическая активность подлежит дополнительному анализу, и соединения, которые входят в состав коллекций и библиотек, фармакологическая активность которых еще должна быть исследована.
Терапевтические агенты, заявленные в соответствии с настоящим изобретением, обычно являются полностью очищенными от нежелательных примесей. Это означает, что агент имеет обычно по крайней мере приблизительно 50% в/в (вес/вес) очистку, а также полностью свободен от примесных белков и контаминантов. Иногда агенты имеют по крайней мере 80% в/в и более предпочтительно по крайней мере 90 или 95% в/в очистку. Однако, используя рутинные технологии очищения белков, можно получить гомогенные пептиды по меньшей мере с 99% в/в очисткой. Терапевтические агенты, в соответствии с настоящим изобретением, могут эффективно предотвращать или лечить заболевания, ассоциированные с отложением амилоида.
Специфическое связывание между двумя соединениями означает, что эти два соединения обладают взаимной аффинностью, которая по крайней мере в 10, 100 раз выше, чем аффинность каждого из этих соединений по отношению к контролю, например, как неродственного антигена или антитела для другого антигена. Взаимная аффинность двух соединений по отношению друг к другу обычно составляет 107, 108, 109 М-1 или 1010 М-1. Аффинности более 108 М-1 являются предпочтительными. Специфическое связывание поликлонального антитела с эпитопом Аβ означает, что антитела в группе поликлональных антител специфично связываются с одним эпитопом Аβ и не связываются с другими эпитопами Аβ.
Термин "антитело" или "иммуноглобулин" используется для обозначения полных молекул антител и их связывающих фрагментов. Обычно фрагменты конкурируют с полной молекулой антитела, из которого они получены, за специфическое связывание с антигенным фрагментом, включая отдельные тяжелые цепи, легкие цепи. Fab, Fab'F(ab')2, Fabc и Fv. Фрагменты получают с помощью рекомбинантных ДНК технологий или с помощью химического разделения полных молекул иммуноглобулинов. Термин "антитело" также относится к одной или нескольким цепям иммуноглобулинов, которые химически конъюгированы, или экспрессируются как белки слияния с другими белками. Термин "антитело" также относится к биспецифичному антителу. Биспецифичное или бифункциональное антитело представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелых/легких цепей и два различных сайта связывания. Биспецифичные антитела могут быть получены с помощью различных методов, включая слияние гибридом или связывание Fab фрагментов. См., например, Songsivilai & Lachmainn, Clin. Exp. Immunol. 79: 315-321 (1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992).
Аβ, также известный как β-амилоидный пептид, или А4 пептид (см. патент США 4666829; Glenner & Wong, Biochem. Biophys. Res. Commun., 120, 1131 (1984)), представляет собой пептид, состоящий из 39-43 аминокислот и являющийся основным компонентом бляшек, характерных для болезни Альцгеймера. Аβ имеет несколько натуральных форм. Натуральные формы Аβ человека обозначают как Аβ39, Аβ40, Aβ41, Аβ42 и Aβ43. Последовательности этих пептидов и их отношение к предшественнику АРР иллюстрирует Фиг.1 у Hardy et al., TINS 20, 155-158 (1997). Например, Аβ42 имеет следующую последовательность:
N2H-Асп-Ала-Глу-Фен-Арг-Гис-Асп-Сер-Глу-Тир-Глу-Вал-Гис-Гис-Глн-Лиз-Лей-Вал-Фен-Фен-Ала-Глу-Асп-Вал-Глу-Асп-Вал-Глу-Сер-Асн-Лиз-Глу-Ала-Иле-Иле-Глу-Лей-Мет-Вал-Глу-Глу-Вал-Вал-Иле-Ала-ОН (SEQ ID NO:1).
Аβ41, Аβ40 и Аβ39 отличаются от Аβ42 отсутствием Ала, Ала-Иле и Ала-Иле-Вал соответственно на С-конце. Аβ43 отличается от Аβ42 наличием остатка треонина на С-конце.
АРР695, АРР751 и АРР770 относятся к длинным полипептидам, включающим 695, 751 и 770 аминокислотных остатков соответственно и кодируемым геном АРР человека. См. Kang et al., Nature, 325, 773 (1987); Ponte et al., Nature, 331, 525 (1988), и Kitaguchi et al., Nature, 331, 530 (1988). Аминокислоты белка предшественника амилоида человека (АРР) пронумерованы соответственно последовательности изоформы АРР770. Такие термины как Аβ39, Aβ40, Аβ41, Aβ42 и Aβ43 относятся к Аβ пептиду, включающему аминокислотные остатки 1-39, 1-40, 1-41, 1-42 и 1-43 соответственно.
Дезагрегированные Аβ или их фрагменты - это мономерные пептидные единицы. Дезагрегированные Аβ или их фрагменты обычно являются растворимыми и обладают способностью самоагрегировать с образованием растворимых олигомеров. Олигомеры Аβ и их фрагментов обычно являются растворимыми и существуют главным образом в виде альфа-спиралей или случайных клубков. Одним из способов получения мономерного Аβ является растворение лиофилизированного пептида в чистом DMSO с последующим разрушением ультразвуком. Полученный раствор центрифугируют для удаления нерастворимых частиц. Агрегированные Аβ или их фрагменты относятся к олигомерам Аβ или их иммуногенным фрагментам, в которых мономерные единицы соединены вместе нековалентными связями и ассоциированы в нерастворимые бета-складчатые структуры. Агрегированные Аβ или их фрагменты также относятся к фибриллярным полимерам. Фибриллы обычно являются нерастворимыми. Некоторые антитела связывают как растворимые Аβ и их фрагменты, так и агрегированные Аβ и их фрагменты. Некоторые антитела связывают растворимый Аβ, но не связывают бляшки.
"Антиген" - это соединение, с которым специфично связывается антитело.
Термин "эпитоп" или "антигенная детерминанта" относится к участку антигена, с которым взаимодействуют В и/или Т-клетки. В-клеточные эпитопы могут быть сформированы из смежных аминокислот или несмежных, которые соприкасаются между собой при четвертичной укладке белка. Эпитопы, сформированные из смежных аминокислот, обычно устойчивы при воздействии денатурирующих агентов, в то время как эпитопы, сформированные при четвертичной укладке белка, обычно разрушаются при обработке денатурирующими агентами. Эпитоп обычно включает по крайней мере 3, более часто по крайней мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Методы определения пространственной конформации эпитопов включают, например, рентгеновскую кристаллографию и двухмерный ядерный магнитный резонанс. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed. (1996). Антитела, которые распознают одинаковые эпитопы могут быть идентифицированы с помощью обычного иммунного анализа, показывающего способность одного антитела блокировать связывание другого антитела с антигеном-мишенью. Т-клетки распознают непрерывные эпитопы из приблизительно 9 аминокислот для CD8 клеток и из 13-15 аминокислот для CD4 клеток. Т-клетки, которые распознают эпитоп, могут быть идентифицированы с помощью анализа in vitro, который позволяет измерить антиген-зависимую пролиферацию, как определено по включению 3H-тимидина примированными Т-клетками, отвечающими на эпитоп (Burke et al., J. Inf. Dis., 170, 1110-19 (1994)), путем антиген-зависимого киллинга (метод цитотоксических Т-лимфоцитов, Tigges et al., J. Immunol., 156, 3901-3910) или секреции цитокинов.
N-концевой эпитоп Аβ относится к эпитопу, образованному остатками 1-11. Эпитоп на С-конце относится к эпитопу, образованному остатками 29-43, а эпитоп, находящийся в центральном участке, образован остатками 12-28.
Термин "иммунологический" или "иммунный" ответ - это развитие предпочтительного гуморального (опосредованного антителами) и/или клеточного (опосредованного антиген-специфичными Т-клетками или их секреторными пептидами) ответа, направленного против амилоидных бляшек в организме пациента. Этот ответ может быть активным, индуцированным введением иммуногена, или пассивным, индуцированным введением антитела или примированных Т-клеток. Клеточный иммунный ответ вызывается презентацией полипептидных эпитопов, ассоциированных с молекулами I или II Класса Главного Комплекса Гистосовместимости, для активации антиген-специфичных CD4+ Т-хелперов и/или CD8+ цитотоксичных Т-клеток. Ответ может включать также активацию моноцитов, макрофагов, NK-клеток, базофилов, дендритных клеток, астроцитов, микроглии, эозинофилов, других компонентов иммунной системы. Наличие клеточного иммунного ответа может быть подтверждено с помощью исследований пролиферации (CD4+ клеток) или CTL (цитотоксичных Т-лимфоцитов от англ. cytotoxic T lymphocyte) (см. Burke, supra; Tigges, supra). Относительный вклад гуморального и клеточного ответов в защитный терапевтический эффект иммуногена можно различить путем раздельного выделения антител и Т-клеток из иммунизированного сингенного животного и измерением их протективного или терапевтического эффекта по отношению ко второму субъекту.
"Иммунологический агент" или "иммуноген" обладает способностью индуцировать иммунный ответ, направленный против него же самого, при введении в организм млекопитающего, возможно совместно с адъювантом.
Термин "голый" полинуклеотид относится к полинуклеотиду, не связанному с коллоидными материалами. "Голые" нуклеотиды иногда клонируют в плазмидном векторе.
Термин "адъювант" относится к соединению, которое при введении совместно с антигеном, усиливает иммунный ответ на этот антиген, а при самостоятельном введении не приводит к иммунному ответу на данный антиген. Адъюванты могут усиливать иммунный ответ с помощью нескольких механизмов, включая рекрутмент (постоянное обновление пула) лимфоцитов, стимуляцию В и/или Т-клеток и стимуляцию макрофагов.
Термин "пациент" относится к человеку или другому млекопитающему, получающему профилактическое или терапевтическое лечение.
Конкуренцию между антителами определяли с помощью анализа, в котором тестируемый иммуноглобулин ингибировал специфическое связывание контрольного антитела с обычным антигеном, таким как Аβ. В настоящее время существует множество методов конкурентного связывания, например твердофазный прямой или непрямой радиоиммунный анализ (RIA от англ. Radioimmunoassay), твердофазный прямой или непрямой ферментный иммунологический анализ (EIA от англ. Enzyme Immunoassay), сэндвич-метод анализа конкурентного связывания (см. Stahli et al., Methods in Enzymology, 9: 242-253 (1983)); твердофазный прямой EIA с биотином-авидином (см. Kirklaud et al., Immunol. 137: 3614-3619 (1986)); твердофазный прямой анализ с меткой, твердофазный прямой сэндвич анализ с меткой (см. Harlow and Lane, "Antibodies, A Laboratory Manual", Cold Spring Harbor Press (1988)); твердофазный прямой RIA с меткой I-125 (см. Morel et al., Molec. Immunol. 25 (1): 7-15 (1988)); твердофазный прямой EIA с биотином-авидином (Cheung et al., Virology, 176: 546-552 (1990)) и прямой RIA с меткой (Moldenhauer et al., Scand. J. Immunol., 32: 77-82 (1990)). Обычно такие методы заключаются в использовании очищенного антигена, связанного с твердой поверхностью или клетками, несущими как непомеченный тестируемый иммуноглобулин, так и меченный контрольный иммуноглобулин. Конкурентное ингибирование измеряют путем определения количества метки, связавшейся с твердой поверхностью или клетками в присутствии тестируемого иммуноглобулина. Обычно тестируемый иммуноглобулин присутствует в избытке. Антитела, определяемые с помощью методов конкурентного связывания (конкурирующие антитела), включают антитела, связывающиеся с тем же эпитопом, что и контрольное антитело, и антитела, связывающиеся со смежным эпитопом, расположенным проксимально по отношению к эпитопу, с которым связывается контрольное антитело, для поддержания стерического барьера. Обычно в том случае,когда конкурирующее антитело присутствует в избытке, оно будет ингибировать связывание контрольного антитела с обычным антигеном по крайней мере на 50 или 75%.
Антитело, которое специфично связывается растворимым Аβ, это антитело, которое связывается с Аβ с аффиностью, составляющей по крайней мере 107 М-1. Некоторые антитела связывают растворимый Аβ с аффинностью от 108 М-1 до 1011 М-1.
Антитело, которое специфично связывается с растворимым Аβ без специфичного связывания с бляшками, представляет собой антитело, которое специфично связывает растворимый Аβ, как описано выше, и имеет по крайней мере в десять и обычно по крайней мере в 100 раз меньшую аффинность специфического связывания по отношению к бляшкам (то есть по отношению к Аβ в форме агрегированных β-складчатых структур), полученным из трупов пациентов, страдавших болезнью Альцгеймера, или из трансгенных модельных животных. Например, такое антитело может связываться с растворимым Аβ с аффинностью 109 М-1, а с бляшками - с аффиностью менее чем 107 М-1. Аффинность таких антител по отношению к бляшкам обычно составляет менее 107 или 106 М-1. Такие антитела дополнительно или альтернативно определяют по интенсивности флуоресценции по отношению к иррелевантному контрольному антителу (например, антителу или смеси поликлональных антител к реверсемерному Аβ пептиду), когда антитела находятся в контакте с бляшками и связывание контролируется с помощью флуоресцентной метки (как описано в примерах). Интенсивность флуоресценции антител, которые связываются с растворимым Аβ пептидом без связывания с бляшками, находится в пределах фактора пяти, иногда в пределах фактора двух и иногда неразличима в пределах экспериментальной ошибки от таковой контрольного антитела.
Композиции или методы "включающие" один или более повторяющихся элементов, могут включать и другие элементы, специфично не повторяющиеся. Например, композиция, содержащая Аβ пептид, включает как изолированный Аβ пептид, так и Аβ пептид как компонент большей полипептидной последовательности.
Аβ пептиды для активной иммунизации
Аβ пептиды, используемые в способах в соответствии с настоящим изобретением, представляют собой иммуногенные пептиды, которые при введении в организм человека или животного способствуют образованию антител, которые специфично связываются с одним или более эпитопом, находящимся в пределах от 12 до 43 остатка Аβ, и не приводят к образованию антител, которые специфично связываются с одним или более эпитопом, находящимся в пределах 1-11 остатков Аβ. Антитела специфично связывающиеся с эпитопами, находящимися между 12 и 43 остатками, специфично связываются с растворимым Аβ и не связываются с Аβ в бляшках. Антитела этого типа могут специфично связывать растворимый Аβ при циркуляции в организме пациента или модельного животного без специфичного связывания с бляшками, представленными отложениями Аβ в головном мозге пациента или модельного животного. Специфическое связывание антител с растворимым Аβ ингибирует включение Аβ в бляшки, таким образом приводя также к прекращению развития бляшек в головном мозге пациента или прекращению дальнейшего увеличения их размеров и количества, в том случае, если бляшки образовались до начала лечения.
Предпочтительно введенный фрагмент Аβ не имеет эпитопа, который будет генерировать Т-клеточный ответ, направленный против этого же фрагмента. В общем, эпитопы Т-клеток включают более 10 смежных аминокислот. Кроме того, предпочтительные фрагменты Аβ состоят из 5-10 или предпочтительно из 7-10 смежных аминокислот, то есть имеют достаточную длину для того, чтобы генерировать антительный ответ, но не вовлекать в иммунный ответ Т-клетки. Отсутствие эпитопов для Т-клеток является предпочтительным, поскольку эти эпитопы не являются необходимыми для иммуногенной активности фрагментов, но могут вызывать нежелательный воспалительный ответ у множества пациентов (Anderson et al., (2002) J. Immunol. 168, 3697-3701; Senior (2002) Lancet Neurol. 1, 3). В некоторых методах используется фрагмент, представляющий собой фрагмент, отличный от Аβ 13-28, 17-28, 25-35, 35-40, 33-42 или 35-42. Большинство Т-клеточных эпитопов находятся в пределах 14-30 аминокислот Аβ.
Фрагмент Aβ15-24 и субфрагменты 7-9 их смежных аминокислот являются предпочтительными, поскольку эти пептиды равным образом генерируют высокий иммунный ответ на Аβ пептид. Эти фрагменты включают Аβ15-21, Аβ16-22, Аβ17-23, Аβ18-24, Аβ19-25, Аβ15-22, Аβ16-23, Аβ17-24, Аβ18-25, Аβ15-23, Аβ16-24, Аβ17-25, Аβ18-26, Аβ15-24, Аβ16-25 и Аβ15-25. Обозначение Аβ15-21, например, относится к фрагменту, включающему остатки 15-21 Аβ и не включающему другие остатки Аβ. Также предпочтительными являются С-концевые фрагменты Аβ42 или 43 из 5-10, предпочтительно 7-10 смежных аминокислот. Эти фрагменты могут генерировать антительный ответ, который вовлекает концевые специфичные антитела. Эти антитела имеют преимущество в специфическом связывании Аβ42 и Аβ43 без специфического связывания с Аβ39-41. Эти антитела связывают растворимый Аβ без связывания с бляшками.
При использовании некоторых методов фрагмент из центрального или С-концевого участка Аβ вводится в режиме, который также включает введение фрагмента и из N-концевого участка. В целом, такие фрагменты способствуют образованию антител, которые специфично связываются с бляшками и индуцируют их разрушение фагоцитирующими клетками. Такой иммунный ответ является наиболее подходящим для разрушения существующих отложений Аβ. Однако далее после разрушения этих отложений является предпочтительным продолжить введение фрагмента из центрального или С-концевого участка Аβ для стимулирования образования антител к растворимому Аβ, чтобы предотвратить дальнейшее отложение Аβ без риска развития нежелательных воспалительных реакций у определенных пациентов. N-концевые фрагменты, начинающиеся с 1-3 остатков Аβ и заканчивающиеся на 7-11 остатках Аβ, являются наиболее предпочтительными. Примерами N-концевых фрагментов являются Аβ1-5, 1-6, 1-7, 1-10, 3-7, 1-3 и 1-4.
Если дополнительно не оговаривается иное, ссылки на фрагменты Аβ включают фрагменты натуральных аминокислотных последовательностей человека, определенные выше, а также их аналоги, выключая алелльные, видовые и индуцированные варианты. Аналоги Аβ фрагментов индуцируют образование антител, которые специфично связываются с натуральным Аβ пептидом (например, Аβ42). Аналоги Аβ фрагментов обычно отличаются от натуральных фрагментов пептида приблизительно на 30% по 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным позициям. Каждая делеция или замена натурального аминокислотного остатка считается за изменение позиции, как и включение аминокислотного остатка без замены. Аминокислотные замены обычно являются консервативными заменами.
Если дополнительно не оговаривается иное, ссылки на Аβ фрагменты включают фрагменты натуральных аминокислотных последовательностей человека, определенные выше, а также их аналоги, включая аллельные, видовые и индуцированные варианты. Аналоги Аβ индуцируют образование антител, которые специфично связываются с натуральным Аβ пептидом (например, Аβ42). Аналоги Аβ фрагментов обычно отличаются от натуральных фрагментов пептида на 30%. Например, аналог Аβ 15-21 может отличаться по 1, 2, 3, 4 или 10 аминокислотным позициям. Каждая делеция или замена натурального аминокислотного остатка считается за изменение позиции, как и включение аминокислотного остатка без замены. Аминокислотные замены обычно являются консервативными заменами.
Некоторые аналоги Аβ или Аβ фрагменты также включают неприродные аминокислоты или модификации N или С концевых аминокислот в одной, двух, пяти, десяти или одиннадцати, или даже во всех позициях. Например, натуральный остаток аспарагиновой кислоты в позиции 1 и/или 7 Аβ может быть замещен изоаспарагиновой кислотой. Примерами синтетических аминокислот являются D, альфа, альфа-двухзамещенные аминокислоты, N-алкиламинокислоты, молочная кислота, 4-гидроксипролин, гамма-карбоксиглутамат, ипсилон-N-ацетиллизин, O-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, омега-N-метиларгинин, β-аланин, орнитин, норлейцин, норвалин, гидроксипролин, тироксин, гамма-аминомасляная кислота, гомосерин, цитруллин и изоаспарагиновая кислота. Некоторые терапевтические агенты, заявленные в соответствии с настоящим изобретением, представляют собой all-D пептиды, например all-D-Аβ или all-D Аβ фрагменты, или all-D пептидные аналоги. Эффективность фрагментов или аналогов в отношении профилактики и лечения может быть изучена на модельных трансгенных животных при сравнении с контрольными группами, не получавшими лечения или получавшими плацебо, как описано ниже.
Аβ, его фрагменты и их аналоги могут быть синтезированы с помощью твердофазного пептидного синтеза или рекомбинантной экспрессии или могут быть получены из естественных источников. Автоматические системы для пептидного синтеза являются коммерчески доступными и предоставляются различными поставщиками, такими как Applied Biosystems, Foster City, California. Рекомбинантная экспрессия может быть осуществлена в бактериях, таких как E.coli, дрожжевых клетках, клетках насекомых или клетках млекопитающих. Методики рекомбинантной экспрессии описаны у Sambrook et al., Molecular Cloning: A Laboratory Manual (C.S.H.P. Press, NY 2d ed., 1989). Некоторые формы Аβ пептида также являются коммерчески доступными (например, American Peptides Company, Inc., Sunnyvale, CA and California Peptide Research, Inc. Napa, CA).
К терапевтическим агентам также относятся более длинные полипептиды, включая, например, иммуногенный фрагмент Аβ пептида вместе с одной или несколькими другими аминокислотами, фланкирующими Аβ пептид с одной или с обеих сторон. Например, предпочтительные терапевтические агенты включают белки слияния, содержащие сегмент Аβ, слитый с гетерологичной аминокислотной последовательностью, которая индуцирует Т-клеточный ответ, направленный против нее же, и, таким образом, способствует развитию В-клеточного иммунного ответа на Аβ сегмент. Для кэпирования Аβ пептида с целью защиты его от деградации во время получения, хранения или использования можно использовать одну или несколько фланкирующих гетерологичных аминокислот. Эффективность этих пептидов в отношении профилактики и лечения может быть изучена на модельных трансгенных животных при сравнении с контрольными группами, не получавшими лечения или получавшими плацебо, как описано ниже. Терапевтические агенты, заявленные в соответствии с настоящим изобретением, включают иммунногенный фрагмент Аβ, фланкированный полилизиновыми последовательностями. Полилизиновая последовательность может быть слита с N-концом, с С-концом или с обоими, N- и С-концевыми участками иммуногенного фрагмента Аβ. Аβ пептид, его аналог, активный фрагмент или другой полипептид могут вводиться в ассоциированной или полимерной форме или в диссоциированной форме. Терапевтические агенты также включают полимерные или мономерные иммуногенные агенты.
Другим вариантом является экспонирование имунногенного фрагмента Аβ вирусом или бактерией как части иммуногенной композиции. Нуклеиновую кислоту, кодирующую иммуногенный пептид, включают в геном или эписому вируса или бактерии. По выбору, нуклеиновую кислоту включают так, что имунногенный пептид экспрессируется как белок секреции или как белок слияния с наружным белком поверхности вируса или с трансмембранным белком бактерии, таким образом, что пептид экспонируется. Вирусы или бактерии, использующиеся в таких методиках, должны быть непатогенными или аттенуированными. Подходящими вирусами являются аденовирус, HSV, вирус венесуэльского энцефалита лошадей и другие альфа-вирусы, вирус везикулярного стоматита и другие рабдовирусы, вирус коровьей оспы и птичьей оспы. Подходящими бактериями являются бактерии рода Salmonella и Shigella. Слияние имунногенного пептида с HBsAg HBV является особенно предпочтительным.
Терапевтические агенты также включают пептиды и другие соединения, чьи аминокислотные последовательности необязательно сходны с таковыми Аβ, но которые могут имитировать действие Аβ и вызывать такой же иммунный ответ. Например, любые пептиды и полипептиды, формирующие β-складчатые структуры могут оказаться подходящими. Анти-идиотипические антитела против моноклональных антител к Аβ или другие амилоидогенные пептиды также могут быть использованы. Такие анти-Id антитела имитируют антиген и генерируют иммунный ответ, направленный на него (см. Essential Immunology (Roit ed., Blackwell Scientific Publications, Palo Alto, 6th ed.), p.181). Агенты, отличные от Аβ пептида, должны вызывать иммунный ответ, направленный против одного или нескольких предпочтительных сегментов Аβ, перечисленных выше (например, 15-24). Предпочтительно такие агенты вызывают иммунный ответ, который главным образом направлен на один из этих сегментов и не направлен на другие сегменты Аβ.
Кроме того, подходящими для этих целей могут оказаться различные библиотеки пептидов и других соединений. Комбинаторные библиотеки могут быть созданы для соединений различных типов, которые могут быть синтезированы поэтапно. К таким соединениям относятся полипептиды, миметики бета-поворота, полисахариды, фосфолипиды, гормоны, простагландины, стероиды, ароматические соединения, гетероциклические соединения, бензодиазепины, олигомерные N-замещенные глицины и олигокарбаматы. Большие комбинаторные библиотеки соединений могут быть сконструированы с помощью метода кодированных синтетических библиотек (ESL от англ. Encoded Synthetic Libraries), описанного в Affymax, WO 95/12608, Affymax, WO 93/06121, Columbia University, WO 94/08051, Pharmacopeia, WO 95/3503 and Scripps, WO 95/30642 (все источники представлены здесь в качестве ссылок). Пептидные библиотеки также могут быть получены с помощью фаговых дисплейных методов. См., например, Devlin, WO 91/18980.
В первую очередь устанавливают, являются ли комбинаторные библиотеки и другие соединения подходящими, путем определения их способности специфично связываться с антителами или лимфоцитами (В или Т), про которые известно, что они являются специфичными для Аβ или других амилоидогенных пептидов. Например, начальные исследования могут быть осуществлены с любой поликлональной сывороткой или моноклональным антителом к Аβ или его фрагментам. Затем можно исследовать, насколько соединения специфично связываются со специфичным эпитопом Аβ (например, 15-24). Соединения могут быть протестированы при использовании технологий, применяемых для определения специфичности эпитопов. Соединения, идентифицированные с помощью таких исследований, затем подвергают анализу для определения их способности индуцировать выработку антител или реактивировать лимфоциты к Аβ или его фрагментам. Например, множественные разведения сыворотки могут быть протестированы на планшетах для микротитрования, которые предварительно покрыли Аβ или его фрагментами, а для определения способности индуцировать антителообразование к Аβ или его фрагменту можно осуществить стандартную ELISA. Затем возможно исследовать профилактическую и терапевтическую эффективность этих соединений на трансгенных животных, предрасположенных к болезни Альцгеймера, как описано в примерах. К таким животным относятся, например, мыши, имеющие 717 мутацию АРР, описанную Games et al., выше, и мыши, имеющие 670/671 шведскую мутацию АРР, как описано McConglogue et al., US 5612486, Hsisao et al., Science, 274, 99 (1996); Staufenbiel et al., Proc. Natl. Acad. Sci. USA, 94: 13287-13292 (1997); Struchler-Pierrat et al., Proc. Natl. Acad. Sci. USA, 94: 13287-13292 (1997); Borchelt et al., Neuron, 19: 939-945 (1997)). Такой же скрининговый подход может быть применен и для других потенциальных агентов, аналогов Аβ и длинных полипептидов, включая фрагменты Аβ, описанные выше.
IV. Конъюгаты
Некоторые агенты, предназначенные для стимулирования иммунного ответа, имеют подходящий эпитоп для индуцирования иммунного ответа против LBs, но имеют слишком маленький размер, чтобы быть иммуногенными. В такой ситуации пептидный иммуноген может быть соединен с подходящей молекулой носителя для формирования конъюгата, который будет вызвать иммунный ответ. Один агент может быть соединен с одним носителем, множественные копии агента могут быть соединены с множественными копиями носителя, которые, в свою очередь, связаны между собой, множественные копии агента могут быть соединены с одн