Препарат матричного типа с замедленным высвобождением, содержащий основное лекарственное средство или его соль, и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины и фармакологии, более конкретно к получению лекарственных средств. Предлагается композиция матричного типа с замедленным высвобождением, содержащая гидрохлорид донепезила и/или гидрохлорид мемантина; растворимый в кишечнике полимер, который, по меньшей мере, один выбран из группы, состоящей из сополимера метакриловой кислоты-этилакрилата, сополимера метакриловой кислоты-метилметакрилата, фталата гидроксипропилметилцеллюлозы и ацетата сукцината гидроксипропилметилцеллюлозы; и водонерастворимый полимер, который, по меньшей мере, один выбран из группы, состоящей из этилцеллюлозы, сополимера аминоалкилметакрилата RS и сополимера этилакрилата-метилметакрилата. Также предлагается способ получения указанной композиции, включающий стадию смешивания гидрохлорида донепезила и/или гидрохлорида мемантина, растворимого в кишечнике полимера и водонерастворимого полимера; и стадию компрессионного формования смеси, полученной на стадии смешивания. Реализация вышеуказанных композиции и способа обеспечивает замедленное высвобождение активного вещества в организме. 2 н. и 9 з.п. ф-лы, 13 табл., 9 ил.
Реферат
Область техники
Настоящее изобретение относится к препарату матричного типа с замедленным высвобождением, содержащему основное лекарственное средство или его соль, более конкретно, относится к препарату, который не только ингибирует начальный пик лекарственного средства (быстрое высвобождение лекарственного средства непосредственно после растворения) в тесте на растворимость, но также в тесте на растворимость обеспечивает растворение с небольшой зависимостью от pH основного лекарственного средства или его соли на ранней стадии растворения. Настоящее изобретение также относится к препарату матричного типа с замедленным высвобождением, содержащему основное лекарственное средство или его соль, в котором отношение скорости растворения основного лекарственного средства или его соли в кислом тестовом растворе к скорости растворения основного лекарственного средства или его соли в нейтральном тестовом растворе (скорость растворения в кислом тестовом растворе/скорость растворения в нейтральном тестовом растворе) уменьшается по мере растворения на поздней стадии растворения по сравнению с ранней стадией растворения.
Уровень техники
По сравнению с обычными быстрорастворимыми препаратами препарат с замедленным высвобождением, содержащий физиологически активное лекарственное средство, позволяет концентрациям лекарственного средства в крови в течение длительного времени находиться на уровне эффективной терапевтической концентрации или выше. Таким образом, при достижении свойств замедленного высвобождения лекарственного средства возможно уменьшить количество введений при обеспечении того же или лучшего терапевтического эффекта, потенциально улучшая восприимчивость пациента к проводимому лечению. При наличии свойств замедленного высвобождения лекарственного средства можно избежать быстрого увеличения концентрации лекарственного средства в крови непосредственно после введения, таким образом, потенциально снижая неблагоприятные воздействия, токсичность и т.п. вследствие действия лекарственного средства.
В основном, препараты с замедленным высвобождением, содержащие лекарственное средство, которое является физиологически активным, можно разделить на два типа препаратов: (1) препарат замедленного высвобождения с покрытием, в котором высвобождение лекарственного средства контролируется покрытием поверхности основной частицы или основной таблетки, содержащей физиологически активное лекарственное средство покрытием для замедленного высвобождения; (2) препарат матричного типа, в котором лекарственное средство и основа для замедленного высвобождения равномерно распределены в препарате.
Так как однородность нанесения покрытия в препаратах с покрытием для замедленного высвобождения влияет на высвобождение лекарственного средства, параметры нанесения покрытия для замедленного высвобождения необходимо строго контролировать, и часто производительность является низкой вследствие длительного времени нанесения покрытия. Кроме того, когда покрытие для замедленного высвобождения наносят на гранулы, покрытие для замедленного высвобождения, как правило, наносят после того, как лекарственное средство нанесено на основную частицу, как правило, содержащую кристаллическую целлюлозу или сахарозу. Поэтому, когда наносят несколько слоев покрытия для замедленного высвобождения или когда препарат содержит большое количество лекарственного средства, размер препарата, как правило, бывает большим, затрудняя его пероральное применение.
С другой стороны, препараты матричного типа с замедленным высвобождением обладают структурой, в которой лекарственное средство и основа для замедленного высвобождения равномерно распределены в препарате и не требуют таких строгих условий производства, как препараты с покрытием для замедленного высвобождения, и их можно получать технологией производства, сходной с технологией производства обычных быстрорастворимых препаратов. Таким образом, для препаратов матричного типа с замедленным высвобождением можно ожидать высокой производительности. Кроме того, препарат матричного типа с замедленным высвобождением легко получать, даже если он содержит большое количество лекарственного средства, и размер препарата не обязательно должен быть большим. Таким образом, с точки зрения производительности и меньшего размера препаратов, препараты матричного типа с замедленным высвобождением являются более пригодными, чем препараты с покрытием для замедленного высвобождения.
Однако когда физиологически активное лекарственное средство представляет собой основное лекарственное средство или его соль, при получении препарата матричного типа с замедленным высвобождением с применением водонерастворимого основания, как правило, существуют следующие проблемы:
Первая проблема состоит в том, что в тесте на растворимость препарата матричного типа с замедленным высвобождением, содержащего основное лекарственное средство или его соль, скорость растворения основного лекарственного средства или его соли в основном тестовом растворе по мере растворения, как правило, становится намного меньшей, чем в кислом тестовом растворе. Это происходит вследствие того, что растворимость основного лекарственного средства или его соли в водном растворителе в нейтральном или щелочном диапазоне pH меньше, чем в кислотном диапазоне pH. Вследствие того, что препараты с замедленным высвобождением, как правило, содержат большие количества лекарственного средства, чем количество лекарственного средства в быстрорастворимых препаратах, если время удерживания препарата с замедленным высвобождением в желудке увеличено, существует риск неожиданного увеличения концентрации основного лекарственного средства или его соли в крови и появления побочных эффектов. Риск появления побочных эффектов особенно серьезен в случае основного лекарственного средства или его соли с сильными побочными эффектами и основного лекарственного средства и его соли с узким безопасным диапазоном концентрации в крови.
Второй проблемой является то, что в тесте на растворимость скорость высвобождения основного лекарственного средства или его соли из препарата матричного типа с замедленным высвобождением на поздней стадии растворения меньше, чем на ранней стадии растворения. Если с целью устранения описанной выше первой проблемы (т.е. быстрого увеличения концентрации в крови вследствие длительного времени удерживания лекарственного средства или его соли в желудке) контролируют скорость растворения основного лекарственного средства или его соли из препарата с замедленным высвобождением в кислом тестовом растворе, в случае препарата с замедленным высвобождением с коротким временем выведения из желудка, этот препарат выводится с экскрементами с большинством лекарственного средства, остающимся в препарате, таким образом, уменьшая биодоступность и формируя другой риск того, что не будут достигнуты фармакологически эффективные концентрации.
Это происходит вследствие того, что водонерастворимый матрикс не растворяется в растворе в тесте на растворимость и, следовательно, диффузионная длина в матриксе, которую для высвобождения должно пройти лекарственное средство по мере растворения, становится длиннее. Таким образом, если скорость высвобождения основного лекарственного средства или его соли на ранней стадии растворения замедлять слишком сильно, может существовать повышенный риск того, что препарат матричного типа с замедленным высвобождением будет выводиться с экскрементами из организма с большинством лекарственного средства, остающимся в препарате. Кроме того, так как препарат матричного типа с замедленным высвобождением попадает из желудка в тонкий кишечник, скорость высвобождение лекарственного средства падает, так как окружающий препарат pH становится нейтральным или слабощелочным, таким образом, увеличивая риск того, что этот препарат выводится с экскрементами из организма с большинством лекарственного средства, оставшимся в препарате. Это нежелательно, так как уменьшает биодоступность лекарственного средства и приводит к неопределенности фармакологических эффектов.
К документам, описывающим препараты матричного типа с замедленным высвобождением, содержащим основное лекарственное средство или его соль, относятся следующие документы. Например, в патенте США № 4792452 описан матричный препарат, содержащий основное лекарственное средство или его соль, альгиновую кислоту или ее соль, не зависящее от pH водорастворимое желатинизирующее средство и связывающее средство. Например, в патенте США № 4968508 описан матричный препарат, содержащий цефаклор, полимер акриловой кислоты, растворяющийся при pH от 5,0 до 7,4 и гидрофильный полимер. Например, в японской выложенной патентной заявке № H6-199657 описано, что зависимое от pH растворение лекарственного средства с более высокой растворимостью в уксуснокислом буфере, pH 4,0, чем в 1-й жидкости и 2-й жидкости по японской фармакопее, можно улучшить посредством получения матричных таблеток, содержащих водорастворимый полимер, "карбоксивинильный полимер или сополимер метилвинилового эфира-малеинового ангидрида" и растворимое в кишечнике основание. Например, в патенте США № 6287599 описан матричный препарат, содержащий основное лекарственное средство или его соль с зависящей от pH растворимостью, независящую от pH основу для замедленного высвобождения и зависящую от pH добавку, такую как растворимое в кишечнике основание, органическая кислота и т.п. (что увеличивает скорость растворения лекарственного средства из таблетки при pH, большем 5,5).
Однако эти документы из области изобретения относятся к препаратам матричного типа с замедленным высвобождением, предназначенным только для не зависящего от pH высвобождения лекарственного средства, и их изобретатели необязательно изучали, как устранить или предотвратить указанные выше риски возникновения нежелательных явлений (первая описанная выше проблема) и сниженной биодоступности вследствие свойств замедленного высвобождения (вторая описанная выше проблема). Таким образом, не существует описания препарата, который не только ингибирует растворение основного лекарственного средства или его соли в соответствии со средой в организме так, чтобы происходило подавление начального пика лекарственного средства (быстрое высвобождение лекарственного средства непосредственно после растворения), но также надежно обеспечивает растворение с низкой зависимостью от pH на ранней стадии теста на растворимость, и где по мере растворения на поздней стадии растворения по сравнению с ранней стадией растворения уменьшается отношение скорости растворения основного лекарственного средства или его соли в кислом тестовом растворе к скорости растворения основного лекарственного средства или его соли в нейтральном тестовом растворе (скорость растворения в кислом тестовом растворе/скорость растворения в нейтральном тестовом растворе).
Описание изобретения
Проблемы, которые будут устранены при применении изобретения
Принимая во внимание среду pH в организме, существует потребность в содержащих основное лекарственное средство препаратах с замедленным высвобождением, которые подавляют неожиданные увеличения концентраций в крови, связанные с быстрым растворением основного лекарственного средства из препаратов и которые обеспечивают сниженный риск уменьшенной биодоступности, связанной со свойствами замедленного высвобождения. Таким образом, существует потребность в препарате матричного типа с замедленным высвобождением, содержащем основное лекарственное средство или его соль, который не только подавляет начальный пик лекарственного средства (быстрое высвобождение лекарственного средства непосредственно после растворения) в тесте на растворимость, но также обеспечивает растворение основного лекарственного средства или его соли с низкой зависимостью от pH на ранней стадии растворения, и где по мере прохождения теста на растворимость скорость растворения в нейтральном тестовом растворе на поздней стадии растворения остается высокой. Таким образом, существует потребность в содержащем основное лекарственное средство или его соль препарате матричного типа с замедленным высвобождением, в котором по мере растворения на поздней стадии растворения по сравнению с ранней стадией растворения отношение скорости растворения основного лекарственного средства или его соли в кислом тестовом растворе к скорости растворения основного лекарственного средства или его соли в нейтральном тестовом растворе (скорость растворения в кислом тестовом растворе/скорость растворения в нейтральном тестовом растворе) снижается. В частности, существует потребность в препарате матричного типа с замедленным высвобождением, который способен контролировать растворение основного лекарственного средства или его соли так, чтобы растворимость основного лекарственного средства или его соли с увеличением pH от близкого к нейтральному к слабощелочному сильно снижалась.
Средства устранения проблем
Ввиду этих обстоятельств авторы настоящего изобретения в результате всесторонних исследований обнаружили, что желаемых целей для осуществления настоящего изобретения можно достичь с применением указанной ниже конструкции:
Другими словами, в одном из аспектов настоящего изобретения предоставлен (I) препарат матричного типа с замедленным высвобождением, содержащий (1) основное лекарственное средство или его соль с большей растворимостью в 0,1н. растворе хлористоводородной кислоты и нейтральном водном растворе, pH 6,0, чем в основном водном растворе, pH 8,0; и (2) по меньшей мере, один растворимый в кишечнике полимер. В этом аспекте нейтральный водный раствор представляет собой 50 мМ фосфатный буфер и основной водный раствор представляет собой 50 мМ фосфатный буфер.
Настоящее изобретение также относится к (II) препарату матричного типа с замедленным высвобождением по пункту (I), где в тесте на растворимость в соответствии со способом с применением мешалки по фармакопее Японии для тестов на растворимость, отношение скорости растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты к скорости растворения основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, уменьшается по мере растворения до времени растворения, при котором скорость растворения основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, составляет 90%.
По предпочтительному аспекту настоящего изобретения предоставлен (III) препарат матричного типа с замедленным высвобождением по пунктам (I) или (II), где в тесте на растворимость в соответствии со способом с применением мешалки по фармакопее Японии для тестов на растворимость, скорость растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты при времени растворения 1 час не превышает 60%. Более предпочтительно, скорость растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты при времени растворения 1 час не превышает 50%, а более предпочтительно - не превышает 40%.
По более предпочтительному аспекту настоящего изобретения предоставлен (IV) препарат матричного типа с замедленным высвобождением по любому из пунктов с (I) по (III), где в тесте на растворимость со способом с применением мешалки по фармакопее Японии для теста на растворимость скорость растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты к скорости растворения основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, при времени растворения 3 часа составляет от 0,3 до 1,5. Более предпочтительно отношение скоростей растворения составляет от 0,3 до 1,4, еще более предпочтительно - от 0,3 до 1,3, наиболее предпочтительно от 0,3 до 1,2.
По еще более предпочтительному аспекту настоящего изобретения предоставлен (V) препарат матричного типа с замедленным высвобождением по любому из пунктов от (I) до(IV), где в тесте на растворимость со способом с применением мешалки по фармакопее Японии для теста на растворимость, скорость растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты при времени растворения 1 час не превышает 60%, а отношение скорости растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты к скорости растворения основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, при времени растворения 3 часа составляет от 0,3 до 1,5. Более предпочтительно скорость растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты при времени растворения 1 час не превышает 50%, а отношение скоростей растворения составляет от 0,3 до 1,4, еще более предпочтительно скорость растворения основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты не превышает 40%, а отношение скоростей растворения составляет от 0,3 до 1,2.
Препарат матричного типа с замедленным высвобождением по настоящему изобретению также может содержать, по меньшей мере, один водонерастворимый полимер. Например, настоящее изобретение относится к препарату матричного типа с замедленным высвобождением, содержащему: (1) основное лекарственное средство или его соль с более высокой растворимостью в 0,1н. растворе хлористоводородной кислоты и 50 мМ фосфатном буфере, pH 6,0, чем в 50 мМ фосфатном буфере, pH 8,0; (2) по меньшей мере, один растворимый в кишечнике полимер; и (3) по меньшей мере, один водонерастворимый полимер.
По более предпочтительному аспекту настоящего изобретения предоставлен препарат матричного типа с замедленным высвобождением, содержащий (1) основное лекарственное средство или его соль, в котором растворимость основного лекарственного средства или его соли в нейтральном водном растворе, pH 6,8, по меньшей мере, вдвое больше его растворимости в основном водном растворе, pH 8,0 и не превышает половины его растворимости в нейтральном водном растворе, pH 6,0; и (2) по меньшей мере, один растворимый в кишечнике полимер. Альтернативно препарат матричного типа с замедленным высвобождением также содержит (3) по меньшей мере, один водонерастворимый полимер. По особенно предпочтительному аспекту настоящего изобретения предоставлен препарат матричного типа с замедленным высвобождением, содержащий (1) основное лекарственное средство или его соль, в котором растворимость основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, по меньшей мере, вдвое больше его растворимости в 50 мМ фосфатном буфере, pH 8,0, и не превышает половины его растворимости в 50 мМ фосфатном буфере, pH 6,0; и (2) по меньшей мере, один растворимый в кишечнике полимер. Альтернативно, препарат матричного типа с замедленным высвобождением также содержит (3) по меньшей мере, один водонерастворимый полимер.
По особенно предпочтительному аспекту настоящего изобретения также предоставлен препарат матричного типа с замедленным высвобождением, содержащий (1) основное лекарственное средство или его соль, в котором растворимость основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты и 50 мМ фосфатном буфере, pH 6,0, составляет 1 мг/мл или более, а растворимость основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 8,0, составляет 0,2 мг/мл или менее; (2) по меньшей мере, один растворимый в кишечнике полимер. Альтернативно, препарат матричного типа с замедленным высвобождением также содержит (3) по меньшей мере, один водонерастворимый полимер.
По особенно предпочтительному аспекту настоящего изобретения также предоставлен препарат матричного типа с замедленным высвобождением, содержащий (1) основное лекарственное средство или его соль, в котором растворимость основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты и 50 мМ фосфатном буфере, pH 6,0, составляет 1 мг/мл или более, растворимость основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 8,0, составляет 0,2 мг/мл или менее, а растворимость основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, по меньшей мере, вдвое больше его растворимости в 50 мМ фосфатном буфере, pH 8,0, и не превышает половины его раствримости в 50 мМ фосфатном буфере, pH 6,0; (2) по меньшей мере, один растворимый в кишечнике полимер. Альтернативно, препарат матричного типа с замедленным высвобождением также содержит (3) по меньшей мере, один водонерастворимый полимер.
По особенно предпочтительному аспекту настоящего изобретения также предоставлен препарат матричного типа с замедленным высвобождением, содержащий: (1) основное лекарственное средство или его соль, в котором растворимость основного лекарственного средства или его соли составляет 1 мг/мл или более в 0,1н. растворе хлористоводородной кислоты и 50 мМ фосфатном буфере, pH 6,0, и составляет 0,2 мг/мл или менее в 50 мМ фосфатном буфере, pH 8,0, а растворимость основного лекарственного средства или его соли в 50 мМ фосфатном буфере, pH 6,8, по меньшей мере, вдвое больше его растворимости в 50 мМ фосфатном буфере, pH 8,0, и не превышает половины его растворимости в 50 мМ фосфатном буфере, pH 6,0; и (2) по меньшей мере, один растворимый в кишечнике полимер. Альтернативно, препарат матричного типа с замедленным высвобождением также содержит (3) по меньшей мере, один водонерастворимый полимер.
Благоприятные эффекты по изобретению
По настоящему изобретению в содержащем основное лекарственное средство или его соль препарате матричного типа с замедленным высвобождением с большей растворимостью в 0,1н. растворе хлористоводородной кислоты и нейтральном водном растворе, pH 6,0, чем в основном водном растворе, pH 8,0, снижена зависимость растворения лекарственного средства или его соли от pH на ранней стадии растворения, и при прохождении теста на растворимость отношение скорости растворения лекарственного средства или его соли в кислом тестовом растворе к скорости растворения лекарственного средства или его соли в нейтральном тестовом растворе (скорость растворения в кислом тестовом растворе/скорость растворения в нейтральном тестовом растворе) снижается по мере растворения (отношение становится ниже на поздней стадии, чем на ранней стадии теста на растворимость). Вследствие такого режима растворения можно снизить риск неблагоприятных событий вследствие свойств замедленного высвобождения на ранней стадии растворения, а также можно снизить риск уменьшенной биодоступности. Кроме того, так как 90% или более лекарственного средства, содержащегося в препарате по настоящему изобретению, могут высвободиться в нейтральном тестовом растворе в пределах 8 часов, которые рассчитаны как верхний предел достижения толстого кишечника у людей, риск снижения биодоступности вследствие свойств замедленного высвобождения является небольшим, и полагают, что препараты по настоящему изобретению являются очень полезными. Благоприятные эффекты по настоящему изобретению продемонстрированы ниже.
Краткое описание чертежей
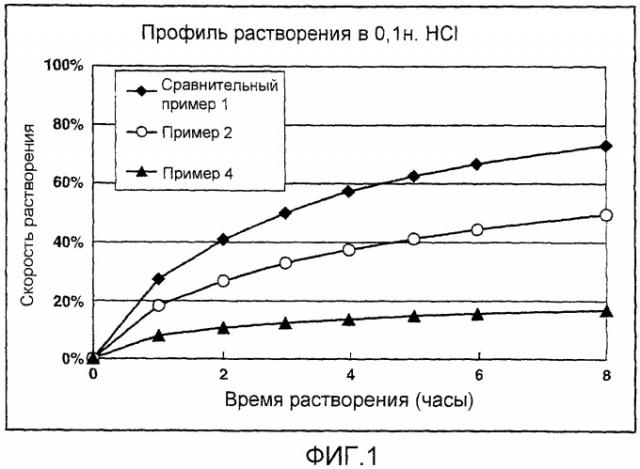
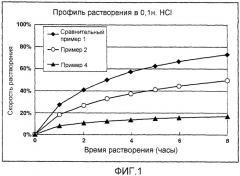
На фигуре 1 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в 0,1н. растворе хлористоводородной кислоты из примеров 2 и 4 по настоящему изобретению (контрольный эксперимент: сравнительный пример 1);
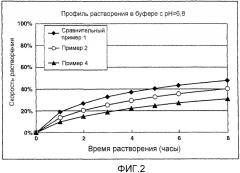
На фигуре 2 показаны результаты профилей растворения гидрохлорида донепезила в матричных препаратах с замедленным высвобождением в 50 мМ фосфатном буфере, pH 6,8, из примеров 2 и 4 по настоящему изобретению (контрольный эксперимент: сравнительный пример 1);
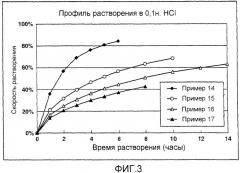
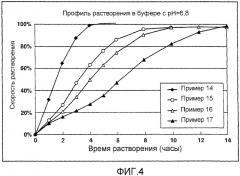
На фигуре 3 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в 0,1н. растворе хлористоводородной кислоты из примеров 14-17 по настоящему изобретению;
На фигуре 4 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в 50 мМ фосфатном буфере, pH 6,8, из примеров 14-17 по настоящему изобретению;
На фигуре 5 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в 0,1н. растворе хлористоводородной кислоты из примеров 12 и 13 по настоящему изобретению (контрольный эксперимент:сравнительный пример 2);
На фигуре 6 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в 50 мМ фосфатном буфере, pH 6,8, из примеров 12 и 13 по настоящему изобретению (контрольный эксперимент:сравнительный пример 2).
На фигуре 7 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в тестовом растворе A и тестовом растворе B из примера 27 по настоящему изобретению.
На фигуре 8 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в тестовом растворе A и тестовом растворе B из примеров 28 и 29 по настоящему изобретению.
На фигуре 9 показаны результаты профилей растворения гидрохлорида донепезила в препаратах матричного типа с замедленным высвобождением в тестовом растворе A и тестовом растворе B из примеров 30 и 31 по настоящему изобретению.
Лучший способ осуществления изобретения
Настоящее изобретение будет подробно описано ниже посредством примеров и сравнительных примеров, но настоящее изобретение не ограничено ими.
Конкретных ограничений на используемое в настоящем изобретении основное лекарственное средство или его соль нет. Например, соль основного лекарственного средства, используемого в настоящем изобретении, может представлять собой соль органической или неорганической кислоты. Примеры соли включают в качестве неограничивающих примеров, гидрохлориды, сульфаты, ацетаты, фосфаты, карбонаты, мезилаты, тартраты, цитраты, тозилаты и т.п. Примеры основного лекарственного средства или его соли, используемых в настоящем изобретении, включают в качестве неограничивающих примеров, лекарственные средства против деменции, такие как гидрохлорид донепезила, гидробромид галантамина, тартрат ривастигмина, гидрохлорид мемантина, такрин и т.п.; противотревожные лекарственные средства, такие как гидрохлорид флуразепама, алпразолам, цитрат тандоспирона, гидрохлорид рилмазафона и т.п.; антигистаминные средства, такие как гидрохлорид дифенилпиралина, малеат хлорфенирамина, циметидин, гидрохлорид изотипендила и т.п.; лекарственные средства, воздействующие на кровеносную систему, такие как гидрохлорид фенилэфрина, гидрохлорид прокаинамида, сульфат хинидина, динитрат изосорбида, никорандил и т.п.; антигипертензивные лекарственные средства, такие как безилат амлодипина, нифедипин, гидрохлорид никардипина, нилвадипин, гидрохлорид атенолола и т.п.; нейролептические лекарственные средства, такие как гидрохлорид пероспирона и т.п.; антибактериальные средства, такие как левофлоксацин и т.п.; антибиотики, такие как цефалексин, гидрохлорид цефкапена-пивоксила, ампициллин и т.п., а также сульфаметоксазол, тетрациклин, метронидазол, индапамид, диазепам, гидрохлорид папаверина, гидрохлорид бромгексина, гидрохлорид тиклопидина, цитрат карбетапентана, гидрохлорид фенилпропаноламина, гидрохлорид цетиризина и другие лекарственные средства и макролидные антибиотики, такие как эритромицин, диритромицин, джозамицин, мидекамицин, китасамицин, рокситромицин, рокитамицин, олеандомицин, миокамицин, флуритромицин, розарамицин, азитромицин, кларитромицин и т.п. В препарате матричного типа с замедленным высвобождением по настоящему изобретению могут содержаться одно или два или более из этих основных лекарственных средств или их солей.
Из этих лекарственных средств или их солей предпочтительны лекарственные средства против деменции, а особенно предпочтительны гидрохлорид донепезила и/или гидрохлорид мемантина. Препарат матричного типа с замедленным высвобождением по настоящему изобретению может подходить для основных лекарственных средств или их солей, которые обладают узким безопасным диапазоном лекарственного средства или которые оказывают неблагоприятные воздействия в зависимости от максимума концентрации лекарственного средства в крови. Конкретных ограничений на лекарственное средство против деменции, содержащееся в препарате матричного типа с замедленным высвобождением по настоящему изобретению, нет, но с точки зрения контролируемого высвобождения он эффективен для основных лекарственных средств или их солей, которые менее растворимы в щелочном водном растворе, чем в кислых водных растворах и растворимость основных лекарственных средств или их солей для pH водного раствора изменяется вблизи нейтрального pH. Примеры включают основные лекарственные средства или их соли с pKa от 7,0 до 12, предпочтительно - от 7,5 до 11, более предпочтительно - от 8,0 до 10,5, еще более предпочтительно - от 8,5 до 10,5. Например, гидрохлорид донепезила представляет собой основное лекарственное средство с pKa 8,90, а гидрохлорид мемантина представляет собой основное лекарственное средство с pKa 10,27.
Конкретных ограничений на растворимость основного лекарственного средства или его соли, используемых в настоящем изобретении, в отношении кислых водных растворов, нейтральных водных растворов или основных водных растворов нет, но растворимость основного лекарственного средства или его соли в кислом водном растворе и нейтральном водном растворе выше, чем их растворимость в основном водном растворе. В настоящем документе для применения в получении этих водных растворах примеры для такого применения включают в качестве неограничивающих примеров фосфатный буфер (например, буферы, полученные с раствором 50 мМ фосфатом натрия и хлористоводородной кислоты), такие буферы как буфер G. L. Miller, буфер Atkins-Pantin, буфер Good или т.п., 0,1н. хлористоводородную кислоту, 0,1 моль/л раствор гидроксида натрия или т.п. Следует отметить, что используемая в настоящем изобретении растворимость относится к растворимости, где температура раствора составляет 25°C.
Используемый в настоящем изобретении термин "растворимость в кислом водном растворе" означает растворимость основного лекарственного средства или его соли в растворе, проявляющем кислотные свойства при растворении основного лекарственного средства или его соли в буфере или т.п. Подобным образом используемый в настоящем изобретении термин "растворимость в нейтральном (основном) водном растворе означает растворимость основного лекарственного средства или его соли в растворе, проявляющем нейтральные (основные) свойства при растворении основного лекарственного средства или его соли в буфере или т.п.
В качестве примера основное лекарственное средство или его соль, используемые в настоящем изобретении, обладают большей растворимостью в кислом водном растворе, pH 3,0, и нейтральном водном растворе, pH 6,0, чем в основном водном растворе, pH 8,0. Используемый в настоящем документе термин "растворимость в кислом водном растворе, pH 3,0" означает растворимость основного лекарственного средства или его соли в кислом растворе с pH 3,0 при растворении основного лекарственного средства или его соли в буфере или т.п. Используемый в настоящем документе термин "растворимость в нейтральном водном растворе, pH 6,0" означает растворимость основного лекарственного средства или его соли в растворе с pH 6,0 при растворении основного лекарственного средства или его соли в буфере или т.п. Подобным образом, используемый в настоящем документе термин "растворимость в основном водном растворе, pH 8,0" означает растворимость основного лекарственного средства или его соли в растворе с pH 8,0 при растворении основного лекарственного средства или его соли в буфере или т.п.
В качестве другого примера основное лекарственное средство или его соль, используемые в настоящем изобретении, обладают большей растворимостью в 0,1н. растворе хлористоводородной кислоты и нейтральном водном растворе, pH 6,0, чем в основном водном растворе, pH 8,0. Используемый в настоящем документе термин "растворимость в 0,1н. растворе хлористоводородной кислоты" означает растворимость основного лекарственного средства или его соли при растворении основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты. Например, растворы гидрохлорида донепезила и гидрохлорида мемантина, которые растворяются в 0,1н. растворе хлористоводородной кислоты, демонстрируют диапазон pH приблизительно от 1 до приблизительно 2.
Предпочтительно основное лекарственное средство или его соль, используемые в настоящем изобретении, обладают растворимостью в 0,1н. растворе хлористоводородной кислоты и нейтральном водном растворе, pH 6,0, более высокой, чем в основном водном растворе, pH 8,0 и растворимостью в нейтральном водном растворе, pH 6,8, по меньшей мере, в два раза больше их растворимости в основном водном растворе, pH 8,0, и не превышающей половины его растворимости в нейтральном водном растворе, pH 6,0. Используемый в настоящем документе термин "растворимость в нейтральном водном растворе, pH 6,8" означает растворимость основного лекарственного средства или его соли в раствор с pH 6,8 при растворении основного лекарственного средства или его соли в буфере или т.п.
Более конкретно, конкретных ограничений нет, пока растворимость основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты и нейтральном водном растворе, pH 6,0, составляет 1 мг/мл или более, растворимость основного лекарственного средства или его соли в основном водном растворе, pH 8,0, составляет 0,2 мг/мл или менее, и растворимость основного лекарственного средства или его соли в нейтральном водном растворе, pH 6,8, в два или более раз больше его растворимости в основном водном растворе, pH 8,0, и не превышает половины его растворимости в нейтральном водном растворе, pH 6,0. Таким образом, растворимость основного лекарственного средства или его соли в 0,1н. растворе хлористоводородной кислоты и нейтральном водном растворе, pH 6,0, конкретно не ограничена, при условии, что указанная выше растворимость составляет 1 мг/мл или более. Указанная выше растворимость, как правило, составляет от 1 до 1000 мг/мл, предпочтительно от 5 до 200 мг/мл, более предпочтительно - от 5 до 100 мг/мл, еще более предпочтительно - от 10 до 80 мг/мл. Растворимость основного лекарственного средства или его соли в основном водном растворе, pH 8,0, конкретно не ограничена, при условии, что указанная выше растворимость составляет 0,2 мг/мл или менее. Указанная выше растворимость, как правило, составляет от 0,0001 до 0,2 мг/мл, предпочтительно - от 0,0005 до 0,1 мг/мл, более предпочтительно - от 0,001 до 0,05 мг/мл, еще более предпочтительно - от 0,002 до 0,03 мг/мл. Кроме того, растворимость основного лекарственного средства или его соли в нейтральном водном растворе, pH 6,8 конкретно не ограничена, при условии, что указанная выше растворимость, по меньшей мере, вдвое больше его растворимости в основном водном растворе, pH 8,0, и не превышает 1/2 растворимости в нейтральном водном растворе, pH 6,0. Указанная выше растворимость предпочтительно, по меньшей мере, в 3 раза больше растворимости в основном водном растворе, pH 8,0, и не превышает 1/3 растворимости в нейтральном водном растворе, pH 6,0, более предпочтительно - по меньшей мере, в 5 раз больше растворимости в основном водном растворе, pH 8,0, и не превышает 1/5 растворимости в нейтральном водном растворе, pH 6,0, еще более предпочтительно - по меньшей мере, в 10 больше растворимости в основном водном растворе, pH 8,0, и не превышает 1/10 растворимости в нейтральном водном растворе, pH 6,0.
В качестве еще одного примера растворимость основного лекарственного средства или его соли, используемых в настоящем изобретении, в 0,1н. растворе хлористоводородной кислоты и 50 мМ фосфатном буфере, pH 6,0, выше, чем их растворимость в 50 мМ фосфатном буфере, pH 8,0. Используемый в настоящем документе термин "рас