Способ продукции 2-амино-3-метил-4-кетопентаноата
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающий следующие стадии: реакции L-изолейцина в водном растворе в присутствии L-изолейциндиоксигеназы и по крайней мере одной 4-гидрокси-L-изолейциндегидрогеназы, выбранной из группы, состоящей из белка, аминокислотная последовательность которого включает последовательность SEQ ID No:6; белка с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью; и белка с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID No:6, и обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью; выделение синтезированного 2-амино-3-метил-4-кетопентаноата. Изобретение позволяет получать 2-амино-3-метил-4-кетопентаноат или его соль с высокой степенью эффективности. 2 н. и 7 з.п. ф-лы, 4 ил, 1 табл.
Реферат
Область техники
Настоящее изобретение относится к микробиологической промышленности и, в частности, к ранее неизвестной дегидрогеназе и способу получения 2-амино-3-метил-4-кетопентаноата или его соли.
Описание предшествующего уровня техники
Поиск микроорганизмов, вырабатывающих вещества, ингибирующие стимулируемый витамином B12 рост Escherichia coli штамма (Davis 113-3) привел к отбору штамма Bacillus cereus, обладающего такой способностью. 2-амино-4-кето-3-метилпентановая кислота была выделена как смесь диастереомеров при ферментации В. cereus 439 и, как обнаружено, является антиметаболитом витамина B12 в системе биоанализа, основанной на использовании штамма Е.coli (Davis 113-3), для роста которого требуется витамин B12. Подобная смесь диастереомеров с биоактивностью была синтезирована при конденсации 2-бром-3-бутанона с натрийдиэтилацетамидомалонатом с последующим гидролизом 6 н. HCl и очисткой методом ионообменной хроматографии. Эффект ингибирования роста антиметаболитами аннулировали витамин B12, L-метионин, L-изолейцин, L-лейцин, L-валин и D-аланин (Perlman D. et al, Bioorganic Chemistry, 6(3), 263-71(1977)).
4-гидрокси-L-изолейцин является аминокислотой, которую можно выделить и очистить из семян пажитника (Trigonella foenum-graecum L. legummosae). 4-гидрокси-L-изолейцин проявляет инсулинотропную активность, представляющую большой интерес, поскольку его стимулирующий эффект четко зависит от концентрации глюкозы в среде, как показано и на выделенной перфузионной поджелудочной железе крыс, и на островках поджелудочной железы человека (Sauvaire, Y. et al, Diabetes, 47: 206-210, (1998)). Такая глюкозная зависимость не подтверждена на сульфонилмочевине (Drucker, D. J., Diabetes 47: 159-169, (1998)), единственном инсулинотропном препарате, используемом в настоящее время для лечения диабета II типа [или диабета, независимого от инсулина-non-insulin-dependent diabetes (NIDD) mellitus (NIDDM)], и в результате гипогликемия является распространенным нежелательным побочным эффектом при лечении сульфонилмочевиной (Jackson, J., and Bessler, R. Drugs, 22: 211-245; 295-320, (1981); Jennings, A. et al. Diabetes Care, 12: 203-208, (1989)). Повышение глюкозной толерантности также известно (Am. J. Physiol. Endocrinol., Vol.287, E463-E471, 2004). Сообщено об этом повышении активности глюкометаболизма и его потенциальном применении в фармацевтике и здоровом питании (выложенная патентная заявка Японии No. Hei 6-157302, заявка США US 2007-000463A1).
Однако в настоящее время отсутствуют сообщения о клонировании какой-либо 4-гидрокси-L-изолейциндегидрогеназы и продукции 2-амино-3-метил-4-кетопентаноата из L-изолейцина с использованием L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы.
Описание изобретения
Целью настоящего изобретения является продукция 2-амино-3-метил-4-кетопентаноата (используемое обозначение включает в себя как свободную форму, так и его соли, может использоваться аббревиатура "АМКР"(от 2-amino-3-methyl-4-ketopentanoate), в дальнейшем обозначает то же самое), предоставить способ производства АМКР из L-изолейцина с использованием L-изолейциндиоксигеназы (IDO, L-isoleucine dioxygenase) и 4-гидрокси-L-изолейциндегидрогеназы (HIDH, 4-hydroxy-L-isoleucine dehydrogenase) или бактерии, обладающей активностью L-изолейциндиоксигеназы и активностью 4-гидрокси-L-изолейциндегидрогеназы. А именно, цели настоящего изобретения включают предоставление новой 4-гидрокси-L-изолейциндегидрогеназы и ДНК, кодирующей 4-гидрокси-L-изолейциндегидрогеназу, и способ продукции АМКР из L-изолейцина с использованием L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы. Вышеуказанные цели были достигнуты путем обнаружения новой 4-гидрокси-L-изолейциндегидрогеназы настоящего изобретения.
Более детально настоящее изобретение описано ниже.
Целью настоящего изобретения является предоставление ДНК, выбранной из группы, состоящей из:
(a) ДНК, включающая нуклеотидную последовательность SEQ ID No:5;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID No:5, и кодирующая белок, обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
(c) ДНК, кодирующая белок, включающий аминокислотную последовательность SEQ ID No:6;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, включающей замену, делению, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Также целью настоящего изобретения является предоставление рекомбинантной ДНК, полученной лигированием вышеописанной ДНК с векторной ДНК. Также целью настоящего изобретения является предоставление клетки, трансформированной вышеописанной рекомбинантной ДНК.
Также целью настоящего изобретения является предоставление способа получения белка, обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью, включающего: культивирование вышеописанной клетки в питательной среде и накопление белка, обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью, в питательной среде или/и клетке.
Также целью настоящего изобретения является предоставление белка, выбранного из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Также целью настоящего изобретения является предоставление способа продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающего стадии:
реакции L-изолейцина в водном растворе в присутствии L-изолейциндиоксигеназы и по крайней мере одной 4-гидрокси-L-изолейциндегидрогеназы, выбранной из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
выделение синтезированного 2-амино-3-метил-4-кетопентаноата.
Также целью настоящего изобретения является предоставление способа продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающего стадии:
реакции L-изолейцина в водном растворе в присутствии бактерии, содержащей L-изолейциндиоксигеназу и по крайней мере одну 4-гидрокси-L-изолейциндегидрогеназу, выбранную из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
выделения синтезированного 2-амино-3-метил-4-кетопентаноата.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия модифицирована с целью увеличения активности 4-гидрокси-L-изолейциндегидрогеназы.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия модифицирована с целью увеличения активности L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что активность белка увеличена путем усиления экспрессии гена, кодирующего указанный белок.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что экспрессия гена усилена путем модификации последовательности, контролирующей экспрессию гена, кодирующего белок, или увеличения числа копий гена, кодирующего белок.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия принадлежит к роду Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus или Bacillus.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия принадлежит к Escherichia coli, Arthrobacter simplex, Corynebacterium glutamicum, Arthrobactor globiformis, Arthrobactor sulfureus, Arthrobactor viscosus или Bacillus subtilis.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия - бактериальная культура, клетки, обработанные клетки или клеточный лизат.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
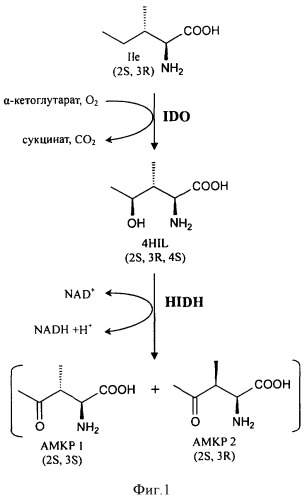
На Фиг.1 показан предполагаемый путь синтеза АМКР в Bacillus thuringiensis.
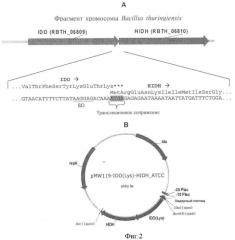
На Фиг.2 показаны: А - Согласование трансляции IDO (RBTH_06809) с трансляцией HIDH (RBTH_06810) с использованием "ATGA" трансляционного сопряжения; В - Структура сконструированной рекомбинантной плазмиды, содержащей IDO-HIDH оперон.
На Фиг.3 показан результат выравнивания аминокислотных последовательностей HIDH Bacillus thuringiensis serovar israelensis ATCC 35646 (ZP_00738909), короткоцепочечной дегидрогеназы/редуктазы SDR Bacillus weihenstephanensis KBAB4 (ZP_01182591), 3-оксоацил-[ацил-переносящий белок]-редуктазы Bacillus cereus ATCC 14579 (NP_830848), гипотетического белка GOS_9257808 [метагеном морского вида] (ЕВН46681) и 3-оксоацил-[ацил-переносящий белок]-редуктазы Pseudomonas syringae pv. phaseolicola 1448A(YP_276118).
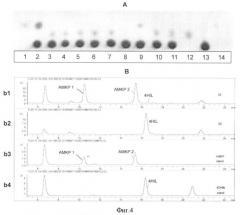
На Фиг.4 показана биоконверсия изолейцина в АМКР с использованием штама Е.coli, обладающего активностями IDO и HIDH. А - ТСХ анализ продукции АМКР. Дорожки: 1, 14 - стандартный 4HIL; 12 - стандартный АМКР; 13 - стандартный Ile; 2 - культуральная жидкость штамма TG1 [pMW119-IDO (2-е-2)]; 3-7 - культуральная жидкость штаммов TG1 [pMW119-IDO-HIDH (2-е-2)] (пять независимых клонов); 8 - культуральная жидкость штамма TG1 [pMW119]; 9- культуральная жидкость штамма TG1 [pMW119-IDO(VKPM В-197)]; 10-11 - культуральная жидкость штаммов TG1 [pMW119-IDO-HIDH (VKPM В-197)] (два независимых клона). В - ВЭЖХ анализ продукции АМКР. b1 - культуральная жидкость штамма TG1 [pMW119-IDO-HIDH (2-е-2)]; b2 - культуральная жидкость штамма TG1 [pMW119-IDO (2-е-2)]; b3 - стандартный АМКР; b4 - стандартный 4HIL.
ПОДРОБНОЕ ОПИСАНИЕ НАИЛУЧШЕГО СПОСОБА ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем изобретении "2-амино-3-метил-4-кетопентаноат" или "АМКР" относится к отдельному(ым) химическому(им) соединению(ям) (2S,3S)-2-амино-3-метил-4-кетопентаноату или/и (2S,3R)-2-амино-3-метил-4-кетопентаноату или смеси, содержащей (2S,3S)-2-амино-3-метил-4-кетопентаноат или/и (2S,3R)-2-амино-3-метил-4-кетопентаноат.
В настоящем изобретении термин "(2S,3R,4S)-4-гидрокси-L-изолейцин" или "(2S,3R,4S)-4HIL" относится к отдельному химическому соединению или смеси, содержащей (2S,3R,4S)-4-гидроксиизолейцин.
Термин "бактерия", как он используется в настоящем описании, включает образующую фермент бактерию, мутант и генетический рекомбинант такой бактерии, в которой существует или увеличена целевая ферментативная активность, и т.п.
Авторы настоящего изобретения получили АМКР как побочный продукт при продукции (2S,3R,4S)-4HIL. Основываясь на экспериментальных данных, изобретатели предположили предполагаемый путь синтеза АМКР (Фиг.1). Он включает гидроксилирование изолейцина L-изолейциндиоксигеназой (IDO) и последующее окисление полученного (2S,3R,4S)-4HIL специфической 4-гидроксиизолейциндегидро-геназой (HIDH). Анализ генома Bacillus thuringiensis показал, что трансляция гена IDO (RBTH_06809) сопряжена с трансляцией следующего за ним гена RBTH_06810 (Фиг.2). Обычно такая "синхронизация " используется для эквимолярного синтеза ферментов, катализирующих последовательные реакции. Более того, RBTH_06810 кодирует гомолог 3-оксоацил-[ацил-переносящий белок] редуктазы (дегидрогеназы). Поэтому предположили, что этот ген кодирует HIDH.
Далее предоставляется детальное описание [I] L-изолейциндиоксигеназы, [II] 4-гидрокси-L-изолейциндегидрогеназы, [III] способа получения 2-амино-3-метил-4-кетопентаноата из L-изолейцина с использованием L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы настоящего изобретения со ссылкой на соответствующие рисунки.
[I] L-изолейциндиоксигеназа
Согласно исследованиям, проведенным изобретателями настоящего изобретения, было подтверждено, что бактериальные штаммы рода Bacillus содержат L-изолейциндиоксигеназу, обладающую способностью образовывать (2S,3R,4S)-4HIL. L-изолейциндиоксигеназа из микробных клеток в дальнейшем обозначается как аббревиатура IDO.
(1) ДНК, кодирующая L-изолейциндиоксигеназу
ДНК, кодирующая IDO штамма Bacillus thuringiensis 2-e-2 (FERM BP-10688) настоящего изобретения показана в Перечне последовательностей под номером SEQ ID No:1. Кроме того, аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:1, показана в SEQ ID No:2. SEQ ID NO:2 - аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:1. IDO с последовательностью SEQ ID NO:2 обладает L-изолейциндиоксигеназной активностью и катализирует реакцию, в которой (2S,3R,4S)-4HIL образуется в результате прямого синтеза из одной молекулы L-изолейцина.
ДНК, кодирующая IDO штамма Bacillus thuringiensis (serovar israelensis) (ATCC 35646) настоящего изобретения, которая идентифицируется, как упомянуто в разделе Примеры, показана в Перечне последовательностей под номером SEQ ID No:3. Кроме того, аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:3, показана в SEQ ID No:4. SEQ ID NO:4 - аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:3. IDO с последовательностью SEQ ID NO:4 обладает L-изолейциндиоксигеназной активностью и катализирует реакцию, в которой (2S,3R,4S)-4HIL образуется в результате прямого синтеза из одной молекулы L-изолейцина.
ДНК, кодирующая IDO, катализирующую реакцию, в которой (2S,3R,4S)-4HIL образуется из L-изолейцина, - не только ДНК, показанные в SEQ ID No:1 и SEQ ID No:3. Это связано с различиями в нуклеотидных последовательностях, наблюдающихся для каждого вида и штамма среди видов Bacillus, которые образуют IDO, катализирующую реакцию образования (2S,3R,4S)-4HIL из L-изолейцина.
ДНК настоящего изобретения не только включает выделенные ДНК, кодирующие IDO, но ДНК, в которых в ДНК, кодирующей IDO, выделенной из хромосомной ДНК IDO-продуцирующих микроорганизмов, искусственно введены мутации, также включены в ДНК настоящего изобретения при условии, что ДНК кодирует IDO с активностью, катализирующей указанную реакцию. Методы для искусственного введения мутаций включают обычно используемые методы, такие как метод для введения сайт-специфических мутаций, описанных в Method, in Enzymol., 154 (1987).
ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:1 или SEQ ID No:3, кодирующая белок, обладающий активностью IDO, также включена в ДНК настоящего изобретения. Как используется здесь, термин "жесткие условия" означает такие условия, при которых специфические гибриды образуются, тогда как неспецифические гибриды не образуются. Хотя количественное описание этих условий является затруднительным, в качестве примера можно сослаться на условия, при которых молекулы ДНК, имеющие более высокую гомологию, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90% и особенно предпочтительно не менее 95% или более, гибридизуются друг с другом, тогда как молекулы ДНК, имеющие более низкую гомологию, не гибридизуются друг с другом, или такие условия, при которых гибридизация имеет место при обычных условиях отмывки во время проведения гибридизации по Саузерну, которая проводится при концентрации солей, 0.1×SSC, 0.1% SDS при температуре 37°С, предпочтительно 0.1×SSC, 0.1% SDS при температуре 60°С, и более предпочтительно 0.1×SSC, 0.1% SDS при температуре 65°С. Длина зонда может быть выбрана соответствующим образом в зависимости от условий гибридизации и обычно варьирует от 100 п.о. до 1 тыс. п.о. Кроме того, определения "L-изолейциндиоксигеназная активность" может быть достаточно для активности, которая синтезирует (2S,3R,4S)-4HIL из L-изолейцина. Однако в случае, если нуклеотидная последовательность гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:1 или SEQ ID No:3, она предпочтительно сохраняет L-изолейциндиоксигеназную активность величиной 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более, и еще более предпочтительно 70% или более, относительно белка с аминокислотной последовательностью SEQ ID No:2 или SEQ ID No:4 в условиях 37°С и pH 8.
L-изолейциндиоксигеназная активность IDO может быть определена путем анализа образования (2S,3R,4S)-4HIL из L-изолейцина с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) (см. Примеры 3 и 4).
Кроме того, ДНК, кодирующая белок, по существу идентичный IDO, кодируемой ДНК SEQ ID No:1 и SEQ ID No:3, также включена в ДНК настоящего изобретения. А именно, следующие ДНК также включены в настоящее изобретение:
(a) ДНК, включающая нуклеотидную последовательность SEQ ID No:1 или SEQ ID No:3;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:1 или SEQ ID No:3, и кодирующая белок, обладающий L-изолейциндиоксигеназной активностью;
(c) ДНК, кодирующая белок, включающий аминокислотную последовательность SEQ ID No:2 или SEQ ID No:4;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, которая содержит замену, делецию, вставку, добавление или инверсию одной или нескольких аминокислот в последовательности SEQ ID No:2 или SEQ ID No:4, и обладающий L-изолейциндиоксигеназной активностью; и
(е) ДНК, кодирующая белок с аминокислотной последовательностью, гомологичной по крайней мере на 70%, предпочтительно гомологичной по крайней мере на 80%, более предпочтительно гомологичной по крайней мере на 90% и еще более предпочтительно гомологичной по крайней мере на 95% аминокислотной последовательности SEQ ID NO:2 или SEQ ID No:4, и обладающий L-изолейциндиоксигеназной активностью.
Здесь "один или несколько" означает диапазон, вне которого стереоизомерия аминокислотных остатков белка или активность L-изолейциндиоксигеназы изменяется незначительно и, в частности, соответствует значениям от 1 до 20, предпочтительно от 1 до 15, более предпочтительно от 1 до 10 и еще более предпочтительно от 1 до 5.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную(ые) мутацию(и) при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) является(ются) консервативная(ые) замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ilе на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, He или Leu.
(2) Способ получения L-изолейциндиоксигеназы
Предоставляется описание способа получения IDO настоящего изобретения. Существует два способа получения IDO настоящего изобретения. Они состоят из (i) способа культивирования IDO-продуцирующего микроорганизма для образования и накопления IDO, и (ii) способа конструирования трансформанта для образования IDO с использованием технологии рекомбинантной ДНК и культивирования трансформантов для накопления IDO.
Оба способа могут быть осуществлены таким же образом, как описано ниже в [II] (3).
[II] 4-гидрокси-L-изолейциндегидрогеназа
Согласно исследованиям изобретателей настоящего изобретения, было подтверждено, что бактериальные штаммы содержат 4-гидрокси-L-изолейциндегидрогеназу, обладающую способностью образовывать (2S,3S)-2-амино-3-метил-4-кетопентаноат или/и (2S,3R)-2-амино-3-метил-4-кетопентаноат из (2S,3R,4S)-4HIL, образованного из L-изолейцина благодаря активности IDO в бактерии, принадлежащей к роду Bacillus. 4-гидрокси-L-изолейциндегидрогеназа из микробных клеток в дальнейшем обозначается как аббревиатура HIDH.
ДНК, кодирующая HIDH штамма Bacillus thuringiensis serovar israelensis (ATCC 35646)
(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=genome&cmd=Retrieve&dopt=Overview&list_uids=5343) показана в Перечне последовательностей под номером SEQ ID No:5. Кроме того, аминокислотная последовательность HIDH, кодируемой нуклеотидной последовательностью SEQ ID NO:5, показана в SEQ ID No:6. SEQ ID NO:6 - аминокислотная последовательность HIDH, кодируемой нуклеотидной последовательностью SEQ ID NO:5. HIDH с последовательностью SEQ ID NO:6 обладает 4-гидрокси-L-изолейциндегидрогеназной активностью и катализирует реакцию, в которой АМКР образуется в результате прямого синтеза из (2S,3R,4S)-4HIL.
Далее предоставляется детальное описание (1) ДНК, кодирующей 4-гидрокси-L-изолейциндегидрогеназу, (2) свойства 4-гидрокси-L-изолейциндегидрогеназы и (3) способа получения 4-гидрокси-L-изолейциндегидрогеназы в указанном порядке.
(1) ДНК, кодирующая 4-гидрокси-L-изолейциндегидрогеназу
Ген HIDH настоящего изобретения, имеющий нуклеотидную последовательность SEQ ID No:5, был выделен из хромосомной ДНК штамма Bacillus thuringiensis (serovar israelensis) (ATCC 35646), полученного во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) и хранящегося под инвентарным номером VKPM В-197, как описано в разделе Примеры. Амнокислотная последовательность HIDH, кодируемой нуклеотидной последовательностью SEQ ID NO:5, показанная в SEQ ID No:6, демонстрирует высокую степень гомологии с аминокислотной последовательностью (Фиг.3) 3-оксоацил-[ацил-переносящий белок] редуктазы Bacillus thuringiensis serovar israelensis (ATCC 35646), короткоцепочечной дегидрогеназы/редуктазы SDR Bacillus weihenstephanensis KBAB4, 3-оксоацил-[ацил-переносящий белок] редуктазы Bacillus cereus (ATCC 14579), гипотетического белка GOS_9257808 метагенома морского вида 3-оксоацил-[ацил-переносящий белок] редуктазы Pseudomonas syringae pv. phaseolicola 1448A.
Фрагмент ДНК, кодирующий IDO, может быть получен в ПЦР с использованием предназначенных для этого праймеров, сконструированных на основе последовательности штамма Bacillus thuringiensis (serovar israelensis) (ATCC 35646).
Процедура ПЦР описана в публикациях, таких как White, T.J. et al., Trends Genet. 5, 185 (1989). Метод выделения хромосомной ДНК так же, как метод выделения необходимых молекул ДНК из библиотеки генов с использованием молекул ДНК в качестве зондов, описан в публикациях, таких как Molecular Cloning, 3rd edition, Cold Spring Harbor Laboratory Press (2001).
Метод определения нуклеотидной последовательности изолированной ДНК, кодирующей HIDH, описан в Practical Guide to Molecular Cloning, John Wiley & Sons, Inc. (1985). Кроме того, нуклеотидная последовательность может быть определена с помощью ДНК-Секвенатора, предлагаемого фирмой Applied Biosystems (США). Нуклеотидная последовательность, кодирующая HIDH штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197), показана в SEQ ID No:5.
ДНК, кодирующая HIDH, катализирующий реакцию, в которой АМКР образуется из (2S,3R,4S)-4HIL, не только ДНК, показанная в SEQ ID No:5. Это связано с различиями в нуклеотидных последовательностях, наблюдающихся для каждого вида и штамма среди видов Bacillus, которые образуют HIDH, катализирующую реакцию образования АМКР из (2S,3R,4S)-4HIL.
ДНК настоящего изобретения включает не только выделенную ДНК, кодирующую HIDH, но ДНК, в которой в ДНК, кодирующую HIDH, выделенную из хромосомной ДНК HIDH-продуцирующего микроорганизма, искусственно введены мутации, также включена в ДНК настоящего изобретения, при условии что она кодирует HIDH, катализирующую указанную реакцию. Методы для искусственного введения мутаций включают обычно используемые методы, такие как метод для введения сайт-специфических мутаций, описанных в Method, in Enzymol., 154 (1987).
ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:5, кодирующая белок, обладающий активностью HIDH, также включена в ДНК настоящего изобретения. Кроме того, определения "4-гидрокси-L-изолейциндегидрогеназная активность" может быть достаточно для активности, которая синтезирует АМКР из (2S,3R,4S)-4HIL. Однако в случае, если нуклеотидная последовательность гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:5, она предпочтительно сохраняет 4-гидрокси-L-изолейциндегидрогеназную активность величиной 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, относительно белка с аминокислотной последовательностью SEQ ID No:6 в условиях 37°С и pH 8.
4-гидрокси-L-изолейциндегидрогеназная активность HIDH может быть определена путем анализа образования АМКР из (2S,3R,4S)-4HIL с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) (см. Примеры 3 и 4).
Кроме того, ДНК, кодирующая белок, по существу идентичный HIDH, кодируемой ДНК SEQ ID No:5, также включен в ДНК настоящего изобретения. А именно, следующие ДНК также включены в настоящее изобретение:
(a) ДНК, включающая нуклеотидную последовательность SEQ ID No:5;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:5 и кодирующая белок, обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
(c) ДНК, кодирующая белок, включающий аминокислотную последовательность SEQ ID No:6;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, которая содержит замену, делецию, вставку, добавление или инверсию одной или нескольких аминокислот в последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, гомологичной по крайней мере на 70%, предпочтительно гомологичной по крайней мере на 80%, более предпочтительно гомологичной по крайней мере на 90% и еще более предпочтительно гомологичной по крайней мере на 95% аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Здесь "один или несколько" означает диапазон, вне которого стереоизомерия аминокислотных остатков белка или активность 4-гидрокси-L-изолейциндегидрогеназы изменяется незначительно и, в частности, соответствует значениям от 1 до 78, предпочтительно от 1 до 52, более предпочтительно от 1 до 26 и еще более предпочтительно от 1 до 13.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную(ые) мутацию(и) при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, He или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, He или Leu.
Кроме того, термин "4-гидрокси-L-изолейциндегидрогеназа" относится к активности, которая обеспечивает синтез АМКР из (2S,3R,4S)-4HIL, как описано выше. Однако в случае, если аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в последовательности SEQ ID No:6, она предпочтительно сохраняет 4-гидрокси-L-изолейциндегидрогеназную активность в размере 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более относительно белка с аминокислотной последовательностью SEQ ID No:6 в условиях 30°С и pH 7.0. 4-гидрокси-L-изолейциндегидрогеназная активность HIDH настоящего изобретения может быть определена анализом образования АМКР из (2S,3R,4S)-4HIL с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ).
Кроме того, ДНК, гомологичная SEQ ID NO:5, может использоваться в качестве гена, кодирующего 4-гидрокси-L-изолейциндегидрогеназу настоящего изобретения. Кодирует ли гомологичная ДНК 4-гидрокси-L-изолейциндегидрогеназу может быть подтверждено определением 4-гидрокси-L-изолейциндегидрогеназы в лизате клеток или в лизате клеток микроорганизма, в котором сверхэкспрессируется гомологичная ДНК.
ДНК, гомологичная SEQ ID NO:5, также может быть получена из генома других видов Bacillus, например. Bacillus cereus. Bacillus weihenstephanensis как кодирующая 4-гидрокси-L-изолейциндегидрогеназу настоящего изобретения. Результат выравнивания аминокислотных последовательностей Bacillus cereus. Bacillus thuringiensis, Bacillus weihenstephanensis показан на Фиг.3.
(2) Свойства HIDH
Далее предоставляется описание свойств очищенной 4-гидрокси-L-изолейциндегидрогеназы из штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPMB-197) (HIDH).
HIDH настоящего изобретения имеет аминокислотную последовательность SEQ ID No:6, что четко определено выделением и анализом гена. Однако настоящее изобретение включает белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в SEQ ID No:6, который также имеет 4-гидрокси-L-изолейциндегидрогеназную активность. А именно, HIDH настоящего изобретения включает следующие белки:
(f) белок, включающий аминокислотную последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одной или нескольких аминокислот в последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок, имеющий по крайней мере 70% гомологии, предпочтительно по крайней мере 80% гомологии, более предпочтительно по крайней мере 90% гомологии и еще более предпочтительно по крайней мере 95% гомологии с аминокислотной последовательностью SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Здесь определения "несколько" и "4-гидрокси-L-изолейциндегидрогеназа" такие же, как определено в секции (1), ДНК, кодирующая 4-гидрокси-L-изолейциндегидрогеназу.
HIDH настоящего изобретения катализирует реакцию синтеза АМКР из (2S,3R,4S)-4HIL путем ферментативной реакции дегидрогенирования.
4-гидрокси-L-изолейциндегидрогеназная активность HIDH настоящего изобретения может быть определена путем анализа образования АМКР из (2S,3R,4S)-4HIL с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ).
HIDH штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197) имеет аминокислотную последовательность SEQ ID NO:6.
(3) Способ получения 4-гидрокси-L-изолейциндегидрогеназы
Далее предоставляется описание способа получения HIDH настоящего изобретения. Существует два способа получения HIDH настоящего изобретения. Они состоят из (i) способа культивирования HIDH-продуцирующего микроорганизма для образования и накапливания HIDH, и (ii) способа получения трансформанта для образования HIDH с использованием техники рекомбинантных ДНК и культивирования трансформанта для накапливания HIDH.
(i) Способ образования и накапливания HIDH путем микробного культивирования
Примеры микроорганизмов, служащих источником получения HIDH в процессе образования и накопления HIDH при культивировании HIDH-продуцирующих микроорганизмов, включают микроорганизмы, принадлежащие к родам Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus или Bacillus.
В настоящем изобретении может использоваться любой микроорганизм, принадлежащий к роду Bacillus, Escherichia, Corynebacterium, Arthrobacter, Aspergillus, Pseudomonas, Granulibacter, Methylobacillus, Granulibacter, Acidiphilium, Agrobacterium, Gluconobacter, Caulobacter, Stigmatella, Myxococcus, Polaromonas, Caulobacter, Polaromonas, Sphingomonas, Acidovorax, Mycobacterium, Azotobacter, Vibrio, Polynucleobacter, Streptomyces при условии, что он образует HIDH, катализирующий реакцию синтеза АМКР из (2S,3R,4S)-4HIL, и предпочтительно микроорганизмы включают штамм Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197) и штамм Bacillus thuringiensis 2-е-2. Среди них особенно предпочтителен штамм Bacillus thuringiensis 2-e-2.
Хотя микроорганизм, служащий источником получения HIDH, может быть культивирован в любой форме, такой как культивирование на жидких и плотных средах, для культивирования в промышленных масштабах предпочтителен метод культивирования с интенсивным аэрированием путем перемешивания. В качестве питательных элементов питательной среды могут использоваться источники углерода, источники азота, неорганические кислоты и другие питательные элементы, обычно используемые при культивировании микроорганизмов. Все источники питательных веществ могут использоваться до тех пор, пока штамм микроорганизма их утилизирует.
Культивирование проводится в аэробных условиях при встряхивании, глубоком вентилировании путем перемешивания и т.п. Температура культивирования может быть в пределах значений, при которых растут микроорганизмы и образуется HIDH. Таким образом, хотя условия не жесткие, температура культивирования обычно от 10 до 50°С и предпочтительно от 15 до 42°С. Время культивирования варьируется в соответствии с другими условиями культивирования. Например, микроорганизмы могут культивироваться до достижения максимального уровня продукции HIDH, это обычно составляет от 5 часов до 7 дней, предпочтительно от 10 часов до 96 часов.
После культивирования микробные клетки отделяются центрифугированием (например, при 10,000×g в течение 10 минут). Так как HIDH в основном находится в клетках, HIDH солюбилизируют путем разрушения или лизиса микробных клеток. Для разрушения микробных клеток может использоваться разрушение ультразвуком, разрушение с использованием French press или разрушение с использованием стеклянных шариков. Для лизиса клеток выбирается метод с использованием лизоцима яичного белка, обработка пептидазой или подходящая комбинация методов.
Когда HIDH из HIDH-продуцирующего организма очищают, хотя HIDH очищают с использованием растворяющего фермент раствора для исходного материала, если остаются неразрушенные или нелизированные остатки, для очистки предпочтительно повторное центрифугирование раствора и удаление осадка.
Для очистки HIDH можно использовать все широко используемые методы очистки обычных ферментов, примеры которых включают осаждение сульфатом аммония, гель-фильтрацию, ионообменную хроматографию, гидрофобную хроматографию и гидроксиапатитовую хроматографию. В результате может быть получена HIDH - содержащая фракция с более высокой специфической активностью.
(ii) Способ продукции с использованием технологии рекомбинантной ДНК
Далее предоставляется описание способа получения HIDH с использованием технологии рекомбинантной ДНК. Существует множество известных примеров получения полезных белков, таких как ферменты и физиологически активные вещества, с использованием технологии рекомбинантной ДНК, и технология рекомбинантной ДНК делает возможным получение в большом количестве полезных белков, в природе присутствующих только в очень малых количествах.
Сначала готовится ДНК, кодирующая HIDH настоящего изобретения.
Затем приготовленную ДНК лигируют с векторной ДНК для получения рекомбинантной ДНК и клетки трансформируют рекомбинантной ДНК для получения трансформантов. Затем трансформанты культивируют в питательной среде для образования HIDH и его накопления в среде или/и клетках.
Затем процесс переходит в стадию, на которой получают очищенный HIDH путем выделения и очистки фермента.
Требуемый АМКР можно получить в большом количестве с использованием очищенной HIDH или среды или/и клеток, в которой/ых накоплена HIDH.
ДНК, которая лигирована с векторной ДНК, может обеспечить экспрессию HIDH настоящего изобретения.
Здесь примеры генов HIDH, лигированных в векторную ДНК, включают ДНК, ранее описанную в [II].
В случае крупномасштабного производства белка с