Новые гликолипидные адъювантные композиции
Иллюстрации
Показать всеИзобретение относится к медицине и касается композиции и способа изготовления стабильных исходных адъювантных растворов, содержащих гликолипиды, слабые кислоты, спирты, неионные поверхностно-активные вещества и буферы. Изобретение обеспечивает улучшенную стабильность адъювантной гликолипидной композиции. 5 н. и 10 з.п. ф-лы, 16 табл.
Реферат
Настоящее изобретение относится к новым композициям гликолипидных адъювантов, способам их применения и их приготовлению. Новые композиции по настоящему изобретению стабильны в течение длительного периода времени без флокуляции. Они особенно полезны при доставке различных лекарственных средств, включая вакцины.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Обычно вакцины используют для защиты людей и домашних животных от инфекционных заболеваний, вызываемых бактериями, вирусами и микроорганизмами-паразитами. Применяемые в вакцинах антигены могут представлять собой любую разновидность агентов, но обычно состоят из убитых патогенных микроорганизмов, патогенных микроорганизмов, остающихся живыми, но которые модифицированы или аттенуированы, белков, рекомбинантных белков или их фрагментов. Каков бы ни был источник антигена, зачастую необходимо добавить адъювант, чтобы усилить иммунный ответ реципиента на антиген.
Адъюванты используют для достижения двух целей: они замедляют высвобождение антигенов из места инъекции и стимулируют иммунную систему.
Первым адъювантом, о котором сообщалось в литературе, был полный адъювант Фрейнда (FCA). FCA содержит эмульсию типа вода-в-масле и экстракты микобактерии. Микобактериальные экстракты являются источником иммуностимулирующих молекул в неочищенной форме. Эмульсия типа вода - в - масле действует, создавая эффект депо, из которого антигены медленно высвобождаются. К сожалению, FCA обладает плохой переносимостью и может вызывать неконтролируемое воспаление. С момента открытия FCA, свыше 80 лет назад, предпринимаются попытки уменьшения нежелательных побочных эффектов адъювантов.
В настоящее время известны гликолипидные аналоги, включающие новый класс соединений, имеющих адъювантные свойства. В патенте США №4855283 (далее ′283) раскрыт синтез гликолипидных аналогов, включая N-гликозиламиды, N-гликозилмочевины, N-гликозилкарбаматы и, конкретно, ацетат N-(2-дезокси-2-L-лейциламино-β-D-глюкопиранозил)-N-октадецил- додеканамида (известный как Bay R1005, О Lockhoff, Angew. Chem. Int. Ed. Engl. (1991) 30: 1611-1620). Соединения, описанные в патенте 283, особенно подходят для применения в качестве адъювантов.
Необходимо, чтобы приготовление гликолипидных адъювантных композиций не вызывало затруднения и чтобы они были стабильны при хранении в течение продолжительных периодов времени без флокуляции липидного компонента. Неацетатные формы гликолипидамидов или гликозиламидов в значительной мере нерастворимы и обычно флокулируют из раствора при хранении их как при комнатной температуре, так и при более низких температурах.
Растворы и адъюванты, содержащие гликозиламиды, предложенные в данном описании, демонстрируют низкую степень флокуляции и совершенно стабильны. Их приготовление не вызывает затруднения, и они могут быть получены в промышленном масштабе. Жидкие гликолипидные адъювантные композиции можно использовать в качестве разбавителя для повторного гидратирования лиофилизированного антигенного препарата. Также предложены способы тестирования стабильности этих композиций в реальном времени с использованием протоколов ускоренного тестирования стабильности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное изобретение включает композицию и способ получения или приготовления как исходного раствора гликозиламида, так и раствора гликолипидного адъюванта. Исходный раствор гликозиламида приготавливают путем растворения гликолипида формулы I в спирте и комбинирования его с соответствующим количеством слабой кислоты и "неионным" поверхностно-активным веществом. Слабую кислоту добавляют к спиртовому раствору гликолипида в молярном избытке слабой кислоты по отношению к гликолипиду. В одном воплощении гликолипид представляет собой гидроацетат N-(2-дезокси-2-L-лейциламино-β-D-глюкопиранозил)-N-октадецилдодеканоиламида. В одном воплощении спиртом является этанол. В одном воплощении слабой кислотой является уксусная кислота. В одном воплощении неионные поверхностно-активные вещества представляют собой различные сорбитаны (Span®) или полиоксиэтиленсорбитаны (Tween®), в частности монолауратсорбитаны (Span 20®) и монолауратполиоксиэтиленсорбитаны (Tween 20®). Раствор гликолипидного адъюванта приготавливают путем введения соответствующего количества исходного раствора гликозиламида в "подходящий буфер". pH описанных в данном изобретении конечных стабильных растворов гликолипидного адъюванта должен составлять от приблизительно 6 до приблизительно 8. Предпочтительно, когда конечный pH составляет от приблизительно 6 до приблизительно 7. Описан конечный pH от приблизительно 6, 3 до приблизительно 6, 4. В растворе гликолипидного адъюванта следует избегать высоких концентраций солей, превышающих 30 мМ NaCI.
Более подробное описание этих двух растворов проиллюстрировано ниже.
Исходный раствор гликозиламида представляет собой композицию, содержащую
а) гликолипид формулы I:
где формула I представляет собой
где R1 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
X представляет собой -СН2-, -О- или -NH-;
R2 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
R3, R4 и R5 независимо представляют собой водород, -SO4 2-, -РО4 2-, -СОС1-10алкил;
R6 представляет собой L-аланил, L-альфа-аминобутил, L-аргинил, L-аспарагинил, L-аспартил, L-цистеинил, L-глутамил, L-глицил, L-гистидил, L-гидроксипропил, L-изолейцил, L-лейцил, L-лизил, L-метионил, L-орнитинил, L-фенилаланил, L-пролил, L-серил, L-треонил, L-тирозил, L-триптофанил и L-валил или их D-изомеры;
в форме соли, которая образована со слабой кислотой;
б) спирт, который представляет собой HO-C1-3алкил;
в) слабую кислоту, которая 1) присутствует в молярном избытке по отношению к содержанию гликолипида и 2) представляет собой любую кислоту, имеющую величину рКа от приблизительно 1,0 до приблизительно 9,5 согласно стандартным таблицам или величинам; и
г) неионное поверхностно-активное вещество, которое представляет собой агент, уменьшающий поверхностное натяжение вещества, в котором он растворен, и содержащий один компонент, который является гидрофобным, и другой компонент, который является гидрофильным.
Раствор гликолипидного адъюванта представляет собой композицию, содержащую:
а) исходный раствор гликозиламида; и
б) подходящий буфер, который представляет собой буфер, приемлемый для применения в ветеринарии или медицине, и может поддерживать относительно постоянный pH в водном растворе от приблизительно 6,0 до приблизительно 8,0.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не установлено иное, следующие далее термины, используемые в описании и формуле изобретения, имеют значения, приведенные ниже.
Термин "спирт" относится к соединению формулы: HO-C1-3алкил. Им может быть метанол, этанол или пропанол в любой форме, например н-пропанол или изопропанол. Этанол предпочтителен.
Термин "алкил" относится как к прямым, так и разветвленным насыщенным углеводородным группировкам.
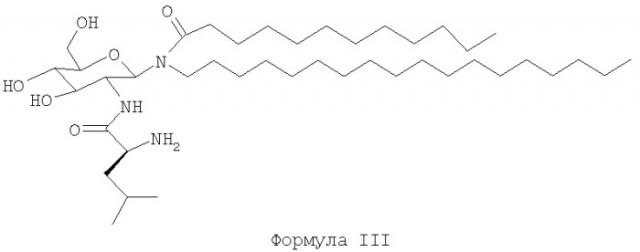
Термин "гликолипиды" относится к приведенным ниже соединениям формулы I. Эти соединения описаны в патенте США 6290971 и патенте США №4855283, опубликованном 8 августа 1989 года. И патент США 6290971, и патент США №4855283 тем самым включены во всей своей полноте посредством ссылки. Гликолипид, в частности описанный в данном изобретении, когда он находится в своей ацетатной форме, имеет торговое название Bay R1005® и химическое название "ацетат N-(2-дезокси-2-L-лейциламино-β-D-глюкопиранозил)-N-октадецилдодеканамида". Амидная форма этого соединения имеет торговое название Bay 15-1583® и химическое название "N-(2-дезокси-2-1-лейциламино-β-D-глюкопиранозил)-N-октадецилдодеканамид".
Гликолипиды формулы I представляют собой:
где R1 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
X представляет собой -СН2-, -О- или -NH-;
R2 представляет собой водород или насыщенный алкильный радикал, имеющий до 20 атомов углерода включительно;
R3, R4 и R5 независимо представляют собой водород, -SO4 2-, -PO4 2- или -СОС1-10алкил;
R6 представляет собой L-аланил, L-альфа-аминобутил, L-аргинил, L-аспарагинил, L-аспартил, L-цистеинил, L-глутамил, L-глицил, L-гистидил, L-гидроксипропил, L-изолейцил, L-лейцил, L-лизил, L-метионил, L-орнитинил, L-фенилаланил, L-пролил, L-серил, L-треонил, L-тирозил, L-триптофанил и L-валил или их D-изомеры;
или их фармацевтически приемлемую соль.
Другое конкретное воплощение описывает гликолипиды формулы I,
где R1 представляет собой водород или насыщенный С12-18алкил;
R2 представляет собой водород или насыщенный С7-11алкил;
X представляет собой -СН2-;
R4 и R5 независимо представляют собой водород;
R6 выбран из L-лейцила.
Переменные для формулы I являются индивидуальными и независимыми, и в данном изобретении описаны и заявлены все комбинации переменных.
В другом воплощении гликолипидами являются гликолипиды, описанные формулой II(a):
В другом воплощении гликолипидами являются гликолипиды, описанные формулой II(b):
В другом воплощении гликолипиды имеют структуру формулы III:
Соединение формулы III может существовать либо в амидной форме, либо в ацетатной форме. Амидная форма этого соединения имеет торговое название Bay 15-1583®. Ацетатная форма имеет торговое название Bay R1005®.
Гликолипиды формулы I могут быть приготовлены с использованием следующих далее методик, взятых из патента США №4855283.
Как можно видеть из формулы I, основой соединений по изобретению является замещенная 2-амино-2-дезоксигексоза. Эти сахара всегда соединены N-гликозидной связью через С-1, аномерный атом углерода, с группой ациламидо, карбамида или алкоксикарбониламидо,
имеющей упомянутые выше значения для R1, R2 и X.
2-Аминогруппа аминосахаров в соединениях формулы I по изобретению соединена амидной связью с α-аминокислотой или производным α-аминокислоты.
Аминокислоты представляют собой природные L-аминокислоты, такие как глицин, саркозин, гиппуровая кислота, аланин, валин, лейцин, изолейцин, серии, треонин, цистеин, метионин, орнитин, цитруллин, аргинин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, фенилаланин, тирозин, пролин, триптофан и гистидин. Также описаны D-аминокислоты, такие как D-аланин, или аминокарбоновые кислоты, такие как альфа-аминомасляная кислота, α-аминовалериановая кислота, α-аминокапроновая кислота или α-аминогептановая кислота как в D-, так и в L-форме, чтобы действовать в качестве заместителя на аминосахаре.
Также предложены способы получения соединений, соответствующих формуле I. Порядок их осуществления начинается с производного 2-амино-2-дезоксигликопиранозы (формула IV), защищенного по аминогруппе,
в котором R10 представляет собой защитную группу для защиты аминогрупп, известную из синтеза пептидов, и которая может, если это целесообразно, быть избирательно удалена.
Примерами подходящих защитных групп являются ацильные группы, такие как трифторацетильная или трихлорацетильная, о-нитрофенилсульфенильные, 2,4-динитрофенилсульфенильные или возможно замещенные низшие алкоксикарбонильные группы, такие как метоксикарбонильные, трет-бутилоксикарбонильные, бензилоксикарбонильные, п-метоксибензилоксикарбонильные или 2,2,2-трихлорэтоксикарбонильные группы. Известны подходящие N-защищенные аминогексозные производные. Например, M.Bergmann and L.Zervas, Ber. 64, 975 (1931); D.Horton, J. Org. Chem. 29, 1776 (1964); P.H.Gross and R.W.Jeanloz, J. Org. Chem. 32, 2759 (1967); M.L.Wolfram and H.B.Bhat, J. Org. Chem. 32, 1821 (1967); в общем случае: J.F.W.McOmie (Editor). Prot. groups. Org. Chem., Plenum Press (1973); Geiger в "The Peptides" Vol.3, p.1-99 (1981) Academic Press; и приведенная там литература). Предпочтительными аминозащитными группами для получения соединений, соответствующих формуле I, являются группа ВОС (трет-бутилоксикарбонил) или группа Z (бензилоксикарбонил).
Блокированные производные аминосахаров (IV) приводят на первой стадии реакции во взаимодействие с аминами (формула V),
где R1 имеет вышеупомянутое значение с получением гликозиламинов (формула VI)
.
Препараты гликозиламинов этого типа в принципе известны (ELLIS, Advances in Carbohydrate Chemistry 10, 95 (1955)) и, в частности, описаны в DE-OS (German Published Specification) №3213650.
На второй стадии реакции гликозиламины (VI) приводят во взаимодействие с подходящими производными карбоновой кислоты (формула VII), такими как галогенангидриды карбоновых кислот или ангидриды карбоновых кислот,
,
где R2 имеет вышеупомянутое значение, a R11 представляет собой галоген, такой, например, как хлор, или представляет собой -О-CO-R2 с упомянутым выше значением для R2, или представляет собой группировку -O-СО-О-низший алкил. Таким способом получают гликозиламиды (формула VIII),
в которых R1 и R2 имеют вышеупомянутые значения, R10 такой же, как R6, а X представляет собой -СН2-. Условия N-ацилирований этого типа указаны в DE-OS (German Published Specification) №3213650.
В предпочтительном воплощении гликозиламины формулы VI приводят во взаимодействие с одним-двумя эквивалентами карбонилхлорида (формула VII) или с одним-двумя эквивалентами смешанного ангидрида, который получен из релевантной карбоновой кислоты R2--CH2--CO2H и этилхлорформиата или изобутилхлорформиата в присутствии вспомогательного органического основания известными из литературы способами с получением гликозиламида формулы VIII, в котором X представляет собой -СН2-.
Это взаимодействие осуществляют в органических или водно-органических растворителях при 0°С - 50°С в присутствии, если целесообразно, неорганического или органического основания. Подходящими разбавителями являются спирты, такие как метанол, этанол, 1-пропанол или 2-пропанол, или простые эфиры, такие как диэтиловый эфир, тетрагидрофуран или 1,4-диоксан, или галогенированные углеводороды, такие как дихлорметан, трихлорметан или 1,2-дихлорэтан, или N,N-диметилформамид.
Когда гликозиламины (VI), полученные на первой стадии, приводят во взаимодействие с эфирами галогеномуравьиной кислоты (IX),
где R12 представляет собой галоген, такой как, например, хлор или бром, a R2 имеет вышеупомянутое значение, тогда получают гликозилкарбаматы (VIII), где X в формуле VIII представляет собой кислород.
В одном воплощении гликозиламины формулы VIII приводят во взаимодействие с одним-двумя эквивалентами эфира хлоругольной кислоты IX с получением гликозилкарбамата. Это взаимодействие предпочтительно осуществляют в органических или водно-органических растворителях при температурах между 0°С и 50°С, но особенно предпочтительно при комнатной температуре. Подходящими растворителями являются спирты, простые эфиры, галогенированные углеводороды или диметилформамид, которые упомянуты выше.
Когда гликозиламины (VI), полученные на первой стадии, приводят во взаимодействие с одним-двумя эквивалентами органического изоцианата (формула X),
где R2 имеет вышеупомянутое значение, тогда получают гликозилмочевины формулы VIII, и X представляет собой -NH-. Подобно вышеупомянутым реакциям, эту реакцию ацилирования предпочтительно осуществляют в органических растворителях при температурах реакции, составляющих от -20°С до 60°С, предпочтительно между 0°С и 25°С. Подходящими растворителями являются вышеупомянутые спирты, простые эфиры, галогенированные углеводороды или диметилформамид.
Гликозиламиды (формула VIII, X представляет собой -СН2-), гликозилкарбаматы (формула VIII, X представляет собой -О-) или гликозилмочевины (формула VIII, X представляет собой -NH-), полученные этим способом, выделяют в форме кристаллических или аморфных твердых веществ известными способами и при необходимости очищают с использованием стандартных методик, таких как перекристаллизация, хроматография, экстракция и т.д.
Кроме того, во многих случаях параллельно с упомянутыми выше стадиями очистки или вместо них выгодно осуществлять получение химических производных (химическую дериватизацию), в результате чего получают производное гликозил-амидов, -карбаматов и -мочевин формулы VIII, обладающее хорошей способностью к кристаллизации. Химическими дериватизациями этого типа являются, в случае гликозиламидов, гликозилкарбаматов и гликозилмочевин по изобретению, например реакции этерификации гидроксильных групп остатков сахара. Примерами подходящих сложноэфирных групп являются ацетильная, бензоильная или п-нитробензоильная группы.
Для получения три-О-ацил-производных гликозиламидов, гликозилмочевин или гликозилкарбаматов соответствующие триолы (формула VIII) приводят во взаимодействие с ацилирующими агентами в присутствии неорганических или органических вспомогательных оснований. Подходящими ацилирующими агентами являются хлорангидриды кислот, такие как ацетилхлорид, бензоилхлорид или п-нитробензилхлорид, либо ангидриды, как например, уксусный ангидрид. Результатом этого является образование сложных эфиров, соответствующих формуле XI,
,
где R1, R2, R10 и X имеют вышеупомянутые значения, и
R13 представляет собой ацетил, бензоил или п-нитробензоил.
Реакции О-ацилирования предпочтительно осуществляют в инертных органических растворителях. Растворителями, которые могут быть использованы, являются галогенированные углеводороды, такие как дихлорметан, трихлорметан или 1,2-дихлорэтан, простые эфиры, такие как тетрагидрофуран или 1,4-диоксан, сложные эфиры, такие как этилацетат, и амиды, такие как диметилформамид.
В качестве подходящих растворителей также можно указать сами органические основания, такие как триэтиламин или пиридин. Все основания, которые могут быть использованы, представляют собой основания, применяемые в органической химии для О-ацилирования. Предпочтительно используют триэтиламин, пиридин или смесь пиридин/4-диметиламинопиридин. Тройные сложные эфиры (формула XI) могут легко кристаллизоваться из органических растворителей. Особенно предпочтительными для кристаллизации являются полярные растворители, такие как спирты с короткой цепью, то есть метанол, этанол, н-пропанол или изопропанол. Другие растворители, подходящие для кристаллизации тройных сложных эфиров (формула XI), представляют собой смеси органических растворителей с полярными неорганическими или органическими растворителями, например тетрагидрофуран - метанол, тетрагидрофуран - вода, этанол - вода и изопропанол - вода. Тройные сложные эфиры (формула XI), очищенные в результате однократной или, где целесообразно, многократной перекристаллизации, переводят обратно в триолы (формула VIII) посредством гидролиза или трансэтерификации трех О-ацетильных групп. В органической химии известно множество способов расщепления эфиров. Для получения триолов (формула VIII) из тройных сложных эфиров (формула XI) можно отметить трансэтерификацию ацильных групп в присутствии метанола и каталитических количеств метанолята натрия, известную в органической химии как гидролиз по Земплену.
Третья стадия реакции получения соединений формулы I по изобретению включает избирательное отщепление защитной группы с 2-аминогруппы сахара в соединениях формулы VIII. В этой реакции необходима особенная осторожность, чтобы не происходило одновременного удаления группы 1-амидо, или 1-карбамидо, или 1-(алкоксикарбониламидо) на сахаре соединений формулы VIII.
Бензилоксикарбонильная группа, предпочтительно используемая по положению С-2 аминогексанов, может быть количественно и избирательно отщеплена с сохранением группы 1-амидо, или 1-карбамидо, или 1-алкокси-карбониламидо в условиях гидрогенолиза. В результате такого гидрогенолиза получаются гликозиламиды, гликозилмочевины или гликозилкарбаматы со свободной 2-аминогруппой сахара, имеющие следующую структурную формулу (XII)
с упомянутыми выше значениями для R1, R2 и X.
Примерами подходящих катализаторов для гидрогенолиза являются благородные металлы, такие как платина или палладий, которые адсорбированы на активированном угле. Предпочтительно используют палладий/уголь (5%-ный или 10%-ный). Гидрогенолиз может быть осуществлен при атмосферном давлении или повышенном давлении в подходящем сосуде под давлением. Для гидрирования подходят инертные растворители, как например спирты, такие как метанол, этанол или пропанол, простые эфиры, такие как тетрагидрофуран или 1,4-диоксан, либо карбоновые кислоты, такие как уксусная кислота, либо их смеси. Там, где это целесообразно, растворитель смешивают с водой или разбавленными кислотами, такими как соляная кислота или серная кислота. Несомненно, когда добавляют такие кислоты, 2-амино-2-дезокси-гликозиламиды, -карбаматы и -мочевины формулы XII получают в виде аммониевых солей этих кислот. трет-Бутилоксикарбонильная защитная группа, которая также предпочтительно используется в соединениях формулы VIII, может быть отщеплена способами, известными из литературы, с использованием минеральных кислот, таких как соляная кислота или серная кислота. В этом случае 2-амино-2-дезокси-гликозиламиды,-карбаматы и -мочевины формулы XII также избирательно получаются в виде аммониевых солей кислот, использованных для отщепления.
Четвертая стадия реакции синтеза соединений формулы I по изобретению включает связывание аминогликозиламидов, амидов, -карбаматов или -мочевин, соответствующих формуле XII, или их солей с подходящим производным аминокислот. Подходящие производные аминокислот представляют собой N-блокированные аминокислоты (формула XIII),
где R7 имеет упомянутое выше значение,
R8 представляет собой водород или метил, и
R14 представляет собой защитную группу, которая обычно используется в пептидном синтезе и может быть избирательно удалена с сохранением пептидной связи.
Предпочтительно используемыми защитными группами для аминогруппы в формуле XIII являются вышеупомянутые группы, а бензилоксикарбонильные или трет-бутилоксикарбонильные группы являются особенно предпочтительными. Сочетание 2-амино-2-дезокси-гликозиламида-карбамата или -мочевины формулы XII с аминокислотным производным формулы XIII может быть осуществлено традиционными способами пептидного синтеза (E.Wunsch et al.: Synthese von Peptiden (Synthesis of peptides) in: Methoden der Org. Chemie (Methods of org. chemistry) (Houben-Weyl) (E.Muller, Editor), Vol.XV/I и XV/2, 4-е издание, опубликовано Thieme, Stuttgart (1974).
Примерами традиционных способов являются конденсация аминогруппы в соединении формулы XII с аминокислотным производным формулы XIII в присутствии удаляющих воду агентов, например дициклогексилкарбодиимида или диизопропилкарбодиимида.
Конденсацию соединений формулы XII с соединениями формулы XIII также можно осуществлять, когда карбоксильная группа активирована. Возможная активированная карбоксильная группа представляет собой, например, ангидрид карбоновой кислоты, предпочтительно смешанный ангидрид, такой как ацетат кислоты, либо амид кислоты, такой как имидазолид, либо активированный сложный эфир. Примерами активированных сложных эфиров являются цианометиловые эфиры, пентахлорфениловые эфиры и N-гидроксифталимидные эфиры. Активированные сложные эфиры также могут быть получены из кислоты (формула XIII) и N-гидроксисукцинимида или 1-гидроксибензотиазола в присутствии удаляющего воду агента, такого как карбодиимид. Производные аминокислот известны и могут быть получены известным способом. В результате конденсации аминосоединения формулы XII с возможно активированными карбоксильными соединениями формулы XIII получают пептидогликолипиды формулы XIV:
с упомянутыми выше значениями для R1, R2, R7, R8, R14 и X.
На заключительной стадии способа получения соединений формулы I защитную группу R14 в соединениях формулы XIV удаляют. Эта стадия должна быть проведена с осторожностью, так чтобы другие амидные, уретановые группы или группы мочевины, имеющиеся в соединениях формулы XIV, не отщеплялись. Защитные группы R14, которые предпочтительно используются в соединениях формулы XIV, N-карбобензоксигруппа и N-трет-бутилоксикарбонильная группа, могут быть удалены с сохранением амидной группы, уретановой группы или группы мочевины. Карбобензоксигруппа может быть избирательно удалена гидрогенолизом в присутствии благородного металла, такого, например, как палладий на угле, в подходящем растворителе, таком как этанол, метанол, ледяная уксусная кислота или тетрагидрофуран. Растворители могут быть использованы в виде чистого растворителя или скомбинированы с другим растворителем или с водой. Реакция может быть осуществлена либо при атмосферном давлении, либо при повышенном давлении. трет-Бутилоксикарбонильная группа R14 в соединениях формулы XIV может быть удалена в результате ацидолитических процессов. Примерами подходящих условий являются использование хлористого водорода в подходящих растворителях, таких как, например, ледяная уксусная кислота, диэтиловый эфир, диоксан или этилацетат, при комнатной температуре. Способы этого типа для расщепления трет-бутилкарбаматов в принципе известны. Пептидогликозиламиды, -карбаматы и -мочевины формулы I, полученные этим способом, выделяют в форме кристаллических или аморфных твердых веществ известными способами и при необходимости очищают стандартными методами, такими как перекристаллизация, хроматография, экстракция и т.д.
Соединения по изобретению формулы I также могут быть получены в соответствии со вторым способом синтеза с аналогичными хорошими результатами. Этот второй способ синтеза отличается от описанного выше первого способа тем, что у него другая последовательность связывания синтонов аминосахар-аминокислота, амин R1-NH2 и карбоновая кислота R2-CH2-СО2-Н или производное карбоновой кислоты R2-O-CO-галоген либо R2-NCO, где значения R1 и R2 упомянуты выше. В этом втором способе в качестве исходного компонента используют подходящие 2-Т-(аминоацил)аминосахара формулы XV
с упомянутыми выше значениями для R7 и R8, и в которых R14 представляет собой известную в пептидной химии защитную группу для аминогруппы, предпочтительно бензилоксикарбонильную или трет-бутилоксикарбонильную группу. Получаемые таким образом соединения формулы XV далее конденсируют с аминосоединениями формулы III с получением гликозиламинов общей формулы XVI
с R1, R7, R8 и R14, имеющими значения, согласующиеся с формулой I и определением R6.
Все описанные выше способы получения соединений общей формулы VI можно использовать для получения соединений общей формулы XVI. Соединения формулы XVI далее приводят во взаимодействие либо с вышеупомянутыми производными карбоновой кислоты (формула VII), либо с эфирами галогеноугольной кислоты (формула IX), либо с органическими изоцианатами (формула X) с получением 2-(аминоацил)-аминогликозиламидов формулы XIV (с X, представляющим собой -СН2--), или -карбаматов формулы XIV (с X, представляющим собой -О-), или -мочевин формулы XIV (с X, представляющим собой -NH-). Эти реакции ацилирования в общем случае могут быть осуществлены с использованием описанных выше способов взаимодействия гликозиламинов с карбоновыми кислотами или производными карбоновых кислот.
Промежуточные соединения (формула XIV), которые получают этим способом, могут быть очищены с использованием вышеупомянутого физического способа очистки. Однако предпочтительным является превращение соединений формулы XIV описанными выше способами О-ацилирования в три-О-ацетаты или три-О-бензоаты общей формулы XVII
со значениями переменных, согласующимися с формулой I.
Эти соединения могут легко кристаллизоваться, предпочтительно из полярных растворителей, таких как метанол или этанол, и таким образом очищены. Очищенные кристаллические производные формулы XVII затем превращают в триолы формулы XIV вышеупомянутыми способами гидролиза сложных эфиров, которые особенно широко используются в химии сахаров. Окончательное удаление защитных групп в аминокислоте в соединениях формулы XIV уже было описано выше для получения соединений формулы I. Изобретение также относится к солям соединений формулы I. Они представляют собой главным образом нетоксичные соли, которые обычно можно использовать в фармации, например хлориды, ацетаты и лактаты, или инертные соли соединений формулы I.
Термин "слабая кислота" означает любую кислоту, имеющую величину рКа (-log Ка) от приблизительно 1,0 до приблизительно 9,5 по стандартным таблицам или величинам. Следующие далее примеры слабых кислот, без ограничения данного изобретения, описаны путем указания названия, формулы и приблизительного значения рКа. Уксусная кислота H(C2H3O2) (рКа 4,76); аскорбиновая кислота(1), H2(C6H6O6) (рКа 4,10); ацетилсалициловая кислота H8(C9O4) (рКа 3,5); бутановая кислота H(C4H7O2) (рКа 4,83); угольная кислота H2CO3 (рКа 4,83; форма 1); хромовая кислота HCrO4 - (рКа 6,49; форма 2); лимонная кислота H3(C6H5O7) (рКа 3,14; форма 1); лимонная кислота H2C6H5O7 - (рКа 4,77; форма 2); лимонная кислота (HC6H5O7)2- (рКа 6,39; форма 3); муравьиная кислота H(CHO2) (рКа 3,75); фумаровая кислота H4(C4O4) (рКа 3,03); гептановая кислота H(C7H13O2) (рКа 4,89); гексановая кислота H(C6H11O2) (рКа 4,84); фтористоводородная кислота HF (рКа 3,20); изолимонная кислота H8(C6O7) (рКа 3,29); молочная кислота H(C3H5O3) (рКа 3,08); малеиновая кислота H4(C4O4) (рКа 1,83); никотиновая кислота H5(C6NO2) (рКа 3,39); щавелевая кислота H2(C2O4) (рКа 1,23; форма 1); щавелевая кислота (HC2O4)- (рКа 4,19; форма 2); пентановая кислота H(C5H9O2) (рКа 4,84); фосфорная кислота H3PO4 (рКа 2,16; форма 1); пропановая кислота H(C3H5O2) (рКа 4,86); пировиноградная кислота H4(C3O3) (рКа 2,39); янтарная кислота H6(C4O4) (рКа 4,19) и трихлоруксусная кислота H(C2Cl3O2) (рКа 0,70). Любые комбинации этих кислот также являются примерами.
Уксусная кислота является предпочтительной. Ацетилсалициловая кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, фтористоводородная кислота, изолимонная кислота, малеиновая кислота, никотиновая кислота, фосфорная кислота, пировиноградная кислота, янтарная кислота и трихлоруксусная кислота являются наиболее общеупотребительными слабыми кислотами, которые реализованы в воплощениях по отдельности, в комбинации и в виде набора.
Термин "неионное поверхностно-активное вещество" означает поверхностно-активное вещество, уменьшающее поверхностное натяжение вещества, в котором оно растворено, а "неионное" означает, что оно имеет полярную, электрически незаряженную группу. Термин "амфифильное поверхностно-активное вещество" означает поверхностно-активное вещество, в котором часть молекулы поверхностно-активного вещества является гидрофобной, а часть гидрофильной. Подходящие поверхностно-активные вещества будут одновременно неионными и амфифильными и приемлемыми для использования в ветеринарии и медицине. Будет или не будет конкретное неионное поверхностно-активное вещество приемлемым для использования в медицине или ветеринарии, легко может быть определено специалистом обычной квалификации в данной области техники. Имеется много подходящих неионных поверхностно-активных веществ, которые могут быть использованы в данном изобретении, и ниже предложены многочисленные примеры.
В воплощениях данного изобретения реализованы два хорошо известных типа неионных поверхностно-активных веществ. Они известны как сорбитаны, обычно продающиеся под товарным знаком Span®, и полиоксиэтиленсорбитаны, обычно продающиеся под товарным знаком Tween®. Конкретными воплощениями в данном описании являются следующие: сорбитанмонолаурат (Span 20®), сорбитанмонопальмиат (Span 40®), сорбитанмоностеарат (Span 60®), сорбитантристеарат (Span 65®), сорбитанмоноолеат (Span 80®), сорбитантриолеат (Span 85®), полиоксиэтиленсорбитанмонолаурат (Tween 20®), полиоксиэтиленсорбитанмонопальмиат (Tween 40®), полиоксиэтиленсорбитанмоностеарат (Tween 60®), полиоксиэтиленсорбитамоноолеат (Tween 80) и полиоксиэтиленсорбитантриолеат (Tween 85). Эти описания понимаются как включающие ингредиенты указанных торговых названий или эквивалентные ингредиенты, которые приведены в поставляемых каталогах для таких поверхностно-активных веществ. Поверхностно-активные вещества могут быть использованы по отдельности или в комбинации.
Конкретно описаны сорбитанмонолаурат (Span 20®), полиоксиэтиленсорбитанмонолаурат (Tween 20®), сорбитанмоноолеат (Span 80®), сорбитантриолеат (Span 85®), полиоксиэтиленсорбитанмоноолеат (Tween 80), полиоксиэтиленсорбитантриолеат (Tween 85).
Термин "подходящий буфер" означает буфер, подходящий для использования в ветеринарии или медицине, и который может поддерживать относительно постоянный pH в водном растворе от приблизительно 6 до приблизительно 8. Одним из воплощений, описанным в данном изобретении, являются фосфатные буферы. Фосфатные буферы могут быть приготовлены для получения конкретного pH в широком диапазоне посредством смешивания в разных соотношениях одноосновной и двухосновной солей фосфата натрия и/или фосфата калия. Приготовление и использование различных буферов на основе (солей) натрия и калия хорошо известно специалистам в данной области техники.
Другими примерами буферов являются следующие:
2-(N-морфолино)этансульфоновая кислота (также известная как MES);
3-(N-морфолино)пропансульфоновая кислота (также известная как MOPS);
н-[трис(гидроксиметил)]-2-аминоэтансульфоновая кислота (также известная как TES);
4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота (также известная как HEPES);
[трис(гидроксиметил)метил]глицин (также известный как TRIS).
Часть I. Приготовление растворов
Описанные в данном изобретении новые композиции представляют собой 1) исходные растворы гликозиламида и 2) растворы гликолипидного адъюванта.
1) Исходный раствор гликозиламида приготавливают путем растворения гликолипида в спирте и комбинирования его с соответствующими количествами слабой кислоты. Слабую кислоту добавляют к спиртовому раствору гликолипида в молярном избытке слабой кислоты по отношению к гликолипиду. Для получения исходного раствора гликозиламида к смеси гликолипида, спирта и кислоты добавляют неионное поверхностно-активное вещество. Примером гликолипида является N-(2-дезокси-2-L-лейциламино-β-D-глюкопиранозил)-N-октадецилдодеканоиламид. Примером спирта является этанол, примером слабой кислоты является уксусная кислота. Неионные поверхностно - активные вещества описаны выше.
Приготовление исходных растворов гликозиламида. К спиртовому раствору, содержащему гликолипид, добавляют слабую кислоту. Слабую кислоту добавляют в молярном избытке по отношению к содержанию гликолипида. Компонент слабой кислоты должен быть добавлен в к