Триазолы, используемые в качестве ингибиторов протеинкиназ
Иллюстрации
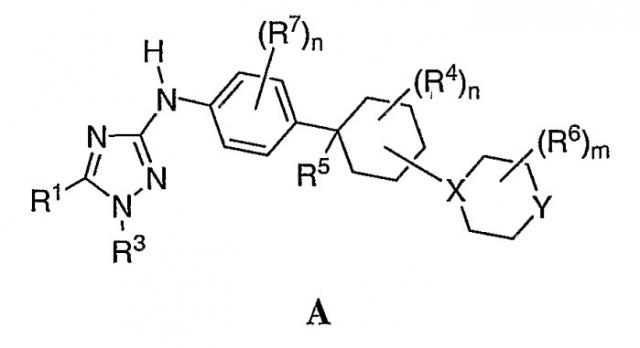
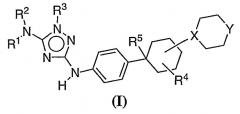
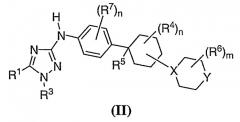
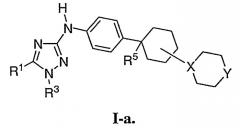
Показать всеОписываются новые производные 1,2,4-триазолов - ингибиторы протеинкиназ общей формулы (I)
где X - N, Y - CH2, NH, NR или 0;
R1 и R2 - каждый независимо означает водород;
R3 - фенил, замещенный -CN, 6-членный гетероарил, содержащий 1-2 атома N, возможно замещенный 7-членным гетероциклилом, содержащим 2 атома азота, который в свою очередь замещен С1-6 алкилкарбонилом;
R4 - водород; R5 - водород или -CN; и
R означает С1-6 алкильную группу, С1-6 алкилкарбонильную группу, замещенную -CN, или С3-6 циклоалкильную группу, способ ингибирования активности FLT-3 или c-KIT протеинкиназ и применение новых соединений для получения лекарственного средства для лечения или уменьшения тяжести острого миелогенного лейкоза. 3 н. и 8 з.п. ф-лы, 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к ингибиторам протеинкиназ. Данное изобретение также предлагает фармацевтические композиции, содержащие соединения данного изобретения, и способы применения композиций для лечения различных заболеваний.
УРОВЕНЬ ТЕХНИКИ
Достигнутое в последнее время глубокое понимание структуры ферментов и других биологических молекул, ассоциированных с разными заболеваниями, существенно облегчает поиск новых терапевтических средств. Одним из важных классов ферментов, подвергающихся обширным исследованиям, являются протеинкиназы.
Протеинкиназы составляют большое семейство структурно-родственных ферментов, регулирующих разные процессы передачи сигнала в клетке. (См., Hardie, G. and Hanks, S. The Protein Kinase Facts Book, I and II, Academic Press, San Diego, CA: 1995.) Поскольку протеинкиназы обладают определенной консервативностью структуры и каталитических функций, считается, что они произошли от общего гена. Почти все киназы содержат одинаковый каталитический домен размером 250-300 аминокислот. Киназы можно подразделить на семейства в зависимости от субстратов, которые они фосфорилируют (например, протеин-тирозиновые, протеин-сериновые/треониновые, липидные и др. киназы). Идентифицированы мотивы последовательностей, которые, как правило, соответствуют каждому из указанных семейств киназ (см., например, Hanks, S.K., Hunter, T., FASEB J. 1995, 9, 576-596; Knighton et al., Science 1991, 253, 407-414; Hiles et al., Cell 1992, 70, 419-429; Kunz et al., Cell 1993, 73, 585-596; Garcia-Bustos et al., EMBO J. 1994, 13, 2352-2361).
Как правило, протеинкиназы опосредуют внутриклеточную передачу сигнала, обеспечивая перенос фосфорила от нуклеозидтрифосфата к белковому акцептору, который участвует в сигнальном пути. Указанные события фосфорилирования действуют как молекулярные механизмы включения/выключения, которые могут модулировать или регулировать целевую биологическую функцию белка. Данные события фосфорилирования в конечном счете запускаются в ответ на ряд внеклеточных и других стимулов. Примеры таких стимулов включают в себя сигналы окружающей среды и химического стресса (например, сигналы осмотического шока, теплового шока, ультрафиолетовое излучение, бактериальный эндотоксин и H2O2), цитокины (например, интерлейкин-1 (IL-I) и фактор некроза опухоли α (TNF-α)), факторы роста (например, колониеобразующий гранулоцитарно-макрофагальный фактор (GM-CSF) и фактор роста фибробластов (FGF)). Внеклеточный стимул может воздействовать на один или несколько клеточных ответов, связанных с клеточным ростом, миграцией, дифференциацией, секрецией гормонов, активацией факторов транскрипции, сокращением мускулатуры, метаболизмом глюкозы, регуляцией синтеза белков и регуляцией клеточного цикла.
Многие заболевания связаны с аномальными клеточными ответами, запускаемыми событиями, опосредованными протеинкиназами, как описано выше. Данные заболевания включают в себя, без ограничения, аутоиммунные заболевания, воспалительные заболевания, заболевания костей, метаболические заболевания, неврологические и нейродегенеративные заболевания, рак, сердечно-сосудистые заболевания, аллергии и астму, болезнь Альцгеймера и гормональные заболевания. Соответственно, в медицинской химии проводится интенсивный поиск ингибиторов протеинкиназ, которые являются эффективными терапевтическими средствами.
Семейство рецепторов тирозинкиназ типа III, включающих в себя Flt3, c-Kit, PDGF-рецептор и c-Fms, играет важную роль в поддержании, росте и развитии гематопоэтических и негематопоэтических клеток. [Scheijen, B, Griffin JD, Oncogene, 2002, 21, 3314-3333 and Reilly, JT, British Journal of Haematology, 2002, 116, 744-757.] FLT-3 и c-Kit регулируют поддержание стволовых клеток/пулов ранних предшественников, а также развитие зрелых лимфоидных и миелоидных клеток [Lyman, S, Jacobsen, S, Blood, 1998, 91, 1101-1134]. Оба рецептора содержат характеристический киназный домен, который активируется путем лиганд-опосредованной димеризации рецепторов. После активации киназный домен индуцирует аутофосфорилирование рецептора, а также фосфорилирование разных цитоплазматических белков, опосредующих распространение сигнала активации, который обеспечивает рост, дифференциацию и выживание. Некоторые из понижающих регуляторов сигнального пути, в котором участвуют рецепторы FLT-3 и c-Kit, включают в себя PLCγ, PI3-kinase, Grb-2, SHIP- и Src-родственные киназы [Scheijen, B, Griffin JD, Oncogene, 2002, 21, 3314-3333]. Показано, что обе рецепторные тирозинкиназы играют важную роль в развитии ряда гематопоэтических и негематопоэтических злокачественных заболеваний. Мутации, приводящие к лиганд-независимой активации FLT-3 и c-Kit, участвуют в развитии острого миелогенного лейкоза (AML), острого лимфолейкоза (ALL), мастоцитоза и стромальной опухоли желудочно-кишечного тракта (GIST). Данные мутации включают в себя одиночные аминокислотные замены в киназном домене или внутренние тандемные дубликации, точечные мутации или делеции в рамке считывания околомембранного участка рецепторов. Помимо активирующих мутаций, лиганд-зависимая (аутокринная или паракринная) стимуляция сверхэкспрессии FLT-3 или c-Kit дикого типа может участвовать в формировании злокачественного фенотипа [Scheijen, B, Griffin JD, Oncogene, 2002, 21, 3314-3333].
c-fms кодирует рецептор макрофагального колониестимулирующего фактора (M-CSF-1R), который экспрессируется преимущественно в линиях моноцитов/макрофагов [Dai, XM et al., Blood, 2002, 99, 111-120]. MCSF-1R и его лиганд регулируют рост и дифференциацию макрофагов. Подобно другим членам семейства, MCSF-1R содержит характеристический киназный домен, который активируется при индуцированной лигандом димеризации рецептора. MCSF-1R также экспрессируется в негематопоэтических клетках, в том числе в эпителиальных клетках молочной железы и нейронах. Мутации данного рецептора потенциально связаны с миелоидными лейкозами, а его экспрессия коррелирует с метастатическими карциномами молочной железы, яичников и эндометрия [Reilly, JT, British Journal of Haematology, 2002, 116, 744-757 and Kacinski, BM, Mol. Reprod and Devel., 1997, 46, 71-74]. Другим возможным показанием для применения антагонистов MCSF-1R является остеопороз [Teitelbaum, S, Science 2000, 289, 1504-1508].
Рецептор PDGF (PDGFR) содержит две субъединицы - PDGFR-α и PDGFR-β, которые могут образовывать гомо- или гетеродимеры при связывании с лигандом. Существует несколько лигандов PDGF: AB, BB, CC и DD. PDGFR экспрессируется ранними стволовыми клетками, мастоцитами, миелоидными клетками, мезенхимальными клетками и клетками гладкой мускулатуры [Scheijen, B, Griffin JD, Oncogene, 2002, 21, 3314-3333]. Только PDGFR-β участвует в развитии миелоидного лейкоза, как правило, в качестве партнера Tel, Huntingtin-связывающего белка (HIP1) или Rabaptin5 по транслокации. Недавно было показано, что активирующие мутации в киназном домене PDGFR-α связаны со стромальными опухолями желудочно-кишечного тракта (GIST) [Heinrich, MC et al., Sciencexpress, 2003].
Циклин-зависимые киназы (CDK) представляют собой серин/треониновые протеинкиназы, состоящие из обогащенной β-складчатой структурой аминоконцевой доли и более крупной карбокси-концевой доли, которая преимущественно находится в конформации α-спирали. CDK содержат 11 субдоменов, общих для всех протеинкиназ и имеющих молекулярную массу от 33 до 44 кДа. Для полной активации киназ данного семейства, которое включает в себя CDK1, CKD2, CDK4 и CDK6, требуется фосфорилирование остатка, соответствующего Thr160 CDK2 [Meijer, L., Drug Resistance Updates 2000, 3, 83-88].
Каждый комплекс CDK формируется из регуляторной субъединицы циклина (например, циклина A, B1, B2, D1, D2, D3 и E) и каталитической киназной субъединицы (например, CDK1, CDK2, CDK4, CDK5 и CDK6). Каждая из разных пар киназа/циклин регулирует разные и специфические фазы клеточного цикла, известные как фазы G1, S, G2 и M [Nigg, E., Nature Reviews 2001, 2, 21-32; Flatt, P., Pietenpol, J., Drug Metabolism Reviews 2000, 32, 283-305].
CDK участвуют в развитии расстройств, связанных с клеточной пролиферацией, в частности, раковых заболеваний. Причиной клеточной пролиферации является прямое или косвенное нарушение регуляции цикла клеточного деления, а CDK играют ключевую роль в регуляции разных фаз данного цикла. Например, сверхэкспрессия циклина D1 обычно связана с рядом раковых заболеваний человека, включающих в себя карциномы молочной железы, толстой кишки и клеток печени, а также глиомы [Flatt, P., Pietenpol, J., Drug Metabolism Reviews 2000, 32, 283-305]. Комплекс CDK2/циклин E играет важную роль в развитии клеточного цикла от ранней фазы G1 до фазы S, а сверхэкспрессия циклина E связана с разными солидными опухолями. Следовательно, ингибиторы циклинов D1, E или ассоциированных с ними CDK можно использовать в качестве мишеней в противораковой терапии [Kaubisch, A., Schwartz, G., The Cancer Journal 2000, 6, 192-212].
CDK, особенно CDK2, также участвуют в апоптозе и развитии T-клеток. CDK2 была идентифицирована как ключевой регулятор апоптоза тимоцитов [Williams, O., et al., European Journal of Immunology 2000, 709-713]. Стимуляция киназной активности CDK2 в ответ на специфические стимулы связана с развитием апоптоза у тимоцитов. Ингибирование киназной активности CDK2 блокирует данный апоптоз и защищает тимоциты.
Помимо регуляции клеточного цикла и апоптоза CDK непосредственно участвуют в процессе транскрипции. Для репликации многих вирусов требуется присутствие CDK. Ингибиторы CDK подавляют репликацию таких вирусов, как человеческий цитомегаловирус, вирус герпеса и вирус ветряной оспы [Meijer, L., Drug Resistance Updates 2000, 3, 83-88].
Ингибиторы CDK также можно использовать для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Гиперфосфорилирование белка Tau под действием CDK5/p25 приводит к появлению спаренных спиральных филаментов (PHF), связанных с болезнью Альцгеймера [Meijer, L., Drug Resistance Updates, 2000 3, 83-88].
Другим семейством киназ, вызывающим особый интерес, являются киназы Src. Данные киназы участвуют в развитии раковых заболеваний, нарушений функции иммунной системы и заболеваний, связанных с реструктурированием костей. Общий обзор по данному семейству можно найти в Thomas and Brugge, Annu. Rev. Cell Dev. Biol. 1997, 13, 513; Lawrence and Niu, Pharmacol. Ther. 1998, 77, 81; Tatosyan and Mizenina, Biochemistry (Moscow) 2000, 65, 49; Boschelli et al., Drugs of the Future 2000, 25(7), 717, (2000).
Члены семейства Src включают в себя следующие восемь киназ млекопитающих: Src, Fyn, Yes, Fgr, Lyn, Hck, Lck и Blk. Данные киназы относятся к нерецепторным протеинкиназам, молекулярная масса которых варьирует от 52 до 62 кДа. Все они имеют общую структурную организацию и содержат шесть разных функциональных доменов: домен 4 Src-гомологии (SH4), уникальный домен, домен SH3, домен SH2, каталитический домен (SH1) и C-концевой регуляторный домен. Tatosyan et al. Biochemistry (Moscow) 2000, 65, 49-58.
Опубликованные данные позволяют рассматривать киназы Src как потенциальные терапевтические мишени при разных заболеваниях человека. У мышей с дефицитом Src развивается остеопетроз, или формирование костей, вследствие подавления резорбции костей под действием остеокластов. Это позволяет предположить, что остеопороз, возникающий вследствие аномально высокой резорбции костей, можно лечить путем ингибирования Src. Soriano et al., Cell 1992, 69, 551 and Soriano et al., Cell 1991, 64, 693.
Сверхэкспрессия CSK в ревматоидных синовиоцитах и остеокластах приводит к подавлению артритической деструкции костей. Takayanagi et al., J. Clin. Invest. 1999, 104, 137. CSK, или C-концевая Src-киназа, фосфорилирует Src и, следовательно, ингибирует ее каталитическую активность. В свою очередь ингибирование Src может предотвращать деструкцию суставов, наблюдающуюся у пациентов, страдающих от ревматоидного артрита. Boschelli et al., Drugs of the Future 2000, 25(7), 717.
Src также участвует в репликации вируса гепатита B. Транскрипция кодируемого вирусом фактора HBx активирует Src на стадии, необходимой для размножения вируса. Klein et al., EMBO J. 1999, 18, 5019, и Klein et al., Mol. Cell. Biol. 1997, 17, 6421.
В ряде исследований обнаружена связь экспрессии Src с раковыми заболеваниями, такими как рак толстой кишки, молочной железы, печени и поджелудочной железы, некоторые B-клеточные лейкозы и лимфомы. Talamonti et al., J. Clin. Invest. 1993, 91, 53; Lutz et al., Biochem. Biophys. Res. 1998 243, 503; Rosen et al., J. Biol. Chem. 1986, 261, 13754; Bolen et al., Proc. Natl. Acad. Sci USA 1987, 84, 2251; Masaki et al., Hepatology 1998, 27, 1257; Biscardi et al., Adv. Cancer Res. 1999, 76, 61; Lynch et al., Leukemia, 1993, 7, 1416. Кроме того, показано, что экспрессия антисмысловой последовательности Src в клетках опухолей яичников и толстой кишки приводит к подавлению опухолевого роста. Wiener et al., Clin. Cancer Res., 1999, 5, 2164; Staley et al., Cell Growth Diff., 1997, 8, 269.
Другие киназы семейства Src также являются потенциальными терапевтическими мишенями. Lck участвует в T-клеточной передаче сигнала. У мышей, утративших ген Lck, наблюдается нарушение развития тимоцитов. Способность Lck активировать T-клеточный сигнальный путь позволяет предположить, что ингибиторы Lck можно использовать для лечения аутоиммунных заболеваний, таких как ревматоидный артрит. Molina et al., Nature, 1992, 357, 161. Hck, Fgr и Lyn были идентифицированы как важные медиаторы интегринового сигнального пути в миелоидных лейкоцитах. Lowell et al., J. Leukoc. Biol., 1999, 65, 313. Следовательно, ингибирование данных киназных медиаторов можно использовать для лечения воспаления. Boschelli et al., Drugs of the Future 2000, 25(7), 717.
Тирозинкиназа Syk играет ключевую роль в FcεRI-опосредованной дегрануляции тучных клеток и активации эозинофилов. Соответственно, киназа Syk участвует в развитии разных аллергических заболеваний, в частности, астмы. Показано, что Syk связывается с фосфорилированной гамма-цепью рецептора FcεRI через N-концевые домены SH2 и играет важную роль в нижестоящем сигнальном пути [Taylor et al., Mol. Cell. Biol. 1995, 75, 4149].
Полагают, что ингибирование апоптоза эозинофилов является ключевым механизмом развития эозинофилии крови и тканей при астме. При астме наблюдается повышающая регуляция IL-5 и GM-CSF, которые предположительно вызывают эозинофилию крови и тканей посредством ингибирования апоптоза эозинофилов. Полагают, что ингибирование апоптоза эозинофилов является ключевым механизмом развития эозинофилии крови и тканей при астме. Существуют данные (полученные с использованием антисмысловой последовательности), что киназа Syk необходима для предотвращения апоптоза эозинофилов под действием цитокинов [Yousefi et al., J Exp Med 1996, 183, 1407].
Роль Syk в FcγR-зависимом и FcγR-независимом ответе макрофагов костномозгового происхождения определяют с использованием облученных химерных мышей, преобразованных фетальными клетками печени, полученными из эмбрионов Syk -/-. У Syk-дефицитных макрофагов не индуцируется фагоцитоз в ответ на FcγR, но индуцируется нормальный фагоцитоз в ответ на комплемент [Kiefer et al., MoI Cell Biol 1998, 18, 4209]. Также было описано, что введение аэрозоля, содержащего антисмысловую последовательность Syk, подавляет экспрессию Syk и высвобождение медиаторов из макрофагов [Stenton et al., J Immunology 2000, 164, 3790].
Киназы Janus (JAK) относятся к семейству тирозинкиназ, включающему в себя JAK1, JAK2, JAK3 и TYK2. JAK играют ключевую роль в передаче сигналов цитокинов. Нижестоящие субстраты семейства тирозинкиназ JAK включают в себя белки, участвующие в передаче сигнала и активации транскрипции (STAT). Сигнальный путь JAK/STAT опосредует многие аномальные иммунные ответы, такие как аллергия, астма, аутоиммунные заболевания, такие как отторжение трансплантата, ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, а также солидные злокачественные заболевания и злокачественные заболевания кроветворной системы, такие как лейкозы и лимфомы. В литературе существует обзор по фармацевтическому вмешательству в путь JAK/STAT [Frank Mol Med. 5, 432-456 (1999) & Seidel, et al., Oncogene 19, 2645-2656 (2000)].
JAK1, JAK2 и TYK2 экспрессируются повсеместно, тогда как JAK3 экспрессируется преимущественно в гематопоэтических клетках. JAK3 связывается исключительно с универсальной гамма-цепью рецепторов цитокинов (γc) и активируется IL-2, IL-4, IL-7, IL-9 и IL-15. Показано, что в действительности пролиферация и выживание мышиных тучных клеток, индуцируемые IL-4 и IL-9, связаны с сигнальными путями JAK3 и γc [Suzuki et al., Blood 96, 2172-2180 (2000)].
Поперечная сшивка высокоаффинных рецепторов иммуноглобулина (Ig)E в сенсибилизированных тучных клетках приводит к высвобождению провоспалительных медиаторов, в том числе ряда вазоактивных цитокинов, которые вызывают острый аллергический ответ или реакцию гиперчувствительности немедленного типа (тип I) [Gordon et al., Nature 346, 274-276 (1990) & Galli, N. Engl. J. Med., 328, 257-265 (1993)]. Установлено, что JAK3 играет ключевую роль в ответах тучных клеток, опосредованных рецептором IgE, in vitro и in vivo [Malaviya, et al., Biochem. Biophys. Res. Commun. 257, 807-813 (1999)]. Кроме того, описано, что ингибирование JAK3 предотвращает реакции гиперчувствительности типа I, в том числе анафилаксию, опосредованные активацией тучных клеток [Malaviya et al., J. Biol. Chem. 274, 27028-27038 (1999)]. Направленная доставка ингибиторов JAK3 к тучным клеткам вызывает модулирование дегрануляции тучных клеток in vitro и предотвращает анафилактические реакции, опосредованные рецептором IgE/антигеном, in vivo.
В одном из последних исследований описана успешная направленная доставка JAK3, обеспечивающая подавление иммунитета и приживление аллотрансплантата. Данное исследование демонстрирует дозозависимое выживание аллотрансплантата сердца буйвола у реципиентов Wistar Furth после введения ингибиторов JAK3, что свидетельствует о возможности регуляции нежелательных иммунных ответов, наблюдающихся при реакции "трансплантат против хозяина" [Kirken, Transpl. Proc. 33, 3268-3270 (2001)].
IL-4-опосредованное STAT-фосфорилирование представляет собой механизм, участвующий в развитии ранних и поздних стадий ревматоидного артрита (RA). Повышенный уровень провоспалительных цитокинов в синовиальной оболочке и синовиальной жидкости является характерным признаком ревматоидного артрита. Показано, что в IL-4-опосредованной активации пути IL-4/STAT участвуют киназы Janus (JAK 1 и 3) и что IL-4-ассоциированные киназы JAK экспрессируются в ревматоидной синовиальной оболочке [Muller-Ladner, et al., J. Immunol. 164, 3894-3901 (2000)].
Семейный боковой амиотрофический склероз (FALS) является неизлечимым нейродегенеративным заболеванием, поражающим приблизительно 10% пациентов, страдающих от ALS. Частота выживания мышей с FALS увеличивается после введения специфического ингибитора JAK3. Это позволяет предположить, что JAK3 участвует в развитии FALS [Trieu, et al., Biochem. Biophys. Res. Commun. 267, 22-25 (2000)].
Белки, участвующие в передаче сигнала и активации транскрипции (STAT), активируются, в числе прочих, киназами семейства JAK. Результаты проведенного в последнее время исследования свидетельствуют о возможности вмешательства в сигнальный путь JAK/STAT путем направленного воздействия специфических ингибиторов на киназы семейства JAK и использования данного механизма для лечения лейкоза [Sudbeck, et al., Clin. Cancer Res. 5, 1569-1582 (1999)]. Показано, что специфические ингибиторы JAK3 подавляют клоногенный рост JAK3-экспрессирующих клеточных линий DAUDI, RAMOS, LC1;19, NALM-6, MOLT-3 и HL-60.
Гибридные белки TEL/JAK2 вызывают миелопролиферативные заболевания у животных моделей, а введение TEL/JAK2 в гематопоэтические клеточные линии приводит к активации STAT1, STAT3, STAT5 и цитокин-независимого роста [Schwaller, et al., EMBO J. 17, 5321-5333 (1998)].
Ингибирование JAK3 и TYK2 подавляет фосфорилирование тирозина STAT3 и клеточный рост грибовидного микоза, вида Т-клеточной лимфомы кожи. Данные результаты свидетельствуют о том, что киназы семейства JAK участвуют в пути JAK/STAT, конститутивно активированном при грибовидном микозе [Nielsen, et al., Proc. Nat. Acad. Sci U.S.A. 94, 6764-6769 (1997)]. Подобным образом показано, что у мышей при Т-клеточной лимфоме, изначально характеризующейся сверхэкспрессией LCK, STAT3, STAT5, JAK1 и JAK2 находятся в конститутивно активированном состоянии, что дополнительно свидетельствует об участии пути JAK/STAT в аномальном клеточном росте [Yu, et al., J. Immunol. 159, 5206-5210 (1997)]. Кроме того, ингибитор JAK блокирует IL-6-опосредованную активацию STAT3, что приводит к инициации апоптоза клеток миеломы [Catlett-Falcone, et al., Immunity 10, 105-115 (1999)].
Одно из важных семейств киназ включает в себя Rho-ассоциированную сверхспирализованную серин/треониновую протеинкиназу (ROCK), которая, как полагают, является эффектором Ras-родственной малой ГТФ-азы Rho. Семейство ROCK включает в себя p160ROCK (ROCK-I) (Ishizaki et al., EMBO J. 1996, 15, 1885-1893) и ROKα/Rho-киназа/ROCK-II (Leung et al., J. Biol. Chem. 1995, 270, 29051-29054; Matsui et al., EMBO J. 1996, 15, 2208-2216; Nakagawa et al., FEBS Lett. 1996, 392, 189-193), протеинкиназу PKN (Amano et al., Science 1996, 271, 648-650; Watanabe et al., Science 1996, 271, 645-648) и цитрон-киназу (Madaule et al., Nature, 1998, 394, 491-494; Madaule et al., FEBS Lett. 1995, 377, 243-248). Показано, что киназы семейства ROCK участвуют в осуществлении ряда функций, в том числе Rho-индуцированного образования актиновых стрессорных волокон и очагов адгезии (Leung et al., Mol Cell Biol. 1996, 16, 5313-5327; Amano et al., Science, 1997, 275, 1308-1311; Ishizaki et al., FEBS Lett. 1997, 404, 118-124), а также в таких процессах, как понижающая регуляция миозин-фосфатазы (Kimura et al., Science, 1996, 273, 245-248), активация тромбоцитов (Klages et al., J. Cell. Biol., 1999, 144, 745-754), сокращение гладкой мускулатуры аорты под действием разных стимулов (Fu et al., FEBS Lett, 1998, 440, 183-187), тромбин-индуцированные ответы клеток гладкой мускулатуры аорты (Seasholtz et al., Cir. Res., 1999, 84, 1186-1193), гипертрофия кардиомиоцитов (Kuwahara et al., FEBS Lett., 1999, 452, 314-318), сокращение гладкой мускулатуры бронхов (Yoshii et al., Am. J. Respir. Cell. Mol. Biol., 1999, 20, 1190-1200), сокращение гладкой мускулатуры и реорганизация цитоскелета немышечных клеток (Fukata et al., Trends in Pharm. Sci. 2001, 22, 32-39), активация регулирумых по объему анионных каналов (Nilius et al., J. Physiol, 1999, 516, 67-74), ретракция нейритов (Hirose et al., J. Cell. Biol., 1998, 141, 1625-1636), хемотаксис нейтрофилов (Niggli, FEBS Lett., 1999, 445, 69-72), заживление раны (Nobes and Hall, J. Cell. Biol., 1999, 144, 1235-1244), инвазия опухоли (Itoh et al., Nat. Med., 1999, 5, 221-225) и трансформация клеток (Sahai et al., Curr. Biol., 1999, 9, 136-145). Более конкретно, ROCK участвует в развитии таких заболеваний и расстройств, как гипертония (Satoh et al., J. Clin. Invest. 1994, 94, 1397-1403; Mukai et al., FASEB J. 2001, 15, 1062-1064; Uehata et al., Nature 1997, 389, 990-994; Masumoto et al., Hypertension, 2001, 38, 1307-1310), спазм мозговых сосудов (Sato et al., Circ. Res. 2000, 87, 195-200; Miyagi et al., J. Neurosurg. 2000, 93, 471-476; Tachibana et al., Acta Neurochir (Wien) 1999, 141, 13-19), коронароспазм (Shimokawa et al., Jpn. Cir. J. 2000, 64, 1-12; Kandabashi et al., Circulation 2000, 101, 1319-1323; Katsumata et al., Circulation 1997, 96, 4357-4363; Shimokawa et al., Cardiovasc. Res. 2001, 51, 169-177; Utsunomiya et al., J. Pharmacol. 2001, 134, 1724-1730; Masumoto et al., Circulation 2002, 105, 1545-1547), бронхиальная астма (Chiba et al., Comp. Biochem. Physiol. C Pharmacol. Toxicol. Endocrinol. 1995, 11, 351-357; Chiba et al., Br. J. Pharmacol. 1999, 127, 597-600; Chiba et al., Br. J. Pharmacol. 2001, 133, 886-890; Iizuka et al., Eur. J. Pharmacol. 2000, 406, 273-279), преждевременные роды (Niro et al., Biochem. Biophys. Res. Commun. 1997, 230, 356-359; Tahara et al., Endocrinology 2002, 143, 920-929; Kupittayanant et al., Pflugers Arch. 2001, 443, 112-114), эректильная дисфункция (Chitaley et al., Nat. Med. 2001, 7, 119-122; Mills et al., J. Appl. Physiol. 2001, 91, 1269-1273), глаукома (Honjo et al., Arch. Ophthalmol. 2001, 1171-1178; Rao et al., Invest. Ophthalmol. Vis. Sci. 2001, 42, 1029-1037), пролиферация клеток гладкой мускулатуры сосудов (Shimokawa et al., Cardiovasc. Res. 2001, 51, 169-177; Morishige et al., Arterioscler. Thromb. Vasc. Biol. 2001, 21, 548-554; Eto et al., Am. J. Physiol. Heart Circ. Physiol. 2000, 278, H1744-H1750; Sawada et al., Circulation 2000, 101, 2030-2023; Shibata et al., Circulation 2001, 103, 284-289), гипертрофия миокарда (Hoshijima et al., J. Biol. Chem. 1998, 273, 7725-77230; Sah et al., J. Biol. Chem. 1996, 271, 31185-31190; Kuwahara et al., FEBS Lett. 1999, 452, 314-318; Yanazume et al., J. Biol. Chem. 2002, 277, 8618- 8625), малигнома (Itoh et al., Nat. Med. 1999, 5, 221-225; Genda et al., Hepatology 1999, 30, 1027-1036; Somlyo et al., Biochem. Biophys. Res. Commun. 2000, 269, 652-659), повреждение, вызванное ишемией/реперфузией (Ikeda et al., J. of Surgical Res. 2003, 109, 155-160; Miznuma et al., Transplantation 2003, 75, 579-586), дисфункция эндотелия (Hernandez-Perera et al., Circ. Res. 2000, 87, 616-622; Laufs et al., J. Biol. Chem. 1998, 273, 24266- 24271; Eto et al., Circ. Res. 2001, 89, 583-590), болезнь Крона и колит (Segain et al., Gastroenterology 2003, 124(5), 1180-1187), разрастание нейритов (Fournier et al., J. Neurosci. 2003, 23, 1416-1423), болезнь Рейно (Shimokawa et al., J. Cardiovasc. Pharmacol. 2002, 39, 319-327) и атеросклероз (Retzer et al., FEBS Lett. 2000, 466, 70-74; Ishibashi et al., Biochim. Biophys. Acta 2002, 1590, 123-130). Соответственно, ингибиторы киназы ROCK можно использовать в качестве терапевтических средств для лечения заболеваний, связанных с путем киназы ROCK.
ERK2 (киназа, регулируемая внеклеточными сигналами) является членом семейства киназ митоген-активируемого белка (MAP)1 млекопитающих. Киназы (MAP)1 представляют собой серин/треониновые киназы, которые опосредуют пути передачи внутриклеточных сигналов (Cobb and Goldsmith, J Biol Chem., 1995, 270, 14843; Davis, Mol. Reprod. Dev. 1995, 42, 459) и активируются митогенами и факторами роста (Bokemeyer et al., Kidney Int. 1996, 49, 1187). Члены киназного семейства MAP имеют подобные последовательности и консервативные структурные домены и, помимо ERK2, включают в себя киназы JNK (N-концевая киназа Jun) и p38. Киназы JNK и p38 активируются в ответ на провоспалительные цитокины TNF-альфа и интерлейкин-1, а также на факторы клеточного стресса, такие как тепловой шок, гиперосмолярность, ультрафиолетовое излучение, липополисахариды и ингибиторы белкового синтеза (Derijard et al., Cell 1994, 76, 1025; Han et al., Science 1994, 265, 808; Raingeaud et al., J Biol Chem. 1995, 270, 7420; Shapiro and Dinarello, Proc. Natl. Acad. Sci. USA 1995, 92, 12230). ERK, наоборот, активируются под действием митогенов и факторов роста (Bokemeyer et al., Kidney Int. 1996, 49, 1187).
ERK2 представляет собой широко распространенную протеинкиназу, которая проявляет максимальную активность при фосфорилировании обоих Thr183 и Tyr185 вышестоящей киназой киназы MAP, MEK1 (Anderson et al., Nature 1990, 343, 651; Crews et al., Science 1992, 258, 478). После активации ERK2 фосфорилирует многие регуляторные белки, в том числе протеинкиназы Rsk90 (Bjorbaek et al., J. Biol. Chem. 1995, 270, 18848) и MAPKAP2 (Rouse et al., Cell 1994, 78, 1027) и факторы транкрипции, такие как ATF2 (Raingeaud et al., Mol. Cell Biol. 1996, 16, 1247), Elk-1 (Raingeaud et al., Mol Cell Biol 1996, 16, 1247), c-Fos (Chen et al., Proc. Natl. Acad. Sci. USA 1993, 90, 10952) и c-Myc (Oliver et al., Proc. Soc. Exp. Biol. Med. 1995, 210, 162). ERK2 также является нижестоящей мишенью для Ras/Raf-зависимых путей (Moodie et al., Science 1993, 260, 1658) и может способствовать передаче сигналов от этих потенциально онкогенных белков. Показано, что ERK2 играет роль в отрицательном контроле роста клеток рака молочной железы (Frey and Mulder, Cancer Res. 1993, 57, 628) и что в клетках рака молочной железы человека наблюдается сверхэкспрессия ERK2 (Sivaraman et al., J Clin. Invest. 1997, 99, 1478). Активированная ERK2 также участвует в пролиферации эндотелин-стимулированных клеток гладкой мускулатуры дыхательных путей, это позволяет предположить, что данная киназа играет важную роль в развитии астмы (Whelchel et al., Am. J. Respir. Cell Mol Biol. 1997, 16, 589).
Киназа-3 гликоген-синтазы (GSK-3) представляет собой серин/треониновую протеинкиназу, включающую в себя α- и β-изоформы, кодируемые разными генами [Coghlan et al., Chemistry & Biology 2000, 7, 793-803; and Kim and Kimmel, Curr. Opinion Genetics Dev., 2000 10, 508-514]. GSK-3 участвует в развитии разных заболеваний, включающих в себя диабет, болезнь Альцгеймера, заболевания ЦНС, такие как маниакально-депрессивное заболевание и нейродегенеративные заболевания, и гипертрофию кардиомиоцитов [заявки PCT №№: WO 99/65897 и WO 00/38675; и Haq et al., J. Cell Biol. 2000, 151, 117-130]. Данные заболевания связаны с аномальным функционированием некоторых клеточных сигнальных путей, опосредованных GSK-3. Обнаружено, что GSK-3 фосфорилирует ряд регуляторных белков и модулирует их активность. Данные белки включают в себя гликоген-синтазу, которая представляет собой фермент, необходимый для синтеза гликогена и ограничивающий скорость синтеза, белок Tau, ассоциированный с микротрубочками, фактор транскрипции генов β-катенин, фактор инициации трансляции e1F2B, а также АТФ-цитрат-лиазу, аксин, фактор теплового шока-1, c-Jun, c-myc, c-myb, CREB и CEPBα. Указанные белковые мишени вовлекают GSK-3 в разные аспекты клеточного метаболизма, пролиферацию, дифференциацию и развитие.
В GSK-3-опосредованном пути, который имеет отношение к лечению диабета типа II, инсулин-индуцированная передача сигнала приводит к поглощению глюкозы клеткой и синтезу гликогена. Наряду с участием в данном пути, GSK-3 также является отрицательным регулятором инсулин-индуцированного сигнала. Как правило, инсулин ингибирует GSK-3-опосредованное фосфорилирование и вызывает дезактивацию гликоген-синтазы. Ингибирование GSK-3 приводит к увеличению синтеза гликогена и поглощению глюкозы [Klein et al., PNAS 1996, 93, 8455-8459; Cross et al., Biochem. J. 1994, 303, 21-26); Cohen, Biochem. Soc. Trans. 1993, 21, 555-567; and Massillon et al., Biochem J. 1994, 299, 123-128]. Однако у диабетических пациентов с расстройством инсулинового ответа синтез гликогена и поглощение глюкозы не повышаются в присутствии относительно высоких уровней глюкозы. Это приводит к аномально высоким уровням глюкозы в крови с острыми и длительными приступами и, в конечном счете, может привести к сердечно-сосудистому заболеванию, почечной недостаточности и слепоте. У таких пациентов отсутствует нормальное инсулин-индуцированное ингибирование GSK-3. Также описано, что у пациентов с диабетом типа II наблюдается сверхэкспрессия GSK-3 [см. заявку PCT: WO 00/38675]. Следовательно, терапевтические ингибиторы GSK-3 можно использовать для лечения диабетических пациентов с нарушением ответа на инсулин.
Активность GSK-3 также связана с болезнью Альцгеймера. Данное заболевание характеризуется присутствием широко известного β-амилоидного пептида и образованием внутриклеточных нейрофибриллярных клубков. Пептиды Aβ образуются из амилоидного белка-предшественника (APP) в результате последовательного протеолиза, катализируемого аспартил-протеазой BACE2, с последующим расщеплением презенилин-зависимой γ-секретазой. Показано, что антитела против β-амилоидных бляшек способны замедлять ухудшение познавательной способности у пациентов с болезнью Альцгеймера (Hock et al., Neuron, 2003, 38, 547-554), следовательно, для лечения болезни Альцгеймера и других психотических и нейродегенеративных заболеваний можно использовать и другие стратегии снижения β-амилоидного уровня (например, с использованием средств, способных ингибировать β-амилоидный пептид). Кроме того, нейрофибриллярные клубки содержат гиперфосфорилированный белок Tau, фосфорилирование которого осуществляется по неправильным участкам, следовательно, средства, способные ингибировать гиперфосфорилирование белка Tau, можно использовать для лечения болезни Альцгеймера и других психотических и нейродегенеративных заболеваний.
Известно, что GSK-3 фосфорилирует данные неправильные участки у клеточных и животных моделей. Кроме того, показано, что ингибирование GSK-3 предотвращает гиперфосфорилирование Tau в клетках [Lovestone et al., Current Biology 1994, 4, 1077-86; and Brownlees et al., Neuroreport 1997, 8, 3251-55]. Таким образом, активность GSK-3 инициирует образование нейрофибриллярных клубков и развитие болезни Альцгеймера. Также показано, что GSK-3 способствует процессингу APP и что ингибитор GSK-3 (литиевый) подавляет образование пептидов Aβ посредством ингибирования GSK-3 (Phiel et al. Nature 2003, 423, 435-439). Следовательно, ингибиторы GSK-3 можно использовать для уменьшения числа амилоидных бляшек и нейрофибриллярных клубков, патологических признаков болезни Альцгеймера, а также для лечения других психотических и нейродегенеративных заболеваний.
Другим субстратом GSK-3 является β-катенин, который разрушается после фосфорилирования под действием GSK-3. Пониженные уровни β-катенина наблюдаются у пациентов, страдающих от шизофрении и других заболеваний, связанных с увеличением гибели нейронных клеток [Zhong et al., Nature 1998, 395, 698-702; Takashima et al., PNAS 1993, 90, 7789-93; and Pei et al., J. Neuropathol. Exp 1997, 56, 70-78].
Активность GSK-3 также связана с ударом [Wang et al., Brain Res 2000, 859, 381-5; Sasaki et al., Neurol Res 2001, 23, 588-92; Hashimoto et al., J. Biol. Chem 2002, 277, 32985-32991].
Подсемейство киназ AGC фосфорилирует субстраты по сериновым и треониновым остаткам и участвует в ряде хорошо известных сигнальных процессов, включающих в себя, без ограничения, сигнальный путь циклического АМФ, ответ на инсулин, защиту от апоптоза, сигнальный путь диацилглицерина и контролирование трансляции белков (Peterson et al., Curr. Biol 1999, 9, R521). Данное подсемейство включает в себя PKA, PKB (c-Akt), PKC, PRK1, 2, P70S6K и PDK.
Показано, что при некоторых типах раковых заболеваний наблюдается сверхэкспрессия AKT (также известной как PKB или Rac-PK-бета), серин/треониновой протеинкиназы, которая опосредует нормальные клеточные функции [(Khwaja, A., Nature 1999, 401, 33-34); (Yuan, Z.Q., et al., Oncogene 2000, 19, 2324-2330); (Namikawa, K., et al., J Neurosci. 2000, 20, 2875-2886)]. AKT содержит N-концевой домен плекстриновой гомологии (PH), киназный домен и C-концевой "хвостовой" участок. До настоящего момента описано три изоформы человеческой киназы AKT (AKT-1, -2 и -3) [(Cheng, J.Q., Proc. Natl. Acad. Sci. USA 1992, 89, 9267-9271); (Brodbeck, D. et at, J. Biol. Chem. 1999, 274, 9133-9136)]. Домен PH связывает 3-фосфоинозитиды, которые синтезируются с помощью фосфатидилинозитол-3-киназы (PI3K) после стимуляции факторами роста, такими как тромбоцитарный фактор роста (PDGF), фактор роста нервов (NGF) и инсулиноподобный фактор роста (IGF-1) [(Kulik et al., Mol. Cell. Biol., 1997, 17, 1595-1606); (Hemmings, B.A., Science, 1997, 275, 628-630)]. Связывание липидов с доменом PH инициирует транслокацию AKT к плазматической мембране и облегчает фосфорилирование под действием других протеинкиназ, содержащих домен PH, PDK1 - по Thr308, Thr309 и Thr305 для изоформ AKT 1, 2 и 3 соответственно. Вторая, еще неизвестная, киназа требуется для фосфорилирования Ser473, Ser474 или Ser472 в C-концевых хвостовых участках AKT-1, -2 и -3 соответственно с получением полностью активированного фермента AKT.
После локализации на мембране AKT опосредует некоторые клеточные функции, в том числе метаболические эффекты инсулина (Calera, M.R. et at, J. Biol. Chem. 1998, 273, 7201-7204), индукцию дифференциации и/или пролиферации, синтез белков и стрессовые ответы (Alessi, D.R. et at, Curr. Opin. Genet. Dev. 1998, 8, 55-62).
Изменение регуляции AKT происходит при повреждениях и заболеваниях, причем наиболее важную роль оно играет при раковых заболеваниях. Первое упоминание об AKT связано с карциномами яичников человека, где повышение экспрессии AKT наблюдается в 15% случаев (Cheng, J.Q. et at, Proc. Natl. Acad. Sci. U.S.A. 1992, 89, 9267-9271). Также было обнаружено, что сверхэкспрессия AKT наблюдается в 12% случаев рака поджелудочной железы (Cheng, J. Q. et at, Proc. Natl. Acad. Sci. U.S.A. 1996, 93, 3636-3641). Показано, что сверхэкспрессия AKT происходит в 12% случаев карциномы яичников и что высокая частота амплификации AKT наблюдается в 50% случаев недифференцированных опухолей, это позволяет предположить, что AKT также может быть связана с агрессивностью опухоли (Bellacosa, et al., Int. J. Cancer 1995, 64, 280-285).
Показано, что PKA (также известная как цАМФ-зависимая протеинкиназа) регулирует многие жизненно важные функции, в том числе энергетический метаболизм, транскрипцию генов, пролиферацию, дифференциацию, репродуктивную функцию, секрецию, активность нейронов, память, сократительную способность и двигательную активность (Beebe, S.J., Semin. Cancer Biol. 1994, 5, 285-294). PKA представляет собой тетрамерный холофермент, который содержит две каталитические субъединицы, связанные с гомодимерной регуляторной субъединицей (функция которой заключается в ингибировании каталитических субъединиц). После связывания цАМФ (активации фермента) каталитические субъединицы отделяются от регуляторных субъединиц с образованием активной серин/треониновой киназы (McKnight, G.S. et al., Recent Prog. Horm. Res. 1988, 44, pp. 307). На сегодняшний день описаны три изоформы каталитической субъединицы (C-α, C-β и C-γ) (Beebe, S.J. et al., J. Biol. Chem. 1992, 267, 25505-25512), причем наиболее широко изучается субъединица C-α, в основном из-за того, что она экспрессируется на повышенном уровне в клетках первичных и метастатических меланом (Becker, D. et al., Oncogene 1990, 5, 1133). В настоящее время способы модулирования активности субъединицы C-α включают в себя применение антител, молекул, которые блокируют активность PKA путем воздействия на регуляторные димеры, и экспрессию антисмысловых олигонуклеотидов.
Рибосомальные протеинкиназы p70S6K-1 и -2 также являются членами подсемейства протеинкиназ AGC и катализируют фосфорилирование и последующую активацию рибосомального белка S6, который участвует в повышающей регуляции трансляции мРНК, кодирующих компоненты аппарата белкового синтеза. Указанные мРНК содержат олигопиримидиновый фрагмент на 5'-сайте инициации транскрипции, называемый 5'TOP, который, как показано, необходим для регуляции на уровне трансляции (Volarevic, S. et al., Prog. Nucleic Acid Res. Mol. Biol., 2001, 65, 101-186). p70S6K-зависимое фосфорилирование S6 инициируется в ответ на ряд гормонов и факторов роста, в основном, через путь PI3K (Coffer, P.J. et al., Biochem. Biophys. Res. Commun, 1994 198, 780-786), который может регулироваться mTOR, поскольку рапамицин ингибирует активность p70S6K и блокирует синтез белков, особенно, посредством понижающей регуляции трансляции мРНК, кодирующих рибосомальные белки (Kuo, C.J. et al., Nature 1992, 358, 70-73).
In vitro PDK1 катализирует фосфорилирование Thr252 в активационной петле каталитического домена p70, которое необходимо для осуществления активности p70 (Alessi, D.R., Curr. Biol., 1998, 8, 69-81). Исследования dp70S6K дрозофил и мышиной p70S6K-1 с использованием рапамицина и делеции генов показали, что p70 играет ключевую роль в передаче сигналов, связанных с клеточным ростом и пролиферацией.
3-Фосфоинозитид-зависимая протеинкиназа-1 (PDK1) играет ключевую роль в регуляции активности ряда киназ, принадлежащих к подсемейству протеинкиназ AGC (Alessi, D. et al., Biochem. Soc. Trans 2001, 29, 1). Данные киназы включают в себя изоформы протеинкиназы B (PKB, также известной как AKT), киназы p70 рибосомального S6 (S6K) (Avruch, J. et al., Prog. Mol. Subcell. Biol. 2001, 26, 115) и киназы p90 рибосомального S6 (Frödin, M. et al., EMBO J. 2000, 19, 2924-2934). Опосредуемая PDK1 передача сигнала активируется в ответ на инсулин и факторы роста, а также на присоединение клетки к внеклеточному матриксу (интегриновый сигнальный путь). После активации данные ферменты опосредуют разнообразные клеточные события путем фосфорилирования основных регуляторных белков, которые играют важную роль в контролировании таких процессов, как выживание, рост и пролиферация клеток, а также метаболизм глюкозы [(Lawlor, M.A. et al., J. Cell Sci. 2001, 114, 2903-2910), (Lawlor, M.A. et al., EMBO J. 2002, 21, 3728-3738)]. PDK1 представляет собой белок из 556 аминокислот, содержащий N-концевой каталитичес