- или -кристаллические модификации 5'-дезокси-n4-карбопентилокси-5-фторцитидина, способ их получения и фармацевтические композиции на их основе
Иллюстрации
Показать всеПредложены α- и β-кристаллические формы 5'-дезокси-N4-карбопентилокси-5-фторцитидина формулы (III), способ их получения путем кристаллизации продукта-сырца из подходящего растворителя и фармацевтические композиции на их основе, обладающие противораковой активностью. При получении α-модификации в качестве растворителя используют сложный эфир или смеси растворителей, содержащие сложный эфир. При получении β-модификации в качестве растворителя используют смесь вода-алканол или смесь тетрагидрофуран-диэтиловый эфир или четыреххлористый углерод. 5 н. и 2 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к биологически активным соединениям, в частности к α- и β-кристаллическим модификациям 5'-дезокси-N4-карбопентилокси-5-фторцитидина, способу их получения и фармацевтическим композициям на их основе. Данные кристаллические модификации могут быть использованы в производстве лекарственных препаратов для лечения рака толстого кишечника, молочной железы и яичников [Fischer, D.S.; Knobf, М.Т.; Durivage, H.J.; Beaulieu, N.J. (2003). The Cancer Chemotherapy Handbook (6 th Ed.). Mosby.].
Известны производные 5'-дезокси-5-фторцитидина общей формулы
демонстрировавшие высокую противораковую активность [Jap. J. Cancer Res., 1990, 81, 188-195].
Представитель этой группы соединений 5'-дезокси-N4-карбопентилокси-5-фторцитидин проявляет противоопухолевую активность за счет высвобождения в клетках опухоли 5-фторурацила, который является антиметаболитом пиримидина (ингибитором тимидилатсинтазы). Применение в производстве лекарств данного биологически активного вещества в форме аморфного порошка имеет недостаток, связанный с его способностью образовывать пыль при проведении операций сушки и фасовки, а также при производстве лекарственной формы, приводящей к загрязнению производственных помещений и представляющей опасность для здоровья персонала. Действие лекарственной пыли на организм в значительной мере зависит от степени ее дисперсности. Характеризуя с этой точки зрения лекарственную пыль, следует отметить, что большинство ее видов является высокодисперсными аэрозолями. На 96-98% они состоят из пылевых частиц размером менее 5 мкм. Вследствие этого практически все аэрозоли лекарств обладают высокой стабильностью в воздухе и способны глубоко проникать в легкие. Попадая на кожу, слизистые оболочки, в дыхательную систему, аэрозоль может оказывать специфическое неблагоприятное воздействие: токсическое, раздражающее, аллергическое и др. Ряд лекарственных веществ одновременно может оказывать и токсическое и раздражающее или какое-либо другое действие. Например, антибиотики широкого спектра действия обладают токсическим, аллергенным свойством и вызывают дисбактериоз. Еще одним недостатком является слеживание и небольшие сроки хранения.
Задача изобретения состоит в том, чтобы разработать такие формы биологически активного соединения, которые наряду с высокой противораковой активностью обладали бы улучшенными свойствами для дальнейшей переработки в лекарственные препараты.
Указанная задача решается предложенной α-кристаллической формой соединения формулы (III):
отличающаяся следующей диаграммой рентгеновской дифракции порошка, измеряемой с применением дифрактометра "STOE Powder Diffraction System" с рабочей частотой K1α 1,54060 Å (Cu), монохроматором Ge (111), излучателем с рабочим напряжением 40 kV при силе тока 40 mA, и выражаемой в терминах: межплоскостное расстояние d, угол 2θ, абсолютная и относительная интенсивности (выражаемые в процентах от наиболее интенсивного рефлекса):
| D, Å | 2θ | Интенсивность абсолютная, % | Интенсивность относительная, % |
| 18.706518 | 4.7200 | 695 | 6.29 |
| 17.392509 | 5.0768 | 2019 | 18.26 |
| 8.349193 | 10.5873 | 1423 | 12.87 |
| 5.145699 | 17.2188 | 1816 | 16.42 |
| 4.984726 | 17.7793 | 1045 | 9.45 |
| 4.714762 | 18.8063 | 4601 | 41.61 |
| 4.589795 | 19.3232 | 2920 | 26.41 |
| 4.526295 | 19.5969 | 3998 | 36.15 |
| 4.415842 | 20.0921 | 11057 | 100.00 |
| 4.248667 | 20.8914 | 1439 | 13.01 |
| 4.169528 | 21.2925 | 1089 | 9.85 |
| 4.041695 | 21.9742 | 1294 | 11.71 |
| 3.586609 | 24.8042 | 599 | 5.42 |
| 3.510801 | 25.3486 | 3100 | 28.04 |
| 3.495126 | 25.4642 | 1643 | 14.86 |
| 3.441927 | 25.8645 | 2445 | 22.11 |
| 3.360984 | 26.4986 | 1331 | 12.03 |
| 3.255179 | 27.3764 | 438 | 3.96 |
| 3.134357 | 28.4535 | 1197 | 10.83 |
| 3.060282 | 29.1573 | 312 | 2.82 |
| 3.002893 | 29.7272 | 374 | 3.38 |
| 2.867519 | 31.1654 | 355 | 3.21 |
| 2.783453 | 32.1317 | 480 | 4.34 |
| 2,702822 | 33.1175 | 963 | 8.71 |
| 2.676631 | 33.4510 | 1177 | 10.64 |
| 2.638055 | 33.9549 | 747 | 6.76 |
| 2.600138 | 34.4654 | 419 | 3.79 |
| 2.586441 | 34.6537 | 1078 | 9.75 |
| 2.483769 | 36.1345 | 507 | 4.59 |
| 2.453536 | 36.5954 | 619 | 5.60 |
| 2.373557 | 37.8746 | 436 | 3.95 |
| 2.360295 | 38.0956 | 436 | 3.94 |
| 2.277506 | 39.5370 | 742 | 6.71 |
Указанная выше задача решается также β-кристаллической формой соединения формулы III:
отличающаяся следующей диаграммой рентгеновской дифракции порошка, измеряемой с применением дифрактометра "STOE Powder Diffraction System" с рабочей частотой К1α 1,54060 Å (Cu), монохроматором Ge(111), излучателем с рабочим напряжением 40 kV при силе тока 40 mA и выражаемой в терминах: межплоскостное расстояние d, угол 2θ, абсолютная и относительная интенсивности (выражаемые в процентах от наиболее интенсивного рефлекса):
| D, Å | 2θ | Интенсивность абсолютная, % | Интенсивность относительная, % |
| 17.457664 | 5.0579 | 5943 | 100.00 |
| 8.355730 | 10.5790 | 851 | 14.33 |
| 5.148365 | 17.2098 | 1076 | 18.10 |
| 4.992127 | 17.7527 | 957 | 16.11 |
| 4.719445 | 18.7875 | 1646 | 27.70 |
| 4.590744 | 19.3192 | 1218 | 20.49 |
| 4.528882 | 19.5856 | 1317 | 22.16 |
| 4.417918 | 20.0826 | 2939 | 49.45 |
| 4.353234 | 20.3842 | 962 | 16.19 |
| 4.250788 | 20.8809 | 850 | 14.31 |
| 4.170886 | 21.2855 | 807 | 13.58 |
| 4.044059 | 21.9612 | 816 | 13.73 |
| 3.590448 | 24.7772 | 472 | 7.95 |
| 3.511590 | 25.3428 | 854 | 14.36 |
| 3.443123 | 25.8554 | 762 | 12.83 |
| 3.363979 | 26.4746 | 554 | 9.32 |
| 3.136288 | 28.4356 | 536 | 9.02 |
| 2.706745 | 33.0681 | 383 | 6.44 |
| 2.676772 | 33.4492 | 400 | 6.72 |
| 2.587544 | 34.6384 | 472 | 7.95 |
Предложен способ получения кристаллических форм соединения формулы (III):
путем кристаллизации продукта-сырца из подходящего растворителя.
Способ, в котором для получения α-кристаллической формы соединения формулы (III) продукт кристаллизуют из растворителя, относящегося к классу сложных эфиров, или смеси растворителей, содержащей сложный эфир, причем в качестве сложного эфира используют этилацетат.
Способ, в котором для получения β-кристаллической формы соединения формулы (III) продукт получают кристаллизацией из смеси вода-алканол, причем в качестве алканола используют метанол.
Способ, в котором для получения β-кристаллической формы соединения формулы (III) продукт получают кристаллизацией из смеси тетрагидрофуран-диэтиловый эфир или из четыреххлористого углерода.
Еще одним объектом изобретения является фармацевтическая композиция, включающая в качестве активного ингредиента α-кристаллическую форму соединения формулы III в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными соединениями.
Предложена также фармацевтическая композиция, включающая в качестве активного ингредиента β-кристаллическую форму соединения формулы III в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными соединениями.
5'-Дезокси-N4-карбопентилокси-5-фторцитидин (формула III) получают селективным дезацилированием О2',О3'-диацетил-5'-дезокси-N4-карбопентилокси-5-фторцитидина (формула II) под действием основания:
О2',O3'-Диацетил-5дезокси-N4-карбопентилокси-5-фторцитидин (формула II) получают селективным присоединением н-пентилхлоркарбоната к О2',O3'-диацетил-5'-дезокси-5'-фторцитидину (формула I) в присутствии органических оснований:
Способы получения предложенных кристаллических модификаций иллюстрируются следующими примерами:
Пример 1. O2'O3'-Диацетил-5'-дезокси-5-фторцитидин (формула I)
К суспензии 2,6 кг (20 моль) 5-фторцитозина в 8 л гексаметилдисилазана (далее ГМДС) при перемешивании добавляют 120-140 мл триметилхлорсилана. Смесь кипятят при перемешивании до растворения осадка 5-фторцитозина (3-5 ч), охлаждают, отгоняют летучие продукты в вакууме. Остаток растворяют в 20 л хлористого метилена и переносят в 100-литровый термостатируемый реактор, снабженный обратным водяным холодильником, производительной механической мешалкой и капельной воронкой. Приливают 20 л хлористого метилена и добавляют 6 кг (21,6 моль) 5-дезокси-1,2,3-три-O-ацетил-β-(D)-рибофуранозы. Реакционную смесь охлаждают до 0°С и при перемешивании по каплям прибавляют 6,24 кг безводного SnCl4 в течение 30-40 мин. Реакционную смесь перемешивают 2 ч при комнатной температуре, охлаждают реакционную смесь до 0-10°С, присыпают 10 кг сухой питьевой соды и по каплям осторожно прибавляют 3,5 л воды. Реакционную смесь перемешивают при комнатной температуре в течение ночи, фильтруют от осадка неорганических солей и остаток на фильтре промывают 7 л хлористого метилена, объединенный фильтрат промывают 10 л 4%-ного раствора питьевой соды, растворитель отгоняют в вакууме при атмосферном давлении. К остатку при перемешивании прибавляют 6 л метилтретбутилового эфира (МТБЭ), выпавший кристаллический продукт фильтруют и сушат на воздухе до постоянной массы. Получают 5,0-5,6 кг белого или желтоватого кристаллического вещества (формула I), т.пл. 191-193°С. (1с CHCl3)+86.
ЯМР 1H (δ м.д. CDCl3) 8,1 (1Н уширенный с.), 7,39 (1Н д. 5,81 Hz), 5,99 (1Н д. 3,79 Hz), 5,69 (1Н уширенный с.), 5,32 (1Н т. 4,95 Hz), 5,00 (1Н т.5,90 Hz), 4,24 (1Н п.6,20 Hz), 2,11 (3Н с.), 2,09 (3Н с.), 1,46 (3Н д. 6,57 Hz).
Пример 2. О2',O3'-Диацетил-5-дезокси-N4-карбопентилокси-5-фторцитидин (формула II)
В 20-литровый термостатируемый реактор, снабженный обратным водяным холодильником, производительной механической мешалкой и капельной воронкой, помещают раствор 2,5 кг (7,6 моль) 2',3'-ди-O-ацетил-5'-дезокси-5-фторцитидина (формула I) в 6 л CH2Cl2 и 1,23 л пиридина, при охлаждении до -10°С добавляют по каплям 1,513 л (1,6 кг, 10,6 моль) н-пентилхлорформиат так, чтобы температура реакционной смеси находилась в интервале от -10°С до -5°С. Реакционную смесь перемешивают 30 мин при комнатной температуре. Прибавляют 60 мл МеОН для связывания избытка н-пентилхлорформиата, 3 л воды, отделяют органический слой, водный слой экстрагируют 2 л хлористого метилена и объединенные органические слои промывают один раз водой 4 л, растворитель упаривают в вакууме. Выход количественный.
ЯМР 1H (δ м.д. CDCl3) 12,0 (1Н уширенный с.), 7,4 (1Н уширенный с.), 5,93 (1Н д. 4,3 Hz), 5,27 (1Н т. 5,4 Hz), 4,99 (1Н т. 5,5 Hz), 4,23 (1Н п. 5,8 Hz), 4,15 (2H т. 6,7 Hz), 2,09 (3Н с.), 2,07 (3Н с.), 1,69 (2Н п.7,2 Hz), 1,44 (3Н д. 6,57 Hz), 1,37-1,29 (4H м.), 0,88 (3Н т. 6,95 Hz).
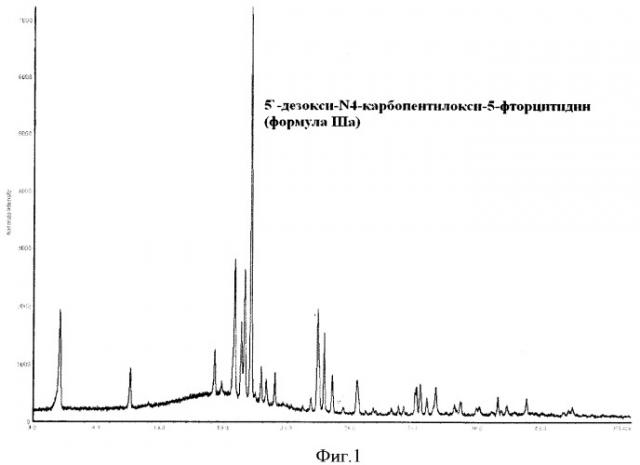
Пример 3. 5'-Дезокси-N4-карбопентилокси-5-фторцитидин α-кристаллическая модификация (формула IIIa) (см. фиг.1)
В 20-литровый термостатируемый реактор, снабженный обратным водяным холодильником, производительной механической мешалкой и капельной воронкой, помещают раствор О2',O3'-диацетил-5'-дезокси-N4-карбопентилокси-5-фторцитидина (формула II) (пример 2) в 5,5 л метанола, охлаждают до -20°С и добавляют по каплям раствор 1,262 кг NaOH в 1,75 л воды с такой скоростью, чтобы температура реакционной смеси была ниже -10°С. Реакционную смесь перешивали еще 5-10 мин, затем добавляют 2,63 л 36%-ной соляной кислоты. Растворитель удаляют в вакууме, к остатку добавляют 3 л воды и 6 л CH2Cl2. Органический слой отделяют, промывают водой и растворитель удаляют в вакууме. Полученную массу нагревают до 60°С и добавляют 2 л этилацетата. Реакционную смесь охлаждают до комнатной температуры и осадок 5'-дезокси-N4-карбопентилокси-5-фторцитидина α-кристаллической модификации (формула IIIa) фильтруют. Продукт промывают водой и сушат в вакууме. Выход 2,5 кг (80%,). Т.пл. 119-121. (с1 МеОН)+96-100. ЯМР 1H (δ м.д. CDCl3) РФА (формула IIIa):
| D, Å | 2θ | Интенсивность относительная, % | Интенсивность абсолютная, % |
| 18.706518 | 4.7200 | 6.29 | 695 |
| 17.392509 | 5.0768 | 18.26 | 2019 |
| 8.349193 | 10.5873 | 12.87 | 1423 |
| 5.145699 | 17.2188 | 16.42 | 1816 |
| 4.984726 | 17.7793 | 9.45 | 1045 |
| 4.714762 | 18.8063 | 41.61 | 4601 |
| 4.589795 | 19.3232 | 26.41 | 2920 |
| 4.526295 | 19.5969 | 36.15 | 3998 |
| 4.415842 | 20.0921 | 100.00 | 11057 |
| 4.248667 | 20.8914 | 13.01 | 1439 |
| 4.169528 | 21.2925 | 9.85 | 1089 |
| 4.041695 | 21.9742 | 11.71 | 1294 |
| 3.586609 | 24.8042 | 5.42 | 599 |
| 3.510801 | 25.3486 | 28.04 | 3100 |
| 3.495126 | 25.4642 | 14.86 | 1643 |
| 3.441927 | 25.8645 | 22.11 | 2445 |
| 3.360984 | 26.4986 | 12.03 | 1331 |
| 3.255179 | 27.3764 | 3.96 | 438 |
| 3.134357 | 28.4535 | 10.83 | 1197 |
| 3.060282 | 29.1573 | 2.82 | 312 |
| 3.002893 | 29.7272 | 3.38 | 374 |
| 2.867519 | 31.1654 | 3.21 | 355 |
| 2.783453 | 32.1317 | 4.34 | 480 |
| 2.702822 | 33.1175 | 8.71 | 963 |
| 2.676631 | 33.4510 | 10.64 | 1177 |
| 2.638055 | 33.9549 | 6.76 | 747 |
| 2.600138 | 34.4654 | 3.79 | 419 |
| 2.586441 | 34.6537 | 9.75 | 1078 |
| 2.483769 | 36.1345 | 4.59 | 507 |
| 2.453536 | 36.5954 | 5.60 | 619 |
| 2.373557 | 37.8746 | 3.95 | 436 |
| 2.360295 | 38.0956 | 3.94 | 436 |
| 2.277506 | 39.5370 | 6.71 | 742 |
Данные рентгеновской дифракции были получены с применением дифрактометра "STOE Powder Diffraction System" с рабочей частотой K1α 1,54060 Å (Cu), монохроматором Ge(111), излучателем с рабочим напряжением 40 kV при силе тока 40 mA и выражаемой в терминах: межплоскостное расстояние d, угол 2θ, абсолютная и относительная интенсивности (выражаемые в процентах от наиболее интенсивного рефлекса).
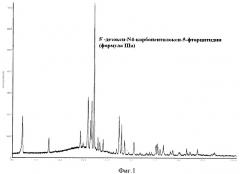
Пример 4. 5'-Дезокси-N4-карбопентилокси-5-фторцитидин β-кристаллическая модификация (формула IIIб) (из смеси метанол/вода) (см. фиг.2)
В 20-литровый термостатируемый реактор, снабженный обратным водяным холодильником, производительной механической мешалкой и капельной воронкой, помещают раствор О2',O3'-диацетил-5'-дезокси-N4-карбопентилокси-5-фторцитидина (формула II) (пример 2) в 5,5 л метанола, охлаждают до -20°С и добавляют по каплям раствор 1,262 кг NaOH в 1,75 л воды с такой скоростью, чтобы температура реакционной смеси была ниже -10°С. Реакционную смесь перешивали еще 5-10 мин, затем добавляют 2,63 л 36%-ной соляной кислоты. Растворитель удаляют в вакууме, к остатку добавляют 3 л воды и 6 л CH2Cl2. Органический слой отделяют, промывают водой и растворитель удаляют в вакууме. Полученную массу нагревают до 60°С и добавляют 2 л метанола. Постепенно прибавляют воду (ок. 4 л) до начала кристаллизации. Реакционную смесь охлаждают до комнатной температуры и осадок 5'-дезокси-N4-карбопентилокси-5-фторцитидина β-кристаллической модификации (формула IIIб) фильтруют. Продукт сушат в вакууме.
Выход 2,0 кг (64%,). Т. пл. 119-121. αD 20 (с1 МеОН)+96-100.
ЯМР 1H (δ м.д. CDCl3)
РФА (формула IIIб)
| D, Å | 2θ | Интенсивность относительная, % | Интенсивность абсолютная, % |
| 17.457664 | 5.0579 | 100.00 | 5943 |
| 8.355730 | 10.5790 | 14.33 | 851 |
| 5.148365 | 17.2098 | 18.10 | 1076 |
| 4.992127 | 17.7527 | 16.11 | 957 |
| 4.719445 | 18.7875 | 27.70 | 1646 |
| 4.590744 | 19.3192 | 20.49 | 1218 |
| 4.528882 | 19.5856 | 22.16 | 1317 |
| 4.417918 | 20.0826 | 49.45 | 2939 |
| 4.353234 | 20.3842 | 16.19 | 962 |
| 4.250788 | 20.8809 | 14.31 | 850 |
| 4.170886 | 21.2855 | 13.58 | 807 |
| 4.044059 | 21.9612 | 13.73 | 816 |
| 3.590448 | 24.7772 | 7.95 | 472 |
| 3.511590 | 25.3428 | 14.36 | 854 |
| 3.443123 | 25.8554 | 12.83 | 762 |
| 3.363979 | 26.4746 | 9.32 | 554 |
| 3.136288 | 28.4356 | 9.02 | 536 |
| 2.706745 | 33.0681 | 6.44 | 383 |
| 2.676772 | 33.4492 | 6.72 | 400 |
| 2.587544 | 34.6384 | 7,95 | 472 |
Данные рентгеновской дифракции были получены с применением дифрактометра "STOE Powder Diffraction System" с рабочей частотой K1α 1,54060 Å (Cu), монохроматором Ge(111), излучателем с рабочим напряжением 40 kV при силе тока 40 mA и выражаемой в терминах: межплоскостное расстояние d, угол 2θ, абсолютная и относительная интенсивности (выражаемые в процентах от наиболее интенсивного рефлекса).
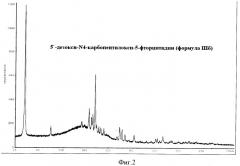
Пример 5. 5'-Дезокси-N4-карбопентилокси-5-фторцитидин β-кристаллическая модификация (формула IIIб) (из смеси тетрагидрофуран/диэтиловый эфир)
В 20-литровый термостатируемый реактор, снабженный обратным водяным холодильником, производительной механической мешалкой и капельной воронкой, помещают раствор О2',O3'-диацетил-5'-дезокси-N4-карбопентилокси-5-фторцитидина (формула II) (пример 2) в 5,5 л метанола, охлаждают до -20°С и добавляют по каплям раствор 1,262 кг NaOH в 1,75 л воды с такой скоростью, чтобы температура реакционной смеси была ниже -10°С. Реакционную смесь перешивали еще 5-10 мин, затем добавляют 2,63 л 36%-ной соляной кислоты. Растворитель удаляют в вакууме, к остатку добавляют 3 л воды и 6 л CH2Cl2. Органический слой отделяют, промывают водой и растворитель удаляют в вакууме. Полученную массу нагревают до 60°С и добавляют 2 л тетрагидрофурана. Постепенно прибавляют диэтиловый эфир (ок. 4 л) до начала кристаллизации. Реакционную смесь охлаждают до комнатной температуры и осадок 5'-дезокси-N4-карбопентилокси-5-фторцитидина β-кристаллической модификации (формула IIIб) фильтруют. Продукт сушат в вакууме.
Выход 2,3 кг (73,6%,). Т.пл. 119-121. αD 20 (с1 МеОН)+96-100.
ЯМР 1H (δ м.д. CDCl3).
РФА (формула IIIб) (см. пример 4).
Пример 6. 5'-Дезокси-N4-карбопентилокси-5-фторцитидин β-кристаллическая модификация (формула IIIб) (из смеси тетрагидрофуран/диэтиловый эфир)
В 20-литровый термостатируемый реактор, снабженный обратным водяным холодильником, производительной механической мешалкой и капельной воронкой, помещают раствор О2',O3'-диацетил-5'-дезокси-N4-карбопентилокси-5-фторцитидина (формула II) (пример 2) в 5,5 л метанола, охлаждают до -20°С и добавляют по каплям раствор 1,262 кг NaOH в 1,75 л воды с такой скоростью, чтобы температура реакционной смеси была ниже -10°С. Реакционную смесь перешивали еще 5-10 мин, затем добавляют 2,63 л 36%-ной соляной кислоты. Растворитель удаляют в вакууме, к остатку добавляют 3 л воды и 6 л CH2Cl2. Органический слой отделяют, промывают водой и растворитель удаляют в вакууме. Полученную массу нагревают до 60°С и добавляют 20 л четыреххлористого углерода до полного растворения осадка. Реакционную смесь охлаждают до комнатной температуры и осадок 5'-дезокси-N4-карбопентилокси-5-фторцитидина β-кристаллической модификации (формула IIIб) фильтруют. Продукт промывают четыреххлористым углеродом и сушат в вакууме. Выход 2,6 кг (83,2%,). Т. пл. 119-121. αD 20 (с1 МеОН)+96-100.
ЯМР 1H (δ м.д. CDCl3).
РФА (формула IIIa) см. пример 4.
Нижеследующий пример иллюстрирует получение предложенных композиций.
Пример получения композиции
Таблетка, покрытая оболочкой, содержащая следующие ингредиенты:
1) α- или β-кристаллическая форма капецитабина - 500,00 мг;
2) лактоза безводная - 142,88 мг;
3) гипромеллоза - 14.28 мг;
4) кросповидон - 150.0 мг;
5) маннит - 92.84 мг;
6) целлюлоза микрокристаллическая - 187.28 мг;
7) магния стеарат - 32.88 мг;
8) аспартам - 62.16 мг;
9) оболочка - 32,03 мг;
Общий вес - 1214,35;
Способ получения таблеток
1) смешать α- или β-кристаллическую форму капецитабина с безводной лактозой и частью кросповидона;
2) растворить гипромеллозу в очищенной воде;
3) смешать смесь по п.1 и раствор по п.2;
4) провести влажное измельчение смеси по п.3;
5) высушить и измельчить гранулят по п.4;
6) смешать гранулят по п.5 с остатком кросповидона, маннитом, микрокристаллической целлюлозой и аспартамом;
7) просеять стеарат магния через сито, добавить в смесь по п.6 и перемешать;
8) спрессовать таблетки из смеси по п.7;
9) приготовить суспензию из смеси для пленочной оболочки и очищенной воды;
10) нанести пленочное покрытие на таблетки, используя суспензию, приготовленную по п.9.
Предложенные кристаллические модификации обладают тем же уровнем указанной выше биологической активности, но более удобны в переработке в лекарственный препарат. Помимо этого, кристаллические формы капецитабина в меньшей степени подвергаются слеживанию при хранении, а лекарственные формы на их основе имеют более высокую стабильность, что обеспечивает сохранение их терапевтических свойств в течение более длительного времени.
1. α-Кристаллическая форма соединения формулы (III) отличающаяся следующей диаграммой рентгеновской дифракции порошка, измеряемой с применением дифрактометра "STOE Powder Diffraction System" с рабочей частотой K1a 1,54060 Å (Cu), монохроматором Ge (111), излучателем с рабочим напряжением 40 кВ при силе тока 40 мА и выражаемой в терминах: межплоскостное расстояние d, угол 2θ, абсолютная и относительная интенсивности (выражаемые в процентах от наиболее интенсивного рефлекса):
| D, Å | 2θ | Интенсивность абсолютная,% | Интенсивность относительная, % |
| 18.706518 | 4.7200 | 695 | 6.29 |
| 17.392509 | 5.0768 | 2019 | 18.26 |
| 8.349193 | 10.5873 | 1423 | 12.87 |
| 5.145699 | 17.2188 | 1816 | 16.42 |
| 4.984726 | 17.7793 | 1045 | 9.45 |
| 4.714762 | 18.8063 | 4601 | 41.61 |
| 4.589795 | 19.3232 | 2920 | 26.41 |
| 4.526295 | 19.5969 | 3998 | 36.15 |
| 4.415842 | 20.0921 | 11057 | 100.00 |
| 4.248667 | 20.8914 | 1439 | 13.01 |
| 4.169528 | 21.2925 | 1089 | 9.85 |
| 4.041695 | 21.9742 | 1294 | 11.71 |
| 3.586609 | 24.8042 | 599 | 5.42 |
| 3.510801 | 25.3486 | 3100 | 28.04 |
| 3.495126 | 25.4642 | 1643 | 14.86 |
| 3.441927 | 25.8645 | 2445 | 22.11 |
| 3.360984 | 26.4986 | 1331 | 12.03 |
| 3.255179 | 27.3764 | 438 | 3.96 |
| 3.134357 | 28.4535 | 1197 | 10.83 |
| 3.060282 | 29.1573 | 312 | 2.82 |
| 3.002893 | 29.7272 | 374 | 3.38 |
| 2.867519 | 31.1654 | 355 | 3.21 |
| 2.783453 | 32.1317 | 480 | 4.34 |
| 2.702822 | 33.1175 | 963 | 8.71 |
| 2.676631 | 33.4510 | 1177 | 10.64 |
| 2.638055 | 33.9549 | 747 | 6.76 |
| 2.600138 | 34.4654 | 419 | 3.79 |
| 2.586441 | 34.6537 | 1078 | 9.75 |
| 2.483769 | 36.1345 | 507 | 4.59 |
| 2.453536 | 36.5954 | 619 | 5.60 |
| 2.373557 | 37.8746 | 436 | 3.95 |
| 2.360295 | 38.0956 | 436 | 3.94 |
| 2.277506 | 39.5370 | 742 | 6.71 |
2. β-Кристаллическая форма соединения формулы (III) отличающаяся следующей диаграммой рентгеновской дифракции порошка, измеряемой с применением дифрактометра "STOE Powder Diffraction System" с рабочей частотой K1a 1,54060 Å (Cu), монохроматором Ge (111), излучателем с рабочим напряжением 40 кВ при силе тока 40 мА и выражаемой в терминах: межплоскостное расстояние d, угол 2θ, абсолютная и относительная интенсивности (выражаемые в процентах от наиболее интенсивного рефлекса):
| D, Å | 2θ | Интенсивность абсолютная | Интенсивность относительная % |
| 17.457664 | 5.0579 | 5943 | 100.00 |
| 8.355730 | 10.5790 | 851 | 14.33 |
| 5.148365 | 17.2098 | 1076 | 18.10 |
| 4.992127 | 17.7527 | 957 | 16.11 |
| 4.719445 | 18.7875 | 1646 | 27.70 |
| 4.590744 | 19.3192 | 1218 | 20.49 |
| 4.528882 | 19.5856 | 1317 | 22.16 |
| 4.417918 | 20.0826 | 2939 | 49.45 |
| 4.353234 | 20.3842 | 962 | 16.19 |
| 4.250788 | 20.8809 | 850 | 14.31 |
| 4.170886 | 21.2855 | 807 | 13.58 |
| 4.044059 | 21.9612 | 816 | 13.73 |
| 3.590448 | 24.7772 | 472 | 7.95 |
| 3.511590 | 25.3428 | 854 | 14.36 |
| 3.443123 | 25.8554 | 762 | 12.83 |
| 3.363979 | 26.4746 | 554 | 9.32 |
| 3.136288 | 28.4356 | 536 | 9.02 |
| 2.706745 | 33.0681 | 383 | 6.44 |
| 2.676772 | 33.4492 | 400 | 6.72 |
| 2.587544 | 34.6384 | 472 | 7.95 |
3. Способ получения кристаллических форм соединения по п.1 или 2 формулы (III) путем кристаллизации продукта-сырца из подходящего растворителя - для получения α-кристаллической формы соединения по п.1 продукт кристаллизуют из растворителя, относящегося к классу сложных эфиров, или смеси растворителей, содержащей сложный эфир, а для получения β-кристаллической формы соединения по п.2 продукт кристаллизуют из растворителя, относящегося к смеси вода-алканол или смеси тетрагидрофуран-диэтиловый эфир или четыреххлористому углероду.
4. Способ по п.3, отличающийся тем, что в качестве сложного эфира используют этилацетат.
5. Способ по п.3, отличающийся тем, что в качестве алканола используют метанол.
6. Фармацевтическая композиция, проявляющая противораковую активность, включающая в качестве активного ингредиента α-кристаллическую форму по п.1, в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными соединениями.
7. Фармацевтическая композиция, проявляющая противораковую активность, включающая в качестве активного ингредиента β-кристаллическую форму по п.2, в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными соединениями.