Лекарственные формы
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для лечения или предупреждения у пациента инфекции, вызванной вирусом гепатита С. Для этого вводят VX-950 или его фармацевтически приемлемую соль. Каждое из изобретений характеризует определенные режимы введения VX-950 для обеспечения эффективного лечения заболевания. Заявленные способы обеспечивают поддержание минимально низкого уровня VX-950 в плазме в течение 24-часового периода, снижение уровня ALT, существенное уменьшение уровня РНК вируса гепатита С в плазме и достижение устойчивого ответа на вирус. 5 н. и 24 з.п.ф-лы, 17 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение связано со способами лечения инфекций, вызываемых вирусом гепатита С.
ОСНОВЫ ИЗОБРЕТЕНИЯ
Инфекция, вызываемая вирусом гепатита С ("HCV"), представляет собой медицинскую проблему, привлекающую особое внимание человечества. HCV считается агентом, вызывающим болезнь в большинстве случаев заболевания не-A, не-B-гепатитом, при этом, согласно оценкам, количество серопозитивных индивидов в целом составляет порядка 3% [A. Alberti и др., "Natural History of Hepatitis C," J. Hepatology, 31., (Suppl.1), pp.17-24 (1999)]. Около четырех миллионов индивидов может быть инфицировано только в Соединенных Штатах [M.J.Alter и др., "The Epidemiology of Viral Hepatitis in the United States, Gastroenterol. Clin. North Am., 23, pp.437-455 (1994); M.J.Alter "Hepatitis C Virus Infection in the United States," J. Hepatology, 31., (Suppl.1), pp.88-91 (1999)].
Из лиц, которые становились инфицированными HCV, 20-25% способны освобождаться от вируса после острой фазы инфекции, но у 75-80% будет развиваться хроническая форма инфекции гепатита C [вводная часть, Frontiers in Viral Hepatitis. Ed. RF Schinazi, J-P Sommadossi, and CM Rice. p. xi. Elsevier (2003)]. Это обычно приводит к рецидивам и постепенному ухудшению воспаления печени, которое часто приводит к более тяжелым формам заболевания, таким как цирроз и злокачественная гепатома [M.C.Kew, "Hepatitis C and Hepatocellular Carcinoma", FEMS Microbiology Reviews, 14, pp.211-220 (1994); I. Saito et. al., "Hepatitis C Virus Infection is Associated with the Development of Hepatocellular Carcinoma," Proc. Natl. Acad. Sci. USA, 87, pp.6547-6549 (1990)]. К сожалению, не существует достаточно эффективных курсов лечения для ослабления прогрессирования хронической HCV.
Геном HCV кодирует полипротеин из 3010-3033 аминокислот [Q.L.Choo, и др., "Genetic Organization and Diversity of the Hepatitis C Virus." Proc. Natl. Acad. Sci. USA, 88, pp.2451-2455 (1991); N. Kato и др., "Molecular Cloning of the Human Hepatitis C Virus Genome From Japanese Patients with Non-A, Non-B Hepatitis," Proc. Natl. Acad. Sci. USA, 87, pp.9524-9528 (1990); A. Takamizawa и др., "Structure and Organization of the Hepatitis C Virus Genome Isolated From Human Carriers," J. Virol., 65, pp.1105-1113 (1991)]. Предполагается, что неструктурные (NS) белки HCV обеспечивают основной каталитический механизм вирусной репликации. NS-белки образуются посредством протеолитического расщепления полипротеина [R. Bartenschlager и др., "Nonstructural Protein 3 of the Hepatitis C Virus Encodes a Serine-Туре Proteinase Required for Cleavage at the NS3/4 and NS4/5 Junctions," J. Virol., 67, pp. 3835-3844 (1993); A. Grakoui и др., Characterization of the Hepatitis C Virus-Encoded Serine Proteinase: Determination of Proteinase-Dependent Polyprotein Cleavage Sites," J. Virol., 67, pp.2832-2843 (1993); A. Grakoui и др., "Expression and Identification of Hepatitis C Virus Polyprotein Cleavage Products," J. Virol., 67, pp.1385-1395 (1993); L. Tomei и др., "NS3 is a serine protease required for processing of hepatitis C virus polyprotein", J. Virol., 67, pp.4017-4026 (1993)].
NS3-белок HCV (NS3) обладает активностью сериновой протеиназы, которая содействует процессу жизнедеятельности большинства вирусных ферментов и является, таким образом, существенной для вирусной репликации и инфекционности. Известно, что мутации в NS3-протеиназе вируса желтой лихорадки снижают инфекционность вируса [Chambers, T.J. и др., "Evidence that the N-terminal Domain of Nonstructural Protein NS3 From Yellow Fever Virus is a Serine Protease Responsible for Site-Specific Cleavages in the Viral Polyprotein", Proc. Natl. Acad. Sci. USA, 87, pp.8898-8902 (1990)]. Обнаружено, что первые 181 аминокислот NS3 (остатки 1027-1207 вирусного полипротеина) содержат домен сериновой протеиназы NS3, который влияет на все четыре располагающихся ниже сайта полипротеина HCV [C. Lin и др., "Hepatitis C Virus NS3 Serine Proteinase: Trans-Cleavage Requirements and Processing Kinetics", J. Virol., 68, pp.8147-8157 (1994)].
Сериновая протеиназа NS3 HCV и связанный с ней кофактор NS4A содействуют процессу жизнедеятельности всех вирусных ферментов и являются, таким образом, существенными для вирусной репликации. Такой процессинг, по-видимому, аналогичен таковому, происходящему при действии аспартильной протеиназы вируса иммунодефицита человека, которая также вовлечена в процессинг вирусного фермента. Ингибиторы протеиназы ВИЧ, которые подавляют процессинг вирусного белка, представляют собой действенные противовирусные агенты для человеческого организма, что свидетельствует о том, что прерывание данной стадии жизненного цикла вируса приводит к терапевтически активным веществам. Следовательно, данное направление представляется привлекательным для усовершенствования лекарственных средств.
В настоящее время не существует удовлетворительных анти-HCV-агентов или способов лечения. До недавнего времени общепризнанной терапией заболевания, вызваемого HCV, было только лечение интерфероном. Сначала одобренной терапией HCV-инфекции было лечение стандартным (неПЭГилированным) интерфероном альфа. Однако интерфероны имеют значительный побочный эффект [M.A.Wlaker и др., "Hepatitis C Virus: An Overview of Current Approaches and Progress," DDT, 4, pp.518-29 (1999); D. Moradpour и др., "Current and Evolving Therapies for Hepatitis C," Eur. J. Gastroenterol. Hepatol., 11, pp.1199-1202 (1999); H.L.A. Janssen и др. "Suicide Associated with Alfa-Interferon Therapy for Chronic Viral Hepatitis," J. Hepatol., 21, pp.241-243 (1994); P.F. Renault и др., "Side Effects of Alpha Interferon," Seminars in Liver Disease, 9, pp.273-277. (1989)], и монотерапия интерфероном альфа вызывает длительную ремиссию только в некоторой части (~25%) случаев заболевания [O. Weiland, "Interferon Therapy in Chronic Hepatitis C Virus Infection", FEMS Microbiol. Rev., 14, pp.279-288 (1994)]. Добавление рибавирина в схему лечения незначительно улучшает степень ответной реакции. Недавнее введение ПЭГилированных форм интерферона (PEG-INTRON® и PEGASYS®), которые также комбинировали с рибавирином, дало в результате только умеренное улучшение степени ремиссии и только частичное уменьшение побочных эффектов. Текущий стандарт медицинского ухода представляет собой лечебную схему, продолжающуюся 24-48 недель, в зависимости от прогностических факторов, таких как генотип HCV и проявление первого ответа на лечение. Более того, перспективы в отношении эффективных анти-HCV-вакцин остаются неопределенными.
Таким образом, существует потребность в анти-HCV-терапии и подходящих режимах лекарственных доз для анти-HCV-соединений.
HCV и другие заболевания и нарушения связаны с повреждением печени. Существует также необходимость в терапии и подходящем режиме лекарственных доз для лечения повреждения печени.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение связано с лечением инфекций, вызываемых вирусом гепатита C. Изобретение, следовательно, связано с предупреждением клинического осложнения заболевания, вызванного вирусной инфекцией гепатита C.
Настоящее изобретение связано также с лечением повреждений печени и воспаления печени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
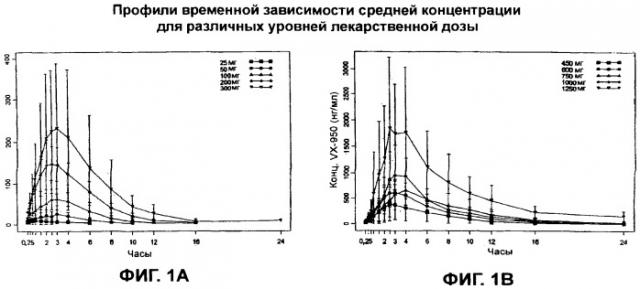
На Фиг.1A и Фиг.1B показаны профили временнόй зависимости средней концентрации для различных уровней лекарственной дозы (Пример 3).
На Фиг.2A-2D приведены полученные фармакокинетические параметры. Линия внутри рамки соответствует среднему значению, а границы рамки соответствуют разбросу средних значений (Пример 3).
На Фиг.3 показана концентрация (МЕд./мл) РНК HCV в плазме в течение 14-дневного исследования (Пример 5).
На Фиг.4 показано изменение концентрации (МЕд./мл) РНК HCV относительно исходного уровня в течение 14-дневного исследования (Пример 5 ).
На Фиг.5 показано изменение концентрации (МЕд./мл) РНК HCV относительно исходного уровня за период 14-дневного исследования для отдельных субъектов в группе лекарственной дозы 750 мг q8h (Пример 5).
На Фиг.6 показаны средние значения неоптерина, ALT (аланинаминотрансфераза) и РНК HCV +/- SEM во всех группах лекарственных доз. На Фиг.6 использованы следующие обозначения: изменения от исходного уровня средних уровней ALT ± SEM (самые верхние 4 линии с полыми символами), средние значения уровней неоптерина плазмы ± SEM (средние 4 линии с полыми символами) и средние значения нагрузки РНК HCV ± SEM (нижние 4 линии, с заполненными символами) показаны для всех 3 групп лекарственных доз и плацебо. Пациентов лечили в течение 14 дней с помощью VX-950. *Кратковременное увеличение среднего значения уровня ALT на 12 день в группе 450 мг q8h является артефактом (5 из 10 образцов отсутствуют, среднее значение 38 Ед./л, область 25-125 Ед./л) (Пример 5).
На Фиг.7 показаны средние значения неоптерина +/- SEM во всех группах. Показаны средние уровни неоптерина в плазме ± SEM до лечения и на 7 и 14 день для всех 3 групп лекарственных доз и плацебо. Отметим, что уменьшение среднего значения неоптерина максимально в группе лекарственной дозы 750 мг q8h, с высокими значениями до лечения и затем с самыми низкими значениями на 14 день. В группе лекарственной дозы 750 мг q8h уменьшение неоптерина по сравнению с исходным уровнем и плацебо становилось значимым на 14 день (*непарный двухсторонний T-тест, **критерий Манна-Уитни). Пунктирная горизонтальная линия при Y=7,7 нмол/л соответствует ULN (Пример 5).
На Фиг.8, 9 и 10 показано, что расщепление TRIF (адапторный белок TLR3) in vitro под действием протеиназы NS3/4A HCV ингибируется посредством VX-950.
На Фиг.8 (домен toll-Il1-рецептора, содержащий адаптор, индуцирующий IFN-Я TRIF
или TICAM-1) показана схематическая иллюстрация TRIF, выявляющая различные протеин-связывающие домены. TRIF расщепляется под действием протеиназы NS3 HCV у Cys 372, что приводит к образованию двух фрагментов - ∆С340 и ∆N372 (модификация Li и др. 2005, PNAS, 102, p 2992-2997).
На Фиг.9 показана кинетика расщепления TRIF под действием протеиназы NS3 HCV. Меченный по 35S-метионину in vitro продукт транскрипции/трансляции белка TRIF (в качестве субстрата) инкубировали с 6 мкМ протеиназы tNS3 в различных временных точках в диапазоне 0-240 минут, с последующим SDS-PAGE. Гель подвергали анализу на аппарате для визуализации фосфорной метки для количественной оценки продуктов расщепления. Количественная оценка продукта расщепления ∆N372 показана на чертеже как функция от времени.
На Фиг.10 показано NS3-протеиназо-зависимое расщепление TRIF и ингибирование расщепления TRIF посредством VX-950. Меченый 35S-метионин, связанный in vitro с продуктом транскрипции/трансляции белка TRIF (в качестве субстрата) инкубировали с увеличенной концентрацией фермента протеиназы tNS3 в диапазоне 0-4 мкМ либо в присутствии (кружочки), либо в отсутствие (квадратики) 10 мкМ VX-950, с последующим SDS-PAGE и анализом на аппарате для визуализации фосфорной метки. Количественный анализ продукта расщепления ∆N372 показан на чертеже.
На Фиг.11, 12, и 13 показано уменьшение соответствия вирусных вариантов.
На Фиг.11 показаны фенотипические характеристики VX-950 резистентных мутантов in vitro. Увеличивающаяся резистентность к VX-950 при ферментативных реакциях in vitro (Ki) связана с мутациями A156V/T, и показан анализ репликона на 2-день (IC50) по сравнению с протеиназой дикого типа. Отношение Kcat/Km у мутантов по сравнению с ферментами дикого типа показано в таблице (модификация Lin и др. 2005, JBC, 280, p.36784-36791).
На Фиг.12 показано расщепление субстрата HCV 4A/B мутантами A156V/T по сравнению с расщеплением протеиназой NS3 дикого типа (WT): меченый 35S-метионин, связанный in vitro с продуктом транскрипции/трансляции инактивированного мутанта протеиназы HCV, слитого с белком SEAP с областью контакта 4A/B (в качестве субстрата) между ними, инкубировали с различными количествами протеиназы tNS3 либо дикого типа (WT) (квадратики), либо A156V/T (тругольники и кружочки), в диапазоне от 0,008 до 6 мкМ, с последующим SDS-PAGE и анализом на аппарате для визуализации фосфорной метки. Количественный анализ продукта расщепления ∆N372 показан на чертеже.
На Фиг.13 показано расщепление субстрата TRIF мутантами A156V/T по сравнению с расщеплением протеиназой NS3 дикого типа (WT). Меченный по 35S-метионину in vitro продукт транскрипции/трансляции TRIF (в качестве субстрата) инкубировали с различными количествами протеиназы tNS3 либо дикого типа (WT) (квадратики), либо A156V/T (треугольники и кружочки), в диапазоне от 0,008 до 6 мкМ, с последующим SDS-PAGE и анализом на аппарате для визуализации фосфорной метки. Количественный анализ продукта расщепления ∆N372 показан на чертеже.
На Фиг.14 показаны средние значения РНК HCV, неоптерина и ALT в исходный момент, на 7 день и на 14 день (Пример 5).
На Фиг.15 и 16 показаны данные, подтверждающие, что VX-950 восстанавливает IFNЯ-зависимую экспрессию гена в клетках Huh7, инфицированных вирусом Sendai.
На Фиг.15 показана супрессия активности промотора IFN-Я под действием протеиназы HCV в клетках Huh7, стимулированных вирусом Sendai. Клетки Huh7 совместно трансфицировали плазмидами, экспрессирующими ген люциферазы под контролем промотора IFN-β и либо протеиназой дикого типа (WT), либо инактивированной мутантной протеиназой (MT), с последующей стимуляцией вирусом Sendai (SeV). Кратное увеличение активности гена люциферазы в сравнении с неиндуцированным вирусом Sendai контролем показаны на данном чертеже.
На Фиг.16 показано, что обработка VX-950 способствует преодолению супрессивного эффекта протеиназы HCV в отношении стимуляции вирусом Sendai активности промотора IFN-Я. Клетки Huh7 совместно трансфицировали плазмидами, экспрессирующими ген люциферазы под контролем промотора IFN-β, и либо протеиназой дикого типа (WT), либо инактивированной мутантной протеиназой (MT). Клетки обрабатывали либо DMSO (контроль), либо 10 мкМ VX-950. Клетки стимулировали вирусом Sendai (SeV) и измеряли активность люциферазы через 16 часов после инфицирования. Кратная активация в сравнении с неактивируемым вирусом Sendai контролем показана на данном чертеже.
На Фиг.17 показаны данные, подтверждающие, что обработка VX-950 приводит к уменьшению РНК HCV у ранее не отвечающих на терапию HCV (Фиг.17A) и у леченых обычным способом пациентов (Фиг.17B). Показаны средние значения уровней РНК HCV пациентов в каждой из терапевтических схем. Концентрации РНК HCV в плазме определяли, используя анализ Roche COBAS TaqMan HCV/HPS.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение связано со специфическими дозами и режимами лекарственной дозы для введения VX-950. VX-950 представляет собой конкурентный, реверсивный пептидомиметик, ингибитор протеиназы NS3/4A с константой связывания в устойчивом состоянии (ki*) 7nM [Международная заявка на патент 02/018369].
VX-950 был протестирован в однократных дозах на человеческом организме, и была обнаружена высокая степень толерантности (Пример 3). Возникновение или увеличение степени тяжести неблагоприятных явлений не учащалась с дозой VX-950. Наблюдаемые неблагоприятные явления не рассматриваются как тяжелые (стадия 3 или стадия 4). Не наблюдалось клинически значимых изменений от исходного уровня лабораторных показателей в гематологии или клинических химических параметрах. Не наблюдалось клинически значимых изменений при физическом осмотре, на уровне жизненных показателей или электрокардиограмм ни у одного из тестируемых субъектов.
Исследования проводили для определения фармакокинетического профиля VX-950. Данные показаны на Фиг.1 и Фиг.2.
Воздействие VX-950 на печень прогнозировали, основываясь на комплексных доклинических и клинических данных. Прогнозируемое воздействие на печень человека сочетали с результатами исследования репликона VX-950 и анализом инфицирующего вируса (см. ниже) для определения лекарственных доз, которые предположительно будут в значительной степени толерантными и будут оказывать благоприятное терапевтическое воздействие. Прогнозируемые средние величины концентрации для печени составляют до 57-кратных анализируемого репликона IC90 и до 113-кратных анализируемого репликона IC50 в области исследуемых лекарственных доз.
Данные результаты означают, что режим лекарственной дозы претендента на изобретение будет достигнут при концентрации VX-950 в печени главным образом при превышении IC50 и IC90, определенных в неклинических опытах.
Согласно одному из воплощений данного изобретения предложены фармацевтические композиции, включающие в себя:
а) VX-950 или его фармацевтически приемлемую соль
в количестве приблизительно от 100 до приблизительно 1500 мг;
в количестве приблизительно от 300 до приблизительно 1500 мг;
в количестве приблизительно от 300 до приблизительно 1250 мг;
в количестве приблизительно 450 мг;
в количестве приблизительно 750 мг; или
в количестве приблизительно 1250 мг; и
b) и фармацевтически приемлемый носитель.
В данном изобретении предложена также терапевтическая схема, предусматривающая введение VX-950 или его фармацевтически приемлемой соли
в количестве приблизительно от 100 до приблизительно 1500 мг;
в количестве приблизительно от 300 до приблизительно 1500 мг,
в количестве приблизительно от 300 до приблизительно 1250 мг;
в количестве приблизительно 450 мг;
в количестве приблизительно 750 мг; или
в количестве приблизительно 1250 мг; где введение указанного количества происходит один раз, два раза или три раза в день. Терапевтическая схема согласно изобретению предусматривает введение VX-950 в составе одной или более лекарственных форм.
Другое воплощение данного изобретения представляет собой способ лечения или предупреждения инфекции HCV у пациента, включающий в себя введение пациенту VX-950 или его фармацевтически приемлемой соли в количестве приблизительно от 300 мг до приблизительно 1500 мг.
В определенных воплощениях доза VX-950 составляет по меньшей мере приблизительно 300 мг. В других воплощениях доза VX-950 составляет по меньшей мере приблизительно 450 мг. В других воплощениях доза VX-950 составляет по меньшей мере приблизительно 500 мг. В других воплощениях доза VX-950 составляет по меньшей мере приблизительно 750 мг. В других воплощениях доза VX-950 составляет по меньшей мере приблизительно 1250 мг. В других воплощениях доза VX-950 составляет по меньшей мере приблизительно 1500 мг.
В следующих воплощениях доза VX-950 составляет не более чем приблизительно 1500 мг. В других воплощениях доза VX-950 составляет не более чем приблизительно 1250 мг. В других воплощениях доза VX-950 составляет не более чем приблизительно 750 мг. В других воплощениях доза VX-950 составляет не более чем приблизительно 450 мг. В других воплощениях доза VX-950 составляет не более чем приблизительно 500 мг. В других воплощениях доза VX-950 составляет не более чем приблизительно 300 мг.
Должно быть понятно, что данные низкие и высокие уровни доз можно комбинировать для получения предпочтительных уровней доз для введения VX-950. Например, в одном из воплощений VX-950 или его фармацевтически приемлемую соль вводят в количестве приблизительно от 300 до 1250 мг.
В определенных воплощениях VX-950 вводят в количестве приблизительно 450 мг. VX-950 вводят в количестве приблизительно 500 мг. В других воплощениях VX-950 вводят в количестве приблизительно 600 мг. В других воплощениях VX-950 вводят в количестве приблизительно 750 мг. В других воплощениях VX-950 вводят в количестве приблизительно 1000 мг. Кроме того, в других воплощениях VX-950 вводят в количестве приблизительно 1250 мг.
В любом из этих воплощений количество VX-950 вводят один раз в день. Альтернативно, количество VX-950 вводят два раза в день (например, BID; q12h). Альтернативно, количество VX-950 вводят три раза в день (например, TID; q8h). VX-950 можно вводить во время еды или вне зависимости от приема пищи.
VX-950 также тестировали на человеке и обнаружили его эффективность в качестве ингибитора репликации HCV. Авторы изобретения продемонстрировали, что введение VX-950 существенно снижает уровни РНК HCV. Важно то, что авторы изобретения продемонстрировали, что введение VX-950 инфицированным HCV субъектам может ингибировать вирус, так что вирусная РНК становится необнаруживаемой путем анализа HCV/HPS Roche COBAS TaqMan™ (производства Roche Molecular Diagnostics). Из 8 субъектов, получавших 750 мг VX-950 каждые 8 часов (q8h), 4 имели уровни РНК HCV ниже предела чувствительности количественного анализа (LLQ 30 МЕд./мл), и 2 из этих 4 субъектов имели уровни РНК HCV ниже детектируемого порога (LLD 10 МЕд./мл).
У субъектов, получавших 750 мг VX-950 каждые восемь часов, достигнуто в среднем более чем в 4 log10 снижениие (т.e. 10 000-кратное уменьшение) уровня HCV-РНК к концу 14-го дня лечения. Среднее более чем в 2 log10 снижение HCV-РНК наблюдали в каждой из двух других групп лекарственных доз VX-950 к концу 14-го дня лечения. У каждого субъекта, получавшего VX-950, достигнуто более чем 2 log10 снижение уровней HCV-РНК в течение первых трех дней лечения, а у 26 из 28 субъектов, получавших VX-950, наблюдалось 3 log10 снижение уровней HCV-РНК в течение первых трех дней лечения. См. Пример 5 и Фиг.3-5.
Было показано, что вирусная нагрузка плазмы быстрее уменьшается у пациентов, которых лечили VX-950. Кроме того, было показано, что после завершения приема лекарства происходит незначительный возврат РНК HCV к исходным уровням. В частности, скорость возврата к исходным уровням РНК HCV после завершения лечения была ниже, чем скорость снижения уровней РНК HCV во время лечения. Указанные результаты, совместно с достижением невыявляемых уровней РНК HCV, свидетельствуют об эффективности VX-950 в качестве монотерапии.
Таким образом, данное изобретение связано со способом лечения пациента, инфицированного HCV, включающим в себя введение пациенту VX-950 или его фармацевтически приемлемой соли в количестве a) приблизительно 450 мг 3 раза в день каждые 8 часов; b) приблизительно 750 мг 3 раза в день каждые 8 часов; c) приблизительно 1250 мг 2 раза в день каждые 12 часов; или d) приблизительно 1250 мг 3 раза в день каждые 8 часов.
В других воплощениях данного изобретения предусмотрен способ введения VX-950 инфицированному HCV пациенту так, чтобы уровень РНК HCV у пациента составлял по меньшей мере приблизительно менее 2 log (предпочтительно, по меньшей мере приблизительно 4 log) после лечения, чем перед лечением. В другом воплощении данное изобретение связано со способом введения VX-950 пациенту, инфицированному HCV, таким, чтобы уровень вирусной РНК у пациента уменьшался до неопределяемых величин и оставался на неопределямых уровнях до достижения "устойчивой реакции на вирус". Как определено в настоящем документе, "устойчивая реакция на вирус" означает, что в течение 24 недель после того, как введение лекарственной дозы завершилось, уровни вирусной РНК остаются неопределяемыми.
Не желая связывать себя какой-либо определенной теорией, авторы изобретения считают, что способ согласно настоящему изобретению, при котором используют 750 мг VX-950 каждые 8 часов, является предпочтительным, потому что данный способ приводит к наиболее значительному падению уровней. Наинизший уровень представляет собой такую концентрацию в плазме, которая обнаруживается непосредственно перед введением следующей дозы (т.e. минимальную концентрацию между дозами). Важно удерживать, в частности при вирусных заболеваниях, уровни лекарственного средства выше определенной концентрации для поддержания соответствующего ингибирования вирусной репликации. Авторы изобретения обнаружили, что преимущественно один из тестируемых режимов введения, 750 мг VX-950 каждые 8 часов, приводит к значительному падению уровней.
Следовательно, в предпочтительном воплощении данное изобретение связано со способом, включающим в себя введение пациенту VX-950 или его фармацевтически приемлемой соли в количестве приблизительно 750 мг 3 раза в день каждые 8 часов.
Нужно признать, что полезно пользоваться гибкими графиками введения доз. Следовательно, в другом воплощении данного изобретения дозу вводят 3 раза на день, но не каждые 8 часов, необязательно с приемом пищи. В определенных воплощениях VX-950 вводится вместе с пищей.
Данное изобретение предусматривает также способ предоставления VX-950 человеку, в случае необходимости, включающий в себя пероральное введение человеку дозы композиции, содержащей VX-950, где указанная доза предоставляется указанному человеку по средней концентрации VX-950 в плазме (Cavg), составляющей по меньшей мере приблизительно 750 нг/мл после введения. В определенных воплощениях (Cavg) составляет приблизительно 1000 нг/мл или приблизительно 1250 нг/мл. В определенных воплощениях указанная доза, по-существу, содержит 750 мг VX-950. В данных воплощениях дозу (Cavg) получают/она достигается в течение 3 часов после введения, предпочтительно в течение 2 часов, более предпочтительно в течение 1 часа после введения. В предпочтительных вариантах данных воплощений доза (Cavg) поддерживается более чем приблизительно в течение 24 часов и предпочтительно более 12 недель.
В определенных воплощениях данное изобретение связано со способом лечения инфекции HCV у пациента посредством введения по меньшей мере одной лекарственной формы, содержащей VX-950, в течение 24-часового периода, где лекарственная форма вводится для поддержания минимального уровня VX-950 в плазме, приблизительно 750 нг/мл, в течение 24-часового периода.
В определенных вариантах данного воплощения лекарственную форму вводят для поддержания минимального уровня VX-950 в плазме, составляющего приблизительно 800 нг/мл, предпочтительно приблизительно 900 нг/мл в течение 24-часового периода и более предпочтительно приблизительно 1000 нг/мл в течение 24-часового периода.
В определенных предпочтительных воплощениях добиваются установления терапевтически эффективной концентрации в плазме и поддерживают ее на определенном минимальном уровне. Данные способы, в частности, применимы для лечения человека, страдающего от инфекции HCV, посредством введения композиции VX-950, когда наинизший уровень VX-950 в плазме поддерживается как минимум на уровне приблизительно 750, 800, 900, или 1000 нг/мл в течение 24-часового периода. Не желая связывать себя какой-либо определенной теорией, авторы изобретения считают, что наинизшие уровни, превосходящие приблизительно 1500 нг/мл, не потребуются в данном изобретении. Соответственно, наинизшие уровни, составляющие приблизительно 750, 800, 900, 1000 нг/мл и приблизительно до 1500 нг/мл (конкретно, от 1000 до приблизительно 1500), входят в объем данного изобретения.
Предоставляется также лекарственная форма для доставки VX-950 в человеческий организм, где лекарственная форма содержит VX-950, указанная лекарственная форма при введении по меньшей мере один раз в течение 24-часового периода поддерживает наинизший уровень VX-950 в плазме, составляющий по меньшей мере приблизительно 750, 800, 900 или 1000 нг/мл в течение 24-часового периода приблизительно до 1500 нг/мл (конкретно, от 1000 до приблизительно 1500 нг/мл) в течение 24-часового периода.
Идеально, когда способ согласно настоящему изобретению включает в себя лечение пациента, инфицированного HCV, относительно быстрое достижение терапевтически эффективной концентрации VX-950 в плазме и затем поддержание наинизшего уровня, при котором достигается эффективный терапевтический ответ. Эффективный терапевтический ответ предпочтительно представляет собой один или оба из следующих: a) достижения устойчивой реакции на вирус; и b) достижения неопределяемого уровня РНК HCV в плазме по меньшей мере в течение 12 недель (12 недель или более). Используемый в данном документе термин "неопределяемый" уровень РНК HCV означает, что РНК HCV присутствует в концентрации менее чем 10 МЕд./мл, что определяется анализом, в настоящее время коммерчески доступным, и, предпочтительно, как определяется с помощью Roche COBAS TaqMan™ - анализа HCV/HPS.
Относительно быстрое падение концентрации в плазме можно получить путем введения пациенту ударной дозы. В одном воплощении ударная доза составляет приблизительно 1250 мг VX-950.
В определенных лекарственных формах согласно изобретению (отличных от лекарственной формы, используемой для введения ударной дозы) содержится приблизительно 750 мг VX-950, и лекарственную форму вводят три раза за каждый 24-часовой период.
В определенных воплощениях продолжительность лечения с помощью VX-950 короче, чем с помощью стандартного, современного лечения.
В определенных воплощениях способ согласно настоящему изобретению включает в себя лечение пациента, инфицированного вирусом гепатита С генотипа 1. Генотип 1 HCV-инфекции является наиболее сложным для лечения штаммом HCV и наиболее распространенным штаммом в Соединенных Штатах.
Авторы изобретения показали также, что введение VX-950 снижает уровни неоптерина и ALT in vivo (Фиг.6, Фиг.7 и Фиг.14). Уровни AST (аспартатаминотрансфераза) также уменьшались после введения VX-950. ALT представляет собой фермент, присутствующий в клетках печени; когда клетки печени разрушаются или воспаляются, ALT просачивается из клетки в кровь. Уровни ALT в крови используют как маркер повреждения или воспаления печени. См. Tatyana Yashina
и J. Sanders Sevall, "Hepatitis C Virus" в Use and Interpretation of Laboratory Tests in Gastroenterology, James B. Peter, ed., р. 127, (1998); и Andres T. Blei, "Liver and Biliary Tract" в Laboratory Medicine, D.A. Noe and Robert C. Rock, eds., ch. 19, р. 363 (1994).
Неоптерин (6-d-эритро-три-гидроксипропилптеридин) представляет собой производное птеридина, которое продуцируется в процессе метаболизма гуанозинтрифосфата (GTP). Неоптерин продуцируется главным образом моноцитами и макрофагами при активации интерфероном гамма или интерфероном альфа и является маркером воспаления. Уровни неоптерина часто повышаются при хронической HCV-инфекции (Quiroga, и др. Dig Dis Sci 1994; 39 (11): 2485-96). Ожидаемый уровень неоптерина в плазме здоровых индивидуумов составляет от 3,1 до 7,7 нмоль/л.
Таким образом, авторы изобретения определяли изменения концентрации неоптерина в сыворотке как маркера активности моноцитов/макрофагов во время введения ингибитора протеиназы NS3·4A (HCV). Как описано в данном документе, VX-950 вводили в течение 14 дней в случайном порядке, двойным слепым методом, контроллируемым плацебо, анализировали разнообразные дозы у 34 пациентов, инфицированных генотипом 1 HCV (Таблица 1). Пациенты получали VX-950 450 мг q8h (n=10), 750 мг q8h (n=8), 1250 мг q12h (n=10), или плацебо (n=6). Концентрации неоптерина в сыворотке измеряли с помощью количественного конкурентного метода ELISA (ELItest® Neopterin, Brahms, Hennigsdorf, Germany) до лечения, на 7 и на 14 день, и в последующие 10 дней. Самый низкий зарегистрированный предел (LLD) составлял 2 нмол/л. РНК HCV определяли через повторяющиеся интервалы в течение исследования ПЦР в реальном масштабе времени (COBAS® TaqMan HCV Test; в линейной динамичной области значений РНК HCV от 3,0 × 101 до 2,0 × 108 МЕд./мл; LLD РНК HCV 10 МЕд./мл; Roche Diagnostics, Branchburg, NJ).
Во время введения VX-950 у каждого пациента наблюдали падение вирусной нагрузки >2-log10 во всех группах лекарственных доз (Таблица 2). В группе лекарственной дозы 750 мг q8h среднее значение РНК HCV падало до 3,6 log10 на 3 день и до 4,3 log10 на 14 день. В группах лекарственных доз 450 мг q8h и 1250 мг q12h максимальный эффект наблюдали с 3 дня по 7 день с последующим увеличением значения вирусной нагрузки между 7 и 14 днями. Средняя вирусная нагрузка увеличивалась во всех группах лекарственных доз в течение последующего наблюдения. В основном в обоих случаях лечения HCV - и при лечении первичных больных HCV, и при лечении пациентов, ранее получавших лечение лечение против HCV, способы согласно изобретению оказывают благоприятное действие. Как показано на Фиг.17A и Фиг.17B, и предварительно леченые пациенты, и первичные пациенты реагировали на VX-950. Во избежание недоразумений следует отметить, что пациенты, которых можно лечить способами согласно настоящему изобретению, включают в себя тех пациентов, у которых HCV не пытались лечить или же попытка лечения HCV оказалась неудачной, включая неотвечающих на лечение пациентов, пациентов с возобновлением симптомов, пациентов с рецидивом и успешно леченых пациентов.
Исходный уровень неоптерина повышался у 23/34 пациентов (среднее значение 9,33 нмол/л; верхний предел нормы (ULN) 7,7 нмол/л). В группе лекарственной дозы 750 мг уменьшение неоптерина по сравнению с исходным уровнем и плацебо становится значительным на 14 день (группа лекарственной дозы 750 мг q8h против исходного уровня на 14 день 10,48±0,84 нмол/л против 7,32±0,48 нмол/л P=0,0104, тест Mann Whitney; группа лекарственной дозы 750 мг q8h против плацебо на 14 день 7,32±0,48 нмол/л против 9,81±1,36 нмол/л P=0,0036, непарный Т-критерий на основе двойной выборки). Средние уровни неоптерина принимают нормальные значения только на 14 день в группе лекарственной дозы 750 мг q8h (Фиг.7 и Фиг.14). В группе лекарственной дозы 450 мг q8h и группе лекарственной дозы 1250 мг q12h уменьшение средних уровней неоптерина было меньше (Фиг.6, 7, и 14). Средние уровни неоптерина не менялись в группе плацебо (Фиг.6 и Фиг.7). Средние уровни неоптерина увеличивались во всех группах лекарственных доз в течение последующего наблюдения.
Средние уровни ALT, повышенные на исходном уровне, уменьшались во время введения дозы во всех группах (Фиг.6). Повышенные средние уровни ALT возвращались к исходному уровню во всех группах лекарственных доз в течение последующего наблюдения.
Хотя РНК HCV увеличивалась в группе лекарственной дозы 450 мг и в группе лекарственной дозы 1250 мг после 7 дня, неоптерин, и особенно ALT, продолжали уменьшаться. Изменения средней концентрации неоптерина коррелируют с падением уровней РНК HCV и ALT в течение введения дозы VX-950. Максимальное падение средней концентрации неоптерина происходило в группе лекарственной дозы 750 мг q8h на 14 день. Данная группа лекарственной дозы также имела максимальное снижение РНК HCV на 14 день. После 7-го дня в группах лекарственных доз 450 мг q8h и 1250 мг q12h уровни ALT и неоптерина уменьшались, в то время как уровни РНК HCV увеличивались. Эти данные наводят на мысль, что ингибирование репликации HCV посредством VX-950 приводит к заметному падению общей воспалительной активности, связанной с вирусной инфекцией.
VX-950 улучшает также повышенные уровни ALT у животных моделей (см. Международную заявку на патент 2005/025517). В частности, экспрессия протеиназы-SEAP WT-HCV у мышей SCID приводит к увеличению уровней ALT, которое может быть улучшено посредством обработки посредством VX-950. Экспрессия одной только протеиназы WT-HCV у мышей SCID приводит также к зависящему от времени и дозы увеличению уровней ALT.
Согласно другому воплощению, данное изобретение предоставляет способ лечения или предотвращения одного или более повреждений печени, воспаления печени, жировой дегенерации, жировой инфильтрации печени, NAFLD, NASH, алкогольной дегенерации и синдрома Рейе у пациента либо с HCV-положительной реакцией, либо с HCV-отрицательной реакцией. Данное изобретение предоставляет также способы предотвращения гепатита у пациента либо с HCV-положительной реакцией, либо с HCV-отрицательной реакцией.
Авторы изобретения продемонстрировали также, что VX-950 блокирует уклонение от механизмов иммунологического надзора in vitro.
VX-950 восстанавливает IFNЯ-зависимую экспрессию генов в инфицированных вирусом Sendai клетках Huh7. Активность промотора IFNЯ уменьшается в ответ на стимуляцию вируса Sendai в присутствии WT HCVpro. VX-950 позволяет обойти опосредованное HCVpro WT подавление промоторной активности IFNЯ (Фиг.15 и Фиг.16).
Более того, известно, что NS3/4A участвует в уклонении от механизмов врожденной иммунной защиты посредством, например, TRIF-зависимого механизма (так же как и вирусного процессинга полипротеинов). Указанное уклонение от иммунологического надзора приводит к вирусной персистенции. Таким образом, соединение, которое ингибирует и полипротеиновый процессинг вируса, и уклонение от механизмов врожденной иммунной защиты, является желательным. Выявлено, что VX-950 преимущественно этому способствует. В частности, VX-950 ингибирует in vitro расщепление TRIF, который представляет собой адапторный белок TLR3 (Фиг.8-10).
Не желая связывать себя какой-либо определенной теорией, авторы изобретения считают, что моделирование позволяет предположить, что VX-950 ингибирует расщепление TRIF с помощью протеиназы NS3. TRIF связывается с активным сайтом протеиназы NS3 на участке, который не является расщепляющим. VX-950 связывается с тем же самым нерасщепляющим участком активного сайта, что и TRIF, и блокирует расщепление TRIF.
Кроме того, авторы изобретения показали, что два вирусных варианта VX-950, A156T и A156V, проявляют пониженную способность расщеплять и TRIF, и 4A/4B (C. Lin и др. "In Vitro Studies of Cross-resistance Mutations Against two Hepatitis C Virus Serine Protease Inhibitors VX-950 and BILN 2061", J. Biol. Chem., (August 8, 2005). Поскольку данные вирусные варианты менее пригодны, они неэффективны и для вирусного полипротеинового процессинга, и для вирусной персистенции. Не желая связывать себя какой-либо определенной теорией, авторы изобретения считают, что это связано с пространственным барьером A156V, затрагивающим связывание с субстратами 4A/4B и TRIF (Фиг.11-13).
Это означает, что VX-950 действует и как прямая противовирусная композиция, и как ингибитор механизма уклонения от иммунологического надзора. Следовательно, данное изобретение также связано со способами ингибирования опосредованного протеиназой HCV механизма уклонения от иммунологического надзора у хозяина.
Эти результаты, совместно с данными in vivo, описанными в настоящем документе, указывают на эффективность VX-950 в качестве монотерапии.
Количество VX-950 согласно изобретению вводят в виде однократной лекарственной дозы или в виде более чем однократной лекарственной дозы. Если вводят раздельные лекарственные формы, каждую лекарственную форму вводят приблизительно в одно и то же время. Во избежание недоразумений следует отметить, что для схем приема лекарственных доз, предусматривающих введение более чем одной лекарственной дозы в день, можно принимать по одной или более таблеток, или каждый раз в т