Способ лечения рака молочной железы
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении больных раком молочной железы. Способ включает внутривенное капельное введение противоопухолевых химиопрепаратов на аутоплазме. При этом полученную аутоплазму подвергают воздействию переменного магнитного поля с параметрами 100 Гц, 50 МТл в течение 30 минут. Затем каждый противоопухолевый химиопрепарат в разовой дозе смешивают с аутоплазмой, инкубируют при +37,0°С в течение не менее 30 минут и реинфузируют внутривенно капельно. Использование изобретения позволяет уменьшить размеры опухоли и лимфоузлов, перевести больных с местно-распространенным процессом из неоперабельного в операбельное состояние, достигнуть ремиссии за счет максимально высокой эффективной концентрации химиопрепарата и его доставки к органам-мишеням с помощью подвергнутой действию магнитного поля плазмы. 4 ил., 5 таб.
Реферат
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения местно-распространенного и диссеминированного рака молочной железы цитостатическими средствами.
Известен "Способ лечения рака (см. патент №2188025, опубликованный в Бюллетене №24 от 28.08.2002), включающий внутривенное капельное введение противоопухолевых химиопрепаратов, инкубированных с кровью больного, отличающийся тем, что в 2 флакона с 50 мл с гемоконсервантом «Глюгицир» производят забор крови из периферической вены по 100-150 мл в каждый, один флакон подвергается воздействию переменного магнитного поля с параметрами 50 мТл, 100 Гц в течение 20 мин, после чего реинфузируют внутривенно капельно, во второй флакон добавляют противоопухолевые химиопрепараты (винбластин 5 мг, метотрексат 25 мг, 5-фторурацил 500 мг, циклофосфан 200 мг, доксорубицин 30 мг, инкубируют в течение 30-40 мин, затем полученную смесь вводят внутривенно капельно, лечебное воздействие повторяют на 3, 5, 8, 10, 12 дни цикла, доводя количество противоопухолевых препаратов до курсовой дозы. Этот способ повышает переносимость общепринятой курсовой дозы препаратов, преодолевая токсический барьер, свойственный системной полихимиотерапии, но имеет свои недостатки. Конкурентное связывание химиопрепаратов с клеточными элементами крови и белками плазмы препятствует максимально полной доставке химиопрепаратов к органам-мишеням и реализации наилучшего клинического эффекта.
Известен метод лечения рака молочной железы - аутоплазмохимиотерапия (патент №2158588 от 10.11.2000 Б.И. №31), выбранный нами в качестве прототипа, включающий внутривенное капельное введение противоопухолевых химиопрепаратов, предварительно инкубированных с аутоплазмой, отличающийся тем, что у пациента из периферической вены забирают 250 мл аутокрови во флакон с гемоконсервантом «Глюгицир», седиментационным способом или центрифугированием разделяют на жидкостную фракцию и клеточные элементы, забирают полученную аутоплазму, смешивают с химиопрепаратами и инкубируют при t 37°С в течение 40 мин: винкристин 1 мг, метотрексат 30 мг, фторурацил 750 мг, циклофосфан 800 мг в 1, 8 дни лечения, доксорубицин 30 мг в 1, 3, 5, 8, 10, 12 дни. Клеточные элементы разводят физраствором и реинфузируют пациенту.
Известный способ лечения рака молочной железы применяется в течение всего курса лечения с использованием аутоплазмы для введения химиопрепаратов и имеет положительный клинический эффект. Однако присутствие в плазменном компоненте крови балластных веществ, токсических субстанций, метаболитов экзо- и эндогенного происхождения, которые также вступают во взаимодействие с белками плазмы, предопределяет снижение связывающей активности последних к химиопрепаратам.
Целью изобретения является повышение степени связывания цитостатиков с белками плазмы и обеспечение целенаправленной доставки препаратов к органам-мишеням.
Поставленная цель достигается тем, что при лечении рака молочной железы, включающем внутривенное капельное введение противоопухолевых химиопрепаратов на аутоплазме, полученную аутоплазму подвергают воздействию переменного магнитного поля с параметрами 100 Гц, 50 МТл в течение 30 минут, затем каждый противоопухолевый химиопрепарат в разовой дозе смешивают с аутоплазмой, инкубируют при +37°С в течение не менее 30 минут и реинфузируют внутривенно капельно.
Экспериментальное обоснование целесообразности предварительного омагничивания аутоплазмы в предлагаемом "Способе лечения рака молочной железы"
С целью обоснования возможности и целесообразности применения переменного магнитного поля (ПеМП) и изучения накопления цитостатика под действием ПеМП в средах и тканях опытных животных с лимфосаркомой Плисса использовали циклофосфан меченый тритием (3H-CF).
Схема опыта: от декапитированных животных брали кровь с консервантом, центрифугировали и отбирали плазму, а также опухоль, которую пипетировали в среде 199. Плазму и взвесь опухолевых клеток подвергали омагничиванию следующими параметрами 100 Гц, 50 МТл, 30 мин в разной последовательности:
- M1 - предварительное (до введения химиопрепарата) омагничивание плазмы и взвеси, далее введение 3H-CF;
- М2 - введение 3H-CF с последующим омагничиванием сред;
- Контроль - введение 3H-CF в плазму и опухоль, без воздействия ПеМП.
3H-CF вводили в дозе 0,025 мК стандартно на все пробы и предварительно инкубировали его с плазмой и взвесью опухолевых клеток, соответственно, в течение 30 мин при t=37°С. Для измерения их радиоактивности биологический материал помещали во флаконы с H2O2 33% и ТХУ (трихлоруксусная кислота) в термостат при t=60°С на 12 часов. Радиоактивность в тканях подсчитывали на β-радиометре «Triathler». В опытах использовали аппарат для магнитотерапевтических воздействий «Градиент».
| Таблица 1. | ||
| Поглощение 3H-CF белками плазмы в зависимости от метода воздействия | ||
| Воздействие ПеМП | Контроль | |
| M1 | М2 | |
| 287,7%* | 178,8%* | 100% |
| * - статистически достоверные отличия от контроля (p<0,00-p<0,01). |
При воздействии ПеМП на плазму и взвесь пипетированной опухоли при разной последовательности ПеМП мы выяснили, что 3Н-CF связывается при M1 больше, чем при других режимах (табл.1), различия достоверны. Таким образом, экспериментально было выявлено, что применение ПеМП как модификатора лекарственных средств более целесообразно при воздействии M1 - предварительном омагничивании плазмы крови. При исследованиях, ранее проведенных в РНИОИ, было выявлено, что эффект противоопухолевого действия магнитного поля не только зависит от его прямого воздействия, но и от механизмов, опосредованно влияющих через нейроэндокринную систему.
Таким образом, применение ПеМП как модификатора лекарственных средств более целесообразно при воздействии M1 (предварительном омагничивании плазмы крови).
Изобретение "Способ лечения рака молочной железы" является новым, так как оно не известно из уровня медицины в области онкологии в лечении рака молочной железы цитостатическими средствами.
Новизна изобретения заключается в том, что в лекарственном лечении рака молочной железы, включающем внутривенное капельное введение противоопухолевых химиопрепаратов на аутоплазме, впервые полученную аутоплазму подвергают воздействию переменного магнитного поля с параметром 100 Гц, 50 МТл в течение 30 минут, затем каждый противоопухлевый химиопрепарат в разовой дозе смешивают с аутоплазмой, инкубируют при +37,0°С в течение не менее 30 минут и реинфузируют внутривенно капельно.
При использовании аутоплазмы для проведения химиотерапии основным действующим началом являются белки плазмы, с которыми и взаимодействует преобладающее количество цитостатиков при отсутствии эффекта конкурентного связывания с форменными элементами крови, что убедительно доказано в экспериментальных исследованиях (Сидоренко Ю.С., 1996, 2000; Владимирова Л.Ю., 2000, 2001, 2005). Повышение связывающей активности белков плазмы к химиопрепаратам в результате предварительного омагничивания позволяет получить максимально высокую эффективную концентрацию химиопрепарата в единице объема плазмы.
Применение омагниченной аутоплазмы в химиотерапии больных местно-распространенным и генерализованным раком молочной железы в качестве естественного носителя фармакологических препаратов обеспечивает их «адресную» транспортную доставку к органам-мишеням. Это способствует повышению эффективности проводимой химиотерапии при минимизации ее токсического влияния на организм и включению механизмов адаптивной регуляции гомеостатических систем.
Изобретение имеет изобретательский уровень, так как для специалиста онколога-химиотерапевта явным образом не следует из уровня медицины в области лечения рака молочной железы.
Предлагаемый "Способ лечения рака молочной железы" оригинален, не очевиден, явным образом не следует из уровня медицины в этой области онкологии - лечении местно-распространенного и генерализованного рака молочной железы - ни в СНГ, ни в России, ни за рубежом.
Изобретение является промышленно применимым, так как может быть использовано в здравоохранении при химиотерапии рака молочной железы в различных медицинских учреждениях, особенно онкологического профиля, в НИИ онкологии, онкодиспансерах.
Конкретное выполнение "Способа лечения рака молочной железы"
У больной производят забор аутокрови в количестве 200-250 мл в стерильный флакон с гемоконсервантом «Глюгицир», осаждают при t +4-8°С в течение 2-3 часов либо центрифугируют при υоб 1500 об/мин в течение 30 мин, отбирают надосадочную плазму в другой стерильный флакон с гемоконсервантом, клеточный осадок реинфузируют. Аутоплазму подвергают воздействию переменного магнитного поля с параметрами 100 Гц, 50 МТл в течение 30 минут. Затем цитостатики в разовых дозах смешивают с аутоплазмой, инкубируют при температуре 37°С не менее 30 минут и вводят пациентке внутривенно капельно.
Комбинация химиопрепаратов CAMF рассчитана на 2 недели и вводится в режиме: метотрексат - 15 мг/м2 в 1 и 8-й дни, доксорубицин - 15 мг/м2, 5-фторурацил - 250 мг/м2, циклофосфан - 100 мг/м2 в 1, 3, 5, 8, 10, 12 дни лечения внутривенно капельно. Суммарные курсовые дозы составляют: метотрексат - 60-80 мг, доксорубицин - 120-180 мг, 5-фторурацил - 2500-3500 мг, циклофосфан - 1000-1200 мг.
После введений наблюдают за общим состоянием пациенток, осуществляют лабораторный контроль: общий анализ крови 2 раза в неделю, биохимический анализ крови, общий анализ мочи 1 раз в неделю, электрокардиограмма, ультразвуковое и рентгенологическое исследование молочной железы и лимфоузлов до и после лечения.
Клинические результаты применения "Способа лечения рака молочной железы"
Лечению предлагаемым "Способом лечения рака молочной железы" подверглись 19 первичных больных с местно-распространенным и генерализованным раком молочной железы (стадии IIIБ-IV) в отделении химиотерапии в 2006-07 гг. В группу вошли больные в возрасте от 29 до 65 лет (средний возраст - 43.9 года). У 11 из них менструальная функция была сохранена, 8 были в менопаузе. По степени распространенности опухоли больные характеризовались следующим образом. Местно-распространенный процесс без отдаленных метастазов, включая пациенток с IV стадией заболевания за счет распространения процесса за пределы молочной железы на кожу, мягкие ткани обнаружен у 10-ти пациенток (с Т3-4 N1 М0-3, с Т4 N2 М0-3, с Т4 N3 М0-2, с Т4 N2 M1-2). Из них 8 ранее были не лечены, у 2 отмечено прогрессирование процесса после нерадикальных операций по месту жительства. Генерализованная форма с наличием отдаленных метастазов, прорастанием грудной стенки до костных структур с вовлечением средостения (Т4 N1-3 M1) выявлена у 8 больных. Отмечены следующие метастатические проявления: распространение опухоли за пределы молочной железы с переходом на ребра, грудину, прорастанием в переднее средостение - 2, метастазы в кожу - 2, метастатическое поражение костей - 5, метастазы в легкие и плевру - 5, метастазы в печень - 3, комбинация отдаленных метастазов в лимфоузлы, кожу, мягкие ткани и висцеральные органы - 7. 6 больных ранее не лечились, у 2 отмечена генерализация процесса после комплексного лечения, у 1 - после нерадикальной операции по месту жительства. Узловая форма встретилась у трех больных, у остальных - узловая со вторичным отеком. Пациентки основной группы были разделены на 2 подгруппы - А и Б - с местно-распространенным и генерализованным процессом соответственно.
Для оценки эффективности "Способа лечения рака молочной железы" были сформированы 2 контрольные группы (А - с местно-распространенным процессом, Б - с генерализованным) из 15-ти пациенток каждая. По возрасту, состоянию овариально-менструальной функции, степени распространенности процесса группы были сопоставимы. Больные контрольных групп подвергались АПХТ теми же препаратами, в тех же дозах и режиме, что и больные основной группы, но без предварительного омагничивания аутоплазмы.
Сравнивались непосредственный клинический эффект отдельно после одного и двух проведенных курсов неоадъювантной химиотерапии в основной и контрольной группах А, частота развития полной и частичной ремиссии, сроки реализации максимального непосредственного клинического эффекта при многокурсовой химиотерапии в основной и контрольной группах Б. Осуществлялся лабораторный контроль: общий анализ крови 2 раза в неделю, биохимический анализ крови, общий анализ мочи 1 раз в неделю, электрокардиограмма. Для объективизации изменения размеров опухоли и лимфоузлов в процессе лечения использовались ультрасонография, рентгенография, спиральная рентгенкомпьютерная томография.
Сравнительный анализ эффективности предлагаемого "Способа лечения рака молочной железы" и АПХТ без предварительного омагничивания аутоплазмы представлен в таблицах 2-5.
| Таблица 2. | |||||
| Клинический эффект 1 курса неоадъювантной АПХТ в зависимости от метода лечения | |||||
| Группа | Результаты лечения (число больных, %) | ||||
| прогрессирование | стабилизация | частичный регресс (ЧР) | полный регресс (ПР) | ПР+ЧР | |
| Основная А, n=10 | 0 | 5 | 5 | 0 | 5 |
| 50,0%* | 50,0%* | 1,9% | 50,0%* | ||
| Контрольная А, n=15 | 0 | 10 | 5 | 0 | 5 |
| 3,1% | 66,7% | 33,3% | 33,3% | ||
| *- статистически достоверные отличия от контрольной группы (р<0,05). |
После первого неоадъювантного курса АПХТ объективный ответ на лечение в подгруппах А, оценивавшийся как регрессия опухоли на 50% и более, в группе больных, получавших АПХТ+М, встречался чаще (50%), чем в контрольной (33.3%), р<0,05.
После 2 курсов объективный ответ на лечение в основной группе наблюдался нами также достоверно чаще (80,0%), чем в контрольной (66,7%), за счет более частой регистрации полной регрессии (6,7% и 30,0%), р<0,05. Случаев прогрессирования заболевания в процессе лечения в основной группе А не было, в контрольной группе А у 1 больной появились новые метастазы в кожу железы.
| Таблица 3. | |||||
| Клинический эффект 2 курсов неоадъювантной АПХТ в зависимости от метода лечения | |||||
| Группа | Результаты лечения (число больных, %) | ||||
| прогрессирование | стабилизация | частичный регресс (ЧР) | полный регресс (ПР) | ПР+ЧР | |
| Основная А, n=10 | 0* | 2 | 5 | 3 | 7 |
| 20,0% | 50,0% | 30,0%* | 80,0%* | ||
| Контрольная А, n=15 | 1 | 4 | 9 | 1 | 10 |
| 6,7% | 26,6% | 60,0% | 6,7% | 66,7% | |
| * - статистически достоверные отличия (р<0.05). |
Все 10 изначально неоперабельных больных, в отношении которых был применен "Способ лечения рака молочной железы" после 2 курса НАХТ, успешно прооперированы.
Из таблицы видно, что в результате применения "Способа лечения рака молочной железы" достоверно чаще удавалось достигнуть выраженного лечебного патоморфоза.
| Таблица 4 | ||
| Степень выраженности лечебного патоморфоза после неоадъювантной АПХТ в зависимости от метода лечения. | ||
| Группа | Степень лечебного патоморфоза (число больных, %) | |
| I-II | III-IV | |
| Основная А, n=10 | 3 | 7 |
| 30,0% | 70,0%* | |
| Контрольная А, n=14 | 8 | 6 |
| 57,2% | 42,8% | |
| *- статистически достоверные отличия (p<0.05). |
Пациентки с генерализованным РМЖ подвергались 6 курсам АПХТ. Результаты лечения представлены в таблице 6. Объективный ответ на лечение в основной группе наблюдался нами достоверно чаще (87,5%), чем в контрольной (66,7%), за счет достижения полной ремиссии в большем проценте случаев (6,7% и 25,0%), p<0,05. Случаев прогрессирования заболевания в процессе лечения в основной группе Б не было, в контрольной группе Б у 2 больных отмечено прогрессирование процесса на фоне лечения.
| Таблица 5. | ||||||
| Клинический эффект многокурсовой АПХТ в зависимости от метода лечения генерализованного РМЖ. | ||||||
| Группа | Результаты лечения (число больных, %) | |||||
| прогрес сирован ие | стабилизация | частичная ремиссия (ЧР) | полная ремиссия (ПР) | ПР+ЧР | Срок регистрации максимального клинического эффекта (курс) | |
| Основная Б, n=8 | 0 | 1 | 5 | 2 | 7 | 3,6 |
| 12,5% | 52,5% | 25,0%* | 87,5%* | |||
| Контрольная Б, n=15 | 2 | 3 | 9 | 1 | 10 | 5,2 |
| 12,6% | 20,0% | 60,0% | 6,7% | 66,7% | ||
| * - статистически достоверные отличия (p<0,05). |
Максимальный клинический эффект в основной группе регистрировался уже после 3,6 курсов, в то время как в контрольной - ближе к концу лечения (5,2). Субъективно у всех пациенток с соответствующими метастатическими поражениями на фоне лечения отмечены исчезновение болевого синдрома, восстановление двигательной активности при поражении костей, купирование симптомов дыхательной недостаточности при поражении легких, плевры, лимфоулов средостения, уменьшение болей в правом подреберье и нормализация биохимических показателей при поражении печени, то есть имело место значительное улучшение качества жизни в результате применения «Способа лечения рака молочной железы».
Для сравнительной оценки токсичности двух методов были проанализированы побочные эффекты 83 курсов АПХТ и 112 курсов АПХТ с предварительным омагничиванием аутоплазмы. Оценка выраженности побочных эффектов производилась согласно рекомендациям ВОЗ и международного противоракового союза для учета токсичности, предусматривающим 5 степеней от 0 до 4.
Достоверных различий в частоте развития лейкопении при сравниваемых методах лечения не выявлено. У большинства больных исходно имела место умеренная анемия (I-II степени), существенных изменений показателей красной крови на фоне лечения не отмечено. Случаев тромбоцитопении не было. Что касается токсических побочных эффектов химиотерапии со стороны желудочно-кишечного тракта, то при АПХТ+М отмечена тенденция к снижению частоты и выраженности стоматитов в сравнении с АПХТ. Тошнота, рвота, диарея, встречавшиеся с одинаковой частотой при обоих методах лечения, носили преходящий характер, быстро купировались антиэметиками и не требовали прерывания АПХТ. Другие побочные эффекты химиотерапии возникали нечасто (до 5%), достоверных различий между методами не выявлено.
Таким образом, предварительное омагничивание аутоплазмы, как установлено экспериментально, повышает способность белков плазмы к связыванию с цитостатиками при последующей инкубации, чем, как мы полагаем, и обусловлен полученный лучший клинический эффект и более быстрая его реализация в сравнении с АПХТ.
Конкретные примеры применения "Способа лечения рака молочной железы" Наблюдение 1.
Больная П. 51 года, ИБ №20813/х, поступила в отделение ХГТ РНИОИ в декабре 2006 г. с диагнозом: Рак левой молочной железы, узловая форма с мультицентричным ростом, мтс в аксиллярные лимфоузлы, St IIIA (T2N2M0), клиническая группа II.
Опухоль в молочной железе обнаружила в овгусте 2006, обратилась в ноябре 2006.
УЗИ брюшной полости, ФЛО - данных за отдаленные мтс не выявлено. При осмотре в левой молочной железе в нижненаружном квадранте плотная опухоль без четких границ до 3,5 см, вторичного отека нет, кожа интактна. Конгломерат аксиллярных лимфоузлов слева общим размером 8×9 см, несмещаем, другие лимфоузлы четко не пальпируются.
Маммография 9.12.06 - в нижненаружном квадранте левой молочной железы опухоль 1.5 см, в хвостовом отделе 3 см, в подмышечной области - множество метастатических лимфоузлов размером от 1 до 5 см (до 7, конгломерат).
Диагноз верифицирован цитологически при пункционной биопсии опухоли и лимфоузлов. ЦА №27631-34 от 9.12.06: умереннодифференцированная карцинома.
Проведен 1-й неоадъювантный курс АПХТ с предварительным омагничиванием аутоплазмы. Суммарные дозы цитостатиков составили: метотрексат 50 мг, 5-фторурацил 3000 мг, циклофосфан 1200 мг, доксорубицин 120 мг. Из осложнений отмечены тошнота 1 степени, алопеция 2 степени.
После 1 курса отмечены уменьшение опухоли до 1 см в диаметре, конгломерат подкрыльцовых лимфоузлов уменьшился до 4×5 см, смещаем.
После 2 аналогичного неоадъювантного курса АПХТ с предварительным омагничиванием аутоплазмы опухоль в молочной железе пальпаторно не определялась, пальпировался одиночный подкрыльцовый смещаемый узел размером 3 см. Из осложнений отмечены тошнота 1 степени, алопеция 2 степени.
При маммографии 5.02.07 «плотная тень, соответствующая проекции образования в нижненаружном квадранте от 9.09.05 практически полностью исчезла, в хвостовом отделе железы образование уменьшилось более чем в 2 раза, подмышечные лимфатические узлы сократились более чем в 2 раза». На Фиг.1, 2 представлены маммограммы больной П. (1 - до лечения, 2 - после лечения).
27.02.2007 г. выполнена радикальная мастэктомия по Пейти слева. Макропрепарат: в молочной железе после лечения опухоль не определяется, в подкрыльцовой клетчатке 1 лимфоузел метастатического характера 1,5 см, в других коллекторах метастазов не выявлено. ГА №925200-2008 «на фоне выраженного склероза мелкие комплексы дистрофически измененных клеток инфильтрирующего долькового рака, лечебный патоморфоз III-IV степени, метастаз в 1 подкрыльцовый лимфоузел». Заживление первичным натяжением. После операции больная подверглась дистанционной гамматерапии на пути лимфооттока из молочной железы, СОД 40 Гр, в настоящее время получает 2-й курс адъювантной АПХТ по схеме CAMF. Признаков активации процесса не наблюдается.
Наблюдение 2.
Больная Б. 33 лет, ИБ №1254/ц, поступила в отделение ХГТ РНИОИ в феврале 2007 г. с диагнозом: Рак левой молочной железы, прогрессирование после нерадикальной операции (февраль 2006), с экзофитным ростом, распадом, распространением на мягкие ткани грудной стенки с ростом в переднее средостение, St IV (T4N2M1) клиническая группа II.
Две опухоли в левой молочной железе заметила в феврале 2006, по месту жительства произведена секторальная резекция, ГА №1413-18 - карцинома, от радикальной операции отказалась. В августе 2006 обследована в РНИОИ по поводу местного рецидива с экзофитным ростом. От рекомендованного лечения (2 курса полихимиотерапии по месту жительства) воздержалась, занималась самолечением.
При СРКТ от 16.02.07 г. - опухоль левой молочной железы 20×9×12 см прорастает мышцы грудной стенки с ростом в переднее средостение, данных за отдаленные метастазы в паренхиматозные органы и кости не выявлено.
При осмотре внутренние и центральные отделы левой молочной железы заняты опухолью, распространяющейся за пределы железы, с экзофитом до 10 см, несколькими поверхностными кровоточащими язвами от 1 до 3 см, вторичный отек железы. Правая молочная железа без патологии. Аксиллярные лимфоузлы слева до 5 см, другие лимфоузлы не пальпируются.
Проведен 1 неоадъювантный курс АПХТ с предварительным омагничиванием аутоплазмы. Суммарные дозы цитостатиков составили: метотрексат 50 мг, 5-фторурацил 3000 мг, циклофосфан 1200 мг, доксорубицин 120 мг. Из осложнений отмечены тошнота 2 степени, рвота 2 степени, анемия 2 степени, алопеция 2 степени, не требующие медикаментозной коррекции.
После 1 курса отмечены полная резорбция экзофитного компонента опухоли, эпителизация язв, конгломерат подкрыльцовых лимфоузлов сегментировался и уменьшился до 2×3 см, смещаем.
После 2 аналогичного неоадъювантного курса АПХТ с предварительным омагничиванием аутоплазмы пальпировалась остаточная опухоль в молочной железе до 3 см, подкрыльцовые лимфоузлы не пальпировались. Из осложнений отмечены тошнота 2 степени, рвота 2 степени, анемия 3 степени, алопеция 2 степени.
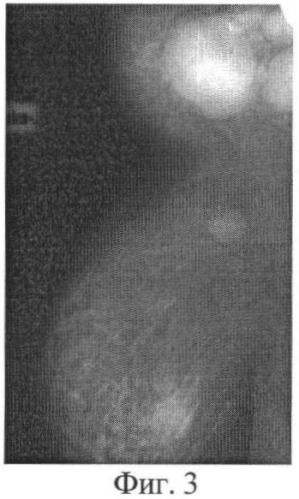
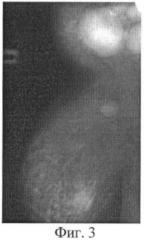
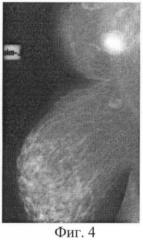
При СРКТ от 16.04.07 г. - в левой молочной железе опухоль 1,5 см, рубцовые изменения мышц грудной стенки, в переднем средостении опухолевого компонента не выявлено, данных за отдаленные метастазы в паренхиматозные органы и кости не выявлено. На Фиг.3, 4 представлены фотограции местного статуса больной Б. (3 - до лечения, 4 - после лечения).
30.04.2007 г. выполнена радикальная мастэктомия по Холстеду слева. Макропрепарат: в молочной железе после лечения опухоль 1,5 см, переходящая на большую грудную мышцу, в подкрыльцовой клетчатке 1 лимфоузел 0,5 см, в других коллекторах метастазов не выявлено.
ГА №925345-52 от 2.05.07 «на фоне выраженного склероза мелкие комплексы дистрофически измененных клеток инфильтрирующего протокового рака, лечебный патоморфоз III-IV степени, метастазов в регионарные лимфоузлы не выявлено». Заживление первичным натяжением. После операции больная подвергается дистанционной гамматерапии на пути лимфооттока из молочной железы. Признаков активации процесса не наблюдается.
Технико-экономическая эффективность «Способа лечния рака молочной железы» заключается в том, что повышение связывающей активности белков плазмы к химиопрепаратам позволяет получить максимально высокую эффективную концентрацию химиопрепарата в единице объема плазмы. Применение омагниченной аутоплазмы в химиотерапии в качестве носителя фармакологических препаратов обеспечивает «адресную» транспортную доставку к органам-мишеням. Это позволяет повысить эффективность лечения: добиться уменьшения размеров опухоли и лимфоузлов, перевести больных с местно-распространенным процессом из неоперабельного в операбельное состояние, достигнуть ремиссии в короткие сроки у больных с генерализованным процессом, улучшить качество их жизни, снизить токсичность проводимой полихимиотерапии, тем самым сокращая дополнительные затраты на купирование осложнений, возникающих в процессе лечения.
Способ лечения рака молочной железы, включающий внутривенное капельное введение противоопухолевых химиопрепаратов на аутоплазме, отличающийся тем, что полученную аутоплазму подвергают воздействию переменного магнитного поля с параметрами 100 Гц, 50 МТл в течение 30 мин, затем каждый противоопухолевый химиопрепарат в разовой дозе смешивают с аутоплазмой, инкубируют при +37,0°С в течение не менее 30 мин и реинфузируют внутривенно капельно.