Способы лечения, требующие фитокомпонентов
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к диетологии и терапии, и может быть использована для уменьшения неблагоприятных эффектов при терапии фитостеринами. Способ по изобретению касается поддержания и/или увеличения биодоступности и/или уровней в крови, по меньшей мере, одного из циркулирующих липофильных витаминов, липофильных лекарственных средств, липофильных питательных веществ или любого липофильного фармацевтически активного ингредиента у субъекта, нуждающегося в терапии фитостеринами введением терапевтически эффективного количества смеси сложного(ых) эфира(ов) фитостерина (PS-E) и 1,3-диглицерида(ов) (DAG). Съедобная композиция по изобретению содержит смесь сложного(ых) эфира(ов) фитостерина (PS-E) и 1,3-диглицерида(ов) (DAG). Использование изобретений позволяет уменьшить концентрацию холестерина и триглицеридов без неблагоприятного действия на уровень липофильных молекул в крови. 2 н. и 26 з.п. ф-лы, 5 табл., 2 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области функционального питания и пищевых добавок при лечении заболеваний. Более детально, настоящее изобретение относится к лечению заболеваний смесями липидов, содержащими фитостерины.
Уровень техники
Все публикации, упомянутые в этой заявке, полностью включены сюда путем отсылки, включая все ссылки, цитируемые здесь.
Стерины растений представляют собой природные вещества, присутствующие в питании в виде минорных компонентов растительных масел. Растительные стерины выполняют в растениях роль, похожую на роль холестерина у млекопитающих, например, при формировании структур клеточной мембраны. И стерины растений, и станолы растений в пище человека эффективно снижают общий уровень холестерина плазмы крови и уровень холестерина в составе липопротеидов низкой плотности (LDL). Термин «фитостерины» охватывает стерины и станолы растений.
Фитостерины являются компонентами нормального питания, поступающими большей частью из растительных источников, например растительных масел, семян, орехов и продуктов, приготовленных на основе зерен злаков. Обычное потребление растительных стеринов в питании западного типа колеблется между 200 и 400 мг/день, тогда как всасывание фитостанолов, насыщенных форм растительных стеринов, пренебрежимо мало.
Потребление больших количеств растительных стеринов и растительных станолов снижает уровень холестерина в крови путем ингибирования всасывания пищевого и эндогенно синтезированного холестерина из тонкого кишечника. Это ингибирование связано со сходством физико-химических свойств растительных стеринов и станолов с холестерином.
Растительные стерины/станолы представляют собой очень плохо всасываемые соединения. Изучение всасывания, распределения, метаболизма и экскреции показало, что растительные стерины плохо всасываются из кишечника (1-10%).
Гипохолестеринемическое действие фитостеринов было обнаружено в начале 1950-х [Jones et al. (1997) Can. J. Physiol. Pharmacol. 75, 217-227]. Эффект снижения уровня холестерина в крови стеринами растений был исследован в большом числе клинических испытаний, включающих около 2400 субъектов, при использовании доз до 25 г в день и продолжительностью до трех лет. Проводимое на протяжении десятилетий медицинское тестирование клинической эффективности или общее клиническое применение растительных стеринов не выявило существенных неблагоприятных эффектов. Более того, лекарственный препарат Cytellin (главным образом, β-ситостерин) назначался в течение более 20 лет и давал превосходные результаты без побочных эффектов. Кроме того, растительные стерины и растительные станолы подвергались тщательной токсикологической оценке.
Фитостерины или фитостанолы, а также их эфиры, образованные жирными кислотами, и другие производные являются распространенными продуктами, обеспечивающимися в виде пищевых добавок или функциональных компонентов в разнообразных оздоровительных продуктах и напитках, а также в виде пищевых добавок с целью снижения уровня общего холестерина и особенно LDL (липопротеин низкой плотности)-холестерина в крови.
Гиперхолестеринемия (высокий уровень холестерина крови), которая может лечиться или регулироваться фитостеринами, является главным фактором риска в развитии сердечно-сосудистых заболеваний (CVD). CVD являются одной из ведущих причин смертности во всем мире. Гиперхолестеринемия вызывает также образование и накопление отложений атеросклеротических бляшек в артериях, что приводит к развитию атеросклероза, патологического процесса, лежащего в основе коронарной болезни сердца (CHD), одного из видов CVD.
Диабет 2 типа и связанные с ним состояния, известные как диабетическая тучность, и метаболический синдром, связаны с CVD, заболеваемость которыми в течение последнего столетия также значительно увеличилась. В большинстве случаев CVD усиливаются и даже инициируются такими метаболическими расстройствами, или их начало и развитие усиливаются названными синдромами. Они также тесно связаны с факторами риска аномального липидного состава крови, особенно высокого уровня общего холестерина и холестерина, не входящего в состав липопротеидов высокой плотности (HDL), главным образом LDL-холестерина.
Люди с риском развития метаболического синдрома, диабета или ожирения, а также CVD и CHD или уже признанные пациентами с вышеназванными состояниями предупреждаются о необходимости мониторинга и контроля липидного состава крови, в особенности высокого уровня холестерина крови. Одним из наиболее эффективных способов реагирования на такой фактор риска, общего для таких состояний здоровья и рисков, является потребление растительных стеринов, или станолов, или их производных.
Эффективным способом лечения, который был направлен на такой фактор риска, было введение одновременно статинов и растительных стеринов. Оба активных ингредиента влияют на высокий уровень холестерина крови, используя различные механизмы действия. Фармацевтические ингредиенты, основанные на статинах, ингибируют синтез холестерина de novo, тогда как фитостерины ингибируют всасывание пищевого и эндогенно синтезируемого холестерина. Было показано, что потребление эфиров растительного станола пациентами, принимающими статины, но все еще имеющими повышенный уровень LDL-холестерина, было способно дополнительно снизить уровни общего и LDL-холестерина до 12 и 17% соответственно [Blair et al. (2000) Am. J. Cardiol. 86, 46-52]. Кроме того, лечение субъектов с начальной гиперхолестеринемией статинами и пищей, содержащей эфиры фитостеринов, оказывало исключительно аддитивный эффект на уровень LDL-холестерина, снижая его [Simons et al. (2002) Am. J. Cardiol. 90, 737-740]. Фактически Симонс и соавт. пришли к выводу, что добавление эфиров фитостеринов в терапию статинами приводит к уменьшению LDL-холестерина, эквивалентному эффекту, получаемому при двойной дозе статинов. Похожие результаты были получены и другими авторами [Vuorio etal. (2002) Arterioscler. Thromb. Vasc. Bidol. 500-506].
Для женщин в постменопаузе характерны некоторые типичные симптомы, такие как приливы, потоотделение ночью, бессонница, вагинальная сухость и такие расстройства, как остеопороз, CVD и перестройки, связанные с центральной нервной системой (тревога и перемены настроения, депрессия и снижение познавательных способностей). В отношении осложнений CVD в такой популяции четко установлено, что доля инфарктов миокарда возрастает в 3 раза, а также быстро растут заболевания сосудов головного мозга. Полагают, что эстроген играет роль в защите клеток эндотелия стенок сосудов и, возможно, защищает от тромбоза, следовательно, вышеупомянутые симптомы являются следствием его дефицита. Гормональная заместительная терапия (HRT) играет заметную роль в лечении симптомов менопаузы и остеопороза. Однако последние данные Women Health Initiative (WHI) показали, что прием HRT увеличивает риск возникновения у женщин болезни сердца, инсульта и легочной эмболии. Недавно показано, что женщины, находящиеся в периоде постменопаузы (возраст 50-55 лет) и потребляющие растительные станолы, содержащиеся в маргарине, в течение 6 недель, демонстрируют заметное снижение LDL-холестерина по сравнению с контрольным уровнем, тогда как уровень HDL-холестерина увеличивался, таким образом, уменьшалось соотношение LDL/HDL холестеринов [Gylling and Miettenen (1999) Metabolism 48: 575-580]. Однако вслед за различным введением станолов было зарегистрировано значительное уменьшении концентраций α- и β-каротина, тогда как уровни ретинола, витамина Д и стандартизованного по липидам α-токоферола были сравнимы с контрольными уровнями.
Также было установлено, что фитостерины имеют противораковые эффекты. Эпидемиологические и экспериментальные исследования позволяют считать, что пищевые фитостерины могут защищать от наиболее распространенных в западном обществе типов рака, таких как рак кишечника, груди и предстательной железы. Популяции с низким риском рака груди потребляют больше пищевых фитостеринов, чем популяции с высоким риском. Несколько исследований in vitro позволяют предполагать, что фитостерины токсичны для раковых клеток груди и предстательной железы человека. Эксперименты in vivo на животных показали, ингибиторный эффект фитостеринов на возникновение, развитие и метастазы опухолей толстой кишки, рака груди и предстательной железы [Awad, A.B. and Fink C.S. (2000) J. Nutr. 130: 2127-2130; Moreaua, R.A. et al. (2002) Progress in Lipid Research. 41: 457-500]. Хотя существуют доказательства противораковых свойств фитостеринов, механизм ингибирования ими роста опухоли все еще неизвестен. Однако возможные механизмы, благодаря которым фитостерины оказывают защитное действие, включают прямой эффект на структуру мембраны и функции опухоли и ткани хозяина, сигнальный путь, который регулирует развитие опухоли, и апоптоз [Awad and Fink (2000) id ibid].
Одним из основных факторов риска CVD и CHD, а также таких метаболических расстройств, как диабет 2 типа, является окислительный стресс, относительное увеличение уровня свободных радикалов. Они ответственны, например, за увеличение образования окисленных LDL, которые, когда они обнаруживаются в относительно высоких концентрациях, несут ответственность за формирование пенистых клеток, признака раннего атеросклероза. Высокий уровень свободных радикалов может обнаруживаться в крови и других тканях в результате различных причин, относящихся, например, к изменениям в окружающей среде, таким как рост загрязнения, или связанных с плохим питанием вследствие получения с пищей проокисленных компонентов или недостаточного потребления антиоксидантов. Кроме того, повышенный уровень свободных радикалов является общим для таких метаболических состояний, как диабет 2 типа, диабетическая тучность и метаболический синдром, сопровождаемый поддерживающимся гипергликемическим состоянием. Окислительный стресс можно вылечить или даже предотвратить с помощью различных активных ингредиентов, обладающих антиоксидантной активностью, в основном путем нейтрализации обнаруженных в организме свободных радикалов.
Фитостерины, вероятно, могут играть роль в предотвращении состояний или расстройств, относящихся к воспалению, включая пролиферативные ответы лимфоцитов, туберкулез легких, вирус иммунодефицита человека (HIV), индуцированное стрессом подавление иммунитета, ревматоидный артрит и аллергический ринит/синусит [Bouic (2001) Opin Clin Nutr. Matab. Care 4: 471-475]. Полагают, что механизмы, с помощью которых растительные стерины проявляют свое противовоспалительное действие, включают ингибирование секреции моноцитами таких медиаторов воспаления, как интерлейкин-6 и α-фактор некроза опухоли; однако большая часть работы была проведена с применением моделей на животных, поэтому механизм нуждается в выяснении.
Фитостерины проявляют также противоязвенную активность, защищая от инфекции Helicobacter pylori. В недавно проведенных исследованиях эфиры фитостеринов (но не стерины) конского горошка (травянистое растение вида Dolichos, культивируемое в Индии для еды и корма скоту) продемонстрировали защитный эффект на модели язвы, вызванной лигатурой пилорического отдела [Jayaraj et al. (2003) Phytother Res 17: 391-398]. Вместе со стеринами и фосфолипидами эти пищевые липиды при питании могут рассматриваться ответственными за малую распространенность язвы двенадцатиперстной кишки в определенных географических зонах, несмотря на равномерное широкое распространение инфекции Helicobacter pylori.
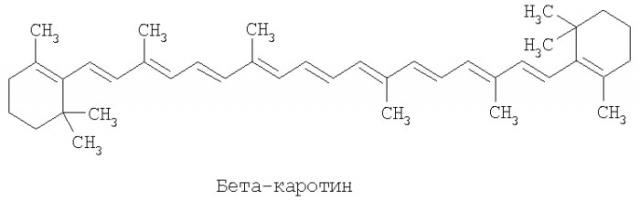
Любое лечение, направленное на названные расстройства и/или состояния, необходимо сочетать со здоровым и сбалансированным питанием. Такое питание, конечно, должно обеспечивать пациента всеми незаменимыми питательными веществами, среди которых витамины. Многие витамины являются липофильными, и среди них для таких пациентов важны витамин А и витамин Е. Эти витамины также обладают антиоксидантной активностью, которая важна для защиты организма от окислительного стресса, и, вероятно, защищают от повреждений, вызванных свободными радикалами. Витамин А, известный также как ретинол, является каротиноидным витамином (см. схему 1). Витамин А продуцируется в печени из различных провитаминных каротиноидов, в особенности из бета-каротина, наиболее важного провитамина А, и самого по себе антиоксиданта. Витамин Е, известный также как альфа-токоферол, обнаруживается, главным образом, в растительных источниках и также является важным антиоксидантом. Этот липофильный витамин обычно сопровождается другими производными токоферольной структуры, такими как бета- и гамма-токоферолы.
Хотя фитостерины и фитостанолы и их сложные эфиры с жирными кислотами, одни или в комбинации со статинами или другими ингредиентами, являются одними из наиболее эффективных способов лечения такого фактора риска, как гиперхолестеринемия, недавние исследования показали, что применение таких фитоингредиентов может иметь неблагоприятные эффекты. Первично заинтересованность во введении фитостеринов заключается в эффекте, который он может оказывать на всасывание и уровень жирорастворимых витаминов и каротиноидов в крови. Пищевые фитостерины ингибируют всасывание пищевого и билиарного холестерина, которые, в свою очередь, уменьшают всасывание каротиноидов и жирорастворимых витаминов [Noakes et al. (2002) Am. J. Clin. Nutr. 75(1): 79-86]. Это представляет интерес, поскольку, как упоминалось выше, существует много полезных для здоровья эффектов, связанных с употреблением с пищей каротиноидов и витаминов [Hendriks et al. (1999) Eur. J. Clin. Nutr. 53(4): 319-327].
Более того, были выявлены некоторые клинические исследования, в которых сообщалось, что потребление фитостеринов приводило к значительному уменьшению уровня каротиноидов в плазме [Katan et al. (2003) Mayo Clin. Proc.78(8): 965-978]. Это снижение следовало за употреблением твердых или жидких масел, включающих 0,83-3,6 г фитостеринов/день в течение периода от 3 до 52 недель. Недавно было описано уменьшение биодоступности бета-каротина и альфа-токоферола у мужчин-добровольцев с умеренным избыточным весом после принятия 2,2 г фитостеринов/день в течение года [Richelle et al. (2004) Am. J. Clin. Nutr. 80(1): 171-177]. Однако в этом исследовании эфиры растительных стеринов уменьшали биодоступность бета-каротина и альфа-токоферола больше, чем свободные растительные стерины. Уменьшение уровня бета-каротина составляло более 50%.
Кроме того, хотя был продемонстрирован полезный эффект терапии комбинацией фитостерина и станинов [Vuorio (2000) id ibid], мониторинг в крови уровней витамина А, витамина Е, а также альфа- и бета-каротина обнаружил, что такое лечение приводит к уменьшению уровня всех витаминов и провитаминов в сыворотке крови на 10-50%. Такие эффекты особенно проявлялись у детей, находящихся на лечении вследствие генетического статуса [см. обзор Berger et al. (2004) Lipids Health Dis. 3: 5-24].
Объединенный европейский научный комитет по питанию (The European Union Scientific Committee on Food) (SCF) пришел к заключению, что продажа питания, включающего фитостерины, должна сопровождаться исследованием возможных неблагоприятных эффектов на здоровье, включающих среди прочих действие на уровень бета-каротина в плазме. Пищевой консультативный комитет Англии (The UK Food Advisory Committee) (FAC) дал рекомендацию, что потребители должны быть информированы о том, что продукты, содержащие эфиры фитостеринов, не пригодны для питания маленьких детей и кормящих грудью женщин, поскольку они не нуждаются в снижении уровня холестерина в крови, и имеется возможность влияния на уровень витамина А. Научный отдел по диетическим продуктам, питанию и аллергии Европейской организации права безопасного питания (The Scientific Panel on Dietetic Products, Nutrition and Allergies of European Food Safety Authority) (EFSA) акцентировал внимание на необходимости мер регуляции риска для того, чтобы минимизировать вероятность ежедневного потребления фитостеринов/фитостанолов на уровне выше 3 г/день, и предоставления соответствующей информации для потребителей относительно необходимости регулярного потребления фруктов и овощей, обращая внимание на потенциальный эффект продуктов, снижающий уровень бета-каротин.
Лихтенштейн и соавторы [Lichtenstein et al. (2001) Circulation. 103: 1177-1179] акцентировали внимание на потенциальных рисках, связанных с применением жиров, включающих сложные эфиры растительных станолов/стеринов, среди них наблюдение, свидетельствующее о снижении в плазме крови уровней альфа- и бета-каротинов, альфа-токоферола и/или ликопена в результате потребления пищи, включающей одновременно сложные эфиры станола и сложные эфиры стерина.
Так как пищевые продукты, включающие растительные стерины, могут потребляться во время приема пищи всеми членами семьи, имеется значительная возможность потребления ее негиперхолестеринемическими представителями. В соответствии с этим. Американская ассоциация здравоохранения (American Heart Association) рекомендовала предпринять дополнительные исследования и широкомасштабный мониторинг для установления долгосрочной безопасности пищи, включающей эфиры растительных стеринов/станолов у взрослых людей с нормальным уровнем холестерина и гиперхолестеринемией, а также у детей.
Как и в случае с неблагоприятным взаимодействием между фармацевтическими активными ингредиентами, того же следует избегать и для различных активных ингредиентов или питательных веществ, фармацевтических или диетических, которые могут приниматься или которые требуются для обеспечения потребностей здоровья в случае CVD и других описанных здесь заболеваний. Такие взаимодействия могут уменьшать эффективность или потребление одного или более ингредиентов, применяемых в лечении. В некоторых случаях взаимодействие ингредиентов, применяемых в лечении названных заболеваний, может приводить к уменьшению эффективности или потребления других диетических питательных веществ или ингредиентов, необходимых отдельным людям для поддержания их общего здоровья и способности справиться со специфическими факторами риска, для чего они и лечатся. В основном наблюдаемый неблагоприятный эффект применения фитостерина на всасывание витамина А и бета-каротина, а также витамина Е может быть также существенным для других диетических питательных веществ, активных фармацевтических ингредиентов или пищевых активных ингредиентов, которые, как каротиноиды и токоферолы, являются липофильными. Такие липофильные диетические питательные вещества, активные фармацевтические ингредиенты или пищевые активные ингредиенты, для которых их всасывание или эффективность могут быть затем скорректированы параллельным введением фитостеринов, включают фармацевтические антилипидемические ингредиенты, природные антиоксиданты, пищевые или активные липиды и так далее. Схемы 1 и 2 иллюстрируют химическую структуру некоторых липофильных активных ингредиентов и диетических питательных веществ, а также витамина А и E.
Схема 1 - Химические структуры витаминов А, Е и других липофильных активных ингредиентов и диетических питательных веществ.
Схема 2 - Химическая структура липофильной омега-3 LC-PUFA DHA
Фармацевтически активные ингредиенты были разработаны с целью регулирования высокого уровня холестерина в крови и широко применялись при лечении популяций с риском, относящимся к описанным состояниям. Возможно, наиболее доступный подход зависит от активных ингредиентов химического семейства статинов, для которых известно, что они ингибируют биосинтетический путь продукции холестерина, что приводит к низкому уровню холестерина крови. Другие применяемые активные ингредиенты представляют собой смолы, связывающие желчные кислоты, ингибиторы абсорбции холестерина, комбинация ингибиторов всасывания холестерина и статины, фибраты и ниацин.
Для производственных и пищевых целей применяются разнообразные синтетические антиоксиданты. Современная методология предпочитает применение природных антиоксидантов, полученных, главным образом, из растительных источников. Такие антиоксиданты, происходящие из растений, включают ликопин, в основном обнаруженный в растениях красного цвета, особенно томатах, и лютеин. Другие антиоксиданты, происходящие из растений, включают зеаксантин и бета-каротин. Все эти антиоксиданты могут быть классифицированы как высоколипофильные, что является непосредственным результатом общего для них каротиноидного скелета. Другие антиоксиданты включают соединения с химическими характеристиками полифенолов. Все такие природные антиоксиданты, как каротиноид, полифенольные и другие липофильные, применимы для лечения описанных состояний, и должно быть полезным их параллельное введение с фитостеринами.
Омега-3 длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA), главным образом докозагексаеновая кислота (DHA) и эйкозапентаеновая кислота (ЕРА), считаются веществами, способствующими обеспечению здоровья сердечно-сосудистой системы, в частности, благодаря их антигипертриглицеридемической активности. Управление пищевых продуктов и лекарственных средств Соединенных Штатов (The US Food and Drug Administration) (FDA) в сентябре 2004 сообщило, что эти жирные кислоты заслужили уточнения их потребностей для сохранения здоровья с целью снижения риска CHD путем потребления пищи или пищевых добавок, включающих ЕРА и DHA. Несомненно, потребление этих жирных кислот может быть полезно для популяций, страдающих от расстройств или заболеваний, обсужденных выше, или для популяций, желающих предотвратить или подавить наступление названных состояний.
Все эти, а также другие ингредиенты могут применяться в комбинации или отдельно для того, чтобы направить их на факторы риска у пациентов с CVD, CHD, метаболическими расстройствами, у популяций с высоким риском, пациентам, больным раком, и так далее.
Таким образом, другие обнаруженные или находящиеся в разработке с целью воздействия на различные заболевания липофильные фармацевтически активные ингредиенты, а также другие липофильные пищевые добавки, главным образом растительные ингредиенты, экстрагированные или происходящие из различных растительных источников, которые требуются для лечения или могут быть полезны при параллельном введении или потреблении фитостеринов и/или их производных, стоят перед проблемой риска их потребления, ограничивающего введение названных фитостеринов.
Следовательно, в свете положительных эффектов фитостеринов как способа лечения гиперхолестеринемии по отдельности или в комбинации с дополнительными ингредиентами, направленными на различные риски CVD, CHD, метаболических расстройств, включая гипертриглицеридемию, гиперглицемию и окислительный стресс, а также другие заболевания, такие как рак, целью изобретения является обеспечение способа лечения, который будет давать возможность создания большей части полезных эффектов фитостеринов/фитостанолов и их эфиров без возможных неблагоприятных эффектов ингибирования поглощения других важных ингредиентов, таких как витамины, антиоксиданты и даже фармацевтически активные ингредиенты.
Избыточный вес или ожирение в значительной степени увеличивает риск заболеваемости рядом состояний, включающим сахарный диабет 2 типа (DM), гипертоническую болезнь, дислипидемию, коронарную болезнь сердца, хроническую сердечную недостаточность, инсульт. Заболевания желчного пузыря, стенозы печени, остеоартрит, синдром апноэ во сне, а также рак эндометрия, груди, предстательной железы и толстой кишки. Увеличение смертности во всех случаях также связано с повышенным весом тела. Многие из этих состояний могут быть вылечены или предотвращены путем применения фитостеринов/фитостанолов и их сложных эфиров.
Дополнительной целью изобретения является предоставление способа лечения, обеспечивающего положительные эффекты фитостеринов/фитостанолов и их сложных эфиров на гиперхолестеринемию, наряду также с контролированием и даже стимулированием снижения веса тела пациента.
Таким образом, объектом настоящего изобретения является предоставление метода лечения состояний, которые нуждаются в терапии фитостеринами, без отрицательного воздействия на биодоступность любых липофильных витаминов, липофильных лекарственных средств, липофильных питательных веществ или любого липофильного фармацевтически активного ингредиента, путем введения смеси PS-E (сложный(е) эфир(ы) фитостерина) и DAG (главным образом, 1,3-диацилглицерид(ы)), растворенных или диспергированных в съедобном масле или жире, либо композиции или пищевого продукта, включающего то же самое, нуждающемуся в этом субъекту. Этот и другие объекты изобретения станут очевидными при дальнейшем описании.
Раскрытие изобретения
В первом аспекте настоящее изобретение обеспечивает способ лечения состояния, нуждающегося в терапии фитостеринами, без вредного действия на биодоступность любого из липофильных витаминов, липофильных лекарственных средств, липофильных питательных веществ или любого липофильного фармацевтически активного ингредиента, названный способ включает введение терапевтически эффективного количества смеси PS-E сложного(ых) (эфира(ов) фитостеринов) и DAG (главным образом, 1,3-диглицерида(ов)), не обязательно растворенных или диспергированных в съедобном масле или жире, либо композиции или пищевого продукта, включающего то же самое, нуждающемуся в этом субъекту.
Главным образом, настоящее изобретение обеспечивает способ лечения состояния, которое нуждается в терапии фитостеринами, не имеющий побочного влияния на биодоступность какого-либо одного из липофильных витаминов, липофильных лекарственных средств, липофильных питательных веществ или любого липофильного фармацевтически активного ингредиента, вышеуказанный способ включает введение терапевтически эффективного количества смеси PS-E и DAG (главным образом 1,3-диглицерида(ов)), растворенных или диспергированных в съедобном масле или жире, либо композиции или пищевого продукта, включающего то же самое, нуждающемуся в этом субъекту.
В одном специфическом воплощении способа изобретения вышеуказанные липофильные витамины являются каротиноидами и токоферолами, предпочтительно витамином А и витамином Е соответственно.
В другом специфическом воплощении способа изобретения вышеуказанные липофильные активные ингредиенты являются фитостерином(ами).
Вышеуказанное заболевание, нуждающееся в терапии фитостеринами, может быть выбрано из группы, включающей следующие: рак, доброкачественную гипертрофию простаты, язву, простатит, CVD, CHD, атеросклероз, туберкулез легких, HIV, подавление иммунитета, вызванное стрессом, ревматоидный артрит и аллергический ринит/синусит. Дефицит жирорастворимых витаминов, возникающий вследствие питания, метаболических расстройств, нарушения всасывания жиров, взаимодействия витаминов с лекарствами или вследствие снижения всасывания витамина, может приводить к инсульту, диабету, раку груди, иммунному дефициту, подавлению иммунитета, остеопорозу, остеопении, старению при воздействии света, опухоли кожи, реакции светочувствительности, развитию катаракты и катаракте, ухудшению светочувствительности сетчатки, фотогемолизу эритроцитов, фотоэритеме, фотоканцерогенезу, болезни Крона, синдрома укороченного кишечника (short bowel syndrome), болезни Альцгеймера, слабоумию, младенческому неалкогольному стеатогепатиту, множественному склерозу.
В другом аспекте настоящее изобретение обеспечивает способ улучшения контроля веса, включающий введение терапевтически эффективного количества смесей PS-E и DAG, растворенных или диспергированных в съедобном масле или жире, либо композиции или пищевого продукта, включающего то же самое, нуждающемуся в этом субъекту.
В дополнительном аспекте изобретение обеспечивает способ лечения метаболического состояния, приводящего к избыточному весу, включающий введение терапевтически эффективного количества смеси PS-E и DAG, необязательно растворенных или диспергированных в съедобном масле или жире, либо композиции или пищевого продукта, включающего то же самое, нуждающемуся в этом субъекту. В частности, вышеназванным состоянием является ожирение.
В одном воплощении способов изобретения названное съедобное масло может быть выбрано из группы, включающей оливковое масло, рыбий жир, масло канолы, соевое масло, подсолнечное масло, масло сафлоры красильной, пальмовое масло, масло авокадо, кунжутное масло, льняное масло и масло огуречника аптечного. Предпочтительно вышеуказанным маслом является рыбий жир.
В другом воплощении способов изобретения вышеназванный жир может быть любым природным жиром, выбранным из группы, включающей сливочное масло, обезвоженное сливочное масло, масло какао и свиной жир.
В дополнительном воплощении способов изобретения остатки жирных кислот в PS-E и DAG не обязательно соответствуют остаткам жирных кислот масла, из которого они получены, таким как остатки олеиновой, пальмитиновой, пальмитолеиновой, стеариновой, линолевой, линоленовой, эйкозановой, докозагексаеновой (DHA) и эйкозапентаеновой (ЕРА) кислот.
В другом дополнительном воплощении способов изобретения вьппеуказанный(ые) эфир(ы) фитостерина является/являются эфиром(ами) жирных кислот стигмастерина, ситостерина, бета-ситостерина, брассикастерина, кампестерина и/или 5-авенастерина и их изомеров и производных, и вышеназванные эфир(ы) фитостанола является/являются эфиром(ами) жирных кислот бета-ситостанола, кампестанола и/или стигмастанола и их изомеров и производных.
В еще одном воплощении способов изобретения вышеназванная смесь дополнительно включает традиционные ингредиенты пищевых композиций.
В одном определенном воплощении способов изобретения весовое соотношение эфиров фитостерина и/или фитостанола и диацилглицерида(ов) в вышеназванной смеси лежит в ряду примерно от 15:1 до 1:1, предпочтительно примерно от 10:1 до 1:1, более предпочтительно от 5:1 до 1:1 и, в частности, около 2:1.
В другом частном воплощении способов изобретения количество диацилглицерида(ов) в вышеназванной смеси составляет, по меньшей мере, 1% по весу. Более специфично, количество диацилглицерида(ов) в вышеназванной смеси составляет примерно от 1 до 99% по весу, предпочтительно примерно от 4 до 70% по весу, в частности примерно от 7 до 48% по весу, еще лучше примерно от 10 до 22% по весу, а количество эфира(ов) фитостерина и/или фитостанола в вышеназванной смеси составляет примерно от 1 до 99% по весу, предпочтительно примерно от 5 до 70% по весу, более предпочтительно примерно от 7 до 60% по весу, в частности примерно от 10 до 60% по весу, более точно примерно от 7 до 35% по весу и в особенности от 20 до 35% по весу.
В дополнительном отдельном воплощении способов изобретения количество эфира(ов) фитостерина и/или фитостанола в вышеназванной смеси составляет, по меньшей мере, 1% по весу.
В одном предпочтительном воплощении способов изобретения вышеназванная смесь состоит на 15% по весу из DAG, главным образом из l,3-DAG(s), и на 25% из общего PS-E(s), растворенных или диспергированных в любом из оливкового масла, масла канолы и рыбьего жира.
В одном специфическом аспекте изобретение обеспечивает способ улучшения контроля веса у женщин, включающий введение терапевтически эффективного количества смеси PS-E и DAG (главным образом, 1,3-диглицерида(ов)), необязательно растворенных или диспергированных в оливковом масле, либо композиции или пищевого продукта, включающего ее, нуждающемуся субъекту.
В дополнительном аспекте настоящее изобретение обеспечивает диетическое питательное вещество или пищевую добавку, включающие съедобную композицию для лечения заболеваний, нуждающихся в терапии фитостеринами, не имеющие побочного отрицательного влияния на биодоступность какого-либо одного из липофильных витаминов, липофильных лекарственных средств, липофильных питательных веществ или любого липофильного фармацевтически активного ингредиента, вышеуказанная композиция включает смесь PS-E и DAG (главным образом 1,3-диглицерида(ов)), необязательно растворенных или диспергированных в съедобном масле или жире.
В одном воплощении диетического питательного вещества или пищевой добавки изобретения вышеназванное масло может быть выбрано из группы, включающей оливковое масло, рыбий жир, масло канолы, соевое масло, подсолнечное масло, масло сафлоры красильной, пальмовое масло, масло авокадо, кунжутное масло, льняное масло и масло огуречника аптечного. Предпочтительно вышеуказанным маслом является рыбий жир.
В другом воплощении диетического питательного вещества или пищевой добавки изобретения вышеназванный съедобный жир может быть любым из природных жиров, выбранным из группы, включающей сливочное масло, безводное сливочное масло, масло какао и свиной жир.
В дополнительном воплощении диетического питательного вещества или пищевой добавки изобретения остатки жирных кислот PS-E и DAG необязательно соответствуют остаткам жирных кислот масла, из которого они получены, таким как остатки олеиновой, пальмитиновой, пальмитолеиновой, стеариновой, линолевой, линоленовой, эйкозановой, докозагексаеновой (DHA) и эйкозапентаеновой (ЕРА) кислот.
В другом дополнительном воплощении диетического питательного вещества или пищевой добавки изобретения эфир(ы) фитостерина является/являются эфиром(ами) жирных кислот и стигмастерина, ситостерина, бета-ситостерина, брассикастерина, кампестерина и/или 5-авенастерина и их изомеров и производных и вышеназванные эфир(ы) фитостанола является/являются эфиром(ами) жирных кислот и бета-ситостанола, кампестанола и/или стигмастанола и их изомеров и производных.
В еще одном дополнительном воплощении диетического питательного вещества или пищевой добавки изобретения вышеупомянутая смесь дополнительно включает традиционные ингредиенты пищевой композиции.
В одном предпочтительном воплощении диетического питательного вещества или пищевой добавки изобретения весовое соотношение эфиров фитостерина и/или фитостанола и диацилглицерида(ов) в вышеназванной смеси составляет примерно от 15:1 до 1:1, предпочтительно от 10:1 до 1:1, более предпочтительно от 5:1 до 1:1 и, в частности, около 2:1.
В другом предпочтительном воплощении диетического питательного вещества или пищевой добавки изобретения количество диацилглицерида(ов) в вышеназванной смеси составляет, по меньшей мере, 1% по весу. Более специфично, количество диацилглицерида(ов) в вышеназванной смеси составляет примерно от 1 до 99% по весу, предпочтительно от 4 до 70% по весу, в частности от 7 до 48% по весу, еще лучше примерно от 10 до 22% по весу, а количество эфира(ов) фитостерина и/или фитостанола в вышеназванной смеси - примерно от 1 до 99% по весу, предпочтительно примерно от 5 до 70% по весу, более предпочтительно примерно от 7 до 60% по весу, особенно предпочтительно от 10 до 60% по весу, в частности примерно от 7 до 35% по весу и в особенности примерно от 20 до 35%.
В следующем предпочтительном воплощении диетического питательного вещества или пищевой добавки изобретения количество эфира(ов) фитостерина и/или фитостанола в вышеназванной смеси составляет, по меньшей мере, 1% по весу.
Наконец, в самом предпочтительном воплощении диетического питательного вещества или пищевой добавки изобретения вышеназванная смесь состоит на 15% по весу из DAG, главным образом, из l,3-DAG(s), и на 25% из общего PS-E(s), растворенных или диспергированных в одном из следующего: оливковое масло, масло канолы и рыбий жир.
Краткое описание фигур
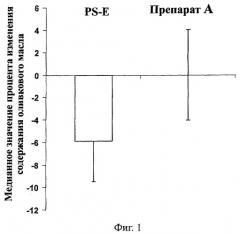
Фигура 1: Доступность жирорастворимых витаминов плазме крови
Гистограмма демонстрирует процент изменения уровня витамина А в плазме крови у субъектов, подвергаемых лечению одними PS-E или PS-E+DAG-рыбы (препарат А), в сравнении с лечением оливковым маслом (контроль).
Сокращения: chan.- изменение; contr.- контроль; ol.o. - оливковое масло; med. - медиана; val. - значение; Prep.A - препарат А.
Фигура 2: PS-E+DAG-оливы (препарат В) уменьшают вес тела
Гистограмма демонстрирует процент изменения индекса массы тела (BMI) у женщин, получающих лечение оливковым маслом, PS-E