Антитела против ангиопоэтина-2 и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и иммунологии. Предложено антитело против ангиопоэтина-2. Раскрыты варианты антитела, продуцируемые гибридомой АТСС РТА-7258, АТСС РТА-7259, АТСС РТА-7260. Раскрыты соответствующая кодирующая нуклеиновая кислота и экспрессионный вектор. Описана клетка-хозяина, продуцирующая антитело на основе указанного вектора. Предложены: способ лечения патологического ангиогенеза на основе антитела и использование антитела для приготовления лекарственного средства для лечения патологического ангиогенеза. Антитела по изобретению имеют Kd порядка 10-10-10-12 M, для антитела 3.19.3 (из АТСС РТА-7260) IC50=99 нМ. Указанные свойства антител могут найти применение в лечении различных опухолей человека. 8 н. и 25 з.п. ф-лы, 18 ил., 18 табл.
Реферат
По настоящей заявке испрашивается приоритет предварительной заявки США рег. № 60/638354, поданной 21 декабря 2004, и предварительной заявки США рег. № 60/711289, поданной 25 августа 2005, которые вводятся в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к моноклональным антителам против ангиопоэтина-2 (Ang-2) и к применению таких антител. Более конкретно, настоящее изобретение относится к полностью человеческим моноклональным антителам против Ang-2 и к применению указанных антител. В других своих аспектах, настоящее изобретение также относится к гибридомам или к другим клеточным линиям, экспрессирующим указанные антитела. Описанные антитела могут быть использованы в качестве диагностических средств и для лечения заболеваний, ассоциированных с активностью и/или со сверхпродуцированием Ang-2.
Предшествующий уровень техники
Ангиогенез представляет собой процесс образования новых капилляров из уже имеющихся кровеносных сосудов и является существенным компонентом процессов эмбриогенеза, нормального физиологического роста, репарации ткани и роста опухолей. Хотя ответы эндотелиальных клеток (ЭК) in vitro и рост кровеносных сосудов in vivo могут модулироваться различными факторами, однако, очевидно, что на сосудистые ЭК почти исключительно влияют только члены семейства сосудистых эндотелиальных факторов роста (VEGF) и ангиопоэтины. Yancopoulos et al., Nature 407:242-48 (2000).
Ангиопоэтины были обнаружены как лиганды для Tie, то есть для членов семейства тирозинкиназ, которые селективно экспрессируются в сосудистом эндотелии. Yancopoulos et al., Nature 407:242-48 (2000). В настоящее время известны четыре различных члена семейства ангиопоэтинов. Ангиопоэтины-3 и -4 (Ang-3 и Ang-4) могут представлять собой широко варьирующиеся аналоги одного и того же генного локуса у мышей и у человека. Kim et al., FEBS Let, 443:353-56 (1999); Kim et al., J Biol Chem 274:26523-28 (1999). Ang-1 и Ang-2 были впервые идентифицированы в экспериментах по культивированию тканей как агонист и антагонист, соответственно. Davis et al., Cell 87:1161-69 (1996); Maisonpierre et al., Science 277:55- 60 (1997). Все известные ангиопоэтины связываются, главным образом, с Tie-2, и оба Ang-1 и Ang-2 связываются с Tie-2 с аффинностью 3 нМ (Kd). Maisonpierre et al., Science 277:55-60 (1997). Было показано, что Ang-1 способствует увеличению продолжительности жизни эндотелиальных клеток и сохранению целостности эндотелия, Davis et al., Cell 87:1161-69 (1996); Kwak et al., FEBS Lett 448:249-53 (1999); Suri et al., Science 282:468-71 (1998); Thurston et al., Science 286: 2511-14 (1999); Thurston et al., Nat. Med. 6:460-63 (2000), тогда как Ang-2 обладает противоположным действием и стимулирует дестабилизацию и регрессию кровеносных сосудов в отсутствии факторов VEGF, ответственных за выживание клеток, или основных факторов роста фибробластов. Maisonpierre et al., Science 277:55-60 (1997). Однако во многих исследованиях функции Ang-2 высказывалось предположение о более сложной роли Ang-2. Ang-2 может представлять собой сложный регулятор ремоделирования сосудов, который играет роль как в развитии сосудов, так и в их деструкции. Для подтверждения такой роли Ang-2 были проведены анализы на его экспрессию, которые показали, что быстрое индуцирование Ang-2 вместе с VEGF приводит к развитию ангиогенеза у взрослых, а индуцирование Ang-2 в отсутствии VEGF приводит к деструкции сосудов. Holash et al., Science 284:1994-98 (1999); Holash et al., Oncogene 18:5356-62 (1999). В соответствии со своей зависимой от окружения ролью, Ang-2 связывается с тем же специфичным к эндотелию рецептором Tie-2, который активируется под действием Ang-1, но эта активация зависит от его окружения. Maisonpierre et al., Science 277:55-60 (1997).
Анализы ангиогенеза в роговице показали, что Ang-1 и Ang-2 имеют аналогичные эффекты, то есть их действие вместе с VEGF, которое стимулирует рост новых кровеносных сосудов, является синергическим. Asahara et al., Circ. Res. 83:233-40 (1998). На возможность увеличения дозозависимого эндотелиального ответа указывает наблюдение того факта, что Ang-2 может быть также про-ангиогенным при высокой концентрации in vitro. Kim et al., Oncogene 19:4549-52 (2000). При высокой концентрации Ang-2 действует как фактор выживания эндотелиальных клеток в процессе индуцированного депривацией сыворотки апоптоза, вызываемого активацией Tie-2 в каскадах реакций киназы PI-3 и Akt. Kim et al., Oncogene 19:4549-52 (2000).
В других in vitro экспериментах было высказано предположение, что при длительных воздействиях эффекты Ang-2 могут постепенно меняться от антагонического действия на агонистическое действие по отношению к Tie-2, а в наиболее поздних стадиях они могут непосредственно приводить к образованию сосудистых микротрубочек и стабилизации новых сосудов. Teichert-Kuliszewska et al., Cardiovasc. Res. 49:659-70 (2001). Кроме того, при культивировании ЭК на фибриновом геле, также наблюдалась активация Tie-2 под действием Ang-2, что, вероятно, указывает на то, что действие Ang-2 может зависеть от уровня дифференцировки ЭК. Teichert-Kuliszewska et al., Cardiovasc. Res. 49:659-70 (2001). В микрососудистых эндотелиальных клетках, культивированных в трехмерном коллагеновом геле, Ang-2 может также индуцировать активацию Tie-2 и стимулировать образование капилляро-подобных структур. Mochizuki et al., J. Cell. Sci. 115:175-83 (2002). Использование трехмерной сфероидной сокультуры в качестве in vitro модели созревания сосудов продемонстрировало, что прямое контактирование эндотелиальных клеток с мезенхимными клетками подавляет восприимчивость к VEGF, тогда как присутствие VEGF и Ang-2 индуцирует разрастание сосудов. Korff et al., Faseb J. 15:447-57 (2001). Etoh и др. продемонстрировали, что в ЭК, которые конститутивно экспрессируют Tie-2, экспрессия MMP-1, -9 и u-PA в высокой степени активируется ангиопоэтином Ang-2 в присутствии VEGF. Etoh, et al., Cancer Res. 61:2145-53 (2001). На in vivo модели мембраны зрачка, Лобов и др. показали, что Ang-2 в присутствии эндогенного VEGF индуцирует быстрое увеличение диаметра капилляров, ремоделирование базальной пластины, пролиферацию и миграцию эндотелиальных клеток, а также стимулирует образование новых кровеносных сосудов. Lobov et al., Proc. Natl. Acad. Sci. USA 99:11205-10 (2002). В противоположность этому, в отсутствии эндогенного VEGF, Ang-2 стимулирует гибель эндотелиальных клеток и деструкцию сосудов. Lobov et al., Proc. Natl. Acad. Sci. USA 99:11205-10 (2002). Аналогичным образом, на in vivo модели опухоли, Vajkoczy и др. продемонстрировали, что мультиклеточные агрегаты инициируют рост сосудов при развитии ангиогенеза посредством одновременной экспрессии VEGFR-2 и Ang-2 в эндотелии хозяина и в эндотелии опухоли. Vajkoczy et al., J. Clin. Invest. 109:777-85 (2002). На этой модели проиллюстрировано, что развивающаяся сеть капиллярных сосудов растущей опухоли характеризуется постоянным ремоделированием, вероятно, опосредованным экспрессией VEGF и Ang-2. Vajkoczy et al., J. Clin. Invest. 109:777-85 (2002).
В исследованиях Tie-2 и ангиопоэтина-1, дефицитные по этим белкам мыши обнаруживали аналогичные фенотипы, и было высказано предположение, что стимулированное ангиопоэтином-1 фосфорилирование Tie-2 опосредует ремоделирование и стабилизацию развивающихся сосудов, стимулирует развитие кровеносных сосудов в процессе ангиогенеза и способствует адгезии эндотелиальных клеток к “якорным” клеткам (Dumont et al., Genes & Development, 8:1897-1909 (1994); Sato, Nature, 376:70-74 (1995); (Thurston, G. et al., 2000 Nature Medicine: 6, 460-463)). Очевидно, что роль ангиопоэтина-1 сохраняется в организме взрослых индивидуумов, где он конститутивно экспрессируется в различных тканях широкого ряда (Hanahan, Science, 277:48-50 (1997); Zagzag, et al., Exp Neurology, 159:391-400 (1999)). В противоположность этому, экспрессия ангиопоэтина-2 ограничена, главным образом, участками ремоделирования сосудов, где он, вероятно, блокирует конститутивную функцию ангиопоэтина-1, ответственную за стабилизацию и развитие сосудов, что позволяет этим сосудам возвращаться в пластичное состояние и оставаться в состоянии, при котором они могут быть более восприимчивы к передаче сигналов (Hanahan, 1997; Holash et al., Oncogene 18:5356-62 (1999); Maisonpierre, 1997). Исследования экспрессии ангиопоэтина-2 при патологическом ангиогенезе показали, что опухоли многих типов обнаруживают экспрессию сосудистого ангиопоэтина-2 (Maisonpierre et al., Science 277:55-60 (1997)). Функциональные исследования, проведенные на мышиной модели ксенотрансплантата, позволяют предположить, что ангиопоэтин-2 участвует в ангиогенезе опухоли, и ассоциировать сверхэкспрессию ангиопоэтина-2 с увеличением роста опухоли (Ahmad, et al., Cancer Res., 61:1255-1259 (2001)). Другие исследования показали, что сверхэкспрессия ангиопоэтина-2 ассоциируется с гиперваскуляризацией опухоли (Etoh, et al., Cancer Res. 61:2145-53 (2001); Tanaka et al., Cancer Res. 62:7124-29 (2002)).
В последние годы было предложено применение ангиопоэтина-1, ангиопоэтина-2 и/или Tie-2 в качестве возможных противораковых терапевтических мишеней. Так, например, в патентах США №№ 6166185, 5650490 и 5814464 описаны лиганд против Tie-2 и антитела против рецепторов.
В исследованиях, проводимых с использованием растворимого Tie-2, сообщалось об уменьшении числа и размера опухолей у грызунов (Lin, 1997; Lin 1998). Siemester и др. (1999) получили человеческие клеточные линии меланомы, экспрессирующие внеклеточный домен Tie-2, а затем эти клетки инъецировали “голым” мышам, после чего был сделан вывод, что растворимый Tie-2 в значительной степени ингибирует рост опухоли и ее ангиогенез. Если учесть, что и ангиопоэтин-1, и ангиопоэтин-2 связываются с Tie-2, то, исходя из этих исследований, остается неясным, могут ли ангиопоэтин-1, ангиопоэтин-2 или Tie-2 служить привлекательной мишенью для противораковой терапии. Однако, очевидно, что терапия, направленная против ангиопоэтина-2, может быть эффективной для лечения таких заболеваний, как рак, прогрессирование которого зависит от степени нарушения ангиогенеза, где блокирование этого процесса может приводить к предотвращению прогрессирования заболевания (Folkman, J., Nature Medicine. 1: 27-31 (1995)). Кроме того, некоторые группы исследователей сообщали об использовании антител, которые связываются с ангиопоэтином-2, см. например, патент США № 6166185 и публикацию заявки на патент США № 2003/0124129 Al. Исследование эффекта локальной экспрессии ангиопоэтина-2 показало, что антагонистическое действие сигнала ангиопоэтин-1/Tie-2 приводит к ослаблению плотной сосудистой структуры и, тем самым, к передаче активирующих сигналов, подаваемых на эндотелиальные клетки (ЭК) индукторами ангиогенеза, например, VEGF. (Hanahan, 1997). Такой про-ангиогенный эффект, индуцируемый ингибированием ангиопоэтина-1, указывает на то, что терапия, направленная против ангиопоэтина-1, по-видимому, не может быть эффективной противораковой терапией.
Ang-2 экспрессируется во время развития сосудов на участках, где происходит ремоделирование кровеносных сосудов. Maisonpierre et al., Science 277:55-60 (1997). У взрослых индивидуумов экспрессия Ang-2 ограничена участками ремоделирования сосудов, а также в опухолях с высокой степенью васкуляризации, включая глиому (Оsada et al., Int. J. Oncol. 18:305-09 (2001); Koga et al., Cancer Res. 61:6248-54 (2001)), гепатоцеллюлярную карциному (Tanaka et al., J. Clin. Invest. 103:341-45 (1999)), карциному желудка (Etoh, et al., Cancer Res. 61:2145-53 (2001); Lee et al., Int. J. Oncol. 18:355-61 (2001)), опухоль щитовидной железы (Bunone et al., Am. J. Pathol. 155:1967-76 (1999)), не-мелкоклеточный рак легких (Wong et al., Lung Cancer 29:11-22 (2000)), рак толстой кишки (Ahmad et al., Cancer 92:1138-43 (2001)) и предстательной железы (Wurmbach et al., Anticancer Res. 20:5217-20 (2000)). Было обнаружено, что некоторые опухолевые клетки экспрессируют Ang-2. Так, например, Tanaka и др. (J. Clin. Invest. 103:341-45 (1999)) была детектирована мРНК Ang-2 в 10 из 12 образцов человеческой гепатоцеллюлярной карциномы (НСС). Группа Эллиса сообщала, что Ang-2 экспрессируется повсеместно в опухолевом эпителии. Ahmad et al., Cancer 92:1138-43 (2001). Другие исследователи сообщали аналогичные данные. Chen et al., J. Tongji Med. Univ. 21:228-30, 235 (2001). Исходя из определения уровней мРНК Ang-2 в архивированных образцах раковых тканей молочной железы человека, Sfilogoi и др. (Int. J. Cancer 103:466-74 (2003)) сообщали, что мРНК Ang-2 ассоциируется, главным образом, с дополнительной инвазией лимфоузлов, с коротким латентным периодом заболевания и, в целом, небольшой продолжительностью жизни. Tanaka и др. (Cancer Res. 62:7124-29 (2002)) наблюдали всего 236 пациентов с не-мелкоклеточным раком легких (NSCLC) на патологической стадии I-IIIа развития заболевания, соответственно. Проведенный ими иммуногистохимический анализ показал, что 16,9% пациентов с NSCLC были положительными по Ang-2. Плотность микрососудов в Ang-2-положительной опухоли была значительно выше, чем в Ang-2-отрицательной опухоли. Такой ангиогенный эффект Ang-2 наблюдался только в случае высокого уровня экспрессии VEGF. Кроме того, пложительная экспрессия Ang-2 является важным фактором, являющимся показателем неблагоприятного прогноза относительно продолжительности жизни после операции. Tanaka et al., Cancer Res. 62:7124-29 (2002). Однако какой-либо заметной корреляции между экспрессией Ang-1 и плотностью микрососудов обнаружено не было. Tanaka et al., Cancer Res. 62:7124-29 (2002). Эти результаты позволяют предположить, что Ang-2 является индикатором плохого прогноза для пациентов с раком различных типов.
Недавно, группа Yancopoulos, проводившая исследования на Ang-2-дефицитных мышиных моделях, сообщила, что Ang-2 необходим для постнатального ангиогенеза. Gale et al., Dev. Cell 3:411-23 (2002). Этими исследователями было показано, что генетически запрограммированная регрессия сосудистой сети стекловидного тела глаза отсутствует у Ang-2-/--мышей, а кровеносные сосуды их сетчатки не развивались из центральной артерии сетчатки. Gale et al., Dev. Cell 3:411-23 (2002). Эти исследователи также обнаружили, что делеция Ang-2 приводит к серьезному нарушению развития и функции лимфатических сосудов. Gale et al., Dev. Cell 3:411-23 (2002). Сохранение гена Ang-1 корректирует дефекты развития лимфатических сосудов, но не устраняет дефекты ангиогенеза. Gale et al., Dev. Cell 3:411-23 (2002).
Петерс (Peters) и коллеги сообщили, что растворимый Tie-2, при его доставке либо в виде рекомбинантного белка, либо в вирусном экспрессионном векторе, ингибирует in vivo рост мышиной карциномы молочной железы и меланомы у мышиных моделей. Lin et al., Proc. Natl Acad. Sci USA 95:8829-34 (1998); Lin et al., J. Clin. Invest. 100:2072-78 (1997). Плотность сосудов в обработанных таким образом опухолевых тканях значительно снижалась. Кроме того, растворимый Tie-2 блокировал ангиогенез в роговице крыс, стимулируемый средой, кондиционированной опухолевыми клетками. Lin et al., J. Clin. Invest. 100:2072-78 (1997). Кроме того, Isner и его группа продемонстрировали, что присоединение Ang-2 к VEGF индуцирует значительно более длительную и более обширную неоваскуляризацию, чем один VEGF. Asahara et al., Circ. Res. 83:233-40 (1998). Избыток растворимого рецептора Tie-2 предотвращает модуляцию VEGF-индуцированной неоваскуляризации под действием Ang-2. Asahara et al., Circ. Res. 83:233-40 (1998). Siemeister и др. (Cancer Res. 59:3185-91 (1999)) в исследованиях, проводимых на “голых” мышах с ксенотрансплантатами, показали, что сверхэкспрессия внеклеточных лиганд-связывающих доменов FIt-I или Tie-2 в указанных ксенотрансплантатах приводит к значительному ингибированию путей их реакций, которые не могут компенсировать друг друга, что позволяет предположить, что путь рецептора VEGF и путь Tie-2 должны рассматриваться как два независимых медиатора, играющих важную роль в процессе ангиогенеза in vivo. Siemeister et al., Cancer Res. 59:3185-91 (1999). Это подтверждается более поздними публикациями White et al., Proc. Natl. Acad. Sci. USA 100:5028-33 (2003). В этом исследовании было продемонстрировано, что резистентный к нуклеазе аптамер РНК, который специфически связывается с Ang-2 и ингибирует Ang-2, значительно ингибирует неоваскуляризацию, индуцированную bFGF в модели ангиогенеза в микрокармане роговицы крыс.
Краткое описание сущности изобретения
В одном из своих вариантов, настоящее изобретение относится к нацеленным на мишень связывающим агентам, которые специфически связываются с ангиопоэтином-2 и, тем самым, ингибируют опухолевый ангиогенез, и снижают рост опухоли. Механизмами, с помощью которых может быть достигнут этот эффект, могут быть, но не ограничиваются ими, ингибирование связывания Ang-2 с его рецептором Tie-2, ингибирование Ang-2-индуцированной передачи сигнала Tie-2 или усиление клиренса Ang-2 и, тем самым, уменьшение эффективной концентрации Ang-2.
В одном из вариантов изобретения, нацеленным связывающим агентом является полностью человеческое антитело, которое связывается с Ang-2 и предотвращает связывание Ang-2 с Tie-2. В еще одном своем варианте, настоящее изобретение относится к полностью человеческому моноклональному антителу, которое связывается с Ang-2 и Ang-1, а также ингибирует Ang-2-индуцированное фосфорилирование Tie-2. Указанное антитело может связываться с Ang-2 с Кd менее чем 100 пM, 30 пM, 20 пM, 10 пМ или 5 пМ.
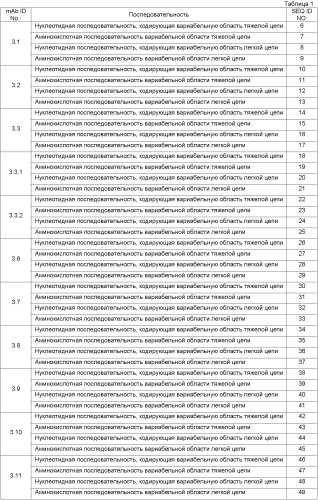
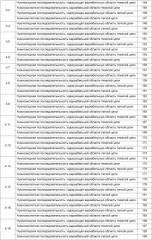
Антитело может содержать аминокислотную последовательность тяжелой цепи, имеющую гипервариабельную область (комплементарность-определяющую область (CDR)), одна из последовательностей которой представлена в таблице 11. Следует отметить, что специалист в данной области может легко определить такие CDR. См. например, руководство Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols.1-3.
Один из вариантов настоящего изобретения включает полностью человеческие моноклональные антитела 3.3.2 (номер доступа в ATCC PTA-7258), 3.19.3 (номер доступа в ATCC PTA-7260) и 5.88.3 (номер доступа в ATCC PTA-7259), которые специфически связываются с Ang-2, как более подробно обсуждается ниже.
В еще одном своем варианте, настоящее изобретение относится к антителу, которое связывается с Ang-2 и содержит аминокислотную последовательность легкой цепи, имеющую CDR, содержащую одну из последовательностей, представленных в таблице 12. В некоторых вариантах изобретения, указанным антителом является полностью человеческое моноклональное антитело.
В другом своем варианте, настоящее изобретение относится к антителу, которое связывается с Ang-2 и содержит аминокислотную последовательность тяжелой цепи, имеющую одну из последовательностей CDR, представленных в таблице 11, и аминокислотную последовательность легкой цепи, имеющую одну из последовательностей CDR, представленных в таблице 12. В некоторых вариантах изобретения, указанным антителом является полностью человеческое моноклональное антитело. Другим вариантом настоящего изобретения является антитело, которое конкурирует с полностью человеческими антителами согласно изобретению за перекрестное связывание с Ang-2, а предпочтительно, антитело, содержащее аминокислотную последовательность тяжелой цепи, имеющую одну из последовательностей CDR, представленных в таблице 11, и аминокислотную последовательность легкой цепи, имеющую одну из последовательностей CDR, представленных в таблице 12. Другим вариантом настоящего изобретения является антитело, которое связывается с тем же эпитопом на Ang-2, что и полностью человеческие антитела согласно изобретению, а предпочтительно, антитело, содержащее аминокислотную последовательность тяжелой цепи, имеющую одну из последовательностей CDR, представленных в таблице 11, и аминокислотную последовательность легкой цепи, имеющую одну из последовательностей CDR, представленных в таблице 12.
Другие варианты настоящего изобретения включают человеческие моноклональные антитела, которые специфически связываются с ангиопоэтином-2, где указанные антитела содержат гипервариабельную область 1 (CDRl) тяжелой цепи, соответствующую каноническому классу 1. Описанные здесь антитела могут также включать гипервариабельную область 2 (CDR2) тяжелой цепи, соответствующую каноническому классу 3, гипервариабельную область 1 (CDR1) легкой цепи, соответствующую каноническому классу 2, гипервариабельную область 2 (CDR2) легкой цепи, соответствующую каноническому классу 1 и гипервариабельную область 3 (CDR3) легкой цепи, соответствующую каноническому классу 1.
Настоящее изобретение также относится к способам анализа уровня ангиопоэтина-2 (Ang-2) в образце, взятом у пациента, где указанный способ включает контактирование анти-Ang-2 антитела с биологическим образцом, взятым у пациента, и детектирование уровня связывания указанного антитела с Ang-2 в указанном образце. В более конкретных вариантах изобретения, указанным биологическим образцом является кровь.
В других своих вариантах, настоящее изобретение относится к композициям, включающим антитело или его функциональный фрагмент и фармацевтически приемлемый носитель.
В других своих вариантах, настоящее изобретение относится к способам эффективного лечения животного, страдающего заболеванием, ассоциированным с ангиогенезом, где указанные способы включают выбор животного, нуждающегося в лечении опухолевого или не-опухолевого заболевания, и введение указанному животному терапевтически эффективной дозы полностью человеческого моноклонального антитела, которое специфически связывается с ангиопоэтином-2 (Ang-2).
Ассоциированными с ангиогенезом заболеваниями, поддающимися лечению, могут быть опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), опухоль щитовидной железы, рак желудочно-кишечного тракта (желудка), рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легких, глиобластома, рак эндометрия, рак почек, рак толстой кишки, рак поджелудочной железы, карцинома пищевода, рак головы и шеи, мезотелиома, саркомы, билиарная холангиокарцинома, аденокарцинома тонкой кишки, злокачественные опухоли у детей и плоскоклеточная карцинома.
В других своих вариантах, настоящее изобретение относится к способам ингибирования индуцированного ангиопоэтином-2 (Ang-2) ангиогенеза у животных. Такие способы включают выбор животного, нуждающегося в лечении Ang-2-индуцированного ангиогенеза, и введение указанному животному терапевтически эффективной дозы полностью человеческого моноклонального антитела, где указанное антитело специфически связывается с Ang-2.
В других своих вариантах, настоящее изобретение относится к применению антитела для приготовления лекарственного средства для лечения ассоциированных с ангиогенезом заболеваний у животного, где указанное моноклональное антитело специфически связывается с ангиопоэтином-2 (Ang-2). Ассоциированными с ангиогенезом заболеваниями, поддающимися лечению, могут быть опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), опухоль щитовидной железы, рак желудочно-кишечного тракта (желудка), рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легких, глиобластома, рак эндометрия, рак почек, рак толстой кишки, рак поджелудочной железы, карцинома пищевода, рак головы и шеи, мезотелиома, саркомы, билиарная холангиокарцинома, аденокарцинома тонкой кишки, злокачественные опухоли у детей и плоскоклеточная карцинома.
В других вариантах изобретения, описанные здесь антитела могут быть использованы для приготовления лекарственного средства для эффективного лечения индуцированного ангиопоэтином-2 ангиогенеза у животного, где указанное моноклональное антитело специфически связывается с ангиопоэтином-2 (Ang-2).
В других описанных здесь вариантах, настоящее изобретение относится к моноклональным антителам, которые связываются с Ang-2 и влияют на функцию Ang-2. В других своих вариантах, настоящее изобретение относится к полностью человеческим антителам против Ang-2 и к препаратам антител против Ang-2, обладающим нужными и перспективными с терапевтической точки зрения свойствами, включая высокую аффинность связывания с Ang-2, способность к нейтрализации Ang-2 in vitro и in vivo и способность ингибировать Ang-2-индуцированный ангиогенез.
В предпочтительном варианте изобретения, описанные здесь антитела связываются с Ang-2 с очень высокими аффинностями (Kd). Так, например, человеческое, кроличье, мышиное, химерное или гуманизованное антитело обладают способностью связываться с Ang-2 с Kd, имеющим значения, но не ограничивающиеся ими, менее 10-5, 10-6, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13 или 10-14 М или любой интервал указанных значений, или любые значения в этом интервале. Аффинность и/или авидность могут быть измерены путем проведения анализа с использованием KinExA® и/или BIACORE®, как описано ниже.
В соответствии с этим, в одном из описанных здесь вариантов, настоящее изобретение относится к выделенным антителам или фрагментам этих антител, которые связываются с Ang-2. Как известно из уровня техники, такими антителами предпочтительно могут быть, например, поликлональные, олигоклональные, моноклональные, химерные, гуманизированные и/или полностью человеческие антитела. В других описанных здесь вариантах, настоящее изобретение также относится к клеткам, продуцирующим такие антитела.
В другом своем варианте, настоящее изобретение относится к полностью человеческому антителу, которое связывается с другими членами семейства, к которому принадлежит ангиопоэтин-2, включая, но не ограничиваясь ими, ангиопоэтин-1, ангиопоэтин-3 и ангиопоэтин-4. В другом своем варианте, настоящее изобретение относится к антителу, которое конкурирует с полностью человеческим антителом согласно изобретению за перекрестное связывание с Tie-2/Ang-2. В одном из вариантов изобретения, указанное антитело связывается с ангиопоэтином-2 и нейтрализует ангиопоэтин-2, а также связывается с ангиопоэтином-1 и нейтрализует ангиопоэтин-1.
Следует отметить, что варианты настоящего изобретения не ограничиваются какой-либо конкретной формой антитела или способом его генерирования или продуцирования. Так, например, анти-Ang-2 антителом может быть полноразмерное антитело (например, антитело, имеющее интактную человеческую Fc-область) или фрагмент антитела (например, Fab, Fab' или F(ab')2). Кроме того, указанное антитело может быть получено из гибридомы, которая секретирует такое антитело, или из рекомбинантно-полученной клетки, которая была трансформирована или трансфицирована геном или генами, кодирующими такое антитело.
Другие варианты настоящего изобретения включают выделенные молекулы нуклеиновой кислоты, кодирующие любые описанные здесь антитела; векторы, содержащие выделенные молекулы нуклеиновой кислоты; кодирующие анти-Ang-2 антитела; или клетку-хозяина, трансформированную любыми такими молекулами нуклеиновой кислоты. Кроме того, в одном из своих вариантов, настоящее изобретение относится к способу продуцирования анти-Ang-2 антитела путем культивирования клеток-хозяев в условиях, благоприятствующих экспрессии молекулы нуклеиновой кислоты и продуцированию антитела, а также последующему выделению такого антитела. Следует отметить, что варианты настоящего изобретения также включают любую молекулу нуклеиновой кислоты, которая кодирует антитело согласно изобретению или его фрагмент, включая последовательности нуклеиновой кислоты, оптимизированные для увеличения выходов антител или их фрагментов при трансфекции таких последовательностей в клетки-хозяева в целях продуцирования антител.
Другой вариант настоящего изобретения включает способ получения высокоаффинных антител против Ang-2 путем иммунизации млекопитающего человеческим Ang-2 или его фрагментом и одной или несколькими ортологичными последовательностями или их фрагментами.
Другие варианты изобретения основаны на генерировании и идентификации выделенных антител, которые специфически связываются с Ang-2. При заболеваниях, ассоциированных с ангиогенезом, таких как опухолевые заболевания, Ang-2 экспрессируется на повышенных уровнях. Ингибирование биологической активности Ang-2 может предотвращать Ang-2-индуцированный ангиогенез и другие желательные эффекты.
Другой вариант настоящего изобретения включает способ диагностики заболеваний или состояний, в которых антитело, полученное как описано в настоящей заявке, используется для детектирования уровня Ang-2 в образце, взятом у пациента. В одном из вариантов изобретения, образцом, взятым у пациента, является кровь или сыворотка крови. В других вариантах изобретения описаны способы идентификации факторов риска, диагностики заболевания и определения стадии заболевания, где указанные способы включают идентификацию сверхэкспресси Ang-2 с использованием анти-Ang-2 антител.
Другой вариант настоящего изобретения включает способ диагностики состояния, ассоциированного с экспрессией Ang-2 в клетках, посредством контактирования сыворотки или клетки с анти-Ang-2 антителом, с последующим детектированием присутствия Ang-2. Предпочтительными состояниями являются заболевания, ассоциированные с ангиогенезом, включая, но не ограничиваясь ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), глиобластома и карцинома щитовидной железы, желудка, предстательной железы, молочной железы, яичника, мочевого пузыря, легких, матки, почек, толстой кишки, поджелудочной железы, слюнных желез и ободочной кишки.
В другом своем варианте, настоящее изобретение включает аналитический набор для детектирования ангиопоэтина-2 и членов семейства ангиопоэтинов в тканях, клетках или физиологических жидкостях млекопитающих в целях скрининга на заболевания, ассоциированные с ангиогенезом. Указанный набор включает антитело, которое связывается с ангиопоэтином-2, и средство, являющееся индикатором реакции антитела с ангиопоэтином-2, если она происходит. Предпочтительным антителом является моноклональное антитело. В одном из вариантов изобретения, указанное антитело, связывающееся с Ang-2, является меченным. В другом варианте изобретения, указанным антителом является немеченное “первое” антитело, а указанный набор дополнительно включает средство для детектирования указанного “первого” антитела. В одном из вариантов изобретения, указанное средство включает меченное “второе” антитело, которым является антитело против иммуноглобулина. Предпочтительным антителом является антитело, меченное маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и материала, который является непроницаемым для радиоактивного излучения.
Еще один вариант настоящего изобретения включает способы лечения заболеваний или состояний, ассоциированных с экспрессией Ang-2 у пациента, путем введения указанному пациенту эффективного количества анти-Ang-2 антитела. Анти-Ang-2 антитело может быть введено отдельно, либо оно может быть введено в комбинации с другими антителами или с химиотерапевтическим средством, или в комбинации с лучевой терапией. Так, например, смесь моноклональных, олигоклональных или поликлональных антител против Ang-2, которые блокируют ангиогенез, может быть введена в комбинации с лекарственным средством, которое, как было показано, непосредственно ингибирует пролиферацию опухолевых клеток. Указанный способ может быть осуществлен in vivo, а указанным пациентом, предпочтительно, является человек. В предпочтительном варианте изобретения, указанный способ включает лечение ассоциированных с ангиогенезом заболеваний, включая, но не ограничиваясь ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), глиобластома и карцинома щитовидной железы, желудка, предстательной железы, молочной железы, яичника, мочевого пузыря, легких, матки, почек, толстой кишки, поджелудочной железы, слюнных желез и ободочной кишки.
В другом своем варианте, настоящее изобретение относится к промышленному изделию, включающему контейнер. Такой контейнер включает композицию, содержащую анти-Ang-2 антитело, и вкладыш в упаковку или этикетку на этой упаковке, где указано, что данная композиция может быть использована для лечения ассоциированных с ангиогенезом заболеваний, характеризующихся сверхэкспрессией Ang-2.
В некоторых вариантах изобретения, пациенту вводят анти-Ang-2 антитело, а затем очищающий агент для удаления избыточного количества антитела из кровотока.
В другом своем варианте, настоящее изобретение относится к применению анти-Ang-2 антитела для приготовления лекарственного средства для лечения заболеваний, таких как заболевания, ассоциированные с ангиогенезом. В одном из вариантов изобретения, ассоциированными с ангиогенезом заболеваниями являются карциномы, такие как рак молочной железы, яичника, желудка, эндометрия, слюнных желез, легких, почек, толстой кишки, ободочной кишки, пищевода, щитовидной железы, поджелудочной железы, предстательной железы и мочевого пузыря. В другом варианте изобретения, ассоциированными с ангиогенезом заболеваниями являются, но не ограничиваются ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), саркома, рак головы и шеи, мезотелиома, билиарная холангиокарцинома, аденокарцинома тонкой кишки, злокачественные опухоли у детей и глиобластома.
Ang-2 представляет собой важный “переключатель" ангиогенеза. В соответствии с этим, предполагается, что подавление активности этой молекулы приводит к ингибированию патофизиологических процессов, а поэтому может служить эффективным средством для лечения различных ангиогенез-зависимых заболеваний. Помимо солидных опухолей и их метастазов, ангиогенез-зависимыми также являются злокачественные опухоли крови, такие как лейкозы, лимфомы и множественная миелома. Избыточный рост сосудов приводит к возникновению различных не-опухолевых расстройств. Такими не-опухолевыми ангиогенез-зависимыми заболеваниями являются: атеросклероз, гемангиома, гемангиоэндотелиома, ангиофиброма, нарушение развития сосудов (например, наследственная геморрагическая телеангиэктазия (НГТ) или синдром Ослера-Вебера), бородавки, пиогенные гранулемы, избыточный рост волос, саркома Капоши, келоидные рубцы, аллергический отек, псориаз, дисфункциональные маточные кровотечения, фолликулярные кисты, гиперстимуляция яичника, эндометриоз, респираторный дистресс-синдром, асцит, перитониальный склероз у пациента, подвергаемого диализу, образование спаек после хирургической операции на брюшной полости, ожирение, ревматоидный артрит, синовит, остеомиелит, избыточный рост паннуса, остеофит, гемофилическая артропатия, воспалительные и инфекцирнные процессы (например, гепатит, пневмония, гломерулонефрит), астма, полипы в носовой полости, регенерация печени, легочная гипертензия, ретинопатия недоношенных, диабетическая ретинопатия, возрастная дегенерация желтого пятна, лейкомаляция, неоваскулярная глаукома, неоваскуляризация трансплантата роговицы, трахома, тиреоидит, увеличение щитовидной железы и лимфопролиферативные расстройства.
Краткое описание графического материала
На фигуре 1 показан вестерн-блот-анализ, который показал, что mAb против Ang-2 ингибируют Ang-2-индуцированное фосфорилирование Tie-2, эктопически экспрессированного в клетках HEK293F.
На фигуре 2 представлена линейная кривая дозозависимого ингибирующего действия моноклональных анти-Ang-2 антител на Ang-2-индуцированное фосфорилирование Tie-2.
На фигуре 3 представлена линейная кривая, иллюстрирующая дозозависимое ингибирование связывания Ang-1 (верхний график) и Ang-2 (нижний график) с Tie-2, в присутствии mAb 3.19.3 или Tie-2/Fc.
На фигуре 4 показан вестерн-блот-анализ, иллюстрирующий ингибирование стимулированного ангиопоэтином-1 фосфорилирования Tie-2 в эндотелиальных клетках Eahy 926 под действием mAb 3.19.3. В этой системе наблюдается ингибирование индуцированного ангиопоэтином-1 фосфорилирования Tie-2. Концентрации антител представлены в нМ.
На фигуре 5 представлена линейная кривая, иллюстрирующая ингибирование стимулированного ангиопоэтином-1 фосфорилирования Tie-2 в эндотелиальных клетках Eahy 926 под действием mAb 3.19.3. IC50=99 нМ. Ось x представляет концентрацию mAb 3.19.3, а ось y представляет ответ.
На фигуре 6 схематически представлена диаграмма структуры человеческих белков Ang-2 и Ang-2443. Верхние цифры означают аминокислотные последовательности (эта диаграмма была взята из публикации Injune et al., (2000) JBC 275: 18550).
На фигуре 7 показана аминокислотная последовательность химерной молекулы мышь/человек (SEQ ID NO: 1). Человеческие остатки (клонированные в виде StuI-TfiI-фрагмента) 310-400 подчеркнуты.
На фигуре 8 показано сравнение аминокислотных последовательностей белков человеческого Ang-1 (SEQ ID NO: 2), человеческого Ang-2 (SEQ ID NO: 3) и мышиного Ang-2 (SEQ ID NO: 4). Сайты присоединения химерных молекул Ang-2 и точковые мутации обозначены жирным шрифтом.
На фигуре 9 показано сравнение аминокислотных последовательностей мышиного Ang-1 (SEQ ID NO: 5), человеческого Ang-1 (SEQ ID NO: 2), мышиного Ang-2 (