Генетически модифицированный микроорганизм и способ получения макролидного соединения с гидроксильной группой в 16-положении с использованием таких микроорганизмов
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предлагается генетически модифицированный микроорганизм, способный продуцировать макролидное соединение, гидроксилированное в 16-положении. Описан способ получения макролидного соединения, гидроксилированного в 16-положении. В частности, предложены генетически модифицированные микроорганизмы, имеющие ДНК, кодирующую полипептид, участвующий в биосинтезе макролидного соединения пладиенолида, и ДНК, кодирующую полипептид, обладающий гидроксилазной активностью, направленной на гидроксилирование пладиенолидов в 16-положении. Изобретение позволяет эффективно продуцировать макролидное соединение, гидроксилированное в 16-положении, непосредственно в одном микроорганизме. Полученное соединение обладает высокой противоопухолевой активностью и может быть использовано для создания противоопухолевых препаратов. 2 н. и 15 з.п. ф-лы, 4 ил., 7 табл.
Реферат
Описание
Область, к которой относится изобретение
Настоящее изобретение относится к рекомбинантным микроорганизмам, обладающим способностью продуцировать макролидные соединения с гидроксильной группой в 16-положении; и к способам получения макролидных соединений, имеющих гидроксильную группу в 16-положении, с использованием указанных микроорганизмов.
Описание прототипов
Среди различных метаболитов, продуцируемых актиномицетами, были выявлены важные биологически активные вещества. В частности, были обнаружены многие соединения, в каркасной структуре которых присутствует поликетид (далее называемые поликетидными соединениями). Известны соединения, имеющие различные биологические функции, включая, например, противомикробные средства, а именно эритромицин, жозамицин, тилозин, мидекамицин и мицинамицин; противогрибковые средства, а именно нистатин и амфотерицин; инсектициды, а именно милбемицин и авермектин; иммусупрессоры, а именно такролимус и рапамицин, и противоопухолевые средства, а именно дауномицин, адриамицин, аклациномицин и т.п.
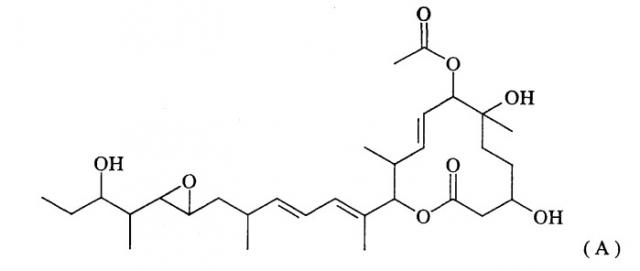
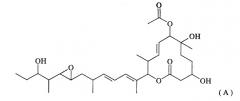
Поликетидные соединения включают группу макролидных соединений, обладающих превосходной противоопухолевой активностью и называемых пладиенолидами. Общим термином “пладиенолиды” называют группу соединений, обнаруженных в культуре штамма Streptomyces sp. Mer-11107; причем известно более 50 родственных соединений, начиная с соединения 11107В (также называемого пладиенолидом В), представленного ниже формулой (А)(см. WO 2002/060890):
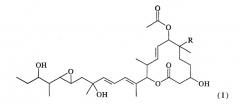
Из указанных пладиенолидов соединение, имеющее гидроксильную группу в 16-положении и представленное нижеследующей формулой (I), обладает превосходными свойствами, включая высокую противоопухолевую активность и т.п., однако, это соединение трудно поддается эффективному продуцированию, поскольку его продуцируемость уступает продуцируемости соединения 11107В.
(где R представляет собой атом водорода или гидроксильную группу).
Соединение, представленное формулой (I), может быть обозначено МЕ-282, если R представляет собой атом водорода, и оно может быть обозначено 11107D или названо пладиенолидом D, если R представляет собой гидроксильную группу.
Впоследствии группой исследователей, включая заявителей настоящего изобретения, были открыты актиномицеты, которые гидроксилируют 16-положение соединения 11107В, но не являются пладиенолид-продуцирующими микроорганизмами (см. WO 2003/099813 и WO 2004/050890), и из этих актиномицетов была получена и идентифицирована ДНК, участвующая в реакции гидроксилирования 16-положения соединения 11107В (ДНК, кодирующая фермент, гидроксилирующий 16-положение, и ферменты ферредоксины), и на основании полученных результатов авторами была представлена патентная заявка (см., WO-А 2005/052152, опубликованная 9 июня 2005.).
Авторами настоящего изобретения из пладиенолид-продуцирующего штамма Streptomyces sp. Mer-11107 были также получены и идентифицированы полипептиды, участвующие в биосинтезе 11107В, а также ДНК, кодирующая эти полипептиды, и на основании полученных результатов была представлена патентная заявка (см. заявку WO-А 2006/009276, опубликованную 26 января 2006 года).
В настоящее время появилась возможность более эффективного продуцирования соединений с гидроксильной группой в 16-положении, чем это было возможно ранее, и такое продуцирование предусматривает получение 11107В или т.п. с использованием штамма Streptomyces sp. Mer-11107 или его вариантов, а затем превращение полученного соединения 11107В в соединение, имеющее гидроксильную группу в 16-положении, с использованием других актиномицетов, способных осуществлять реакцию гидроксилирования в 16-положении. Однако поскольку этот способ требует проведения двухстадийной реакции, то трудности его осуществления возрастают вдвое, а поэтому желательно разработать более эффективный способ получения этих соединений.
Известны случаи, когда ген, кодирующий фермент, модифицирующий поликетидное соединение, был введен в штамм, продуцирующий поликетидное соединение, в целях его экспрессии в этом штамме, что приводило к прямому продуцированию поликетидного соединения, модифицированного введенным ферментом. Так, например, сообщалось, что прямое продуцирование 6-гидрокси-тетраценомицина С может быть достигнуто путем введения гена гидроксилирования, происходящего от Streptomyces fradiae Tu2717, в микроорганизм Streptomyces glaucescens GLA.0, который продуцирует тетраценомицин С (см. J. Bacteriol. 1995, Vol. 177, 6126-6136).
Известны также случаи, когда ген биосинтеза поликетидного соединения был введен для его экспрессии в штамме, имеющем фермент, модифицирующий поликетидное соединение, что позволяло осуществлять прямое продуцирование поликетидного соединения, модифицированного ферментом, изначально присутствующим в штамме-хозяине. Так, например, сообщалось, что прямое продуцирование 6-гидрокси-тетраценомицина С может быть достигнуто путем введения гена биосинтеза тетраценомицина С Streptomyces glaucescens GLA.0 в микроорганизм Streptomyces fradiae Tu2717, который содержит фермент, гидроксилирующий тетраценомицин С в 6-положении (см. J. Bacteriol. 1995, Vol. 177, 6126-6136).
В некоторых случаях продуцирование модифицированного поликетидного соединения может быть достигнуто с использованием штаммов различных видов путем введения в эти штаммы гена биосинтеза поликетидного соединения вместе с геном, кодирующим фермент, модифицирующий поликетидное соединение. Так, например, сообщалось, что прямое продуцирование 8,8а-дигидрокси-6-эритронолида В было достигнуто путем введения гена биосинтеза 6-эритронолида В Saccharopolyspora erythraeа и гена Р-450 Streptomyces antibioticus ATCC11891 в микроорганизм Streptomyces lividans K4-114, используемый в качестве хозяина (см. J. Antibiot. 2000, Vol. 53, 502-508).
Описание сущности изобретения
Целью настоящего изобретения является получение рекомбинантных микроорганизмов, обладающих способностью продуцировать макролидное соединение с гидроксильной группой в 16-положении, представленное вышеуказанной формулой (I). Другой целью настоящего изобретения является разработка способа продуцирования макролидного соединения с гидроксильной группой в 16-положении с использованием этих рекомбинантных микроорганизмов.
Для решения вышеуказанных проблем авторами настоящего изобретения были применены методы генной инженерии для получения (отбора) микроорганизмов, включающих ранее выделенную и идентифицированную ДНК, участвующую в биосинтезе 11107В, и ДНК, участвующую в реакции гидроксилирования 16-положения 11107В; при этом авторами было обнаружено, что макролидное соединение с гидроксильной группой в 16-положении аккумулируется в полученной культуральной среде в больших количествах. И на основании этого было осуществлено настоящее изобретение.
Таким образом, настоящее изобретение относится к нижеследующим аспектам (1)-(21):
(1) Рекомбинантный микроорганизм, который представляет собой микроорганизм, обладающий способностью продуцировать макролидные соединения с гидроксильной группой в 16-положении, представленные формулой (I):
(где R представляет собой атом водорода или гидроксильную группу), и который включает:
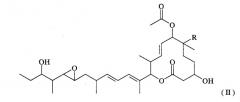
(а) ДНК, кодирующую полноразмерный или неполный полипептид, участвующий в биосинтезе макролидных соединений, представленных формулой (II):
(где R представляет собой атом водорода или гидроксильную группу), и
(b) ДНК, кодирующую полноразмерный или неполный полипептид, обладающий ферментативной активностью, направленной на гидроксилирование макролидных соединений в 16-положении, представленных вышеуказанной формулой (II).
(2) Рекомбинантный микроорганизм, описанный в п. (1), где ДНК, описанная выше в п. (а), представляет собой ДНК, кодирующую полноразмерный или неполный полипептид, обладающий поликетид-синтетазной активностью; полипептид, обладающий ацетилазной активностью в 7-положении; полипептид, обладающий эпоксидазной активностью в 18,19-положении; и полипептид, обладающий активностью фактора регуляции транскрипции.
(3) Рекомбинантный микроорганизм, описанный в п. (1) или (2), где ДНК, описанная выше в п.(а), представляет собой ДНК, включающую:
(а-1) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 8340-27935 в последовательности NO:1;
(а-2) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 28021-49098 в последовательности NO:1;
(а-3) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 49134-60269 в последовательности NO:1;
(а-4) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 60269-65692 в последовательности NO:1;
(а-5) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 68160-66970 в последовательности NO:1;
(а-6) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 69568-68270 в последовательности NO:1; и
(а-7) непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 72725-70020 в последовательности NO:1; или ее вариант.
(4) Рекомбинантный микроорганизм, описанный в п.(2) или (3), где ДНК, описанная выше в п.(а), также включает ДНК, кодирующую полноразмерный или неполный полипептид, обладающий ферментативной активностью, направленной на гидроксилирование 6-положения.
(5) Рекомбинантный микроорганизм, описанный в п.(4), где указанная ДНК, кодирующая полноразмерный или неполный полипептид, обладающий ферментативной активностью, направленной на гидроксилирование 6-положения, представляет собой ДНК, включающую непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 65707-66903 в последовательности NO:1, или ее вариант.
(6) Рекомбинантный микроорганизм, описанный в любом из п.п.(1)-(5), где ДНК, описанная выше в п.(b), представляет собой ДНК, выбранную из группы, состоящей из:
(b-1) непрерывной нуклеотидной последовательности, состоящей из нуклеотидов 1322-2548 в последовательности NO:2;
(b-2) непрерывной нуклеотидной последовательности, состоящей из нуклеотидов 420-1604 в последовательности NO:3; и
(b-3) непрерывной нуклеотидной последовательности, состоящей из нуклеотидов 172-1383 в последовательности NO:4; или ее вариант.
(7) Рекомбинантный микроорганизм, описанный в любом из п.п. (1)-(6), где ДНК, описанная выше в п. (b), представляет собой вариант ДНК, включающий непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 1322-2548 в последовательности NO:2, которая имеет 1 или 2 или более модифицированных сайтов, выбранных из группы, состоящей из нижеуказанных сайтов 1)-6):
1) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1592-1594, заменена кодоном, кодирующим аминокислоту, не являющуюся аргинином;
2) модифицированного сайта, где последовательность аtg, состоящая из нуклеотидов 1655-1657, заменена кодоном, кодирующим аминокислоту, не являющуюся метионином;
3) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1904-1906, заменена кодоном, кодирующим аминокислоту, не являющуюся аргинином;
4) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 2027-2029, заменена кодоном, кодирующим аминокислоту, не являющуюся аргинином;
5) модифицированного сайта, где последовательность atc, состоящая из нуклеотидов 2054-2056, заменена кодоном, кодирующим аминокислоту, не являющуюся изолейцином; и
6) модифицированного сайта, где последовательность сtg, состоящая из нуклеотидов 2528-2530, заменена кодоном, кодирующим аминокислоту, не являющуюся лейцином.
(8) Рекомбинантный микроорганизм, описанный в любом из п.п. (1)-(6), где ДНК, описанная выше в п. (b), представляет собой вариант ДНК, включающий непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 1322-2548 в последовательности NO:2, которая имеет 1 или 2 или более модифицированных сайтов, выбранных из группы, состоящей из нижеуказанных сайтов 1)-6):
1) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1592-1594, заменена кодоном, кодирующим цистеин, метионин или пролин;
2) модифицированного сайта, где последовательность аtg, состоящая из нуклеотидов 1655-1657, заменена кодоном, кодирующим треонин или серин;
3) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1904-1906, заменена кодоном, кодирующим лейцин, изолейцин, пролин, тирозин или фенилаланин;
4) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 2027-2029, заменена кодоном, кодирующим лейцин, изолейцин или пролин;
5) модифицированного сайта, где последовательность atc, состоящая из нуклеотидов 2054-2056, заменена кодоном, кодирующим фенилаланин или валин; и
6) модифицированного сайта, где последовательность сtg, состоящая из нуклеотидов 2528-2530, заменена кодоном, кодирующим метионин, цистеин или изолейцин.
(9) Рекомбинантный микроорганизм, описанный в любом из п.п. (1)-(6), где ДНК, описанная выше в п. (b), представляет собой вариант ДНК, включающий непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 1322-2548 в последовательности NO:2, которая имеет 1 или 2 или более модифицированных сайтов, выбранных из группы, состоящей из нижеуказанных сайтов 1)-6):
1) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1592-1594, заменена кодоном, кодирующим цистеин;
2) модифицированного сайта, где последовательность аtg, состоящая из нуклеотидов 1655-1657, заменена кодоном, кодирующим треонин;
3) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1904-1906, заменена кодоном, кодирующим лейцин или тирозин;
4) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 2027-2029, заменена кодоном, кодирующим лейцин;
5) модифицированного сайта, где последовательность atc, состоящая из нуклеотидов 2054-2056, заменена кодоном, кодирующим фенилаланин; и
6) модифицированного сайта, где последовательность сtg, состоящая из нуклеотидов 2528-2530, заменена кодоном, кодирующим метионин.
(10) Рекомбинантный микроорганизм, описанный в п. (1) и представляющий собой микроорганизм-хозяин, содержащий ДНК, описанную выше в п.(а), в которую была введена ДНК, описанная выше в п. (b) и происходящая от микроорганизма другого вида.
(11) Рекомбинантный микроорганизм, описанный в п. (1) и представляющий собой микроорганизм-хозяин, содержащий ДНК, описанную выше в п.(b), в которую была введена ДНК, описанная выше в п. (а) и происходящая от микроорганизма другого вида.
(12) Рекомбинантный микроорганизм, описанный в п. (1) и представляющий собой микроорганизм-хозяин, не содержащий ни одну из ДНК, описанных выше в п.п.(а) и (b), в которые была введена ДНК, описанная выше в п.п. (а) и (b) и происходящая от микроорганизма другого вида.
(13) Рекомбинантный микроорганизм, описанный в любом из п.п. (1)-(12), где указанным рекомбинантным микроорганизом, обладающим способностью продуцировать макролидное соединение с гидроксильной группой в 16-положении, представленное формулой (I), является штамм, принадлежащий к роду Streptomyces.
(14) Рекомбинантный микроорганизм, описанный в любом из п.п. (1)-(13), где 50 мг или более указанного макролидного соединения с гидроксильной группой в 16-положении, представленного формулой (I), на 1 л культуральной среды может быть продуцировано при посеве указанного рекомбинантного микроорганизма в 250 мл-колбу Эрленмейера, содержащую 30 мл описанной ниже среды, с последующим культивированием при 25°С в течение 4 дней при перемешивании на роторном шейкере (220 об/мин), экстрагированием путем добавления 270 мл ацетонитрила и анализом полученного экстракта с помощью ВЭЖХ в описанных ниже условиях анализа, проводимого для определения количества макролидного соединения с гидроксильной группой в 16-положении, представленного формулой (I).
Среда:
Растворимый 5% крахмал, 1% глюкоза, 3% Pharmamedia, 0,1% CaCО3, рН 7,5.
Условия измерения с помощью ВЭЖХ
Устройство: ВЭЖХ Shimadzu 10Avp
Колонка: Develosil ODS UG-3 (⌀ 4,6 мм × 50 мм × 3 мкм)
Подвижная фаза: 45%-55% метанол (0-5 мин), 55% метанол (5-13 мин), 55%-70% метанол (13-21 мин), 70% метанол (21-25 мин).
Скорость потока: 1,2 мл/мин
Детекция: УФ на 240 нм
Объем впрыска: 5 мкл
Температура колонки: 40°С.
(15) Способ получения макролидных соединений с гидроксильной группой в 16-положении, представленных формулой (I), или их фармакологически приемлемых солей или гидратов, где указанный рекомбинантный микроорганизм, описанный в любом из п.п. (1)-(14), культивируют в питательной среде, и из этой культуральной среды выделяют макролидные соединения с гидроксильной группой в 16-положении, представленные формулой (I).
(16) Способ, описанный в п.(15), где в указанной культуральной среде присутствует циклодекстрин.
(17) Способ, описанный в п.(16), где указанным циклодекстрином является циклодекстрин, выбранный из группы, состоящей из β-циклодекстрина, γ-циклодекстрина, частично метилированного β-циклодекстрина, диметил-β-циклодекстрина, триметил-β-циклодекстрина, гликозил-β-циклодекстрина и гидроксипропил-β-циклодекстрина.
(18) Вариант ДНК, включающий непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 1322-2548 в последовательности NO:2, которая имеет 1 или 2 или более модифицированных сайтов, выбранных из группы, состоящей из нижеуказанных сайтов 1)-6):
1) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1592-1594, заменена кодоном, кодирующим аминокислоту, не являющуюся аргинином;
2) модифицированного сайта, где последовательность аtg, состоящая из нуклеотидов 1655-1657, заменена кодоном, кодирующим аминокислоту, не являющуюся метионином;
3) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1904-1906, заменена кодоном, кодирующим аминокислоту, не являющуюся аргинином;
4) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 2027-2029, заменена кодоном, кодирующим аминокислоту, не являющуюся аргинином;
5) модифицированного сайта, где последовательность atc, состоящая из нуклеотидов 2054-2056, заменена кодоном, кодирующим аминокислоту, не являющуюся изолейцином; и
6) модифицированного сайта, где последовательность сtg, состоящая из нуклеотидов 2528-2530, заменена кодоном, кодирующим аминокислоту, не являющуюся лейцином.
(19) Вариант ДНК, включающий непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 1322-2548 в последовательности NO:2, которая имеет 1 или 2 или более модифицированных сайтов, выбранных из группы, состоящей из нижеуказанных сайтов 1)-6):
1) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1592-1594, заменена кодоном, кодирующим цистеин, метионин или пролин;
2) модифицированного сайта, где последовательность аtg, состоящая из нуклеотидов 1655-1657, заменена кодоном, кодирующим треонин или серин;
3) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1904-1906, заменена кодоном, кодирующим лейцин, изолейцин, пролин, тирозин или фенилаланин;
4) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 2027-2029, заменена кодоном, кодирующим лейцин, изолейцин или пролин;
5) модифицированного сайта, где последовательность atc, состоящая из нуклеотидов 2054-2056, заменена кодоном, кодирующим фенилаланин или валин; и
6) модифицированного сайта, где последовательность сtg, состоящая из нуклеотидов 2528-2530, заменена кодоном, кодирующим метионин, цистеин или изолейцин.
(20) Вариант ДНК, включающий непрерывную нуклеотидную последовательность, состоящую из нуклеотидов 1322-2548 в последовательности NO:2, которая имеет 1 или 2 или более модифицированных сайтов, выбранных из группы, состоящей из нижеуказанных сайтов 1)-6):
1) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1592-1594, заменена кодоном, кодирующим цистеин;
2) модифицированного сайта, где последовательность аtg, состоящая из нуклеотидов 1655-1657, заменена кодоном, кодирующим треонин;
3) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 1904-1906, заменена кодоном, кодирующим лейцин или тирозин;
4) модифицированного сайта, где последовательность сgc, состоящая из нуклеотидов 2027-2029, заменена кодоном, кодирующим лейцин;
5) модифицированного сайта, где последовательность atc, состоящая из нуклеотидов 2054-2056, заменена кодоном, кодирующим фенилаланин; и
6) модифицированного сайта, где последовательность сtg, состоящая из нуклеотидов 2528-2530, заменена кодоном, кодирующим метионин.
(21) Полипептид, кодируемый вариантом ДНК, описанным в любом из п.п. (18)-(20).
Настоящее изобретение определено нижеследующими терминами.
Термин “рекомбинантный микроорганизм” означает микроорганизм (бактерии, актиномицеты, дрожжи, плесень или т.п.), содержащий ген, происходящий от другого организма и введенный в конкретный микроорганизм посредством генетической рекомбинации, однако, применяемые методы введения генов не ограничиваются генетической рекомбинацией с использованием плазмид и других векторов, и включают методы гомологичной рекомбинации и т.п.
“Вариант ДНК” означает:
(1) ДНК, которая гибридизуется с исходной ДНК в условиях высокой жесткости;
(2) ДНК, имеющую нуклеотидную последовательность, которая на 70% или более гомологична нуклеотидной последовательности исходной ДНК;
(3) ДНК, имеющую нуклеотидную последовательность, комплементарную нуклеотидной последовательности исходной ДНК; или
(4) ДНК, которая не гибридизуется в условиях высокой жесткости с исходной ДНК вследствие вырожденности генного кодона, но которая имеет нуклеотидную последовательность, кодирующую аминокислотную последовательность, аналогичную аминокислотной последовательности, кодируемой ДНК, определенной в любом из п.п. (1)-(3).
Термин “ДНК, которая гибридизуется в условиях высокой жесткости” означает, например, ДНК, полученную путем гибридизациии колоний, гибридизации методом бляшек, Саузерн-гибридизации или т.п., с использованием исходной ДНК в качестве зонда, а в частности, этот термин может означать ДНК, которая может быть идентифицирована с использованием фильтра, имеющего ДНК, выделенную из фиксированных на нем колоний или бляшек сначала путем гибридизации при 65°С в присутствии 0,7-1,0 М хлорида натрия, а затем промывки фильтра при 65°С с использованием 0,1 - 2х концентрации раствора SSC (раствора SSC, содержащего хлорид натрия в концентрации 1 × 150 мМ и цитрат натрия в концентрации 1 × 15 мМ).
Термин “родственное соединение” означает соединение, имеющее тот же самый остов, характеризующий исходную химическую структуру, но отличающееся тем, что оно имеет модификацию в боковой цепи или другую форму боковой цепи.
Термин “ферментативная активность, направленная на гидроксилирование 16-положения” означает активность, направленную на замену атома водорода в 16-положении макролидного соединения (II) в гидроксильную группу.
Термин “ферментативная активность, направленная на гидроксилирование 6-положения” означает активность, направленную на замену атома водорода в 6-положении макролидного соединения (иногда обозначаемого МЕ-265), представленного нижеследующей формулой (В), гидроксильной группой:
Термин “поликетид-синтетазная активность” означает активность, направленную на синтез макролидного соединения, представленного нижеследующей формулой (Е):
Термин “ацетилазная активность в 7-положении” означает активность, направленную на замену гидроксильной группы в 7-положении макролидного соединения, представленного нижеследующей формулой (С), ацетильной группой:
(где R представляет собой атом водорода или гидроксильную группу).
Термин “эпоксидазная активность в 18,19-положении” означает активность, направленную на замену двойной связи в 18,19-положении макролидного соединения, представленного нижеследующей формулой (D), эпоксигруппой:
(где R представляет собой атом водорода или гидроксильную группу).
Термин “активность регуляции транскрипции” означает активность, направленную на регуляцию транскрипции ДНК, кодирующей полипептид, участвующий в биосинтезе макролидного соединения (II).
В соответствии с настоящим изобретением может быть получен рекомбинантный микроорганизм, который имеет ДНК, кодирующую полипептид, участвующий в биосинтезе макролидного соединения (II), и ДНК, кодирующую полипептид, обладающий ферментативной активностью, направленной на гидроксилирование макролидного соединения (II) в 16-положении, и который способен к прямому ферментативному продуцированию макролидного соединения (I) с гидроксильной группой в 16-положении. Макролидное соединение (I) с гидроксильной группой в 16-положении может быть эффективно продуцировано путем культивирования указанного рекомбинантного микроорганизма и выделения этого соединения из культуральной среды.
В частности, макролидное соединение (I) с гидроксильной группой в 16-положении может быть продуцировано с большей эффективностью и селективностью с использованием ДНК, кодирующей полипептид, обладающий ферментативной активностью, направленной на гидроксилирование 16-положения, где аминокислотная последовательность данного полипептида была частично модифицирована вышеупомянутым методом.
Краткое описание графического материала
На фиг.1 представлен путь биосинтеза пладиенолидов в Mer-11107.
На фиг.2 представлено соответствие между космидами и каждой из ОРС ДНК, участвующей в биосинтезе пладиенолидов в Mer-11107.
На фиг.3 представлена структура плазмиды pKU253.
На фиг.4 представлена структура плазмиды pUC19aph::oriT::intphiC31.
Подробное описание изобретения
Варианты настоящего изобретения более подробно описаны ниже.
ДНК, кодирующая полипептид, участвующий в биосинтезе макролидного соединения (II) согласно изобретению, может быть получена известным методом (таким, как метод гибридизации колоний, описанный в руководстве Molecular Cloning, 2-е издание) из культивированного мицелия микроорганизма, способного продуцировать указанное макролидное соединение. Любой из этих микроорганизмов может обладать способностью продуцировать макролидное соединение независимо от его вида или штамма, однако, предпочтительными являются штаммы, принадлежащие к актиномицетам рода Streptomyces. Одним из таких примеров является штамм Streptomyces sp. Mer-11107, который был выделен из почвы. Штамм Mer-11107 был депонирован 19 декабря 2000 под номером FERM P-18144 в депозитарии Национального института биологических наук и Центра промышленных исследования и технологий (National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology) (1-3, Higashi 1-chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan), а затем 27 ноября 2001 года он был передан на международное депонирование в Международный депозитарий патентуемых микроорганизмов (IPOD) Национального института новых промышленных исследований и технологий под номером FERM BP-7812 (Tsukuba Central 6, 1-1, Higashi 1-Chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan).
Процедуры получения нужной ДНК описаны ниже на примере штамма Mer-11107. Рекомбинантную ДНК, полученную путем присоединения геномной ДНК Mer-11107, которая была частично гидролизована подходящим рестриктирующим ферментом, к космидному вектору, способному реплицироваться в E.coli и гидролизованному подходящим рестриктирующим ферментом, вводят в E.coli с получением трансдуцированных штаммов. Затем множество трансдуцированных штаммов, полученных как описано выше, скринируют с использованием фрагмента известного гена гидроксилирующего фермента (фермента цитохорома Р450) в качестве зонда, а затем отбирают трансдуцированные штаммы, гибридизующиеся с этим зондом. После этого получают и секвенируют ДНК, которая гибридизуется с геном гидроксилирующего фермента, присуствующим в выбранных космидах. Эту ДНК вводят в E.coli, и после подтверждения присутствия в трансформированной E.coli ферментативной активности, направленной на гидроксилирование 6-положения, указанная ДНК, кодирующая фермент, гидроксилирующий 6-положение, может быть использована в качестве зонда в Саузерн-гибридизации для отбора космид, содержащих кластер генов биосинтеза макролидного соединения, смежный с ДНК, кодирующей фермент, гидроксилирующий 6-положение, из множества позитивных клонов (космид), полученных как описано выше, и нужную ДНК получают путем конструирования этих космид. Подробное описание всех указанных процедур приводится в сравнительном примере 1, а также в заявке WO-A 2006/009276, описание которой рассматривается заявителями в настоящей заявке и может быть использовано в настоящем описании посредством ссылки.
Полученная таким образом нуклеотидная последовательность (аминокислотная последовательность кодирующей последовательности), содержащая область, окружающую ДНК, кодирующую полипептид, участвующий в биосинтезе макролидного соединения (II), представлена последовательностью NO:1 в списке последовательностей.
ДНК, представленная последовательностью NO:1, включает 8 открытых рамок считывания (ОРС): pldA I (нуклеотиты 8340-27935), pldA II (нуклеотиды 28021-49098), pldA III (нуклеотиды 49134-60269), pldA IV (нуклеотиды 60269-65692), pldB (нуклеотиды 65707-66903), pldC (нуклеотиды 68160-66970), pldD (нуклеотиды 69568-68270) и pldR (нуклеотиды 72725-70020).
Из этих ДНК, pldA I, pldA II, pldA III и pldA IV имеют несколько транскрипционных рамок считывания, каждая из которых, так же как и другие известные гены биосинтеза поликетидов, включает одну или несколько повторяющихся единиц, называемых модулями. Как описано ниже, каждый модуль кодирует все или несколько доменов, выбранных из доменов ацил-переносящего белка (ACP), β-кетоацил-ACP-синтетазы (KS) и ацил-трансферазы (AT), которые участвуют в реакциях конденсации при синтезе поликетидов, а также доменов кетоацил-редуктазы (KR), дегидрогеназы (DH) и еноилредуктазы (ER), которые участвуют в реакциях модификации карбонильной группы β-положения, а конечный модуль включает домен тиоэстеразы (TE), который удаляет поликетидную цепь из поликетид-синтетазы.
На фиг.1 показан путь биосинтеза макролидного соединения в штамме Mer-11107. В отличие от других модулей в загрузочном модуле центральный цистеин заменен глутамином, что указывает на то, что pldA I участвует в исходной реакции. Модуль 10 включает домен тиоэстеразы (TE), что указывает на то, что pldA IV участвует в конечной реакции синтеза основного поликетидного остова. После образования основного остова поликетида таким путем его модифицируют в 18,19-положении эпоксидазой, кодируемой pldD, в 7-положении - ацетилазой, кодируемой pldC, и в 6-положении - гидроксилазой, кодируемой pldB, для биосинтеза макролидного соединения (II). Макролидное соединение (II), в котором R представляет собой атом водорода, может быть получено либо путем делеции pldB либо путем ее модификации так, чтобы функция, за которую ответственна эта рамка считывания, не экспрессировалась. PIdR, которая имеет высокую степень гомологии с геном aveR, кодирующим фактор регуляции транскрипции в биосинтезе авермектина, кодирует фактор регуляции транскрипции ДНК, участвующий в биосинтезе макролидных соединений.
В настоящем изобретении, ДНК, кодирующая полипептид, обладающий ферментативной активностью, направленной на гидроксилирование макролидного соединения (II) в 16-положении, может быть получена методом, хорошо известным специалисту в данной области (таким, как метод гибридизации колоний, описанный в руководстве Molecular Cloning, 2-е издание), из культивированного мицелия микроорганизма, обладающего способностью к гидроксилированию макролидного соединения в 16-положении. При этом может быть использован любой микроорганизм, обладающий способностью заменять атом водорода макролидного соединения в 16-положении гидроксильной группой, независимо от вида или штамма этого микроорганизма, однако, предпочтительными примерами являются штаммы, принадлежащие к актиномицетам. Примерами таких штаммов являются штамм Streptomyces sp. A-1544, штамм Streptomyces sp. Mer-11107 и штамм Streptomyces sp. A-1560. Штамм A-1544 был депонирован под рег. номером FERM P-18943 в Международном депозитарии патентуемых микроорганизмов Национального института новых промышленных исследований и технологий (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 23 июля 2002 года, а затем он был передан на международное депонирование под номером FERM BP-8446 30 июля 2003 года, в Международный депозитарий патентуемых микроорганизмов (IPOD) Национального института новых промышленных исследований и технологий (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan). Штамм A-1560 был депонирован под рег. номером FERM P-19585 в Международном депозитарии патентуемых микроорганизмов Национального института новых промышленных исследований и технологий (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 13 ноября 2003 года, а затем 19 августа 2004 года он был передан на международное депонирование под в Международный депозитарий патентуемых микроорганизмов (IPOD) Национального института новых промышленных исследований и технологий (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) номером FERM BP-10102.
Процедуры получения нужной ДНК описаны ниже на примере штамма A-1544. Сначала получали геномную ДНК штамма A-1544 и подвергали ПЦР-реакции с использованием праймеров, созданных исходя из данных о последовательности известного гена гидроксилирующего фермента (цитохрома P450), в результате чего получали специфически амплифицированный ДНК-фрагмент, который затем секвенировали. Затем исходя из данных о полученной последовательности нуклеотидную последовательность смежной области, расположенной выше и ниже от фрагмента клонированной ДНК, амплифицировали с помощью обратной ПЦР (Cell Technology, Vol. 14, pp. 591-593, 1995) и клонировали, после чего эту последовательность анализировали. Детали всех этих процедур подробно описаны в сравнительном примере 2 (штамм A-1544), в сравнительном примере 3 (штамм Mer-11107) и в сравнительном примере 4 (штамм A-1560), а также в заявке WO-A 2005/052152, опубликованной 9 июня 2005 года, и могут быть указаны посредством ссылки.
Полученная таким образом ДНК (включая смежную область) из штамма A-1544, которая кодирует полипептид, обладающий ферментативной активностью, направленной на гидроксилирование макролидного соединения (II) в 16-положении, представлена последовательностью NO:2 в списке последовательностей. ДНК, представленная последовательностью NO:2, включает две открытые рамки считывания (ОРС), а именно psmA (нуклеотиды 1322-2548) и psmB (нуклеотиды 2564-2761), которые кодируют фермент, гидроксилирующий 16-положение, и ферредоксин соответственно.
Аналогичным образом ДНК (включая смежную область), кодирующая полипептид, обладающий ферментативной активностью, направленной на гидроксилирование макролидного соединения (II) в 16-положении, и выделенная из штамма Mer-11107, представлена последовательностью NO:3 в списке последовательностей. Эта ДНК, представленная последовательностью NO:3, включает две открытые рамки считывания (ОРС), а именно bpmA (нуклеотиды 420-1604) и bpmB (нуклеотиды 1643-1834), которые кодируют фермент, гидроксилирующий 16-положение, и ферредоксин соответственно.
ДНК (включая смежную область), кодирующая полипептид, обладающий ферментативной активностью, направленной на гидроксилирование макролидного соединения (II) в 16-положении, и выделенная из штамма А-1560, представлена последовательностью NO:4 в списке последовательностей. Эта ДНК, представленная последовательностью NO:4, включает две открытые рамки считывания (ОРС), а именно tpmA (нуклеотиды 172-1383) и tpmB (нуклеотиды 1399-1593), которые кодируют фермент, гидроксилирующий 16-положение, и ферредоксин соответственно.
Кроме того, варианты вышеупомянутых различных ДНК, кодирующих полипептид, обладающий ферментативной активностью, направленной на гидроксилирование соединения в 16-положении, могут быть получены в соответствии с нижеследующими процедурами. Сначала на основе данных об исходной последовательности ДНК проводят сайт-направленную модификацию, а затем ДНК-вариант, полученный посредством сайт-направленной модификации, вводят хозяину. Таким образом, нужные варианты могут быть отобраны и получены с использованием в качестве маркера, в высокой степени селективного и активного фермента, гидроксилирующего 16-положение и кодируемого ДНК-вариантом полученного рекомбинантного микроорганизма. Так, например, сайт-направленная модифика