Лекарственная субстанция для подавления геликобактероподобных эрозивно-язвенных повреждений слизистой оболочки желудка
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается лекарственной субстанции для подавления геликобактероподобных эрозивно-язвенных повреждений слизистой оболочки желудка, содержащей в эффективном количестве в качестве действующего начала динитрат 9-(2-диэтиламиноэтил)-2-фенили-мидазо[1,2-а]бензимидазола формулы I. Изобретение направлено на расширение арсенала средств для подавления геликобактероподобных эрозивно-язвенных повреждений слизистой оболочки желудка. 1 табл.
Реферат
Изобретение относится к химико-фармацевтической промышленности и касается создания лекарственной субстанции для подавления геликобактероподобных эрозивно-язвенных повреждений слизистой оболочки желудка.
Среди заболеваний системы пищеварения по распространенности и тяжести возможных осложнений язвенная болезнь желудка и 12-ти перстной кишки занимает ведущее место. В лечении язвенной болезни желудка одной из базисных групп антисекреторных препаратов являются Н2-гистаминоблокаторы (Машковский М.Д., Лекарственные средства, М.: «Новая волна», 2006, с.561).
Препаратом сравнения является селективный Н2-гистаминоблокатор фамотидин, демонстрирующий не только Н2-антагонистическую активность, но и способность устранять патологическое действие гидроксильного радикала Van (Zyl J.M., Kriegler A., van der Walt B.J., Antioxidant properties of H2 receptor antagonists. Effects on myeloperoxidase-catalysed reactions and hydroxyl radical generation in a ferrous-hydrogen peroxide system, Biochem. Pharmacol., 1993, vol. 45, №12, p.2389-2397).
При использовании фамотидина наиболее часто встречаются побочные эффекты со стороны ЦНС, такие как головная боль, головокружение (в 1-5% случаев), а также со стороны желудочно-кишечного тракта: обстипация, диарея (в 1-2% случаев) (Texter Е.C., Jr. Introduction. Famotidine: clinical applications of a new H2-receptor antagonist, Am. J. Med., 1986, Vol.81 (SuppL 4B), p.1-7).
Известно также, что Н2-блокаторы, в том числе и фамотидин, вызывают гиперплазию эпителия слизистой оболочки желудка (Григорьев Л.А., Исаков В.А. и др., Фамотидин - новый блокатор Н2-рецепторов гистамина, Клин. медицина, 1991, №4, с.23-29).
Учитывая вышеизложенное, в последние годы ведется изыскание и изучение новых средств для лечения и профилактики язвенной болезни желудка, при этом наиболее перспективным считается сочетание угнетающего действия на секрецию соляной кислоты в желудке, гастропротективных свойств и влияния на процессы ульцерогенеза, обусловленные Helicobacter pylori (Рысс B.C., Звартау Э.Э., Фармакотерапия язвенной болезни, М.: Изд-во Бином, С-Пб, Невский Диалект, 1998, с.256).
Одним из патогенетических аспектов ульцерогенеза при инвазии Н. pylori является образование в слизистой оболочке желудка монохлорамина (NH2Cl), обладающего цитотоксическими свойствами, обусловленное взаимодействием аммиака (NH4OH), образующегося вследствие уреазной активности Н. pylori, и хлорноватистой кислоты (НСlO), продуцируемой нейтрофилами, способность которых к выработке НСlO значительно повышается в условиях ишемии и гипоксии вследствие повышения активности ксантиноксидазы и гиперпродукции пероксида водорода (Suzuki Н., Miura S., Suzuki M. et al., Gastric mucosal injury: microcirculation and Helicobacter pylori, Keio J. Med., 1994, vol. 43, №1, p.1-8; Murakami M., Asagoe K., Dekigai Н. et al. Products of neutrophil metabolism increase ammonia-induced gastric mucosal damage. Dig. Dis. Sci, 1995, vol. 40, p.268-273).
Модель повреждения слизистой оболочки желудка с применением малых субэрозивных концентраций раствора аммиака на фоне нарушения микроциркуляции, вызванной тотальной ишемией, отражает специфические механизмы повреждения слизистой оболочки желудка эндогенным NH2Cl. Этот механизм повреждения слизистой соответствует процессу ульцерогенеза при инфицировании Helicobacter pylori (Umeda M., Fujita A., Nishiwaki Н., Takeuchi K., Monochloramine and gastric lesions. Effect of lafutidine, a novel histamine H2-receptor antagonist, on mono-chloramineinduced gastric lesions in rats J. of Gastroenterology and Hepatology, 1999, №14, p.859-865; Спасов А.А., Черников М.В., Сперанская А.С., Зайченко С.И., Изучение влияния мизопростола и таурина на монохлораминовый ульцерогенез у крыс. Бюллетень экспериментальной биологии и медицины, т.141, №3, 2006, с.309-312).
Среди производных имидазо[1,2-а]бензимидазола и их различных солей наиболее выраженными антисекреторными и противоязвенными свойствами обладает динитрат 9-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазола (патент РФ № 2058142, кл.7А61К 31/4184, 1991).
Задачей изобретения является разработка эффективных лекарственных гастропротективных средств для подавления эрозивно-язвенных повреждений слизистой оболочки желудка при инфицировании Helicobacter pylori, более активных, чем применяемые в практической медицине.
Техническим результатом является повышение эффекивности лекарственной гастропротективной субстанции за счет подавления эрозивно-язвенных повреждений слизистой оболочки желудка.
Технический результат достигается тем, что лекарственная субстанция для подавления геликобактероподобных зрозивно-язвенных повреждений слизистой оболочки желудка в качестве действующего начала содержит динитрат 9-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазола формулы I:
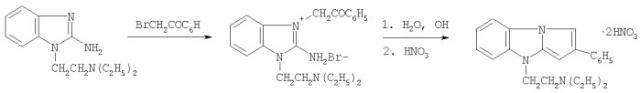
Соединение I синтезировано по схеме:
Ниже приведены примеры осуществления изобретения.
Пример синтеза соединения I.
При взаимодействии 2,32 г (10 ммоль) 2-амино-1-диэтиламино-этилбензимидазола и 1,99 г (10 ммоль) фенацилбромида в 50 мл ацетона при перемешивании и комнатной температуре выпадает осадок бромида 2-амино-1-диэтиламиноэтил-3-фенацилбензимидазолия. Его отфильтровывают и промывают ацетоном. Выход бромида 4,0-4,1 г. (93-95%). Т.пл. 192-193°С (разл.).
Кипятят 3,88 г (9 ммоль) полученного бромида в 50 мл воды до полного протекания циклизации (контроль - ТСХ). Полученный раствор охлаждают и подщелачивают 22%-ным раствором аммиака до рН 9. Основание 9-диэтиламиноэтил-2-фенилимидазо[1,2-а]бензимидазола экстрагируют хлороформом, хроматографически очищают от примесей, сидящих на старте и получают 2,60-2,66 г (87-89%) основания I в виде светло-желтого густого масла. Его растворяют в ацетоне и переводят в динитрат, подкисляя раствор азотной кислотой до рН 1-2. Выпавший осадок через 1-2 ч отфильтровывают, промывают тщательно ацетоном. Выход динитрата I 96-97%; т.пл. 181-182°С (разл., из ЕtOН).
Соединение желтеет на свету, поэтому его следует хранить в темноте. Найдено, %: С 55,2; Н 5,6; N 18,4. C21H24N4·2HNO3. Вычислено, %: С 55, 0; Н 5,7; N 18,3. УФ-спектр (95%-ный этанол), λmax, нм: 216±2, 233-234 (плечо), 276±2. ИК-спектр (вазелиновое масло), ν, см-1: 1665 (C=N+H), 3130-3600 (N+H). Спектр ПМР основания (CDCl3), δ, м.д.: 0,97 (6Н, т, 2СН3), 2,52-2,73 (4Н, к, 2 CH 2СН3), 2,90-3,04 (2Н, т, СН 2N(СН2CH3)2) 4,22-4,36 (2Н, т, NCH2), 7,12-7,93 (10 Н, м, аромат, протоны).
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА СОЕДИНЕНИЯ I.
ИССЛЕДОВАНИЕ ГАСТРОПРОТЕКТИВНОЙ АКТИВНОСТИ СОЕДИНЕНИЯ I in vivo
(при геликобактероподобных эрозивно-язвенных повреждениях слизистой оболочки желудка).
Для воспроизведения геликобактероподобного ульцерогенеза (Umeda M., Fujita A., Nishiwaki Н., Takeuchi K., Monochloramine and ga stric lesions. Effect of lafutidine, a novel histamine H2-receptor antagonist, on monochloramine-induced gastric lesions in rats, J. of Gastroenterology and Hepatology, 1999, №14, p.859-865) крысам вводили раствор аммиака в субповреждающих концентрациях (100 ммоль/л) на фоне ишемии путем создания острой дозированной кровопотери (из расчета 1 мл на 100 г веса). Через 1 час производили оценку повреждений слизистой оболочки желудка.
Соединение I и препарат сравнения фамотидин (SIGMA, США) вводили внутрижелудочно через зонд за 1 час до введения повреждающего агента.
Эксперименты выполнены на 32-х нелинейных белых крысах обоего пола, массой 180-260 г. Наркотизацию животных проводили нембуталом (40 мг/кг, внутрибрюшинно).
Статистическую обработку результатов экспериментов производили в пакете прикладных программ «Statistika 6.0» с использованием парного критерия Стьюдента при предварительной проверке выборки на нормальность распределения. Величины ЕД50 определены при помощи метода наименьших квадратов.
Исследуемое соединение I дозозависимо подавляло образование эрозивно-язвенных повреждений слизистой оболочки желудка крыс, вызванных введением аммиака на фоне ишемии (табл.1). Величины ЕД50 гастропротективных эффектов соединения I и фамотидина составили 16,0 мг/кг и 21,8 мг/кг соответственно.
Таким образом, при данной специфической модели повреждения слизистой оболочки желудка крыс соединение I показало четкий дозозависимый гастро-протективный эффект, превышающий таковой фамотидина в 1,4 раза.
| Таблица 1.ВЛИЯНИЕ СОЕДИНЕНИЯ I И ФАМОТИДИНА (при внутрижелудочном введении) НА РАЗВИТИЕ ГЕЛИКОБАКТЕРОПОДОБНЫХ ЭРОЗИВНО-ЯЗВЕННЫХ ПОВРЕЖДЕНИЙ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА КРЫС (М±m) | |||
| Группа/ Вводимое вещество | Доза, мг/кг | Выраженность повреждений | |
| Эрозивно-язвенный индекс, мм2/животное | Δ% | ||
| Контроль | - | 35,5±4,50 | - |
| Соединение I | 3 | 26,4±0,87 | -25,6 |
| 10 | 17,1±1,09* | -51,8 | |
| 30 | 12,1±0,99* | -65,9 | |
| Фамотидин | 3 | 35,3±0,80 | -0,6 |
| 10 | 23,1±3,96 | -34,9 | |
| 30 | 12,2±0,50* | -65,4 | |
| * - данные достоверны по отношению к контролю (р<0,05); |
Лекарственная субстанция для подавления геликобактероподобных эрозивно-язвенных повреждений слизистой оболочки желудка, содержащая в эффективном количестве в качестве действующего начала динитрат 9-(2-диэтиламиноэтил)-2-фенили-мидазо[1,2-а]бензимидазола формулы I