Способ получения гамма-амидов глутамовой кислоты
Иллюстрации
Показать всеИзобретение касается способа получения γ-амидов глутамовой кислоты формулы
где R4 представляет аминозащитную группу, выбранную из карбобензилоксигруппы (CBz), R5 представляет неразветвленный или разветвленный C1-С10алкил, R2 и R3 независимо представляют атом водорода, R-NH2 представляет собой 3-аминопроизводное желчной кислоты, которые далее способны реагировать с образованием ценных органических соединений-лигандов, комплексы которых с ионами парамагнитных двух-трех-валентных металлов, выбранных из группы, состоящей из Fe(2+), Fe(3+), Cu(2+), Cr(3+), Gd(3+), Eu(3+), Dy(3+), Yb(3+) или Mn(2+), могут служить основой для получения диагностических композиций для применения в ЯМР-томографии кровеносной системы организмов человека и животных. 1 табл., 4 ил.
Реферат
Настоящее изобретение относится к способу получения γ-амидов глутаминовой кислоты, которые являются промежуточными соединениями в синтезе комплексов ионов металлов конъюгатов желчных кислот с молекулами, обладающими хелатирующей активностью. Указанные комплексы могут найти применение в качестве контрастных агентов для применения в способах диагностики, известных как «ЯМР-томография», в частности в качестве агентов для кровяного депо.
Комплексы, образованные хелатирующими агентами и подходящими металлами, уже используют в качестве контрастных агентов в следующих способах диагностики: томографии с помощью рентгеновских лучей, томографии с помощью ядерного магнитного резонанса (M.R.I.) (ЯМР-томография) и сцинтиграфии.
В частности, в медицинской диагностике, использующей ЯМР-томографию (M.R.I.), признанную мощным способом диагностики в клинической практике (Stark, D.D., Bradley, W.G., Jr., Eds. "Magnetic Resonance Imaging" The C.V. Mosby Company, St. Louis, Missouri (USA), 1988), применяют, главным образом, парамагнитные фармацевтические композиции, предпочтительно содержащие хелатные комплексы ионов двух-трех-валентных парамагнитных металлов с полиаминополикарбоксильными лигандами и/или их производными или аналогами.
Изображения, полученные, по существу, за счет ЯМР-сигнала протонов воды, являются результатом сложных взаимосвязей между различными параметрами, такими как плотность протонов и время релаксации T1 и T2. Усиления контраста можно достичь за счет введения экзогенных химических веществ, которые значительно изменяют резонансные характеристики соседних протонов воды (см. Lauffer, R.B. Chem. Rev. 1987, 87, 901).
Парамагнитные контрастные агенты, используемые для ЯМР-томографии, изменяют время релаксации протонов воды, присутствующей в тканях, в которых указанные контрастные агенты сконцентрированы, и поэтому они усиливают контраст между различными тканями или между здоровой и больной тканью.
Парамагнитные комплексы гадолиния были целью исследований, публикаций и патентов благодаря своей высокой способности уменьшать время релаксации протонов соседних молекул воды в результате диполярных взаимодействий.
Некоторые из них представлены в клинической практике в качестве M.R.I. контрастных агентов:
Gd-DTPA, гадолиниевого комплекса N-метилглюкаминовой соли диэтилентриаминопентауксусной кислоты, MAGNEVIST®; Gd-DOTA, гадолиниевого комплекса N-метилглюкаминовой соли 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты, DOTAREM®; Gd-HPDO3A, гадолиниевого комплекса [10-(2-гидрокси-пропил)-1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты, PROHANCE®; Gd-DTPA-BMA, гадолиниевого комплекса бис(метиламида) диэтилентриаминопентауксусной кислоты, OMNISCAN®.
Перечисленные выше контрастные агенты коммерчески доступны и предназначены для широкого использования. На деле, после введения для получения M.R.I. указанные контрастные агенты диффундируют в крови и во внеклеточных зонах различных частей тела, прежде чем они выводятся. Поэтому в этом плане они аналогичны иодированным соединениям, которые используют в медицине для диагностики с помощью рентгеновских лучей.
В настоящее время медицинские работники нуждаются в таких контрастных агентах, которые предназначены для исследования конкретных органов, или для томографии кровеносной системы, которую нельзя качественно определить с помощью продуктов, коммерчески доступных в настоящее время. Первоначальный подход для получения последних состоит в ковалентном связывании контрастного агента с макромолекулами, такими как белки, или в заключении их внутрь стабильных агрегатов молекул, таких как липосомы, или в использовании так называемых суперпарамагнитных частиц.
Так, например, гадолиниевый комплекс диэтилентриаминопентауксусной кислоты (Gd-DTPA) связывали с человеческим альбумином (HSA), полилизином или декстраном (Oksendal A.N. et al., J. Magn. Reson. Imaging, 157, 1993; Rocklage S.M., “Contrast Agents”, Magn. Res. Imaging, Mosby Year Book, 372-437, 1992) для уменьшения или даже прекращения диффузии из крови во внеклеточную жидкость, обеспечивая тем самым более длительное пребывание агента в кровеносной системе. Такой подход хотя и позволял достичь нужного эффекта, страдает от непозволительных побочных эффектов, так как сам агент выводится при этом с трудом.
Другой подход состоит в использовании суперпарамагнитных частиц, покрытых полиэтиленгликолями или углеводородами для уменьшения захвата их в печени эндотелиальным ретикулумом или в других системах (Tilcock C., Biochim. Biophys. Acta, 77, 1993; Bogdanoy A.A. et al., Radiology, 701, 1993), тем самым увеличивая длительность пребывания этих агентов в крови. В этом случае также наблюдаются вышеуказанные эффекты, а также возникают проблемы, связанные с высокой стоимостью производства.
Поэтому до сих пор существует необходимость в эффективном агенте для кровяного депо, который обладал бы низкой токсичностью и отличался бы разумной ценой.
Некоторые комплексы, полученные в результате конъюгации желчной кислоты с хелатирующим агентом, которые способны образовывать хелатные комплексы с ионами парамагнитных двух-трехвалентных металлов, уже были ранее раскрыты заявителем в международной патентной заявке WO-A-95/32741.
Указанные соединения демонстрируют хорошую гепатобилиарную экскрецию (см. Anelli P.L. et al., Acta Radiologica, 38, 125, 1997), что делает их многообещающими контрастными агентами для визуализации гепатобилиарной системы.
Неожиданно было обнаружено, что специфический класс указанных соединений остается в сосудистой системе достаточно длительное время, что дает возможность использовать их в качестве контрастных агентов для томографии сосудистой системы, в частности коронарной системы.
Этот эффект можно четко наблюдать в тестах in vivo на животных (таких как кролики и обезьяны). Постоянство нахождения этих соединений в сосудистой системе действительно можно немедленно выявить при построении диаграммы значений времени релаксации протонов (1/Т1) в образцах крови животного, отобранных с соответствующими временными интервалами после введения контрастного агента.
Так как комплексы Gd(III) являются парамагнитными, высокие значения 1/Т1 являются доказательством наличия в крови высоких концентраций контрастного агента.
Различие между обычным внеклеточным контрастным агентом и агентом кровяного депо хорошо показано в статье Lauffer et al., Radiology, 529, 1998, где приводятся кривые для Т1 в крови как функция времени, прошедшего после введения контрастного агента.
В частности, комплексы, одной из стадий получения которых является способ в соответствии с настоящим изобретением, при введении, например, кроликам в дозе, сравнимой с разумным коэффициентом безопасности, способны вызвать изменения в скоростях релаксации (определяемых как Δ1/Т1) в крови более чем 5 сек-1 через 10 мин после введения и таким образом являются многообещающими соединениями для использования в качестве контрастных агентов для томографии кровеносной системы.
Было обнаружено, что этот тип эффекта нельзя полностью отнести за счет присутствия желчных кислот, но он зависит от химического строения комплексов. По-видимому, в действительности хелатирующий фрагмент должен предпочтительно связываться со стероидальным скелетом связью в положениях 3, 7 или 12 желчной кислоты.
Действительно, было доказано, что любая связь между хелатирующим фрагментом и желчной кислотой, включающая карбоксильную группу в положении 24, приводит к образованию комплексов, отличающихся неудовлетворительным постоянством в сосудистой системе:
Поэтому способ настоящего изобретения является частью синтеза комплексов соединений общей формулы (I) с ионами парамагнитных двух-трехвалентных металлов, выбранных из группы, состоящей из Fe(2+), Fe(3+), Cu(2+), Cr(3+), Gd(3+), Eu(3+), Dy(3+), Yb(3+) или Mn(2+),
X-L-Y (I),
где X представляет остаток полиаминополикарбоксильного лиганда или его производного, выбранного из группы, состоящей из:
этилeндиаминотетрауксусной кислоты (EDTA), диэтилeнтриаминопентауксусной кислоты (DTPA), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA), 1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты (DО3A), [10-(2-гидроксипропил)-1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты (HPDО3A), 4-карбокси-5,8,11-трис(карбоксиметил)-1-фенил-2-окса-5,8,11-триaзaтридекан-13-овой кислоты (BOPTA);
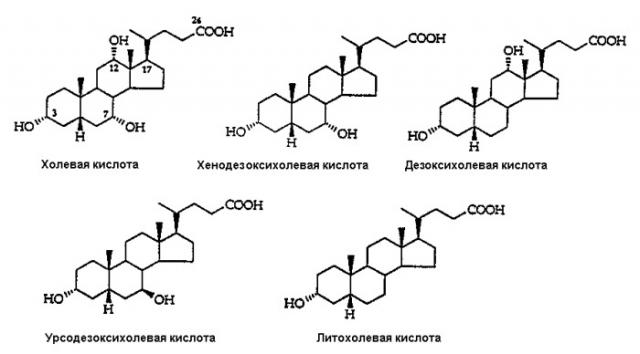
Y представляет производное желчной кислоты, выбранное из группы, состоящей из остатков холевой, хенодезоксихолевой, дезоксихолевой, урсодезоксихолевой, литохолевой кислот:
как таковых, а также как функционированных по положениям, содержащим гидроксильную группу в качестве реакционно-способной группы, независимо от стереохимии конечных продуктов, причем указанное производное включает также конъюгат кислотной группы в положении 24 с таурином и глицином;
L представляет цепь, связанную с любым положением Х, необязательно включающую одну из карбоксильных групп, которая таким образом превращается в амидную группу, и с C-3, C-7, C-12 положениями Y, и имеет следующую формулу (II):
где m представляет целое число от 1 до 10, где для значений больше 1, А может иметь различные значения;
A представлен следующей формулой (III):
n и q могут быть 0 или 1, но они не могут одновременно быть нулем,
p может принимать значения в интервале от 0 до 10,
Z представляет атом кислорода или -NR группу,
где R представляет атом водорода или (C1-C5)алкильную группу, незамещенную или замещенную -COOH группой,
используемых в качестве агентов для кровяного депо
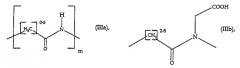
Наиболее предпочтительными соединениями являются те, в которых пространственные цепи L имеют следующие общие формулы (IIIa) и (IIIb):
Предпочтительны также структуры, в которых Z представляет атом кислорода, а L при этом образуется за счет гидроксильных групп, присутствующих в 3, 7, 12 положениях, независимо от стереохимии конечных продуктов.
Особенно предпочтительны соединения формулы (I), в которых остаток X выбирают из группы, состоящей из: EDTA, DTPA, DOTA, DО3A, BOPTA; L выбирают из группы, состоящей из (IIIa), (IIIb).
Y предпочтительно выбирают из группы, состоящей из остатков холевой, дезоксихолевой, хенодезоксихолевой, литохолевой кислот, связанных с L через аминогруппу в 3 положении, и кислотная группа в положении 24 присутствует как таковая или в виде ее тауринового или глицинового производного.
Y можно также функционировать различным образом, например, превращая одну или более гидроксильных групп в кетогруппы.
Особенно предпочтительными комплексами с ионами парамагнитных металлов, указанных выше, являются комплексы с гадолинием или с марганцем.
Предпочтительны соединения общей формулы (IV), в которых в общей формуле (I) остаток Х представляет DTPA, замещенный по центральной цепи, и где R1 представляет атом водорода или -СООН группу,
где Y выбирают из группы, состоящей из остатков холевой, дезоксихолевой, хенодезоксихолевой, литохолевой кислот, а L представлено формулой (III).
Особенно предпочтительны соединения общей формулы (IVa):
где R1 представляет -СООН группу, а Y принимает указанные выше для соединений общей формулы (IV) значения, и L представлено формулами (IIIa) или (IIIb).
Следующими целями настоящего изобретения являются новые соединения, принадлежащие к классу соединений общей формулы (IVa), а также способы их получения:
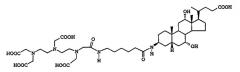
[3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил](карбоксиметил)амино]холан-24-овая кислота:
[3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]холан-24-овая кислота:
[3β(S),5β,7β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-7-гидроксихолан-24-овая кислота:
[3α(S),5β]-3-[2-[[5-[бис[2-[бис(карбоксиметил)амино]этил]амино]-5-карбоксипентил]амино]-2-оксоэтокси]холан-24-овая кислота:
[3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-оксохолан-24-овая кислота:
[3β(S),5β,7α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-7-гидроксихолан-24-овая кислота:
N2-бис[2-[бис(карбоксиметил)амино]этил]-N-[(3β,5β,7α,12α)-7,12-дигидрокси-24-оксо-24-[(2-сульфоэтил)амино]холан-3-ил]-L-глутамин:
N2-бис[2-[бис(карбоксиметил)амино]этил]-N-[(3β,5β)-24-оксо-24-[(2-сульфоэтил)амино]холан-3-ил]-L-глутамин:
[3β(S),5β,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-гидроксихолан-24-овая кислота:
[3β(R),5β,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-гидроксихолан-24-овая кислота:
[3β(RS),5β,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-гидроксихолан-24-овая кислота:
[3α(S),5β,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-гидроксихолан-24-овая кислота:
[3β(RS),5β,7α,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-7,12-дигидроксихолан-24-овая кислота:
[3α(S),5β,7α,12α]-3-[[[[5-[бис[2-[бис(карбоксиметил)амино]этил]амино]-5-карбоксипентил]амино]карбонил]окси]-7,12-дигидроксихолан-24-овая кислота:
[3α(S),5β]-3-[2-[[5-[бис[2-[бис(карбоксиметил)амино]этил]амино]-5-карбоксипентил]амино]-2-оксоэтокси]холан-24-овая кислота:
Другие соединения, принадлежащие к этому классу, комплексы которых с гадолинием раскрыты в патентной заявке WO-A-95/32741, представлены далее:
[3β(S),5β,7α,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-7,12-дигидроксихолан-24-овая кислота:
[3β(S),5β,7α,12α]-3-[[4-[[5-[бис[2-[бис(карбоксиметил)амино]этил]амино]-5-карбоксипентил]амино]-1,4-диоксобутил]амино]-7,12-дигидроксихолан-24-овая кислота:
Предпочтительны также соединения общей формулы (IVb), которые также являются DTPA производными, замещенными в центральном положении,
где Y принимает указанные выше для соединений формулы (IV) значения, а L принимает значения, соответствующие формуле (IIIa).
Далее настоящее изобретение относится к следующим новым соединениям, которые принадлежат к классу соединений общей формулы (IVb), а также к способу их получения:
(3β,5β,7α,12α)-3-[[[бис[2-[бис(карбоксиметил)амино]этил]амино]ацетил]амино]-7,12-дигидроксихолан-24-овая кислота:
(3β,5β)-3-[[[[[бис[2-[бис(карбоксиметил)амино]этил]амино]ацетил]амино]ацетил]амино] холан-24-овая кислота:
Другие соединения, принадлежащие к этому классу, комплексы которых с гадолинием были раскрыты в патентной заявке WO-A-95/32741, представлены далее:
(3β,5β,7α,12α)-3-[[[[[бис[2-[бис(карбоксиметил)амино]этил]амино]ацетил]амино]ацетил]амино-7,12-дигидроксихолан-24-овая кислота:
(3β,5β,7α,12α)-3-[[6-[[[бис[2-[бис(карбоксиметил)амино]этил]амино]ацетил]амино]-1-оксогексил]амино]-7,12-дигидроксихолан-24-овая кислота:
Особенно предпочтительны также соединения общей формулы (V), в которых в общей формуле (I) остаток X представляет DTPA, Y принимает значения, указанные выше для соединений общей формулы (IV), и L представлен формулой (IIIa):
Другие соединения, принадлежащие этому классу, комплексы которых с гадолинием были раскрыты в патентной заявке WO-A-95/32741, представлены далее:
(3β,5β,7α,12α)-3-[[N-[N-[2-[[2-[бис(карбоксиметил)амино]этил](карбоксиметил)амино]этил]-N-(карбоксиметил)глицил]глицил]амино]-7,12-дигидроксихолан-24-овая кислота:
18-[[(3β,5β,7α,12α)-23-карбокси-7,12-гидрокси-24-норхолан-3-ил]амино]-3,6,9-трис(карбоксиметил)-11,18-диоксо-3,6,9,12-тетраaзaоктадекановая кислота:
Предпочтительны также соединения формулы (VI), в которой в формуле (I) остаток Х представлен DО3A, Y принимает значения, указанные выше для соединений общей формулы (IV), и L выбирают из соединений, соответствующих формулам (IIIa) и (IIIb):
Среди соединений формулы (VI) особенно предпочтительна 10-[3-[[(3α,5β,7α,12β)-23-карбокси-7,12-дигидрокси-24-норхолан-3-ил]окси]-2-гидроксипропил]-1,4,7,10-тетраазациклододекан-1,4,7-триуксусная кислота, комплекс которой с гадолинием был раскрыт в патентной заявке WO-A-95/32741:
Аналогично предпочтительны соединения общей формулы (VII), в которых в формуле (I) остаток Х представлен EDTA, Y принимает значения, указанные выше для соединений формулы (IV), а L соответствует формуле (III).
Особенно предпочтительны комплексы соединений формулы (VII) с марганцем:
Среди соединений формулы (VII) особенно предпочтительны следующие:
[3α(S),5β,12α]-3-[[[[5-[[2-[бис(карбоксиметил)амино]этил](карбоксиметил)амино]-5-карбоксипентил]амино]карбонил]окси]-12-гидроксихолан-24-овая кислота:
[3β(S),5β,7α,12α]-3-[[4-[[5-[[2-[бис(карбоксиметил)амино]этил](карбоксиметил)амино]-5-карбоксипентил]амино]-1,4-диоксобутил]амино]-7,12-дигидроксихолан-24-овая кислота:
[3α(S),5β]-3-[2-[[5-[[2-[бис(карбоксиметил)амино]этил](карбоксиметил)амино]-5-карбоксипентил]амино]-2-оксоэтокси]холан-24-овая кислота
[3β(S),5β,12α]-3-[[4-[[2-[[бис(карбоксиметил)амино]этил](карбоксиметил)амино]-4-карбокси-1-оксобутил]амино]-12-гидроксихолан-24-овая кислота:
[3β(S),5β]-3-[[4-[[2-[[бис(карбоксиметил)амино]этил](карбоксиметил)амино]-4-карбокси-1-оксобутил]амино]-12-оксохолан-24-овая кислота:
Соединения общей формулы (I) можно получить способом конвергентного синтеза, который включает:
1) синтез функционированного лиганда, т.е. лиганда, способного координировать один ион парамагнитного металла, при этом оставаясь стабильно связанным с желчной кислотой за счет подходящей функциональной группы;
2) синтез функционированной желчной кислоты;
3) реакцию сочетания двух различных синтонов;
4) удаление любой защитной группы;
5) образование комплекса с ионом парамагнитного металла;
подробно проиллюстрирован в вышеуказанной патентной заявке WO-A-95/32741.
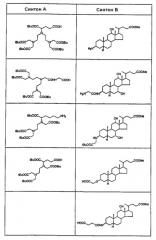
Некоторые из предпочтительных способов получения лигандов настоящего изобретения включают образование амидной связи между двумя синтонами, причем один из них является предшественником хелатообразующей системы парамагнитного иона (Синтон А), а другой является предшественником остатка желчной кислоты, содержащейся в конечном комплексе (Синтон В).
Описываемые далее способы не следует рассматривать как ограничивающие способы получения соединений настоящего изобретения.
Амидную связь можно создать:
а) осуществляя взаимодействие синтонов А, содержащих карбоксильную функцию, с синтоном В, содержащим первичную или вторичную аминофункцию;
b) осуществляя взаимодействие синтонов А, содержащих первичную или вторичную аминофункцию, с синтоном В, содержащим карбоксильную функцию;
с) осуществляя взаимодействие DTPA диангидрида (коммерчески доступный продукт) с синтоном В, содержащим первичную или вторичную аминофункцию.
Перечень некоторых синтонов А и В, используемых в способе настоящего изобретения, представлен в следующей таблице:
Естественно, что используемые синтоны должны быть хорошо защищены по тем группам, которые могли бы стать источником нежелательных реакций в условиях, которые используют для создания амидной связи. После образования амидной связи между двумя синтонами можно предусмотреть одну или более из стадий удаления защитных групп для сохранения групп исходных.
В качестве альтернативы способам такого типа хелатирующую субъединицу можно ввести в результате многостадийных реакций, исходя из производного желчной кислоты, как в случае синтеза соединений, раскрытых в примере 3 экспериментального раздела, что иллюстрируется на схеме 1:
Схема 1
Настоящее изобретение относится также к новому способу, проиллюстрированному на следующей схеме 2:
Схема 2
где R4 представляет аминозащитную группу;
R5 представляет разветвленный или неразветвленный C1-С10алкил или арил;
R2 и R3 представляют независимо атом водорода, разветвленный или неразветвленный C1-C20алкил, незамещенный или замещенный арильными группами, или указанные группы образуют С3-С10 цикл;
причем в этом способе используется реакция трансамидирования, что позволяет сохранить стереохимию по хиральному центру, соседнему с атомом азота исходного пирролидинона, и получить вторичный амид. Объединенный выбор групп R4 и R5 важен в том плане, что расщепление должно происходить в различных условиях. Возможными примерами R4 являются карбоксибензилокси (Cbz) группы, а примерами R5 являются метильная или трет-бутильная группы.
Данный способ обычно используют для получения γ-амидов глутаминовой кислоты и он очень полезен и выгоден для получения соединений настоящего изобретения, в частности γ-амидов глутаминовой кислоты с 3-аминопроизводными остатков Y, как определено выше. В действительности он позволяет получить конечное соединение, избегая использования дорогостоящих конденсирующих агентов для образования γ-амидо связи между глутаминовой кислотой и соответствующим амином.
Примером применения этого совершенно нового способа является синтез [3β(S),5β,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-гидроксихолан-24-овой кислоты, обычный способ получения которой представлен в примере 4 экспериментального раздела, тогда как альтернативный способ представлен в примере 5, и полная схема синтеза представлена далее на схеме 3:
Схема 3
Аналогично получают производное холевой кислоты, уже описанное в патентной заявке WO-95/32741, [3β(S),5β,7α,12α]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-7,12-дигидроксихолан-24-овую кислоту.
Ионами металлов, способными образовывать комплекс с хелатирующими агентами общей формулы (I), являются двухвалентные или трехвалентные ионы элементов, выбранные из группы, состоящей из Fe(2+), Fe(3+), Cu(2+), Cr(3+), Gd(3+), Eu(3+), Dy(3+),
Yb(3+) или Mn(2+).
Что касается диагностического использования новых хелатных комплексов настоящего изобретения, то их можно использовать в качестве контрастных агентов, особенно для применения в качестве агентов для кровяного депо для диагностики с помощью ЯМР-томографии.
Комплексы получают обычно в соответствии со способом, в котором оксид или подходящую соль парамагнитного металла, растворенную в воде или суспендированную в водно-спиртовом растворе, добавляют к водному или водно-спиртовому раствору хелатирующего агента при перемешивании, и, при необходимости, нагревают умеренно или до температуры кипения, до завершения реакции. Если комплекс нерастворим в реакционном растворителе, его можно отфильтровать. Если он растворим, его можно выделить, выпаривая растворитель до получения остатка, например, с помощью сушки распылением.
В том случае, если полученный комплекс все еще содержит свободные кислотные группы, его превращают в нейтральную соль реакцией с органическим или неорганическим основанием, которые образуют физиологически совместимые катионы в растворах.
Для получения таких нейтральных солей достаточное количество основания можно добавить к комплексам, содержащим свободные кислотные группы, в водном растворе или суспензии до нейтральности. Полученный раствор можно обычным образом выпарить или подходящий растворитель можно добавить для кристаллизации соли комплекса.
Предпочтительные неорганические катионы, пригодные для получения солей хелатных комплексов настоящего изобретения, включают, в частности, ионы щелочных или щелочно-земельных металлов, таких как калий, натрий, кальций, магний и их смеси. Особенно предпочтителен ион натрия.
Предпочтительные катионы, полученные из органических оснований, пригодные для вышеуказанных целей, включают (наряду с другими) катионы первичных, вторичных и третичных аминов, таких как этаноламин, диэтаноламин, морфолин, глюкамин, N-метилглюкамин, N,N-диметилглюкамин, причем наиболее предпочтителен N-метилглюкамин.
Предпочтительные катионы, полученные из аминокислот, включают, например, катионы таурина, глицина, лизина, аргинина или орнитина.
Альтернатива этому способу состоит в получении композиций для инъекций без выделения соли комплекса. В этом случае конечный раствор обязательно не должен содержать свободных ионов металла, которые токсичны для организма.
Это можно проверить титрованием, например, с цветными индикаторами, такими как ксиленол оранжевый. Можно также предусмотреть стадию очистки соли комплекса.
В такого типа способе хелатирующий агент, соль или оксид металла и любые солеобразующие основания подвергают взаимодействию в стехиометрических отношениях в воде для инъекций, затем после завершения реакции пирогены отфильтровывают и продукт распределяют в подходящие контейнеры, а затем осуществляют термическую стерилизацию.
Фармацевтические композиции для инъекций обычно получают, растворяя активный ингредиент, полученный как указано выше, и эксципиенты в воде необходимой степени чистоты с фармакологической точки зрения с тем, чтобы получить фармацевтическую композицию, пригодную для энтерального или парентерального введения, в молярных концентрациях в интервале от 0,01 до 1,0. Полученный контрастный агент соответствующим образом стерилизуют.
Контрастные агенты вводят в зависимости от диагностических требований в дозах от 0,01 до 0,3 ммоль/кг массы тела.
В принципе дозы для парентерального введения находятся в интервале от 0,001 до около 1,0 ммоль/кг массы тела. Предпочтительные дозы для парентерального введения находятся в интервале от 0,01 до около 0,5 ммоль/кг массы тела.
Дозы для энтерального введения обычно находятся в интервале от 0,5 до около 10 ммоль/кг массы тела, предпочтительно от около 1,0 до около 10 ммоль/кг массы тела.
Новые композиции настоящего изобретения демонстрируют хорошую переносимость; более того, их растворимость в воде является дополнительной важной особенностью, которая делает их особенно подходящими для использования в ядерном магнитном резонансе.
Диагностические композиции настоящего изобретения используют обычным образом. Композиции можно вводить пациенту, обычно теплокровному животному, как системно, так и поверхностно в орган или ткань, которые предстоит визуализировать с использованием ядерного магнитного резонанса.
Схемы анализов и аппаратуру можно найти в работах, таких как Stark, D.D., Bradley, W.G., Magnetic Resonance Imaging, Mosby Year Book, St. Louis, Mo, 1992.
Используемые условия экспериментов будут проиллюстрированы подробно в экспериментальном разделе.
Экспериментальный раздел
ПРИМЕР 1
Комплекс гадолиния с 1-деокси-1-(метиламино)-D-глуцитоловой солью [3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]холан-24-овой кислоты (1:3):
А) Метиловый эфир [3β(S),5β]-3-[[5-(1,1-диметилэтокси)-4-[бис[2-[бис[2-(1,1-диметилэтокси)-2-оксоэтил]амино]этил]амино]-1,5-диоксопентил]амино]холан-24-овой кислоты
3,6 г Метилового эфира (3β,5β)-3-аминохолан-24-овой кислоты (полученного аналогично способу, раскрытому в WO-A-95/32741: пример 5) (9,24 ммоль), 8,5 г трет-бутилового эфира N,N-бис[2-[бис[2-(1,1-диметилэтокси)-2-оксоэтил]амино]этил]-L-глутаминовой кислоты (полученного как описано в WO-A-95/32741: пример 15) (11,39 ммоль) и 1,64 г диэтилцианофосфоната (9,39 ммоль) растворяют в 160 мл ДМФ. Раствор охлаждают до 0°С, по каплям добавляют 1,28 мл Et3N (9,24 ммоль) и реакционную смесь оставляют на 30 минут при комнатной температуре. Спустя 1 час раствор упаривают при пониженном давлении, остаток смешивают с EtOAc, промывают 5% NaHCО3, а затем рассолом. Органическую фазу выделяют, сушат над Na2SО4, а затем выпаривают при пониженном давлении. Сырой продукт очищают с помощью флэш-хроматографии, получая 9,5 г нужного продукта (8,50 ммоль).
Выход: 92%
K.F.: 3,47%
| Элементный анализ | C | H | N |
| % вычислено: | 66,63 | 9,74 | 5,01 |
| % найдено:а | 67,42 | 10,08 | 5,07 |
a - после сушки при 120°С в вакууме
ТСХ: Неподвижная фаза: пластина силикагеля 60F 254 Merck
Элюент = 4:6 EtOAc/н-гексан
Детектирование: 0,5% KMnО4 в 1 M NaOH Rf= 0,46
Спектры 1Н-ЯМР, 13C-ЯМР, ИК и МС соответствуют указанной структуре.
B) Метиловый эфир [3β(S),5β]-3-[[4-карбокси-4-[бис[2-[бис(карбоксиэтил)амино]этил]амино]-1-оксобутил]амино]холан-24-овой кислоты
К перемешиваемому раствору 9,3 г соединения, полученного на стадии А) (8,32 ммоль), в 50 мл СН2Сl2 добавляют 5,1 мл CF3COOH (66,6 ммоль); спустя 10 минут при температуре 0-5°С раствор выпаривают. Остаток помещают в 50 мл CF3COOH и спустя 24 часа при комнатной температуре добавляют еще 30 мл CF3COOH для завершения реакции. Через 5 часов реакционную смесь выпаривают и остаток обрабатывают СН2Сl2, выпаривая каждый раз растворитель при пониженном давлении до получения порошка. Твердый продукт промывают Н2О, фильтруют и сушат, получая нужный продукт (6,9 г; 8,24 ммоль).
Выход 99% Т.пл: 205°С
K.F.: 7,78%
| Элементный анализ | C | H | N |
| % вычислено: | 60,27 | 8,18 | 6,69 |
| % найдено:а | 59,28 | 8,11 | 6,68 |
a - после сушки при 120°С в вакууме
ТСХ: Неподвижная фаза: пластина силикагеля 60F 254 Merck
Элюент = 6:4:1 CHCl3/MeOH/25% NH4ОH.
Детектирование: 0,5% KMnО4 в 1 M NaOH Rf= 0,28
Спектры 1Н-ЯМР, 13C-ЯМР, ИК и МС соответствуют указанной структуре.
C) [3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]холан-24-овая кислота
К суспензии 6,14 г соединения, полученного на стадии B) (7,33 ммоль), в 50 мл Н2О добавляют 50 мл 1 M NaOH (50 ммоль), поддерживая значение pH 13 с помощью pH-stat аппарата. Через 2 часа при комнатной температуре реакционную смесь подкисляют (pH 0,5) добавлением 12 M HCl, получая суспензию, которую фильтруют, промывают Н2О и сушат с получением нужного продукта (5,64 г; 6,85 ммоль).
Выход: 93% Т. пл.: 205°С
K.F.: 9,02%
| Элементный анализ | C | H | N | Cl | Na |
| % вычислено: | 59,84 | 8,08 | 6,81 | ||
| % найдено:а | 59,56 | 8,15 | 6,80 | <0,1 |
a - после сушки при 120°С в вакууме
ТСХ: Неподвижная фаза: пластина силикагеля 60F 254 Merck
Элюент = 6:4:1 CHCl3/MeOH/25% NН4OH
Детектирование: 0,5% KMnО4 в 1 M NaOH Rf= 0,25
Спектры 1Н-ЯМР, 13C-ЯМР, ИК и МС соответствуют указанной структуре.
D) Комплекс гадолиния с 1-деокси-1-(метиламино)-D-глуцитоловой солью [3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]холан-24-овой кислоты (1:3)
4,53 г соединения, полученного на стадии C) (5,5 ммоль), суспендируют в 50 мл Н2О и солюбилизируют 10 мл 2 M водного раствора меглумина (20 ммоль), получая раствор при рН 6,8. После этого в течение 1 часа добавляют 11 мл 0,5 M водного раствора GdCl3 (5,5 ммоль), поддерживая значение рН 6,8 добавлением 6,5 мл 2 М водного раствора меглумина (13 ммоль). За ходом реакции следят с помощью капиллярного электрофореза. Через 2 часа раствор фильтруют через мембрану Millipore®, фильтруют через нанофильтр и выпаривают. Остаток сушат, получая нужное соединение (6,15 г; 4,17 ммоль).
Выход: 76% Т пл.: 220°С
K.F.: 8,44%
CE (капиллярный электрофорез) анализ: 100% (площадь %)
Капилляр: кварцевое стекло 0,56 м × 50 мм с шариковой ячейкой
Напряжение: 25 кВ
Буфер: 0,05 M борат pH 9,3, 0,3 мM EDTA
Температура: 40°С
Время остановки: 20 минут
Детектирование (УФ): 200-210 нм
Инжекция: гидростатическая (50 мбар, 5 сек)
Концентрация образца: 1 мг/мл;
Прибор: Hewlett PacKard 3D HPCE
Подготовка:
| t (мин) | действие | |||||
| 2 | промывка Н2О | |||||
| 2 | промывка 0,1 M NaOH | |||||
| 1 | промывка Н2О | |||||
| 5 | промывка буфером | |||||
| 9 | начало анализа | |||||
| Элементный анализ | C | H | Gd | N | Cl | Na |
| % вычислено: | 47,65 | 7,35 | 10,06 | 6,27 | ||
| % найдено:а | 47,83 | 7,36 | 10,01 | 6,24 | <0,1 |
a - после сушки при 120°С в вакууме
Спектры ИК и МС соответствуют указанной структуре.
Нижеследующие соединения и соответствующие комплексы гадолиния получают аналогичным образом:
комплекс гадолиния с 1-деокси-1-(метиламино)-D-глуцитоловой солью [3β(S),5β,7β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-7-гидроксихолан-24-овой кислоты (1:3);
комплекс гадолиния с 1-деокси-1-(метиламино)-D-глуцитоловой солью [3α(S),5β]-3-[2-[5-[бис[2-[бис(карбоксиметил)амино]этил]амино]-5-карбоксипентил]амино]-2-оксоэтокси]холан-24-овой кислоты (1:3).
ПРИМЕР 2
Комплекс гадолиния с 1-деокси-1(метиламино)-D-глуцитоловой солью [3β(S),5β]-3-[[4-[бис[2-[бис(карбоксиметил)амино]этил]амино]-4-карбокси-1-оксобутил]амино]-12-оксохолан-24-овой кислоты (1:3):
A) Метиловый эфир (3β,5β)-3-азидо-12-оксохолан-24-овой кислоты 12,5 мл реагента Джонса [33,3 ммоль Cr(VI)] добавляют по каплям к раствору 17,8 г метилового сложного эфира (3β,5β,12α)-3-азидо-12-гидроксихолан-24-овой кислоты (41,1 ммоль) (полученного аналогично способу, описанному для метилового эфира (3β,5β,7α,12α)-3-азидо-7,12-дигидроксихолан-24-овой кислоты в WO-A-95/32741: пример 5) в ацетоне (600 мл) в течение 90 минут при комнатной температуре. Через 20 часов смесь фильтруют и раствор выпаривают. Остаток растворяют в СHCl3 (400 мл) и раствор промывают насыщенным водным NaHCO3, затем Н2О. Раствор сушат и выпаривают, получая сырой продукт, который кристаллизуют из 96% EtOH с получением 14,1 г нужного продукта (32,9 ммоль).
Выход: 84% Т.пл.:153°С
K.F.: <0,1%
[α]20D = + 83,25 (с 2,1, СHCl3)
| Элементный анализ | C | H | N |
| % вычислено: | 69,90 | 9,15 | 9,78 |
| % найдено: | 69,98 | 9,32 | 9,69 |
ТСХ: Неподвижная фаза: пластина силикагеля 60F 254 Merck
Элюент: 8:2 н-гексан/EtOAc
Детектирование: 0,5% KMnО4 в 1 M NaOH Rf=0,43
Спектры 1Н-ЯМР, 13C-ЯМР, ИК и МС соответствуют указанной структуре.
B) Метиловый эфир (3β,5β)-3-амино-12-оксохолан-24-овой кислоты
Раствор 16,4 г соединения А) (38,2 ммоль) в ТГФ (130 мл) гидрируют в присутствии 5% Pd/C (1,6 г) при