Лекарственное средство с гиполипидемическим эффектом "аторваглизин"
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и медицине, а именно к новому лекарственному средству, обладающему гиполипидемическим эффектом, и представляющему собой молекулярный комплекс аторвастатина с β-глицирризиновой кислотой при мольном соотношении аторвастатин: β-глицирризиновая кислота 1:(1-4). Изобретение обладает высокой эффективностью при значительно меньших дозах введения, чем исходный аторвастатин. 2 ил., 3 табл.
Реферат
Изобретение относится к области медицины, а именно к разработке новых лекарственных средств, обладающих гиполипидемическим эффектом.
Гиперхолестеринемия (ГХС) играет ключевую роль в патогенезе сердечно-сосудистых заболеваний (ССЗ) атеросклеротического генеза [1, 2], заболеваемость и смертность от которых продолжают оставаться чрезвычайно высокими в России [3]. В связи с этим при ишемической болезни сердца (ИБС) приоритетным является применение холестеринснижающей терапии при уровнях общего холестерина (ХС) крови >5 ммоль/л и ХС липопротеинов низкой плотности (ЛНП-ХС) >3 ммоль/л [4]. На сегодняшний день, ингибиторы 3-гидрокси-3-метил-глутарил-КоА редуктазы (3-HMG-СоА редуктазы), так называемые статины, наиболее эффективны в отношении снижения уровня ЛНП-ХС и смертности от атеросклероза и ИБС [5].
Известно, что цитохром Р-450 зависимый метаболизм статинов приводит к действию их активных метаболитов через ядерные PPARa-активаторы рецепторов, ингибированию ими фермента ГМГ-КоА-редуктазы в цепочке синтеза ХС, к снижению его внутриклеточного содержания и к увеличению количества апо-В,Е-рецепторов на мембране гепатоцитов. Как следствие, увеличивается захват атерогенных ЛНП из крови, приводящий к выраженному гипохолестеринемическому эффекту. Кроме того, повышается секреция антиатерогенных липопротеинов высокой плотности (ЛВП), снижается образование атерогенных субфракций ЛНП из субфракций липопротеинов очень низкой плотности (ЛОНП) за счет подавления их синтеза в печени, повышенного катаболизма ремнантов ЛОНП через апо-В,Е-рсцепторы [6, 7].
В настоящее время проблема ГХС и ИБС решается использованием в качестве липидснижающих средств статинов как оригинальных препаратов - ловастатин (Мевакор), симвастатин (Зокор), правастатин (Липостат), аторвастатин (Липримар), флувастатин (Лескол), так и статинов-дженериков. Характеризуя в целом имеющийся ряд статинов, необходимо отметить, что у большинства из них высокая суточная доза (20-80 мг), что обуславливает, во-первых, возникновение нежелательных побочных эффектов (повышение печеночных трансаминаз АЛТ и ACT, миалгия, миопатия с повышением КФК, рабдомиолиз) [8] и, во-вторых, высокую стоимость курса лечения этими препаратами. Поэтому актуальны поиск и создание новых статинов с более низкой суточной дозой, более безопасных, пролонгированного действия и эффективных в отношении снижения уровней атерогенного ХС.
Одним из современных подходов к созданию новых лекарственных соединений является использование известных фармаконов в виде комплексов с природными комплексонами, в частности, с глицирризиновой кислотой. Ранее было продемонстрировано усиление лекарственного эффекта бутадиена, индометацина [9] и нифедипина [10] при использовании их в комплексах с глицирризиновой кислотой.
В качестве прототипа нами выбран аторвастатин (Липримар), обычная доза которого составляет для человека массой 60 кг 10-20 мг/сутки или 160-320 мкг/кг массы тела. К недостаткам прототипа следует отнести нежелательные побочные эффекты: изменения функции печени с повышением уровня трансаминаз ACT и АЛТ в сыворотке крови, диспепсия, головные боли, кожная сыпь, мышечные боли, изменения в мышцах, связанные с повышением содержания в крови и мышечной ткани КФК, с появлением миопатии, общей слабости [8].
Задачей изобретения является создание эффективного, низкотоксичного лекарственного средства, обладающего гиполипидемическим эффектом, а также расширение ассортимента липидснижающих средств.
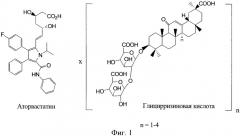
Поставленная задача решается новым химическим соединением, являющимся молекулярным комплексом аторвастатина (АС) с глицирризиновой кислотой (ГК) в соотношении 1÷(1-4), в качестве гиполипидемического средства. Для этого комплекса предлагается название «Аторваглизин» (АСГ). Комплексы аторваглизина получают смешением растворов аторвастатина и β-глицирризиновой кислоты в легкоудаляемых и нетоксичных растворителях, таких как этиловый спирт, вода, ацетон. Структура комплекса представлена на фиг.1.
Комплексообразование аторвастатина (АС) с глицирризиновой кислотой (ГК) изучено с использованием методов ядерного магнитного резонанса (ЯМР) и электронной оптической UV-Vis спектроскопии. Обнаружено, что в присутствии ГК спектр поглощения АС существенно изменяется, что указывает на образование комплекса включения (см. фиг.2).
Как видно из спектров поглощения (фиг.2) при увеличении мольного соотношения ГК:АС от 1:1 (К1) до 4:1 (К4) интенсивность полосы поглощения растет, одновременно сдвигаясь в длинноволновую область, и максимум интенсивности достигается при соотношении 4:1, дальнейшее увеличение количества ГК до мольного соотношении 6:1 (К5), ведет к снижению интенсивности полосы поглощения. Концентрация АС - 01 мМ, ГК - 0.1-0.6 мМ. Известно, что в диапазоне концентраций от 0.2 до 0.8 мМ ГК образует циклические ассоциаты, состоящие из 4-х молекул ГК. Данный результат хорошо согласуется с результатами по измерению динамической вязкости водно-спиртовых растворов ГК. Вязкость растворов ГК скачком увеличивается при [ГК]=0.1 мМ и 0.8 мМ с дальнейшим плавным увеличением, что можно связать с ростом ассоциатов. По аналогии с мицеллами, точку 0.1 мМ можно назвать критической концентрацией мицеллообразования, причем положение этой точки зависит от содержания спирта в растворе.
В спектрах ЯМР АС и ГК также наблюдаются изменения при смешении растворов АС и ГК, что указывает на наличие связывания. Заметные изменения в положении и интенсивности линий ЯМР наблюдаются для ароматических протонов АС. В спектре ГК наблюдаются сдвиги линий протонов 1-Н и 2-Н, расположенных в центральной части молекулы. Это позволяет предположить участие карбонильной группы глицирризиновой кислоты в механизме связывания с аторвастатином.
Предварительное тестирование комплексов показало их высокую гиполипидемическую активность, причем наилучшие результаты показал комплекс состава АС:ГК=1:4 (молярные доли). Одна весовая часть аторваглизина содержит в этом случае 0,1 части аторвастатина.
Проведены доклинические экспериментальные исследования по изучению эффективности по гипохолестеринемическому действию и безопасности аторваглизина in vivo в экспериментальной модели ГХС у крыс. Модель ГХС создавалась в течение 4 недель кормлением крыс per os XC 3-5% от объема пищи, животным жиром 5% от объема пищи, 0,1% 6-N-пропил-2-тиоурацилом, 0,3% таурохолатами [11, 12], далее был 2-недельный период активного вмешательства (прием гипохолестеринемических соединений - аторвастатина и 3-х доз аторваглизина).
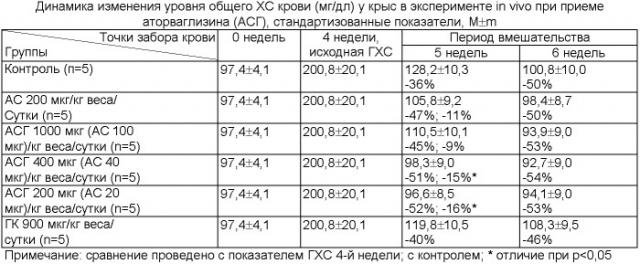
В эксперимент, общей продолжительностью 6 недель, вошли 30 самцов крыс Вистар массой 180-200 г., по 5 крыс в каждой из 6 групп (контрольная группа, группа приема АС 200 мкг/на кг веса/сутки, группы приема АСГ 1000, 400 и 200 мкг/на кг веса/сутки, группа ГК 900 мкг/кг веса/сутки). Заборы крови по 1 мл у крыс через хвостовую вену проводились в точках «0, 4, 5 и 6 недель)). Биохимическими энзиматическими методами с использованием стандартных реактивов «Biocon» (Германия) проводилось измерение в динамике эксперимента липидного профиля крови у крыс (общий ХС, ЛВП-ХС и ТГ) и активности печеночных ферментов (АЛТ, АЛТ, КФК-Nac). Все биохимические измерения проводились в 2-х параллелях.
Расчет суточной дозы ингибиторов ГМГ-КоА-редуктазы - аторвастатина и аторваглизина у крыс
Аторвастатин (АС): Обычная доза человека массой 60 кг - 10-20 мг/сутки или 160-320 мкг/кг массы тела. У крысы массой 200 г - доза 32-64 мкг/крысе в сутки. Для эксперимента установлена доза 40 мкг/крысе в сутки или 200 мкг/кг массы тела/сутки, что сопоставимо с дозой для человека - 12 мг/сутки.
Аторваглизин (АСГ): доля АС в АСГ (по молярному весу) - 1/10 часть. Дозы в эксперименте: 1) концентрация по АС меньше в 2 раза - АСГ 1000 мкг/кг массы тела/сутки (АС 100 мкг/кг массы тела/сутки); 2) концентрация по АС меньше в 5 раз - АСГ 400 мкг/кг массы тела/сутки (АС 40 мкг/кг массы тела/сутки); 3) концентрация по АС меньше в 10 раз - АСГ 200 мкг/кг массы тела/сутки (АС 20 мкг/кг массы тела/сутки).
Глицирризиновая кислота (ГК): рассчитана по содержанию ГК в максимальной дозе АСГ - 900 мкг/кг массы тела/сутки.
Результаты измерения общего ХС крови у крыс в динамике эксперимента (Пример 3) показали, что 4-недельный период создания экспериментальной модели ГХС охарактеризовался повышением уровня общего ХС крови на 106% по сравнению с исходными данными до начала эксперимента (p<0,01). За период 1- и 2-недельного активного вмешательства в контрольной группе на фоне обычной диеты уровень общего ХС крови снизился на 36 и 50% соответственно в сравнении с показателями 4-й недели (p<0,01). У крыс в группе АС и в 3-х группах АСГ (со сниженными в 2, 5 и 10 раз дозами АС в АСГ) через 1 и 2 недели вмешательства уровни общего ХС снизились сходным образом - на 45-52% и 50-54% соответственно в сравнении с показателями 4-й недели (p<0,01). Важно, что в группах АСГ со сниженной в 5 и 10 раз дозой АС в комплексе выявлено значимое снижение уровня общего ХС крови через 1 неделю приема препаратов (на 15% и 16% соответственно p<0,05) по сравнению с контрольной группой крыс. В группах собственно АС, максимальной дозы АСГ и в группе с ГК такого снижения уровня общего ХС крови отмечено не было. Полученные по уровню общего ХС крови результаты свидетельствуют, что аторваглизин после 1 недели приема в дозах, меньших в 5 и 10 раз по содержанию в нем аторвастатина, вызывает снижение уровня общего ХС крови, не только сопоставимое с подобным снижением от приема АС в среднетерапевтической дозе, но и на 15-16% значимое в сравнении с контрольной группой. Это указывает на хорошую гипохолестеринемическую эффективность АСГ и возможность снижения эффективной лекарственной дозы, имея в виду долю собственно аторвастатина в аторваглизине.
Результаты измерения уровня антиатерогенного ЛВП-ХС крови у крыс в динамике эксперимента (Пример 4) показали, что в группе АСГ максимальной дозы (сниженной до дозы АС в АСГ в 2 раза) через 1 и 2 недели приема препарата отмечена тенденция к повышению этого показателя на 13% и 12% соответственно в сравнении с исходными значениями экспериментальной ГХС, что указывает на наличие дополнительного положительного эффекта аторваглизина в случае его дозировки, содержащей аторвастатина 100 мкг/кг веса/сутки.
Результаты измерения уровней ТГ, ACT и АЛТ в крови у крыс в динамике эксперимента не выявили значимых различий между группами и в сравнении с контрольной группой крыс, что соответствует литературным данным по аторвастатину [4, 5, 8] и указывает на отсутствие гепатотоксического действия исследованных суточных доз аторваглизина.
Результаты измерения уровня активности фермента КФК крови (как маркера миотоксичности) у крыс в динамике эксперимента (Пример 5) показали, что в период 2-недельного активного вмешательства уровень КФК крови значимо не изменился в контрольной группе и в группе с глицирризиновой кислотой, а в основных экспериментальных группах крыс повысился (p<0,01). Однако у крыс, принимающих среднюю терапевтическую дозу АС, уровень КФК крови повысился после 1- и 2-й недель приема препарата на 55% и 59% соответственно (p<0,01), в то время как в 3-х группах АСГ - только на 27-33% в сравнении с показателями 4-й недели эксперимента. Проведенное сравнение между группами вмешательства и контрольной показало, что средняя терапевтическая доза АС привела к повышению уровня активности КФК крови на 53% (p<0,01). Дозы АСГ (сниженные в 2, 5 и 10 раз до дозы АС в комплексе) привели к практически в 2 раза менее выраженному повышению уровня КФК крови - всего на 25-31% (p<0,05) в сравнении с контрольной группой. Кроме того, в группах АСГ, сниженных в 5 и 10 раз до дозы АС в АСГ, уровни КФК крови были ниже на 24% и 28% соответственно (p<0,05) в сравнении с группой терапевтической дозы аторвастатина, что указывает на большую безопасность в отношении миотоксического эффекта аторваглизина в сравнении с собственно аторвастатином.
Таким образом, комплексное соединение аторваглизин в суточной дозе, в 5-10 раз меньшей (рассчитанной относительно доли аторвастатина в аторваглизине), чем терапевтическая суточная доза у собственно аторвастатина, продемонстрировало свою хорошую эффективность по гипохолестеринемическому действию (снижение уровня общего ХС крови на 15-16%), сопоставимую с эффективностью аторвастатина, и одновременно большую безопасность в связи с уменьшением на 24-28% побочного эффекта - миотоксического действия.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение комплекса аторвастина с 3-0-(2'-O-βH-20-β-олеан-12-ен-30-овой кислотой) (β-глицирризиновой кислотой) при соотношении 1:4 3,48 г (4·10-3 моля) 95%-ной β-глицирризиновой кислоты растворили в 30 мл 70% водного раствора этанола и добавили к раствору 0,6 г (1·10-3 моля) аторвастатина в 1 мл ацетона. Смесь кипятили в течение 2 ч, растворители упарили на ротационном испарителе, отвакуумировали осадок (3 ч, комнатная температура, остаточное давление 1 мм рт.ст.), получили 4.07 г (100% комплекса).
Элементный состав: определено С - 62.98%, Н - 7.59%, F - 0.44%, N - 0.75%, O - 28.24%; вычислено С - 63.09%, Н - 7.41%, F - 0.49, N - 0.72, O - 28.29%. C205H293FN2O69.
Пример 2.
Получение комплекса аморвастатина с 3-0-(2'-O-βH-20-β-олеан-12-ен-30-овой кислотой) (β-глицирризиновой кислотой) при соотношении 1:1.
0,87 г (1·10-3 моля) 95%-ной β-глицирризиновой кислоты растворили в 10 мл 70% водного раствора этанола и добавили к раствору 0,41 г (1·10-3 моля) аторвастатина в 1 мл ацетона. Смесь кипятили в течение 2 ч, растворители упарили на ротационном испарителе, отвакуумировали осадок (3 ч, комнатная температура, остаточное давление 1 мм рт.ст.), получили 1,28 г (100% комплекса).
Элементный состав: определено С - 65.52%, Н - 6.98%, F - 1.32%, N - 1.97%, O - 24.21%; вычислено С - 65.55%, Н - 6.95%, F - 1.36%, N - 2.011%, O - 24.13%; C76H96FN2O21.
Пример 3.
Пример 4.
Пример 5.
Список использованных источников
1. Anderson K.M., Castelli W.P., Levy D. Cholesterol and mortality. 30-year follow-up from the Framingham study. // J. Am. Med. Assoc., 1987; V.257: 2176-2180.
2. Steinberg D. Atherogenesis in perspective: hypercholesterolemia and inflammation as partners in crime. // Nature Medicine, 2002, 8:1211-1218.
3. Оганов Р.Г., Масленникова Г.Я. Смертность от сердечно-сосудистых и других хронических неинфекционных заболеваний среди трудоспособного населения России. // Кардиоваск. терапия профил., 2002; 3:4-8.
4. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации ВНОК. // Кардиоваск. терапия профил., 2004; 2 (прил.), 36 с.
5. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults: Executive Summary of the Third Report of the National Cholesterol Education, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). // JAMA, 2001; 285:2486-2497.
6. Fruchart J.C. PPARS as targets for antiatherosclerotic therapies. // Atherosclerosis, 2003, 6: 29-38.
7. Fruchart J.C. PPARS alpha agonists and atherosclerosis. // Atherosclerosis, 2005, 6: 125-134.
8. Puddu P., Puddu G.M., Muscari A. Current thinking in statin therapy. // Acta Cardiol., 2001; 56:225-231.
9. Толстиков Г.А., Балтина Л.А., Шульц Э.Э., Покровский А.Г. Глицирризиновая кислота. // Биоорганическая химия, 1997, Т.23. №9: 691-703.
10. Толстикова Т.Г., Сорокина И.В., Брызгалов А.О., Долгих М.П., Лифшиц Г.И., Хвостов М.В. Использование нового подхода комплексообразования известных лекарственных препаратов с растительными гликозидами в профилактике и купировании острых гипертензивных состояний. // Рациональная фармакотерапия в кардиологии, 2006, №1: 55-58.
11. Swift L.L., Soule P.D., LeQuire V.S. Hapatic Golgi lipoproteins: precursors to plasma lipoproteins in hypercholesterolemic rats. // J. Lipid Research, 1982, V.23: 962-971.
12. Salter A.M., Hayashi R., Alseeni M., Brown N.F., Bruce J. et al. Effects of hypothyroidism and high-fat feeding on mRNA concentrations for the low-density-lipoprotein receptor and on acyl-CoA: cholesterol acyltransferase activities in rat liver. // Biochem J., 1991; V.276: 825-832.
Лекарственное средство с гиполипидемическим эффектом, включающее молекулярный комплекс аторвастатина с β-глицирризиновой кислотой при мольном соотношении аторвастатин: β-глицирризиновая кислота 1:(1-4).