Многофазный фармацевтический препарат для ингибирования овуляции у млекопитающего
Иллюстрации
Показать всеМногофазный фармацевтический препарат для ингибирования овуляции у млекопитающего включает ряд отдельно упакованных и индивидуально извлекаемых суточных лекарственных единиц, размещенных в единой упаковке и предназначенных для перорального приема в течение, по меньшей мере, 21 дня подряд, при этом указанные суточные лекарственные единицы включают комбинацию эстрадиола и дроспиренона. Суточная лекарственная единица включает от 0,5 до 4 мг эстрадиола и от 2 до 4 мг дроспиренона. По меньшей мере 70% указанного дроспиренона высвобождается из указанной лекарственной единицы в течение 30 минут. Изобретение обеспечивает повышение пероральной биодоступности дроспиренона. 5 з.п. ф-лы, 5 ил.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции, включающей дроспиренон и этинилэстрадиол, способу получения раствора дроспиренона, способам ингибирования овуляции в результате введения дроспиренона, а также к применению дроспиренона и этинилэкстрадиола для ингибирования овуляции.
Предпосылки изобретения
Пероральные противозачаточные средства, содержащие комбинацию таких компонентов как гестаген и экстроген, применяют с 1960-х гг. Самые ранние противозачаточные препараты включали 21 таблетку, содержащую комбинацию активных агентов, и 7 таблеток, не содержащих активного агента, при этом количество каждого активного агента в каждой таблетке было одинаковым (так называемые "однофазные препараты"). Впоследствии были разработаны препараты, включающие таблетки, содержащие различные количества и соотношения активных агентов на протяжении цикла введения (так называемые "многофазные препараты").
Надежность контрацептива в основном обеспечивает такой компонент как гестаген. Суточная доза должна быть, по меньшей мере, минимальной от дозы, необходимой для того, чтобы применяемый гестаген эффективно ингибировал овуляцию. Эстроген способствует повышению действия гестагена по подавлению овуляции и обеспечению стабильности цикла. Со времени появления пероральных контрацептивов суточная доза гестагена снижалась благодаря разработке новых и более эффективных гестагенов, чем те, которые применялись в более ранних противозачаточных препаратах. Появилась также возможность снизить суточную дозу эстрогена.
6β,7β;15β,16β-диметилен-3-оксо-17α-прегн-4-ен-21,17-карболактон (дроспиренон) известен из DE 2652761, в котором описано его применение в качестве диуретика.
В DE 3022337 описана гестаген-подобная активность соединения и его применение в качестве противозачаточного агента при введении дозы, составляющей 0,5-50 мг дроспиренона в сутки. Также указано, что механизм действия соединения очень похож на механизм действия природного гормона желтого тела, прогестерона, и что он не вызывает повышения кровяного давления, поэтому его можно принимать женщинам с высоким давлением или потенциальным гипертоникам. Далее указано, что дроспиренон может быть введен вместе с этинилэстрадиолом в количестве, составляющем 0,03-0,05 мг в сутки.
DE 3051166 описывает применение дроспиренона для лечения гинекологических нарушений, а также для контрацепции при введении дозы, составляющей 0,5-50 мг в сутки.
ЕР 398460 описывает применение дроспиренона для лечения расстройств, индуцируемых андрогенами, альдостеронами, и гормональных нарушений, а также для контрацепции при введении дозы, составляющей 0,5-50 мг, предпочтительно 1-10 мг в сутки. Вместе с ним может быть введен этинилэстрадиол в дозе, составляющей 0,02-0,04 мг в сутки.
US 5756490 описывает препараты фармацевтических комбинаций, включающие 23 или 24 лекарственные единицы, содержащие комбинации гестагена и эстрогена, а также 4-10 лекарственных единиц, содержащих только эстроген. Дроспиренон упомянут как возможное, но не предпочтительное гестагенное соединение, а этинилэстрадиол упомянут как возможное, но не предпочтительное эстрогенное соединение.
Краткое описание изобретения
В ходе исследований, приведших к настоящему изобретению, было обнаружено, что для надежной противозачаточной активности требуется не установленная до сих пор минимальная доза дроспиренона. Подобным образом была установлена предпочтительная максимальная доза, при которой по существу могут быть предотвращены неприятные побочные эффекты, в частности избыточный диурез.
Соответственно, согласно первому аспекту, настоящее изобретение относится к фармацевтической композиции, включающей в качестве первого активного агента 6β,7β;15β,16β-диметилен-3-оксо-17α-прегн-4-ен-21,17-карболактон (дроспиренон) в количестве, соответствующем суточной дозе, после введения композиции в количестве, составляющем от около 2 до около 4 мг, и в качестве второго агента 17α-этинилэстрадиол (этинилэстрадиол) в количестве, соответствующем суточной дозе, составляющей от около 0,01 мг до около 0,05 мг, вместе с одним или несколькими фармацевтически приемлемыми носителями или добавками.
Помимо самих активных веществ предусматривается, что в соответствии с настоящим изобретением может быть использован сложный эфир или пролекарство дроспиренона, например оксииминопрегнанкарболактон, описанный в WO 98/24801. Подобным образом предусматривается, что в композицию могут быть включены сложные или простые эфиры этинилэстрадиола.
В соответствии со следующим аспектом данное изобретение относится к способу ингибирования овуляции у млекопитающих, в частности у человека, включающему введение указанному млекопитающему дроспиренона в количестве, составляющем от около 2 до около 4 мг в сутки, вместе с этинилэстрадиолом в количестве, составляющем от около 0,01 до около 0,05 мг в сутки, при этом указанные количества эффективно ингибируют овуляцию у указанного млекопитающего.
В соответствии с еще одним аспектом данное изобретение относится к применению дроспиренона в комбинации с этинилэстрадиолом для получения фармацевтического препарата, предназначенного для ингибирования овуляции у млекопитающих, в частности у человека, при этом композиция включает количество дроспиренона, соответствующее суточной дозе после введения композиции, составляющей от около 2 до около 4 мг, а также количество этинилэстрадиола, соответствующее суточной дозе после введения композиции, составляющей от около 0,01 до около 0,05 мг.
Краткое описание чертежей
Данное изобретение далее описывается со ссылкой на чертежи, на которых:
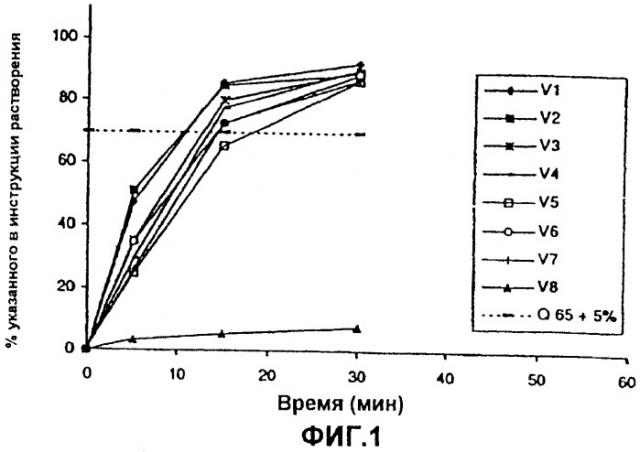
Фиг.1 - графическое изображение скорости растворения дроспиренона in vitro из ядер таблеток, при этом V1-V7 означают партии, содержащие тонкоизмельченный дроспиренон, a V8 означает партию, содержащую макрокристаллический дроспиренон;
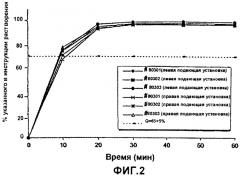
Фиг.2 - графическое изображение скорости растворения дроспиренона in vitro из ядер таблеток, при этом различные линии представляют различные аналитические партии;
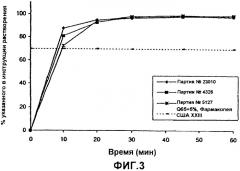
Фиг.3 - графическое изображение скорости растворения дроспиренона in vitro из покрытых пленкой таблеток, при этом различные линии представляют различные аналитические партии;
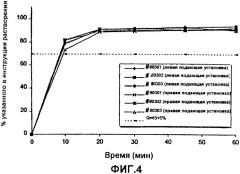
Фиг.4 - графическое изображение скорости растворения этинилэстрадиола in vitro из ядер таблеток, при этом различные линии представляют различные аналитические партии; и
Фиг.5 - графическое изображение скорости растворения этинилэстрадиола in vitro из покрытых пленкой таблеток, при этом различные линии представляют различные аналитические партии.
Подробное описание изобретения
Дроспиренон, который может быть по существу получен, в основном, как описано, например, в US 4129564 или в WO 98/06738, представляет собой умеренно растворимое в воде и водных буферах вещество при различных значениях рН. Более того, дроспиренон перегруппировывается в неактивный изомер в кислых условиях и гидролизуется в щелочных условиях. Поэтому для того, чтобы обеспечить высокую биодоступность соединения, целесообразно применять его в виде, способствующем его быстрому растворению.
Было обнаружено, что если дроспиренон в составе фармацевтической композиции тонкоизмельчен (таким образом, что частицы активного вещества имеют площадь поверхности свыше 10000 см2/г и следующее распределение размеров частиц, определяемое под микроскопом, не более 2 частиц в определенной партии с диаметром свыше 30 мкм, предпочтительно ≤20 частиц с диаметром, составляющим ≥10 мкм и ≤30 мкм), то быстрое растворение активного соединения из композиции происходит in vitro ("быстрое растворение" означает растворение, по меньшей мере, 70% в течение приблизительно 30 минут, в частности, по меньшей мере, 80% в течение приблизительно 20 минут, из таблетированного препарата, содержащего 3 мг дроспиренона в 900 мл воды при 37°С, определенное при помощи описанного в Фармакопее США XXIII лопастного метода с применением описанного в Фармакопее США прибора для определения растворения 2 при 50 об/мин). Вместо тонкого измельчения дроспиренона его можно растворять в подходящем растворителе, например метаноле или этилацетате, и распылять его на поверхность частиц инертного носителя с последующим введением частиц, содержащих на своей поверхности дроспиренон, в композицию.
Без ограничения какой-либо конкретной теорией оказывается, что скорость растворения дроспиренона in vitro связана со скоростью растворения in vitro, приводя к быстрому всасыванию дроспиренона in vitro после перорального введения соединения. Это является преимуществом, поскольку изомеризация соединения в желудочной среде и/или гидролиз в кишечнике существенно ниже, что обеспечивает высокую биодоступность соединения.
Что касается этинилэстрадиола, который также является умеренно растворимым веществом, хотя и менее чувствительным к распаду, чем дроспиренон, в условиях, преобладающих в желудочно-кишечном тракте, также целесообразно его нанесение в тонкоизмельченном виде или распыление из раствора, например в этаноле, на поверхность частиц инертного носителя. Это обеспечивает дополнительное преимущество, облегчая более равномерное распределение этинилэстрадиола в композиции, которое в противном случае было бы нелегко осуществить, поскольку этинилэстрадиол вводят в чрезвычайно небольших количествах. Если этинилэстрадиол находится в микроизмельченном виде, то он предпочтительно имеет следующее распределение размера частиц, определяемое под микроскопом: 100% частиц имеют диаметр, составляющий ≤15,0 мкм, 99% частиц - ≤12,5 мкм, 95% частиц - ≤10,0 мкм и 50% частиц - ≤3,0 мкм. Более того, отсутствуют частицы размером свыше 20 мкм, и ≤10 частиц имеют диаметр, составляющий - ≤15 мкм и ≤20 мкм.
Для того, чтобы получить более высокую скорость растворения, предпочтительно включение носителей или добавок, способствующих растворению обоих активных веществ. Примеры таких носителей и наполнителей включают вещества, легко растворимые в воде, такие как производные целлюлозы, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, желатинизированный крахмал, желатин или поливинилпирролидон. В частности, представляется, что поливинилпирролидон особенно способствует растворению.
Композиция в соответствии с данным изобретением предпочтительно включает дроспиренон в количестве, соответствующем суточной дозе, составляющей приблизительно от 2,5 до 3,5 мг, в частности около 3 мг. Количество этинилэстрадиола предпочтительно соответствует суточной дозе, составляющей от около 0,015 до около 0,04 мг, в частности от около 0,015 мг до около 0,03 мг. Более конкретно, данная композиция включает количество дроспиренона, соответствующее суточной дозе, составляющей от около 3,0 до около 3,5 мг, и этинилэстрадиол в количестве, соответствующем от около 0,015 до около 0,03 мг.
Было обнаружено, что помимо своей способности ингибировать овуляцию композиция в соответствии с данным изобретением обладает ярко выраженными противоандрогенными свойствами и поэтому может быть использована для профилактики или лечения индуцируемых андрогенами расстройств, в частности акне. Такое применение может быть независимым или сопутствующим ее вышеописанному применению в качестве контрацептива. Более того, поскольку дроспиренон является антагонистом альдостерона, он обладает мочегонными свойствами и поэтому подходит для противодействия свойствам этинилэстрадиола по удерживанию воды.
В соответствии с конкретным вариантом его осуществления данное изобретение относится к фармацевтическому препарату, состоящему из ряда отдельно упакованных и индивидуально извлекаемых суточных лекарственных единиц, размещенных в единой упаковке и предназначенных для перорального приема в течение, по меньшей мере, 21 дня подряд, в которой каждая из указанных суточных лекарственных единиц включает комбинацию дроспиренона в количестве, составляющем от около 2 до около 4 мг, и этинилэстрадиола в количестве, составляющем от около 0,01 до около 0,05 мг.
В соответствии с одним из вариантов осуществления препарат дополнительно включает 7 и менее указанных суточных лекарственных единиц, не содержащих активного агента. Альтернативно, схема приема препарата может включать период, составляющий 7 дней или менее, не требующий приема лекарственного препарата. Однако с целью соблюдения схемы целесообразно включать в упаковку соответствующее количество пустышек, в таком случае общее количество суточных лекарственных единиц препарата составит, по меньшей мере, 28. Включение пустышек или свободных от препарата дней затем вызовет возобновление кровотечения.
Препарат может представлять собой однофазную композицию, то есть препарат, в котором количество каждого активного агента остается постоянным на протяжении всего, по меньшей мере, 21-дневного периода, либо количество одного или обоих активных агентов может варьироваться на протяжении, по меньшей мере, 21-дневного периода, образуя многофазный препарат, например двух- или трехфазный препарат, по существу описанный, к примеру, в ЕР 148724. При получении многофазного препарата вместо этинилэстрадиола может быть включен природный эстроген, такой как эстрадиол, например, в количестве, составляющем от около 0,5 до около 4 мг в сутки.
В подходящих вариантах осуществления данного препарата количество суточных лекарственных единиц, включающих сочетание дроспиренона и этинилэстрадиола, может составлять 21, 22, 23 или 24, а количество суточных лекарственных единиц, не содержащих активного агента, может составлять 7, 6, 5 или 4, соответственно. В соответствии с другим вариантом осуществления данного препарата количество суточных лекарственных единиц, включающих комбинацию дроспиренона и этинилэстрадиола, составляет 28 или кратное 28, например 2-4, в частности 2 или 3 раза по 28.
В соответствии с альтернативным вариантом его осуществления данное изобретение относится к противозачаточному препарату, включающему ряд отдельно упакованных и индивидуально извлекаемых суточных лекарственных единиц, размещенных в единой упаковке и предназначенных для перорального приема в течение, по меньшей мере, 28 дней подряд, в которой, по меньшей мере, 21 указанная суточная лекарственная единица включает комбинацию дроспиренона в количестве, составляющем от около 2 до около 4 мг, и этинилэстрадиола в количестве, составляющем от около 0,01 до около 0,05 мг, и в которой 7 и менее указанных суточных лекарственных единиц содержат только этинилэстрадиол в количестве, составляющем приблизительно от около 0,01 до около 0,05 мг.
Включение подходящего количества лекарственных единиц, содержащих только этинилэстрадиол, может обеспечить высокую контрацептивную надежность, низкое фолликулярное развитие и удовлетворительный контроль над циклом с незначительным кровотечением между менструациями или его отсутствием.
В данном случае количество каждого активного агента в препарате также может оставаться постоянным на протяжении всего, по меньшей мере, 21-дневного периода (двухфазный препарат), либо количество одного или обоих активных агентов может варьироваться на протяжении, по меньшей мере, 21-дневного периода, образуя многофазный препарат, например трех- или четырехфазный препарат, по существу описанный, например, в ЕР 148724. При получении многофазного препарата вместо этинилэстрадиола может быть включен природный эстроген, такой как эстрадиол, например, в количестве, составляющем от около 0,5 до около 4 мг в сутки.
В подходящих вариантах данного препарата количество суточных лекарственных единиц, включающих сочетание дроспиренона и этинилэстрадиола, может составлять 21, 22, 23 или 24, а количество суточных лекарственных единиц, содержащих только этинилэстрадиол, может составлять 7, 6, 5 или 4, соответственно.
В соответствии с одним из вариантов осуществления данного способа ингибирования овуляции указанный способ включает введение указанному млекопитающему каждый день из, по меньшей мере, 21 дня подряд суточной лекарственной дозы, включающей сочетание дроспиренона в количестве, составляющем от около 2 до около 4 мг, и этинилэстрадиола в количестве, составляющем от около 0,01 до около 0,05 мг, с последующим введением каждый день из 7 и менее дней подряд суточной лекарственной единицы, не содержащей активного агента, либо, наоборот, отсутствием введения лекарственных единиц в течение 7 дней и менее.
В подходящих вариантах осуществления данного способа суточные лекарственные единицы, включающие комбинацию дроспиренона и этинилэстрадиола, могут быть введены в течение 21, 22, 23 или 24 дней подряд, а суточные лекарственные единицы, не содержащие активного агента, могут затем быть введены в течение 7, 6, 5 или 4 дней подряд, соответственно. Более того, суточные лекарственные дозы, включающие комбинацию дроспиренона и этинилэстрадиола, могут быть введены в течение 28 дней подряд. В соответствии с одним из вариантов данного осуществления способа суточные лекарственные единицы, включающие комбинацию дроспиренона и этинилэстрадиола, вводят в течение 2-4, предпочтительно 2 или 3 раза по 28 дней подряд с последующим введением суточных лекарственных единиц, включающих сочетание дроспиренона и этинилэстрадиола, в течение 21, 22, 23 или 24 дней подряд, а затем введением суточных лекарственных единиц, не содержащих активного агента, или отсутствием введения суточных лекарственных единиц в течение 7, 6, 5 или 4 дней подряд.
Альтернативно, данный способ включает введение каждый день из, по меньшей мере, 21 дня подряд суточной лекарственной дозы, включающей комбинацию дроспиренона в количестве, составляющем от около 2 до около 4 мг, и этинилэстрадиола в количестве, составляющем от около 0,01 до около 0,05 мг, с последующим введением каждый день из 7 и менее дней подряд суточной лекарственной дозы, содержащей только этинилэстрадиол в количестве, составляющем от около 0,01 до около 0,05 мг.
В соответствии с данным альтернативным способом суточные лекарственные дозы, содержащие комбинацию дроспиренона и этинилэстрадиола, могут быть подходящим образом введены в течение 21, 22, 23 или 24 дней подряд, а суточные лекарственные дозы, включающие только этинилэстрадиол, затем могут быть введены в течение 7, 6, 5 или 4 дней подряд, соответственно. В соответствии со следующим вариантом осуществления данного способа суточные лекарственные дозы, содержащие комбинацию дроспиренона и этинилэстрадиола, вводят в течение 2-4, предпочтительно 2 или 3 раз, по 28 дней подряд с последующим введением суточных лекарственных доз, включающих комбинацию дроспиренона и этинилэстрадиола, в течение 21 дня подряд, а затем введение суточных лекарственных доз, включающих только этинилэстрадиол, в течение 7 дней подряд.
При использовании в соответствии с данным изобретением фармацевтический препарат может иметь вид ряда отдельно упакованных и по отдельности доставаемых суточных лекарственных единиц, размещенных в единой упаковке и предназначенных для перорального введения в течение, по меньшей мере, 21 дня подряд, при этом каждая из указанных суточных лекарственных единиц включает комбинацию дроспиренона в количестве, составляющем от около 2 мг до около 4 мг, и этинилэстрадиол в количестве, составляющем от около 0,01 до около 0,05 мг.
Как указано выше, упаковка может также включать 7 или менее суточных лекарственных единиц, не содержащих активного агента (либо может содержать 7 и менее пустых "мест", например, в виде пустых ячеек в вытяжной упаковке, обозначая дни, в которые не происходит введение суточных лекарственных доз).
Альтернативно, фармацевтический препарат может иметь вид ряда отдельно упакованных и индивидуально извлекаемых суточных лекарственных единиц, размещенных в единой упаковке и предназначенных для перорального введения в течение, по меньшей мере, 28 дней подряд, в которой, по меньшей мере, 21 указанная суточная лекарственная единица включает комбинацию дроспиренона в количестве, составляющем от около 2 до около 4 мг, и этинилэстрадиола в количестве, составляющем от около 0,01 до около 0,05 мг, при этом указанная единая упаковка дополнительно включает 7 и менее суточных лекарственных доз, содержащих только этинилэстрадиол в количестве, составляющем от около 0,01 до около 0,05 мг.
Композиция в соответствии с данным изобретением может быть получена любым способом, известным в фармацевтической области. В частности, как указано выше, композиция может быть получена способом, предусматривающим присутствие дроспиренона и, при желании, этинилэстрадиола в тонкоизмельченном виде в указанной дозированной лекарственной форме, либо распылена из раствора на частицы инертного носителя в смеси с одним или несколькими фармацевтически приемлемыми добавками, способствующими растворению дроспиренона и этинилэстрадиола таким образом, чтобы обеспечить быстрое растворение дроспиренона и, предпочтительно, этинилэстрадиола после перорального введения. Примеры подходящих добавок включают наполнители, например сахара, такие как лактоза, глюкоза или сахароза, сахарные спирты, такие как маннит, сорбит или ксилит, крахмал, такой как пшеничный, кукурузный или картофельный крахмал, модифицированный крахмал или натриевый гликолят крахмала, смазывающие агенты, такие как тальк, стеарат магния, стеарат кальция, коллоидный диоксид кремния или стеариновая кислота, а также связующие, такие как поливинилпирролидон, производные целлюлозы, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза или желатин, для получения пероральных лекарственных форм, таких как таблетки, пилюли или капсулы.
На таблетки при необходимости может быть нанесен подходящий пленкообразующий агент, например гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза или этилцеллюлоза, к которой может быть необязательно добавлена подходящая добавка, например мягчитель, такой как глицерин, пропиленгликоль, диэтилфталат или триацетатглицерин, наполнитель, такой как сахароза, сорбит, ксилит, глюкоза или лактоза, краситель, такой как гидроксид титана, и т.д.
Данная композиция также может быть получена в жидком виде, например в виде раствора, суспензии или эмульсии, вместе с обычными разбавителями или добавками способом, известным per se в фармацевтической области.
Единая упаковка, содержащая вышеописанные суточные лекарственные дозы, может быть получена способом, аналогичным способу получения других контрацептивов для перорального использования. Это может быть, к примеру, обычная блистерная упаковка или любая другая упаковка, пригодная для данной цели, например упаковка, содержащая нужное количество лекарственных единиц (в данном случае, по меньшей мере, 21, либо, для особых случаев, 28 или кратное 28) в запечатанной блистерной упаковке с основой из картона, бумаги, фольги или пластмассы, покрытой подходящей оболочкой. Каждая ячейка блистерной упаковки может быть для удобства пронумерована или помечена каким-либо другим образом, например, начиная с первой из, по меньшей мере, 21 лекарственной дозы, содержащей комбинацию дроспиренона и этинилэстрадиола, за которыми следуют 7 и менее пустых ячеек или 7 и менее лекарственных доз, не содержащих активного агента, либо содержащих только этинилэстрадиол (хотя нумерация может также начинаться с первой из 7 и менее лекарственных доз, содержащих только этинилэстрадиол).
Также предусматривается, что данная композиция может быть в виде состава для парентерального применения, такого как подкожный имплантат или трансдермальный состав. Для получения имплантатов активные агенты могут быть соответствующим образом соединены с одним или несколькими полимерами, которые при использовании постепенно разъедаются или разрушаются, например силиконовые полимеры; этиленвинилацетат, полиэтилен или полипропилен.
Что касается трансдермальных составов, то они могут быть получены в виде матриц или мембран, либо в виде жидких или вязких составов в масле или гидрогелях. При получении трансдермальных пластырей необходимо применять клеящее вещество, совместимое с кожей, такое как полиакрилат, силиконовый клей или полиизобутилен, а также пленку, изготовленную, например, из полиэтилена, полипропилена, этиленвинилацетата, поливинилхлорида, поливинилиденхлорида или полиэфира, и удаляемую защитную пленку, изготовленную, например, из полиэфра, либо покрытую силиконом или фторполимером. Для получения трансдермальных растворов или гелей могут быть использованы вода или органические растворители, либо их смеси. Трансдермальные гели могут дополнительно содержать один или несколько подходящих желирующих агентов или загустителей, таких как силикон, трагакант, крахмал или его производные, целлюлоза или ее производные, либо полиакриловая кислота или ее производные. Трансдермальные составы могут также соответственно включать одно или несколько веществ, усилителей абсорбции через кожу, таких как соли желчных кислот или их производные, и/или фосфолипиды. Подходящие трансдермальные составы могут, к примеру, быть получены способом, аналогичным способу, описанному в WO 94/04157 для 3-кетодезогестрела. Альтернативно, трансдермальные составы могут быть получены в соответствии со способом, описанным, например, в B.W.Barry, "Dermatological Formulations, Percutaneous Absorption", Marcel Dekker Inc., New York-Basel, 1983, или Y.W.Chien, "Transdermal Controlled Systemic Medications", Marcel Dekker Inc., New York-Basel, 1987.
Настоящее изобретение далее описано в нижеследующих примерах, никоим образом не ограничивающих объем изобретения, как оно заявлено.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пример 1
Получение таблеток, содержащих дроспиренон и этинилэстрадиол
Получали ядра таблеток, имеющие следующий состав:
| тонкоизмельченный дроспиренон | 3,00 мг |
| тонкоизмельченный этинилэстрадиол | 0,03 мг |
| моногидрат лактозы | 48,17 мг |
| кукурузный крахмал | 14,40 мг |
| модифицированный крахмал | 9,60 мг |
| поливинилпирролидон 25000 | 4,00 мг |
| стеарат магния | 0,80 мг, |
загружая в гранулятор с псевдоожиженным слоем 31,68 кг кукурузного крахмала, 21,12 кг модифицированного крахмала, 6,60 кг тонкоизмельченного дроспиренона, 0,066 кг тонкоизмельченного этинилэстрадиола и 105,974 кг моногидрата лактозы и активируя псевдоожиженный слой. Водный раствор 8,80 кг поливинилпирролидона 25000 в 46,20 кг очищенной воды непрерывно распыляли на псевдоожиженный слой во время сушки, нагревая поток воздуха псевдоожиженного слоя. В конце процесса 1,76 кг стеарата магния всасывали в гранулятор и смешивали с гранулами, поддерживая псевдоожиженный слой. Полученный гранулят прессовали в ядра для таблеток путем прессования с применением ротационного таблеточного пресса.
2,22464 кг гидроксипропилметилцеллюлозы и 0,44528 кг макрогола 6000 растворяли в 14,67 кг очищенной воды. 0,44528 кг талька, 1,22430 кг диоксида титана и 0,06050 кг пигмента оксида железа суспендировали в 10,26 кг очищенной воды с перемешиванием и гомогенизацией. Раствор и суспензию объединяли и применяли для покрытия ядер таблеток путем непрерывного нанесения суспензии для покрытия в машине для нанесения покрытий.
Пример 2
Растворение дроспиренона из таблеток
Скорость растворения дроспиренона из таблеток, полученных в примере 1, определяли при помощи описанного в Фармакопее США XXIII лопастного метода с применением описанного в Фармакопее США прибора для определения растворения 2, включающего 6 закрытых стеклянных сосудов и 6 лопастей. Таблетки помещали в 900 мл воды при температуре 37°С (±0,5°С) и перемешивали при 50 об/мин.
Результаты представлены на фиг.1, 2 и 4. Из фиг.1 понятно, что партия, обозначенная как V8 и содержащая макрокристаллический дроспиренон (но в других отношениях идентичная таблеткам, полученным в примере 1), имела чрезвычайно низкую скорость растворения дроспиренона, в то время как все партии, содержащие тонкоизмельченный дроспиренон, имели скорость растворения, составляющую более 70% в течение 30 минут.
Фиг.2 и фиг.4 представляют результаты растворения дроспиренона из ядер таблеток и покрытых пленкой таблеток, соответственно. В большинстве случаев более 70% активного агента растворялось в течение 30 минут. Таким образом, пленочное покрытие не оказывало существенного влияния на скорость растворения.
Пример 3
Скорость растворения этинилэстрадиола из таблеток in vitro
Скорость растворения этинилэстрадиола из таблеток, полученных в соответствии с описанием, приведенным в примере 1, определяли при помощи описанного в Фармакопее США лопастного метода в соответствии с описанием, приведенным в примере 2 для дроспиренона. Результаты представлены на фиг.3 и 5, демонстрируя скорости растворения ядер таблеток и покрытых пленкой таблеток, соответственно. В обоих случаях более 70% активного агента растворялось в течение 30 минут. Таким образом, пленочное покрытие не оказывало существенного влияния на скорость растворения.
Пример 4
Биодоступность дроспиренона и этинилэстрадиола из таблеток, содержащих 3 мг дроспиренона и 0.03 мг этинилэстрадиола
В открытом перекрестном исследовании принимали участие 42 здоровые женщины в возрасте от 18 до 35 лет после получения их письменного согласия. Целью исследования было определение относительной биодоступности дроспиренона и этинилэстрадиола из таблетки, содержащей 3 мг дроспиренона и 0,03 мг этинилэстрадиола по сравнению с пероральной суспензией, содержащей 6 мг дроспиренона и 0,06 мг этиниолэстрадиола на флакон.
Биодоступность определяли, используя в качестве параметров концентрацию в сыворотке каждого активного агента. По сравнению с пероральной суспензией относительная доступность дроспиренона и этинилэстрадиола из таблеток составляла 107 и 117%, соответственно. Поэтому был сделан вывод о том, что как дроспиренон, так и этинилэстрадиол полностью высвобождаются из таблеток in vivo.
Абсолютная биодоступность дроспиренона, определенная в результате двух исследований, составляла 76±13% после перорального введения 2 мг дроспиренона 8 молодым здоровым женщинам и 85±24% после перорального введения микрокристаллической суспензии, содержащей 3,13 мг дроспиренона, 6 женщинам, находящимся в постклимактерическом периоде.
Пероральную биодоступность этинилэстрадиола определяли по результатам нескольких исследований. Полученные средние величины, составляющие от 36 до 59%, опубликованные в отчетах, свидетельствовали о достижении эффекта после первого приема.
Пример 5
Противозачаточная эффективность составов, содержащих дроспиренон и этинилэстрадиол
Открытое рандомизированное испытание, в котором принимали участие 52 женщины-добровольца в возрасте 20-35 лет, давшие письменное согласие, включало 1 цикл предварительной обработки, 3 основных цикла с приемом двух различных таблеток, содержащих 2 и 3 мг дроспиренона, соответственно, но в других отношениях, соответствующих таблеткам, полученным в примере 1, а также фазу последующего врачебного наблюдения. Обработке предшествовала фаза вымывания, составляющая 1 месяц.
Через определенные промежутки времени определяли выбранные центральные и периферические параметры: LH (лютеинизирующий гормон), FSH (фолликулостимулирующий гормон), 17β-эстрадиол, прогестерон, шейный показатель, кристаллизацию слизи, феномен папоротника. Функцию яичников проверяли ультразвуком. Кроме того, определяли SHBG, CBG (кортикостероидсвязывающий глобулин), пролактин, общее содержание тестостерона, андростенедион, DHEA-S и выбранные метаболические параметры (содержание в сыворотке глюкозы, триглицерида, холестерина, ЛВМ, ЛНП). Записывали показатели давления крови, частоты сердечных сокращений, массы тела и контроля над циклом.
Результаты исследования показали, что как LH, так и FSH отчетливо подавлялись обоими исследуемыми препаратами. Соответственно, на протяжении всех трех циклов обработки секреция эстрадиола и прогестерона сильно снизилась, за исключением 3 добровольцев, получавших препарат, содержащий 2 мг дроспиренона. Полученный результат, в принципе, был подтвержден дополнительными ультразвуковыми исследованиями. Созревание фолликула происходило в нескольких случаях при приеме обоих исследуемых препаратов. Несмотря на то, что при приеме препарата, содержащего 2 мг дроспиренона, диагностировали три случая овуляции (один из которых был описан как "двусмысленный", а другой - как "ошибка при приеме таблетки"), не было установлено статистической разницы (р>0,05) между двумя исследуемыми препаратами в отношении гормонов LH, FSH, эстрадиола и прогестерона, а также параметра "овуляция во время циклов обработки". Поддерживаемая гормонами цервикальная функция была сильно снижена, шейный показатель ("spinnbarkeit") и кристаллизуемость цервикальной слизи также сильно снижались в результате приема обоих исследуемых препаратов. Пролактин возрастал минимально и SHBg и CBg увеличивались для обоих препаратов. Количество триглицеридов и уровень ЛВП при приеме обоих препаратов повышались, в то время как уровень ЛНП понижался. Общее содержание холестерина оставалось в основном неизменным в обеих исследуемых группах. Толерантность к принимаемой перорально глюкозе оставалась по существу неизменной либо слегка снижалась. Содержание тестостерона, андростендиона и DHEA-S снижалось минимально.
Субъективная и объективная толерантность были хорошими в обеих группах. Так же обстояло дело с контролем цикла, за исключением первого цикла при приеме 2 мг дроспиренона. Давление крови, частота сердечных сокращений и масса тела в большинстве случаев оставались постоянными или проявляли небольшую тенденцию к снижению.
После трех месяцев приема были сделаны выводы о том, что:
- оба исследуемых препарата являются одинаково хорошими в отношении субъективной и объективной толерантности.
При использовании обоих препаратов не наблюдалось негативных метаболических явлений. ЛВП испытывали положительное действие в смысле повышения.
Полученные результаты подтвердили результаты более ранних исследований о том, что 2 мг препарат дроспиренона находится в пороговой области ингибирования овуляции, в то время как 3 мг препарат дроспиренона имеет ярко выраженный эффект по ингибированию овуляции во всех исследованных случаях.
1. Многофазный фармацевтический препарат для ингибирования овуляции у млекопитающего, состоящий из ряда отдельно упакованных и индивидуально извлекаемых суточных лекарственных единиц, размещенных в единой упаковке и предназначенных для перорального приема в течение по меньшей мере 21 дня подряд, где указанная суточная лекарственная единица включает от 0,5 до 4 мг эстрадиола и от 2 до 4 мг дроспиренона и где по меньшей мере 70% указанного дроспиренона растворяется из указанной лекарственной единицы в течение 30 мин, где растворение определяют в соответствии с описанным в Фармакопее США XXIII лопастным методом II с использованием воды при 37°С в качестве среды растворения и скорости перемешивания 50 об/мин.
2. Многофазный фармацевтический препарат по п.1, где указанный дроспиренон находится в тонкоизмельченной форме.
3. Многофазный фармацевтический препарат по п.1, где указанный дроспиренон имеет площадь поверхности свыше 10000 см2/г.
4. Многофазный фармацевтический препарат по п.1, где указанный дроспиренон распыляется из раствора дроспиренона на частицы инертного носителя.
5. Многофазный фармацевтический препарат по любому из предыдущих пунктов, где указанная лекарственная единица включает от 2,5 до 3,5 мг дроспиренона.
6. Многофазный фармацевтический препарат по п.5, где указанная лекарственная единица включает около 3 мг дроспиренона.