Штаммы дрожжей, продуцирующие холестерин, и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к генетически модифицированным дрожжам, автономно продуцирующим холестерин исходя из простого источника углерода. Данные дрожжи экспрессируют ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу, а фермент стерол 24-С-метилтрансфераза у них инактивирован. Продукция холестерина у них равна или превышает 20% от всех продуцируемых стеринов. Кроме того, предлагается способ получения холестерина и применение штамма дрожжей по изобретению для получения не меченого и меченого холестерина. Данное изобретение позволяет получать безопасный с санитарной точки зрения холестерин в больших количествах. 5 н. и 7 з.п. ф-лы, 13 ил., 1 табл.
Реферат
Настоящее изобретение относится к продуцированию холестерина у организмов царства Fungi.
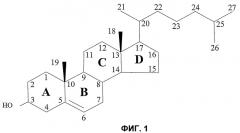
Холестерин (см. фиг.1) является наиважнейшим животным стерином. Он представляет собой фундаментальный компонент клеточных мембран, текучесть которых он регулирует, и присутствует во всех животных тканях и особенно в нервной ткани.
Холестерин является продуктом, представляющим большой промышленный интерес. Так, он используется обычно в косметической промышленности. Он также используется в фармацевтической промышленности, например, для введения лекарственных средств ("Drug delivery"), а также в клеточной культуре.
Холестерин используется также в промышленном синтезе витамина D3. Этот витамин используется затем для дополнения питания человека (например, в молочных продуктах) и животных. Холестерин также предпочтительно используют как добавку к пище животных, в частности к пище, предназначенной для искусственно выращиваемых креветок.
В настоящее время большинство выпускаемого на продажу холестерина экстрагируют из животной ткани (ничтожно малое количество получают химическим синтезом). Два больших источника, используемых для экстракции холестерина: спинной мозг крупного рогатого скота и ланолин, который является природным жировым материалом овечьей шерсти.
Использование животной ткани как исходного продукта связано с определенными проблемами. Таким образом, недавние проблемы, связанные с передачей приона, ответственного за овечью трясучку, крупному рогатому скоту (заболевание, названное ESB (губчатая энцефалопатия крупного рогатого скота) у крупного рогатого скота), напомнили о необходимости соблюдения осторожности в процессе использования животной ткани в качестве сырья. Между тем, несмотря на принятые меры, риск передачи патогенного фактора не может быть абсолютно исключенным, и было бы крайне желательно, таким образом, располагать источником холестерина, не происходящим из животной ткани.
Настоящее изобретение имеет целью предоставить источник холестерина, обильный и безопасный с санитарной точки зрения. Авторы изобретения неожиданно показали, что возможно изменить естественную продукцию эргостерола у Fungi таким образом, чтобы продуцировался холестерин.
Общее описание изобретения
Первый аспект изобретения касается организма царства Fungi, продуцирующий автономно холестерин.
Второй аспект изобретения касается организма царства Fungi, такого как определенный выше, отличающегося тем, что этот последний генетически модифицирован.
Третий аспект изобретения касается организма царства Fungi, такого как определенный выше, отличающегося тем, что этот последний продуцирует холестерин на основе простого источника углерода.
Изобретение касается также организма царства Fungi, такого как определенный выше, экспрессирующего ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу. В частности, изобретение касается организма, такого как определенный выше, в котором инактивирован фермент стерол 24-C-метилтрансфераза и/или инактивирован фермент C-22 стерол десатураза.
Другой аспект изобретения касается организма царства Fungi, такого как определенный выше, отличающегося тем, что экспрессию ферментов 7-дегидрохолестерин редуктазы и 3β-гидроксистерин Δ24-редуктазы осуществляют за счет трансформации организма.
Изобретение касается также организма царства Fungi, такого как определенный выше, отличающегося тем, что инактивацию фермента стерол 24-С-метилтрансферазы осуществляют за счет генетической инактивации, и/или инактивацию фермента C-22 стерол десатуразы осуществляют за счет генетической инактивации.
Другой аспект изобретения касается организма царства Fungi, такого как определенный выше, отличающегося тем, что его выбирают из типа Ascomycete, в частности из подтипа Saccharomycotina, предпочтительно, из класса Saccharomycetes или Schizosaccharomycetes, более предпочтительно, из порядка Saccharomycetales или Schizosaccharomycetales, еще более предпочтительно, из семейства Saccharomycetaceae или Schizosaccharomycetaceae, еще более предпочтительно, из рода Saccharomyces или Schizosaccharomyces.
Другой аспект изобретения касается организма царства Fungi, такого как определенный выше, отличающегося тем, что он представляет собой дрожжи вида Saccharomyces cerevisiae или Schizosaccharomyces pombe.
Изобретение касается также способа получения холестерина неживотного происхождения, включающего культивирование организма, такого как определенный выше.
В частности, этот способ отличается тем, что после стадии культивирования организма следует стадия экстракции холестерина. Предпочтительно, экстракцию холестерина осуществляют с использованием растворителя, не смешивающегося с водой.
В частности, способ, такой как определенный выше, отличается тем, что перед экстракцией холестерина осуществляют стадию омыления. Предпочтительно, способ, такой как определенный выше, отличается тем, что перед омылением или экстракцией холестерина осуществляют стадию механического дробления клеток.
Другой аспект изобретения касается применения организма царства Fungi, такого как определенный выше, для получения холестерина или одного из промежуточных продуктов его метаболизма, или смеси стеринов, меченых 13C или 14С.
Изобретение также относится к способу получения холестерина или одного из промежуточных продуктов его метаболизма, или смеси стеринов, меченых 13C или 14C, включающему следующие стадии:
- культивирование организма царства Fungi, такого как определено выше, на субстрате, меченом 13C или 14C, и
- экстракция указанного холестерина или одного из его метаболизма промежуточных продуктов, или из смеси стеринов.
Изобретение касается также способа получения изотопной смеси холестерина, промежуточных продуктов или метаболитов холестерина, меченых в различных положениях при помощи изотопных маркеров, включающего культивирование организма царства Fungi, такого как определено выше, на меченом субстрате, затем на немеченом субстрате, причем продолжительность культивирования на каждом из этих субстратов выбирают таким образом, чтобы получить определенный изотопный профиль. Изобретение касается также образца молекул холестерина, промежуточных продуктов или метаболитов холестерина, меченых в различных положениях при помощи изотопных маркеров, имеющего определенный изотопный профиль, и который может быть получен этим способом.
Изобретение касается также композиции, содержащей в качестве маркера для отслеживания происхождения изотопную смесь холестерина, промежуточных продуктов или метаболитов холестерина, меченых в различных положениях при помощи изотопных маркеров и имеющих определенный изотопный профиль. В частности, эта композиция предназначена для области питания или терапии человека или животных.
Подробное описание изобретения
Настоящее изобретение касается продукции холестерина у организмов царства Fungi. У Fungi холестерин не встречается в естественном состоянии, поскольку он является животным стерином. Основным стерином клеточных мембран этих организмов является эргостерол.
Настоящее изобретение позволяет осуществить синтез холестерина путем размножения Fungi в присутствии простого источника углерода. Метод, предложенный в настоящем изобретении, позволяет таким образом получить большое количество холестерина, при низкой стоимости, так как в способе осуществляют культивирование организмов царства Fungi и добавление простого источника углерода, легко доступного в продаже.
Под простым источником углерода согласно настоящему изобретению понимают источники углерода, используемые специалистом для нормального роста fungus, а в частности дрожжей. В частности, под такими источниками понимают различные усваиваемые сахара, такие как глюкоза, галактоза или сахароза, или патоки, или субпродукты этих сахаров. Особенно предпочтительным простым источником углерода является этанол и глицерин.
Тот факт, что продуцирование осуществляется автономно, означает, что не является необходимым добавлять субстраты для получения холестерина, но что организм может его продуцировать исходя только из первоначального простого источника углерода. Также ясно, что штамм может продуцировать холестерин путем использования субстрата, располагающегося выше в пути метаболизма, при условии, что штамм организма согласно настоящему изобретению содержит все гены, необходимые для полного осуществления метаболического пути получения холестерина.
Изобретение касается, в частности, генетически модифицированного организма царства Fungi (Fungus), автономно продуцирующего холестерин, исходя из простого источника углерода.
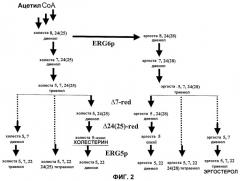
Некоторое количество генетических изменений у fungus могут быть осуществлены для того, чтобы изменить естественный метаболический путь получения эргостерола таким образом, чтобы продуцировался холестерин. Настоящее изобретение касается таким образом генетически модифицированного организма царства Fungi, экспрессирующего ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу. Измененный таким образом штамм организма царства Fungi продуцирует холестерин. Заявитель смог составить модель благодаря полученным результатам (см. экспериментальную часть настоящей заявки), пути метаболизма, приводящего к эргостеролу и к некоторым из его производных (см., фиг.2). Экспрессия ферментов 7-дегидрохолестерин-редуктазы и 3β-гидроксистерин Δ24-редуктазы у fungus S. cerevisiae может обеспечить продукцию холестерина, частично изменяя путь биосинтеза эргостерола.
Фермент 7-дегидрохолестерин редуктаза несет номер EC: 1.3.1.21 в международной классификации ферментов (Enzyme Classification). Ее также называют дельта 5,7-стерол-дельта 7-редуктазой, 7-DHC- редуктазой или Стерол-дельта 7-редуктазой, а также дельта 7-стерол-редуктазой, дельта 7Red, дельта 7-редуктазой или Δ7-редуктазой в следующей части этого документа. Этот фермент катализирует в естественном состоянии у растений, например НАДФН-зависимое восстановление 5,7-холестадиенола до дельта-5-холестенола или восстановление промежуточных стериновых продуктов, имеющих двойную связь в положении 7-8 (Taton and Rahier, 1991). Ген, кодирующий фермент 7-дегидрохолестерин-редуктазу, был впервые выделен у растения Arabidopsis thaliana, выделение соответствующего гена и экспрессия этого фермента у дрожжей Saccharomyces cerevisiae описаны в патенте EP 727489. Последовательности этого гена и белка доступны под следующим номером доступа в GenBank: U49398 (Lecain et al., 1996).
Некоторое число гомологов этого гена были описаны у других видов. Таким гомологом является, например, гомологичный ген у человека (нуклеотидная последовательность которого доступна под номером GenBank AF034544, белковая последовательность под номером GenBank: AAC05086) (Moebius et al., 1998). Гомологичный ген у крысы Rattus norvegicus (нуклеотидная последовательность которого доступна под номером GenBank: AB016800, белковая последовательность под номером GenBank: BAA34306). Гены-гомологи также были идентифицированы у курицы Gallus gallus с номером в Genbank BM490402, или у жабы Xenopus laevis с номером в Genbank B1315007, или у рыбы-зебры Danio rerio с номером в Genbank BQ132664. Ген, кодирующий активность дельта 7-стерол редуктазы, также обнаруживается у растений, таких как рис Oryza sativa с номером в Genbank CA753545, картофель Solanum tuberosum с номером в Genbank BF342071. Этот ген, кодирующий активность дельта 7-стерол редуктазы, может быть также обнаружен у простейшего Mastigomoeba balamuthi с номером в Genbank BE636562.
Специалист может легко выделить другие гомологичные гены, кодирующие фермент 7-дегидрохолестеринредуктазу у других организмов. Он может обратиться, в частности, к способу клонирования, описанному в примере 1 патента EP 727489, в котором описан метод клонирования, позволяющий выделить кДНК, кодирующую белок, обладающий активностью дельта 5,7-стерол-дельта-7-редуктазы. Специалист может также легко определить активность 7-дегидрохолестеринредуктазы соответствующих белков, в частности используя тест на активность, также описанный в примере 1 патента EP 727489.
Экспрессия фермента 7-дегидрохолестерин редуктазы у организма царства Fungi согласно изобретению может быть получена любым способом, известным специалисту. Это может быть, в частности, трансформация организма с помощью конструкции, включающей кассету экспрессии, состоящую из промотора транскрипции, преимущественно гомологичного, открытой рамки считывания, кодирующей фермент 7-дегидрохолестерин редуктазу, и терминатора транскрипции, адаптированного согласно обычным правилам, известным специалисту. В качестве гомологичного промотора обычно используют промотор, подходящий для обеспечения достаточной и функциональной экспрессии гетерологичного белка. Промотором может быть, например, промотор PGK, промотор ADH, промотор CYCl, промотор GALIO/CYCI, промотор TDH3 или промотор TPI. Терминатором может быть, например, терминатор гена фосфоглицерат киназы (PGK). Указанная кассета экспрессии может быть встроена в форме одной или некоторых копий в ядерный или митохондриальный геном хозяина, или находиться в составе искусственной структуры типа искусственной хромосомы дрожжей (YAC) или в составе эписомального генетического элемента, такого как плазмида. Для осуществления этого типа экспрессии могут быть использованы, например, дрожжи типа Yarrowia lipolitica, Kluyveromyces lactis или Pichia pastoris.
Предпочтительно, экспрессируемым ферментом 7-дегидрохолестерин редуктазой является фермент растения Arabidopsis thaliana (пример способа экспрессии этого фермента у дрожжей Saccharomyces cerevisiae описан в патенте EP 727489). Тем не менее, это может быть любой, гомологичный или нет, природный или искусственный фермент, обладающий той же ферментативной активностью.
Фермент 3β-гидроксистерин Δ24-редуктаза, также называемый DHCR24 или 24-дегидрохолестеринредуктазой, катализирует в естественном состоянии восстановление десмостерола (холеста 5, 24 диенола) или производных ланостерола, имеющих двойную связь в положении 24-25 на боковой цепи (например, 14 десметилланостерола, зимостерола или холеста 7,24 диенола), необходимое для биосинтеза холестерина, в частности у человека (Waterham HR. et al, 2001). Этот фермент в следующих частях этого документа называют дельта 24-(25) стерол редуктазой, дельта 24 стерол редуктазой или Δ24-редуктазой.
Ген, кодирующий фермент 3β-гидроксистерин Δ24-редуктазу, был впервые выделен у человека, выделение соответствующего гена и экспрессия этого фермента у дрожжей Saccharomyces cerevisiae описаны в публикации Waterham HR. et al., 2001. Последовательности этого гена и белка доступны под следующими номерами доступа GenBank: NM_014762.et NP_055577.
Некоторое число гомологов этого гена были описаны у других видов. Например, таким гомологом является гомологичный ген мыши (Mus musculus) (нуклеотидная последовательность которого доступна под номером GenBank: NM_053272, белковая последовательность - под номером GenBank: NP_444502). Гомологи были описаны у червя Caenorhabditis elegans, в частности комплементарная ДНК с номером в Genbank AF026214. Гомологичные последовательности были описаны также у растений, таких как хлопок Gossypium hirsutum с номером в Gehbank AAM 47602.1, рис Orysa sativa с номером в Genbank AAP53615, горох Pisuni satinum с номером в Genbank AAK15493.
Специалист может легко выделить другие гомологичные гены, кодирующие фермент 3β-гидроксистерин Δ24-редуктазу у других организмов. Он может, в частности, обратиться к способу клонирования, описанному в публикации Waterham HR. et al., 2001. Специалист может также легко определить активность 3β-гидроксистерин Δ24-редуктазы соответствующих белков, в частности, используя тест на активность, также описанный в этой публикации (Waterham et al., 2001).
Экспрессия фермента 3β-гидроксистерин Δ24-редуктазы у организма царства Fungi согласно изобретению может быть получена любым способом, известным специалисту. Это могут быть, в частности, средства, описанные выше в отношении экспрессии фермента 7-дегидрохолестерин редуктазы.
Предпочтительно, экспрессируемый фермент 3β-гидроксистерин Δ24-редуктаза представляет собой человеческий фермент. Пример выделения соответствующего гена и экспрессии этого фермента у дрожжей Saccharomyces cerevisiae описан в публикации Waterham HR. еt al, 2001. Тем не менее, это может быть любой гомологичный или природный, или искусственный фермент, обладающий той же ферментативной активностью.
Предпочтительно, организмы царства Fungi согласно настоящему изобретению экспрессируют ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу, и, кроме того, осуществляют инактивацию фермента стерол 24-C-метилтрансферазы.
Фермент стерол 24-C-метилтрансфераза несет номер EC-2.1.1.41 в международной классификации ферментов (Enzyme Classification). Его также называют ERG6p, дельта(24)-метилтрансферазой, дельта(24)-стерол метилтрансферазой, зимостерол-24-метилтрансферазой, S-аденозил-4-метионин:стерол дельта(24)-метилтрансферазой, SMT1, 24-стерол C-метилтрансферазой, S-аденозил-L-метионин:дельта(24(23))-стерол метилтрансферазой или фитостерол метилтрансферазой.
Этот фермент катализирует в естественном состоянии метилирование в положении C-24 зимостерола, что приводит к образованию фекостерола.
Ген, кодирующий фермент стерол 24-C-метилтрансферазу, был назван Erg6 у дрожжей Saccharomyces cerevisiae. Последовательность этого гена доступна под следующим номером доступа GenBank: NC_001145. Последовательность соответствующего белка доступна под следующим номером доступа GenBank: NP_013706 (Bowman et al., 1997), (Goffeau et al., 1996).
Некоторое число гомологов этого гена были описаны у других Fungi. Таким гомологом является, например, гомологичный ген у Schizosaccharomyces pombe (нуклеотидная последовательность которого доступна под номером GenBank Z99759, белковая последовательности - под номером GenBank: CABl 6897) (Wood et al., 2002). Гомологичный ген у Neurospora crassa (нуклеотидная последовательность которого доступна под номером GenBank: NCB24P7, белковая последовательность под номером GenBank: CAB97289). Гомологичный ген у Candida albicans (нуклеотидная последовательность которого доступна под номером GenBank: AF031941, белковая последовательность под номером GenBank: AAC26626) (Jensen-Pergakes et al., 1998). Гены, кодирующиеся фермент, гомологичный ERG6, были описаны также у Candida lusitaniae с номером Genbank AA021936.1, а также у Pneumocystis carinii (Kanesbiro et al., 2002) или у Kluveromyces lactis (Ozier-Kalogeropoulos et al., 1998).
Специалист может легко выделить другие гены, гомологичные гену ERG6, в организмах царства Fungi. Специалист может также легко определить активность стерол 24-C-метилтрансферазы соответствующих белков, в частности, используя в качестве теста на активность функциональную комплементацию штамма дрожжей, у которого отсутствуют эти гены. О комплементации свидетельствует образование стеринов, включенных в положении 24, в частности стеринов типа эргоста-, несущих метиленовую группу в положении 24-28. Присутствие биологической активности стерол 24-C-метилтрансферазы типа ERG6 также определяют in vitro благодаря методам, разработанным (McCammon et al., 1984) или Taylor и Parks (Тэйлор и Пакс, 1978). С другой стороны, полученные стерины и субстрат фермента ERG6 разделяют Хроматографией в газовой фазе согласно технологии, разработанной Nes в (Methods in Enzymology Steroids and Isoprenoids Volume 111 part B, 1985 «A comparison of Methods for the Identification of Sterols» pp3-37).
Штамм организма царства Fungi согласно настоящему изобретению, экспрессирующий ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу, и в котором, кроме того, инактивирован фермент стерол 24-C-метилтрансфераза, продуцирует холестерин. Заявитель неожиданно смог определить, что инактивация фермента стерол 24-C-метилтрансферазы блокирует путь биосинтеза эргостерола на более ранних стадиях и позволяет штамму fungus продуцировать повышенные количества холестерина (см. экспериментальную часть настоящей заявки).
Экспрессию ферментов 7-дегидрохолестерин редуктазы и 3β-гидроксистерин Δ24-редуктазы осуществляют, как описано выше.
Инактивация фермента стерол 24-C-метилтрансферазы может быть осуществлена любым способом, известным специалисту. Это может быть, в частности, введение путем мутагенеза нонсенс-мутации, вставки или делеции, приводящие к изменению рамки считывания в гене, кодирующем указанный белок.
Это также может быть экспрессия антисмысловой РНК, комплементарной по отношению к информационной РНК, кодирующий указанный белок, или системы генной экстинкции, известной специалисту под именем siРНК (small interfering RNA), и ассоциированных ферментных систем, если они отсутствуют в естественных условиях в хозяине. Мутагенез может быть осуществлен в кодирующей последовательности или в некодирующей последовательности таким образом, чтобы сделать кодируемый белок неактивным или воспрепятствовать его экспрессии или трансляции. Мутагенез может быть осуществлен in vitro или in situ путем супрессии, замены, делеции и/или добавления одного или нескольких оснований в соответствующий ген, или инактивацией гена.
В частности, может быть осуществлено введение экзогенной ДНК в кодирующую или промоторную последовательность (например, кассеты экспрессии с гомологичным промотором и/или терминатором и гетерологичной кодирующей частью). Кассета экспрессии предпочтительно обеспечивает экспрессию селективного маркера. Также возможно модифицировать промотор гена для понижения уровня экспрессии. Для fungi инактивация также может происходить за счет прерывания кодирующей последовательности последовательностью, кодирующей гетерологичный или гомологичный маркерный ген. Основные методы прерывания гена fungi описаны в статье Johnston et al (2002) (Methods in Enzymology Volume 350 Edited by Christine Guthrie and Gerry Fink ; «Gene Disruption»; M. Johnston,- L. Riles, J. Hegemann pp 290-315).
Предпочтительно, организмы царства Fungi согласно настоящему изобретению экспрессируют ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу и в них инактивирован фермент C-22 стерола десатураза.
Фермент C-22 стерол десатураза также называют ERG5p, Cyp61, цитохром p-45061, стерол дельта22-десатураза. Этот фермент катализирует в естественном состоянии конверсию эргоста-5,7,24(28)-триенола в эргоста-5,7,22,24(28)-тетраенол, добавляя двойную связь в положении C22 (см. фиг.2).
Ген, кодирующий фермент C-22 стерол десатуразу, был назван Erg5 у дрожжей Saccharomyces cerevisiae. Последовательность этого гена доступна под следующим номером доступа GenBank: U34636. Последовательность соответствующего белка доступна под следующими номерами доступа GenBank: AAB06217 (Skaggs et al., 1996) или P54781 (Bowman et al., 1997).
Некоторое число гомологов этого гена были описаны у других Fungi. Таким гомологом является, например, гомологичный ген у Schizosaccharomyces pombe (нуклеотидная последовательность которого доступна под номером GenBank Z98974, белковая последовательность - под номером GenBank: CAB11640) (Wood et al., 2002). Гомологичный ген у Symbiotаphrina buchneri (нуклеотидная последовательность которого доступна под номером GenBank: AB086896, белковая последовательность - под номером GenBank: BACOl 142) (Noda and Koizumi, 2003). Гомологичный ген у Symbiotaphrina kochii (нуклеотидная последовательность которго доступна под номером GenBank: AB086890, белковая последовательность - под номером GenBank: BAC01139) (Noda and Koizumi, 2003). Гомологичный ген у Candida albicans (нуклеотидная последовательность которого доступна под номером GenBank: AL033396, белковая последовательность - под номером GenBank: CAA21953) (Tait et al., 1997). Ген ERG5 был также описан у Candida lusitaniae с номером Genbank AAO48601.
Специалист может легко выделить другие гены, гомологичные гену Erg5, в организмах царства Fungi. Специалист может также легко определить активность C-22 стерол десатуразы соответствующих белков, в частности, используя тест на активность, описанный Skaggs, B.A., et al, 1996. Эта активность может также быть выявлена функциональной комплементацией дрожжей S. Cerevisiae, у которых предварительно был осуществлен разрыв на уровне гена erg5. Об этой комплементации будет свидетельствовать присутствие в комплементированном штамме эргоста 5,7,22 триенола. Активность C-22 стерол десатуразы может быть измерена in vitro с использованием метода, описанного Kelly and Baldwin et al JBC (1997) после лизиса дрожжей (Kelly et al., 1997).
Штамм организма царства Fungi согласно настоящему изобретению, экспрессирующий ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу, и у которого, кроме того, инактивирован фермент C-22 стерол десатураза, продуцирует холестерин. Заявитель смог определить, что инактивация фермента C-22 стерол десатуразы предпочтительно блокирует превращение холестерина в холеста 5,22 диенол и обеспечивает стабилизацию продукции холестерина (см. экспериментальную часть настоящей заявки). Эта блокировка происходит также на уровне превращения холеста 5,7 диенола, предшественника холестерина, в холеста 5,7,22 триенол, предшественник холеста 5,22 диенола. Неожиданно, фермент C-22 стерол десатураза использует в качестве субстрата холестерин, который он превращает в холеста 5,22 диенол. Эта паразитная реакция может быть устранена путем инактивации фермента-22 стерол-десатуразы, как удалось определить заявителю.
Экспрессию ферментов 7-дегидрохолестерин редуктазы и 3β-гидроксистерин Δ24-редуктазы осуществляют, как описано выше. Инактивация фермента C-22 стерол десатуразы может быть осуществлена любым известным специалисту способом. Это могут быть, в частности, методы, описанные выше относительно инактивации фермента стерол 24-C-метилтрансферазы.
Предпочтительно, организмы царства Fungi согласно настоящему изобретению экспрессируют ферменты 7-дегидрохолестерин редуктазу и 3β-гидроксистерин Δ24-редуктазу, и, кроме того, у них инактивирован фермент C-22 стерол десатураза и фермент стерол 24-C-метилтрансфераза. Эти штаммы действительно обладают кумулированными преимуществами, связанными с инактивацией обоих ферментов, и являются штаммами-продуцентами холестерина.
Экспрессию ферментов 7-дегидрохолестерин редуктазы и 3β-гидроксистерин Δ24-редуктазы и инактивацию ферментов C-22 стерол десатуразы и стерол 24-C-метилтрансферазы осуществляют, как описано выше.
В способе осуществления холестерин присутствует в штамме организма согласно настоящему изобретению в количестве более 20%, преимущественно 35%, наиболее предпочтительно 50% или более от общего количества стеринов, продуцируемых штаммом, согласно изобретению (в частности, промежуточных продуктов синтеза).
Предпочтительно, организмы царства Fungi согласно настоящему изобретению выбирают из типа Ascomycetes, более предпочтительно, их выбирают из подтипа Saccharomycotina, еще более предпочтительно, их выбирают из класса Saccharomycetes или Schizosaccharоmycetes, еще более предпочтительно, их выбирают из порядка Saccharomycetales или Schizosaccharomycetales, еще более предпочтительно, их выбирают из семейства Saccharomycetaceae или Schizasaccharomycetaceae, еще более предпочтительно, их выбирают из рода Saccharomyces или Schizosaccharomyces, наиболее предпочтительно, организмы царства Fungi согласно изобретению принадлежат виду Saccharomyces cerevisiae или Schizosaccharomyces pombe.
Настоящее изобретение касается также способа получения холестерина неживотного происхождения, включающего следующие стадии:
- культивируют организм царства Fungi такой, как описан выше,
- экстрагируют холестерин, продуцированный этим организмом.
Экстракция основана на обработке fungus растворителем холестерина, предпочтительно, не смешивающимся с водой. Эта обработка может быть предпочтительно скомбинирована с каким-либо методом механического дробления клеток. Более предпочтительно, fungus обрабатывают до экстракции растворителем омыляющей смесью, предназначенной для высвобождения холестерина, возможно связанного с другими клеточными компонентами, такими как, в частности, жирные кислоты. Эта омыляющая смесь может состоять из основания, например, гидроксида аммония, гидроксида натрия, гидроксида калия, растворенного в воде или, более предпочтительно, в органическом растворителе, поддающемся смешиванию с водой, таком как, например, метанол или этанол, или в смеси растворитель-вода. Омыление может быть осуществлено без или, предпочтительно, с нагреванием при температуре 60-120°C, при атмосферном давлении или при пониженном давлении. Экстракция растворителем, не смешивающимся с водой, может быть заменена экстракцией в твердой фазе на гидрофобной смоле. Метод экстракции стеринов описан L. Parks и сотрудниками (1985) (Methods in Enzymology 111 Edited by L Rilling, L. Parks, C. Bottema, R. Rodriguez and Thomas Lewis pp333-339).
Полученный таким образом сырой холестерин может быть очищен любыми способами, известными специалисту, в частности описанными Boselli E, Velazco V, Caboni Mf и Lercker G J Chromatogr A. 2001 May 1 1; 917(1-2):239-44.
Другие методы могут также быть использованы, например, описанный способ экстракции холестерина из овечьей шерсти. Специалист может, в частности, обратиться к способам, описанным в патентах США 2688623 или 2650929, или в английских патентах GB690879, GB646227 или GB613778.
Другой аспект изобретения касается применения штаммов согласно настоящему изобретению для получения холестерина или одного из промежуточных продуктов его метаболизма, или меченой смеси стеринов. Под промежуточным продуктом метаболизма холестерина понимают, в частности, стерины, указанные на фиг.2. Это может, в частности, быть холеста 8,24(25) диенол, холеста 7,24(25) диенол, холеста 5,7,24(25)триенол, холеста 5,24(25) диенол, холеста 5,22 диенол.
Принцип получения меченого холестерина описан на фиг.10. Эта манипуляция состоит в том, чтобы сначала вырастить штамм fungus на полностью меченом субстрате. Клетки затем культивируют на не меченом субстрате. Таким образом происходит изменение изотопной метки источника углерода, далее следует синтез de novo промежуточных продуктов метаболизма, затем стерина, включая холестерин, содержащего постепенное изменение метки. Речь идет, таким образом, о сложном, но вполне поддающемся экспериментальному определению профиле, который представляет уникальную изотопную подпись, которая зависит одновременно:
1) от протокола мечения и, в частности, сроков и условий культивирования на меченом и не меченом субстрате;
2) от точной генетической структуры использованного штамма;
3) точного времени остановки культивирования.
После остановки культивирования (например, лизисом клеток или путем остановки культивирования в присутствии суб-летальной концентрации цитотоксических или цитостатических противогрибковых продуктов) меченый холестерин или один из промежуточных продуктов его метаболизма, или меченую смесь стеринов экстрагируют и очищают, как описано выше.
Изотопный профиль меченого холестерина или одного из промежуточных продуктов его метаболизма, или меченой смеси стеринов обладает несколькими уникальными свойствами:
1) его можно при необходимости менять за счет изменений условий культивирования, используемого штамма и выбранного стерина, таким образом может быть получен уникальный регистр меток;
2) он является "комбинируемым", а именно некоторые изотопные подписи, соответствующие некоторым уникальным стеролам, меченым изотопными профилями, которые сами по себе являются модулируемыми, могут быть скомбинированы с получением «молекулярного алфавита»;
3) он является воспроизводимым и легко определимым экспериментально;
4) он соответствует трассирующей молекулярной смеси, легкой в выделении, стабильной, бесцветной и лишенной запаха, нелетучей, не токсичной и которая может быть внедрена в продукты питания, в лекарственное средство, добавки или другие продукты, потребляемые человеком;
5) он не поддается фальсификации, если неизвестны специфические рекомбинантные штаммы и очень точные условия мечения, культивирования и экстракции. К тому же знание изотопной подписи не позволяет выявить параметры, которые могли бы позволить осуществить его получение.
Таким образом, не поддающийся фальсификации «изотопный алфавит» общего назначения и который может быть включен в любой тип продуктов, в том числе употребляемых в пищу, может быть легко получен благодаря настоящему изобретению. Число «изотопных слов», которые можно построить исходя из такого алфавита, является практически неограниченным благодаря использованию одновременно профилей мечения и различных типов стеринов. Включение таких подписей в состав разнообразных продуктов представляет собой, таким образом, уникальный способ не поддающейся фальсификации маркировки, в отличие, например, от подписей ДНК, которые, став один раз известными, могут быть воспроизведены. Подпись может быть к тому же считана способами, не наносящими повреждений, например лазерной ионизацией с последующим анализом масс-спектометрией (MALDI-TOF и т.п.).
Использование субстрата, меченого 13C, вместо немеченых источников углерода для культивирования штаммов fungus согласно изобретению, позволяет осуществить синтез стеринов и, в частности, очень сильно меченого холестерина (включающего по меньшей мере 95% углерода 13C). Получение стеринов и радиоактивного холестерина 14C также возможно с использованием того же подхода. Способ может быть также использован в отношении штаммов дрожжей, продуцирующих стероиды, в частности, гидрокортизон (см. заявку на патент WO 02/061109) для получения стероидов, меченых 13C или 14C, например, для тестов RIA.
Описание чертежей
Фиг.1. Химическая формула холестерина, а также номенклатура, обычно используемая для нумерации различных атомов углерода и названия различных циклов. Четыре цикла молекулы холестерина названы соответственно A, B, C и D, и углероды пронумерованы от 1 до 27.
Фиг.2. Упрощенная схема поздней части пути биосинтеза стеринов типа эргоста- и холеста- в натуральных или модифицированных дрожжах. Схема не является исчерпывающей, но позволяет определить стадии, в которых участвуют ферменты, процитированные в этом документе. Белки ERG2p, ERG3p, ERG5p и ERG6p являются белками fungus или дрожжей, в то время как белки Дельта-7Red (Дельта 7 стерол редуктаза), Дельта 24-(25)Red (Дельта 24-(25) стерол редуктаза) являются гетерологичными белками, происходящими от млекопитающих или растений.
Фиг.3. Профиль, сравненный в ВЭЖХ с УФ-детекцией при 206 нм, свободных стеринов штаммов, производных от штамма BMA64, и идентификация этих стеринов. Были исследованы следующие штаммы: WGIF01 (штамм BMA64 с разрушенным геном erg6 (см. пример 1)), WGIF02 (штамм BMA64 с разрушенным геном erg6 и экспрессирующий Δ24-редуктазу, пример 12), WGIF03 (штамм BMA64 с разрушенным геном erg6 и экспрессирующий Δ7-редуктазу, пример 13), WGIF04 (штамм BMA64 с разрушенным геном erg6 и экспрессирующий Δ7-редуктазу и Δ24-редуктазу, пример 14). C5: холеста 5 енол (холестерин); C5,22: холеста 5,22 диенол; C5,24: холеста 5,24 диенол (десмостерол); C8,24: холеста 8,24 диенол (зимостерол); C5,7,22: холеста 5,7,22 триенол; C5,7,24: холеста 5,7,24 триенол; C5,22,24: холеста 5,22,24 триенол; C5,7,22,24: холеста 5,7,22,24 тетраенол; lan: ланостерол.
Фиг.4. Профиль, сравниваемый в ВЭЖХ с УФ-детекцией при 206 нм, свободных стеринов штамма WGIF04 (штамм BMA64 с разрушенным геном erg6 и экспрессирующий Δ7-редуктазу и Δ24-редуктазу, пример 14) после 0,2,4,8,24 часов индукции галактозой. Δ:штамм WGIF01 (пример 1). Для штамма WGIF04 отборы проб осуществляли через 0, 2, 4, 8 и 24 ч после замены источника углерода галактозой. Представленный профиль штамма BMA64, имеющего разрушение в гене erg6 (WGIF01), соответствует профилю, полученному сразу после замены на галактозу. Этот профиль остается практически неизменным в течение индукции (0-24 ч). Сигнал поглощения при 206 нм соответствует коэффициентам поглощения, меняющимся от одного стерина к другому. C5:10 холеста 5 енол (холестерин); C5,22: холеста 5,22 диенол; C5,24: холеста 5,24 диенол (десмостерол); C8,24: холеста 8,24 диенол (зимостерол); C5,7,22: холеста 5,7,22 триенол; C5,7,24: холеста 5,7,24 триенол; C5,22,24: холеста 5,22,24 триенол; C5,7,22,24: холеста 5,7,22,24 тетраенол; lan: ланостерол.
Фиг.5. Профиль, сравниваемый в ВЭЖХ с детекцией с электрораспылением и положительной ионизацией (масс-спектометрия) свободных стеринов штамма WGIF04 (пример 14) после 0, 2, 4, 8, 24 часов индукции галактозой. Δ:штамм WGIF01. C5:холеста 5 енол (холестерин); C5,22: холеста 5,22 диенол; C5,24: холеста 5,24 диенол (десмостерол); C8,24: холеста 8,24 диенол (зимостерол). Профили ВЭЖХ получены в том же тесте, что и в случае фиг.4.
Фиг.5A (слева): детекция при m/z=367, Фиг.5B (справа) m/z=3 69.
Ордината: число подсчитанных ионов/в секунду. Абсцисса: продолжительность элюирования в минутах.
Фиг.6. Деталь профиля при m/z=369 в ВЭЖХ для трех штаммов