Аминоспиртовые производные
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы [I] или их фармацевтически приемлемым солям, обладающим свойствами ингибитора повышения внутрипузырного давления. В формуле [I]
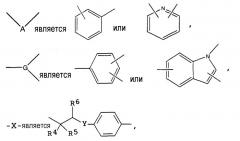
представляет собой или , является ,
R1 означает водород, галоген, нитро или амино, R2 означает водород или низший алкил, R3 означает водород, -Х- является
где -Y- является связью, -O-, -NH- или -CH2-, и R4, R5 и R6 каждый означают водород, R7 означает (С1-С8)-алкил, (С3-С8)-циклоалкил, -Z-R9 или , где -Z- является -О- или -S-, и каждый R9 независимо означает (C1-C8)-алкил, (С3-С8)-циклоалкил, и R8 означает -D-E-R10, в которой -D- является -CONHSO2-, E является (С1-С6)-алкиленом, и R10 означает -O-R11, в которой R11 означает водород. Изобретение относится также к применению указанных соединений для получения лекарственного средства, фармацевтической композиции и способу профилактического и/или терапевтического лечения гиперактивного мочевого пузыря и/или нарушений мочеиспускания. 4 н. и 3 з.п. ф-лы.
Реферат
Область изобретения
Настоящее изобретение относится к новым аминоспиртовым производным и их солям, которые являются агонистами бета-3 (β3) адренергических рецепторов и пригодными в качестве лекарственного средства.
Предыдущий уровень техники в данной области
Международная публикация No. WO 90/06299, опубликованная 14 июня 1990, описывает производные фенилэтаноламинов, которые оказывают влияние на метаболизм, предпочтительно на снижение уровня сахара в крови и степени ожирения, Международная публикация No. WO 02/32897, опубликованная 25 апреля 2002, описывает производные альфа-арилэтаноламинов, применяемых в качестве агонистов β3-адренергических рецепторов, и Международная публикация No. WO 2004/002939, опубликованная 8 января 2004, и Международная публикация No. WO 2005/061433, опубликованная 7 июля 2005, описывают аминоспиртовые производные, которые являются пригодными в качестве агониста β3-адренергических рецепторов.
Описание изобретения
Настоящее изобретение относится к новым аминоспиртовым производным, которые являются агонистами β3-адренергических рецепторов, и к их солям.
Конкретнее, изобретение относится к новым аминоспиртовым производным и к их солям, которые являются пригодными для лечения и/или профилактики болезней желудочно-кишечного тракта, язвы, гиперактивного мочевого пузыря, расстройств мочеиспускания, панкреатита, ожирения, диабета и т.д., к способам получения указанных соединений, к фармацевтической композиции, содержащей данные соединения, и к способу лечения и/или профилактики вышеуказанных заболеваний у человека или животного посредством терапии данными соединениями.
Одной целью данного изобретения является предоставление новых и пригодных к употреблению аминоспиртовых производных и их солей, которые можно использовать для лечения и/или профилактики указанных выше расстройств.
Другой целью данного изобретения является разработка способов получения указанных аминоспиртовых производных и их солей.
Еще одной целью настоящего изобретения является создание фармацевтической композиции, содержащей в качестве активного ингредиента указанные выше аминоспиртовые производные и их соли.
Еще другой целью настоящего изобретения является разработка терапевтического способа лечения и/или профилактики вышеупомянутых заболеваний у человека или животного с использованием указанных аминоспиртовых производных и их солей.
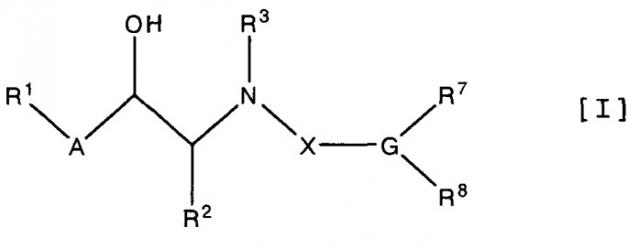
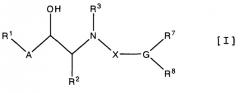
Целевыми аминоспиртовыми производными являются новые производные, которые могут быть представлены соединением следующей формулы [I]:
где
в которой -Y- является связью, -О-, -NH- или -СН2-, и
R4, R5 и R6 каждый независимо, означает водород, низший алкил или гидрокси(низший)алкил, или
в которой n равно 0, 1 или 2,
R1 означает водород, галоген, низший алкил, гидрокси, низший алкокси, арилокси, нитро, амино, (моно или ди)(низший)алкиламино или ариламино,
R2 означает водород, низший алкил или гидрокси(низший)алкил,
R3 означает водород или аминозащитную группу,
R7 означает водород, низший алкил, цикло(низший)алкил, низший алкенил, -Z-R9, или в которой -Z- является -O-, -S-, -SO- или -SO2-, и
каждый R9 независимо означает водород, низший алкил, цикло(низший)алкил, низший алкенил, карбамоил, низший алкилкарбамоил, низший алкилсульфонил, арил или гетероциклическую группу, и
R8 означает -D-E-R10, в которой -D- является -CONHSO2- или -SO2NHCO-,
E является связью или низшим алкиленом, и
R10 означает галоген, циано, карбокси, низший алкоксикарбонил, карбамоил, низший алкилкарбамоил, гетероциклическую группу, -O-R11, -S-R11 или в которой каждый R11 независимо означает водород, низший алкил, низший алканоил, низший алкоксикарбонил или арил(низший)алкил,
или его пролекарством или его солью.
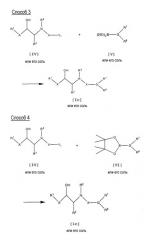
Согласно данному изобретению, целевые соединения могут быть получены способами, которые представлены на следующих схемах.
каждая группа является такой, как определено выше,
R3 a означает аминозащитную группу,
R12 означает низший алкил, и
Y1 является уходящей группой.
Что касается исходных соединений [II], [III], [Ia], [IV], [V], [VI], [Id], [VIII] и [IX], некоторые из них являются новыми соединениями и могут быть получены посредством процедур, описанных в разделе «Получение и примеры», приведенном ниже, или традиционным способом.
В приведенном выше и последующем описании настоящего изобретения подходящие примеры различного определения, которые предназначены быть включенными в объем изобретения, раскрыты подробно следующим образом.
Термин “низший” означает группу, содержащую от 1 до 8, предпочтительно от 1 до 7, более предпочтительно от 1 до 6, наиболее предпочтительно от 1 до 4 атома(ов) углерода, если не указано особо.
Подходящий “низший алкил” и фрагмент “низшего алкила” в терминах “гидрокси(низший)алкил, “(моно или ди)(низший)алкиламино”, “низший алкилкарбамоил”, “низший алкилсульфонил” и “арил(низший)алкил” может включать в себя “низший алкил” и фрагмент “низшего алкила” с прямой или разветвленной цепью, имеющей от 1 до 8, предпочтительно от 1 до 7, более предпочтительно от 1 до 6 атома(ов) углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, 1-метилпентил, трет-пентил, неопентил, гексил, изогексил и тому подобный, где предпочтительным “низшим алкилом” или фрагментом “низшего алкила” может быть метил, этил, пропил, изопропил или изобутил.
Подходящий “низший алкокси” и фрагмент “низшего алкокси” в термине “низший алкоксикарбонил” может включать в себя метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентилокси, трет-пентилокси, гексилокси и тому подобное, где предпочтительным “низшим алкокси” и фрагментом “низшего алкокси” может быть метокси или трет-бутокси.
Подходящий “низший алканоил” может включать в себя формил, ацетил, пропаноил, бутаноил, 2-метилпропаноил, пентаноил, 2,2-диметилпропаноил, гексаноил и тому подобное, где предпочтительным “низшим алканоилом” может быть ацетил.
Подходящий “цикло(низший)алкил” может включать в себя циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и тому подобное, где предпочтительным “цикло(низшим)алкилом” может быть цикло(С3-С7)алкил и более предпочтительным “цикло(низшим)алкилом” может быть циклопентил, циклогексил или циклогептил.
Подходящий “низший алкенил” может включать в себя винил, 1-(или 2-)пропенил, 1-(или 2- или 3-)бутенил, 1-(или 2- или 3- или 4-)пентенил, 1-(или 2- или 3- или 4- или 5-)гексенил, 1-(или 2-)метилвинил, этилвинил, 1-(или 2- или 3-)метил-1-(или 2-)пропенил, 1-(или 2- или 3-)этил-1-(или 2-)пропенил, 1-(или 2- или 3- или 4-)метил-1-(или 2- или 3-)бутенил и тому подобное, где предпочтительным “низшим алкенилом” может быть С2-С4 алкенил.
Подходящий “низший алкилен” может включать в себя алкилен с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, такой как метилен, этилен, триметилен, 2,2-диметилтриметилен, 3,3-диметилтриметилен, тетраметилен, пентаметилен, гексаметилен и пропилен, где предпочтительным “низшим алкиленом” может быть алкилен с прямой цепью, имеющей от 1 до 4 атомов углерода.
Подходящим “галогеном” может быть фтор, хлор, бром и йод, где предпочтительным галогеном может быть фтор или хлор.
Подходящий “арил” и “арильный” фрагмент в терминах “арилокси”, “ариламино” и “арил(низший)алкил” может включать в себя фенил, нафтил, инденил, антрил и тому подобное, где предпочтительным “арилом” и “арильным” фрагментом может быть фенил.
Подходящей “гетероциклической группой” может быть группа, содержащая, по крайней мере, один гетероатом, выбранный из атома азота, серы и кислорода, и может включать в себя насыщенную или ненасыщенную, моноциклическую или полициклическую гетероциклическую группу, и предпочтительной гетероциклической группой может быть N-содержащая гетероциклическая группа, такая как ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая от 1 до 4 атомов азота, например пирролил, пирролинил, имидазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазолил [например, 4Н-1,2,4-триазолил, 1Н-1,2,3-триазолил, 2Н-1,2,3-триазолил и т.д.], тетразолил [например, 1Н-тетразолил, 2Н-тетразолил и т.д.] и т.д.;
насыщенная 3-7-членная гетеромоноциклическая группа, содержащая от 1 до 4 атомов азота [например, пирролидинил, имидазолидинил, пиперидил, пиперазинил, гомопиперазинил и т.д.];
ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 5 атомов азота, например индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, имидазопиридил, индазолил, бензотриазолил, тетразолопиридазинил [например, тетразоло[1,5-b]пиридазинил и т.д.], хиноксалинил и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая атом кислорода, например пиранил, фурил и т.д.;
насыщенная 3-6-членная гетеромоноциклическая группа, содержащая атом кислорода, например 1Н-тетрагидропиранил, тетрагидрофуранил и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая 1-2 атома серы, например тиенил и т.д.;
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, например оксазолил, изоксазолил, оксадиазолил [например, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.], оксазолинил [например, 2-оксазолинил и т.д.] и т.д.;
насыщенная 3-6-членная гетеромоноциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота [например морфолинил и т.д.];
ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота [например, бензофуразанил, бензоксазолил, бензоксадиазолил и т.д.];
ненасыщенная 3-6-членная гетеромоноциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота, например тиазолил, тиадиазолил [например, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил и т.д.] и т.д.;
насыщенная 3-6-членная гетеромоноциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота [например, тиазолидинил и т.д.];
ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота [например, бензотиазолил, бензотиадиазолил и т.д.];
ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома кислорода [например, бензофуранил, бензодиоксолил, хроманил и т.д.] и тому подобное.
Подходящая “уходящая группа” может включать в себя гидрокси, химически активную группу, производную от гидрокси, и тому подобное.
Подходящая “реакционноспособная группа, производная от гидроксигруппы”, может включать в себя кислотный остаток и тому подобное.
Подходящий “кислотный остаток” может включать в себя галоген [например, фтор, хлор, бром, йод], ацилокси [например, ацетокси, тозилокси, мезилокси, трифторметансульфонилокси и т.д.] и тому подобное.
Подходящим примером “аминозащитной группы” может быть общая аминозащитная группа, такая как замещенный или незамещенный низший алканоил [например, формил, ацетил, пропионил, трифторацетил и т.д.], фталоил, низший алкоксикарбонил [например, трет-бутоксикарбонил, трет-амилоксикарбонил и т.д.], замещенный или незамещенный аралкилоксикарбонил [например, бензилоксикарбонил, п-нитробензилоксикарбонил и т.д.], замещенный или незамещенный аренсульфонил [например, бензолсульфонил, тозил и т.д.], нитрофенилсульфенил, арил(низший)алкил [например, тритил, бензил и т.д.] и тому подобное, где предпочтительной аминозащитной группой является трет-бутоксикарбонил.
Подходящими солями целевого аминоспиртового производного [I] являются фармацевтически приемлемые соли, и они включают в себя обычные нетоксичные соли, такие как аддитивная соль неорганической кислоты [например, гидрохлорид, гидробромид, сульфат, фосфат и т.д.], аддитивная соль органической кислоты [например, формиат, ацетат, трифторацетат, оксалат, малеат, фумарат, тартрат, цитрат, метансульфонат, бензолсульфонат, толуолсульфонат и т.д.], соль щелочного металла [например, натриевая соль, калиевая соль и т.д.] и тому подобное, где предпочтительной солью является гидрохлорид.
Способы от 1 до 6 получения целевых соединений согласно настоящему изобретению описаны подробно в следующем разделе.
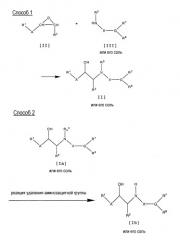
Способ 1
Целевое соединение [I] или его соль могут быть получены путем взаимодействия соединения [II] с соединением [III] или с его солью.
Подходящей солью соединения [III] может быть такая же соль, как приведена для соединения [I].
Реакцию, предпочтительно, проводят в присутствии основания, такого как карбонат щелочного металла [например, карбонат натрия, карбонат калия и т.д.], карбонат щелочноземельного металла [например, карбонат магния, карбонат кальция и т.д.], бикарбонат щелочного металла [например, бикарбонат натрия, бикарбонат калия и т.д.], три(низший)алкиламин [например, триметиламин, триэтиламин и т.д.], пиколин и тому подобное.
Обычно реакцию осуществляют в стандартном растворителе, таком как спирт [например, метанол, этанол, пропанол, изопропанол и т.д.], диэтиловый эфир, тетрагидрофуран, диоксан, или любом другом органическом растворителе, который не оказывает неблагоприятного воздействия на реакцию.
Температура реакции не является критической, и реакцию можно проводить в условиях, колеблющихся от охлаждения до нагревания.
Способ 2
Целевое соединение [Ib] или его соль может быть получено путем реакции удаления аминозащитной группы в соединении [Ia].
Подходящими солями соединений [Ia] и [Ib] могут быть такие же соли, которые приведены для соединения [I].
Указанную реакцию можно проводить подобно реакции примера 3, описанного ниже.
Способ 3
Целевое соединение [Ic] или его соль могут быть получены путем взаимодействия соединения [IV] или его соли с соединением [V] или с его солью.
Подходящими солями соединений [Iс], [IV] и [V] могут быть такие же соли, которые приведены для соединения [I].
Указанную реакцию можно проводить подобно реакции примера 2, описанного ниже 2.
Способ 4
Целевое соединение [Ic] или его соль могут быть получены путем взаимодействия соединения [IV] или его соли с соединением [VI] или с его солью.
Подходящими солями соединений [Iс], [IV] и [VI] могут быть такие же соли, которые приведены для соединения [I].
Указанную реакцию можно проводить подобно реакции получения 43, описанного ниже.
Способ 5
Целевое соединение [If] или его соль могут быть получены путем реакции деэтерификации, которой подвергают соединение [Id] или его соль, с последующим взаимодействием полученного в результате реакции соединения [Ie] или его соли с соединением [VII] или с его солью.
Подходящими солями соединений [If], [Id], [Ie] и [VII] могут быть такие же соли, которые приведены для соединения [I].
Указанные реакции можно проводить подобно реакциям получения 3 и примера 11, описанным ниже.
Способ 6
Целевое соединение [Ig] или его соль могут быть получены путем взаимодействия соединения [VIII] или его соли с соединением [IX] или с его солью.
Подходящими солями соединений [Ig], [VIII] и [IX] могут быть такие же соли, которые приведены для соединения [I].
Указанную реакцию можно проводить подобно реакции примера 18, описанного ниже.
Соединения, полученные вышеуказанными способами, могут быть выделены и очищены обычным методом, таким как порошкование, перекристаллизация, колоночная хроматография, переосаждение и тому подобное, и превращены в желаемую соль обычными способами, по необходимости.
Следует отметить, что соединение [I] и другие соединения могут включать в себя один или более стереоизомеров вследствие асимметрических атомов углерода, и все такие изомеры и их смеси включены в объем данного изобретения.
Кроме того, следует отметить, что изомеризация или перегруппировка целевого соединения [I] может происходить в результате действия света, кислоты, основания или тому подобного, и соединение, полученное в результате указанной изомеризации или перегруппировки, также является включенным в объем настоящего изобретения.
Также следует отметить, что сольватированная форма соединения [I] [например, гидрат и т.д.] и любая форма кристалла соединения [I] включены в объем настоящего изобретения.
Целевое соединение [I] и его соль являются пригодными для лечения и/или профилактики болезней желудочно-кишечного тракта у человека или животных и, точнее, для лечения и/или профилактики спазма или гиперкинезии в случае синдрома раздраженной толстой кишки, гастрита, язвы желудка, язвы двенадцатиперстной кишки, энтерита, холецистопатии, воспаления желчных путей, мочевого конкремента и тому подобного; для лечения и/или профилактики язвы, такой как язва желудка, язва двенадцатиперстной кишки, пептическая язва и тому подобное; для лечения и/или профилактики гиперактивного мочевого пузыря, такого как нервная поллакиурия, нейрогенное нарушение мочеиспускания, никтурия, нестабильный мочевой пузырь, цистоспазм, хронический цистит, хронический простатит, гипертрофия предстательной железы и тому подобное; для лечения и/или профилактики расстройств мочеиспускания, таких как стрессовое недержание мочи, императивное недержание мочи, смешанное недержание мочи, функциональное недержание мочи, непроизвольное мочеиспускание при перерастяжении мочевого пузыря и тому подобное; для лечения и/или профилактики панкреатита, ожирения, диабета, глюкозурии, гиперлипидемии, гипертензии, атеросклероза, глаукомы, меланхолии, депрессии и тому подобного; для лечения и/или профилактики заболеваний, возникающих в результате инсулинорезистентности [например, гипертензия, гиперинсулинемия и т.д.]; для лечения и/или профилактики нейрогенного воспаления; и для ослабления болезни, вызывающей истощение, и тому подобное.
Кроме того, известно, что агонисты β3-адренергических рецепторов понижают уровни триглицеридов и холестерина и повышают уровни липопротеинов высокой плотности у млекопитающих (патент США No. 5451677). Таким образом, целевое соединение [I] является пригодным в лечении и/или профилактике состояний, таких как гипертриглицеридемия, гиперхолестеринемия, и состояний, связанных со снижением уровней липопротеинов высокой плотности, а также в лечении атеросклеротических и сердечно-сосудистых заболеваний и родственных состояний.
Кроме того, целевое соединение [I] является пригодным для подавления маточных сокращений, предотвращения преждевременных родов и лечения и профилактики дисменорреи.
Кроме того, можно ожидать, что целевое соединение [I] при его использовании вместе с антихолинергическим средством в случае гиперактивного мочевого пузыря, таким как хлоргидрат пропиверина, хлоргидрат оксибутинина, хлоргидрат флавоксата, тартрат толтеродина и тому подобное, будет усиливать эффект, направленный против учащенного мочеиспускания.
Для терапевтических целей соединение [I] и его фармацевтически приемлемая соль согласно настоящему изобретению могут быть использованы в виде фармацевтического препарата, содержащего одно из указанных выше соединений в качестве активного ингредиента в смеси с фармацевтически приемлемым носителем, таким как органический или неорганический твердый или жидкий наполнитель, подходящий для перорального введения, парентерального введения, наружного введения, включая местное, внутреннего введения, внутривенного введения, внутримышечного введения, для ингаляции, назального введения, внутрисуставного введения, интраспинального введения, через трахею или через глаз. Фармацевтические препараты могут быть в твердом виде, полутвердом виде или в виде растворов, таком как капсулы, таблетки, пилюли, драже, порошки, гранулы, суппозитории, мази, кремы, лосьоны, формы для ингаляции, инъекции, припарки, гели, пластыри, капли для глаз, раствор, сиропы, аэрозоли, суспензия, эмульсия и тому подобное. По желанию, в указанные препараты могут быть включены вспомогательные вещества, стабилизирующие реагенты, увлажняющие или эмульгирующие средства, буферы и другие обычно применяемые добавки.
Хотя дозировка соединения (I) будет изменяться в зависимости от возраста и состояния больного, средняя разовая доза, составляющая приблизительно 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг, 500 мг и 1000 мг соединения (I), может быть эффективной для лечения заболеваний, таких как язва, гиперактивный мочевой пузырь, нарушения мочеиспускания и тому подобное. Вообще, количества между 0,1 мг/вес тела и 1000 мг/вес тела могут быть введены в день.
Для того чтобы продемонстрировать пригодность соединения [I] для профилактического и терапевтического лечения вышеуказанных заболеваний у человека или животных, характерный пример соединения [I] исследовали с помощью следующего фармацевтического теста.
Тест
Влияние на повышение внутрипузырного давления, вызванного карбохолином, у собаки, подвергаемой анестезии.
Тестируемое соединение
(1) Гидрохлорид 3-(циклогексилокси)-N-[(2-гидроксиэтил)сульфонил]-4′-[2-[[(2R)-2-гидрокси-2-фенилэтил]амино]этил]-4-бифенилкарбоксамида (целевое соединение примера 1-(8), описанного ниже)
Метод тестирования
Самок гончих собак, имеющих вес 8,0-15,0 кг, держали в состоянии голода в течение 24 часов и поддерживали в условиях анестезии галотаном. Катетер Фолея 12F смазывали водорастворимым желе, вводили в отверстие мочеиспускательного канала и продвигали вперед приблизительно на 10 см до тех пор, пока наконечник баллона хорошо не разместился внутри пузыря. Затем баллон наполняли 5 мл воздуха, и катетер медленно выводили до той части, когда первое сопротивление стало ощущаться у шейки мочевого пузыря. Мочу полностью выпускали через катетер, и вливали 30 мл физиологического раствора. Катетер соединяли с датчиком давления, и внутрипузырное давление (IVP) постоянно записывали. Тестируемое соединение вводили подкожно за 30 минут до введения карбохолина (1,8 мкг/кг). Процент ингибирования повышения IVP, достигаемого тестируемым соединением, рассчитывали путем деления значения IVPa (повышение IVP, вызываемое карбохолином после введения тестируемого соединения) на значение IVPb (повышение IVP, вызываемое карбохолином непосредственно до введения тестируемого соединения).
Результат тестирования
| Обработка | Процент ингибирования повышения IVP |
| Тестируемое соединение (1)(0,32 мг/кг) | 78 |
Предпочтительными вариантами целевого соединения [I] являются следующие:
-Х- является
в которой -Y- означает связь, -О-, -NH- или -СН2, и
R4, R5 и R6, каждый, независимо, означает водород, низший алкил (более предпочтительно С1-С4 алкил) или гидрокси(низший)алкил (более предпочтительно гидрокси(С1-С4)алкил).
Более предпочтительными вариантами целевого соединения [I] являются следующие:
R1 означает водород, галоген (более предпочтительно фтор или хлор), нитро или амино,
R2 означает водород или низший алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно метил),
R3 означает водород,
R7 означает водород, низший алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно изопропил или изобутил), цикло(низший)алкил (более предпочтительно цикло(С3-С6)алкил, наиболее предпочтительно циклопентил), -Z-R9 или ,
в которой -Z- является -O-, -S-, -SO- или -SO2-, и
каждый R9 независимо означает водород, низший алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно пропил, изопропил или изобутил) или цикло(низший)алкил (более предпочтительно цикло(С3-С6)алкил, наиболее предпочтительно циклопентил, циклогексил или циклогептил), и
R8 является -D-E-R10, где -D- является -CONHSO2- или -SO2NHCO-,
E означает связь или низший алкилен (более предпочтительно С1-С4 алкилен, наиболее предпочтительно метилен, этилен, триметилен, 3,3-диметилтриметилен или тетраметилен), и
R10 означает галоген, циано, карбокси, низший алкоксикарбонил (более предпочтительно С1-С4 алкоксикарбонил, наиболее предпочтительно метоксикарбонил), карбамоил, пиридил, -O-R11 или , в которой каждый R11 независимо означает водород, низший алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно метил или этил), низший алканоил (более предпочтительно С1-С4 алканоил, наиболее предпочтительно ацетил) или низший алкоксикарбонил (более предпочтительно С1-С4 алкоксикарбонил, наиболее предпочтительно трет-бутоксикарбонил).
Кроме того, предпочтительными вариантами соединения [I] являются следующие:
-Х- является
в которой -Y- является связью, -O-, -NH- или -CH2-, и
R4, R5 и R6, каждый, означает водород,
R7 означает низший алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно изопропил или изобутил), цикло(низший)алкил (более предпочтительно цикло(С3-С6) алкил, наиболее предпочтительно циклопентил), -Z-R9 или ,
в которой -Z- является -O- или -S-, и
каждый R9 независимо означает низший алкил или цикло(низший)алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно пропил, изопропил или изобутил) или цикло(низший)алкил (более предпочтительно цикло(С3-С6) алкил, наиболее предпочтительно циклопентил, циклогексил или циклогептил), и
R8 является -D-E-R10, где -D- является -CONHSO2- или -SO2NHCO-,
Е означает связь или низший алкилен (более предпочтительно С1-С4 алкилен, наиболее предпочтительно метилен, этилен, триметилен, 3,3-диметилтриметилен или тетраметилен), и
R10 означает циано, карбокси, карбамоил, пиридил, -O-R11 или , в которой каждый R11 независимо означает водород, низший алкил (более предпочтительно С1-С4 алкил, наиболее предпочтительно метил или этил).
Следующий раздел, в котором описывают получение и примеры, приведен с целью иллюстрации данного изобретения. В тексте вышеупомянутую группу “карбамоил” соотносят с группой “аминокарбонил”.
Использованы следующие сокращения в данных ЯМР:
s - с, m - м, t - т, d - д, br - ушир., Hz - Гц
Получение 1
К раствору трет-бутил [(2R)-2-гидрокси-2-фенилэтил][2-[3′-(изопропокси)-4′-[[(метилсульфонил)амино]карбонил]-4-бифенилил]этил]карбамата (65 мг) в 1,4-диоксане (2 мл) добавляли раствор хлористоводородной кислоты в 1,4-диоксане (4N, 4 мл) при комнатной температуре, и смесь перемешивали при этой же температуре в течение 2,5 часов. Смесь упаривали при пониженном давлении с получением гидрохлорид 4′-[2-[[(2R)-2-гидрокси-2-фенилэтил]амино]этил]-3-изопропокси-N-(метилсульфонил)-4-бифенилкарбоксамида (38 мг).
ЯМР (200 MHz, DMSO-d6, δ): 1,37 (6H, d, J=5,7 Hz), 3,06-3,25 (6H, m), 3,38 (3H, s) 4,97-5,00 (2H, m), 6,23 (1H, br s), 7,28-7,48 (9H, m), 7,72-7,79 (3H, m)
(+)ESI-МС (m/z): 497 (M+H)+
Пример 1
Следующие соединения были получены способом, подобным способу получения 1.
(1) Гидрохлорид 4′-[2-[[(2R)-2-гидрокси-2-фенилэтил]амино]этил]-N-[(3-гидроксипропил)сульфонил]-3-изопропокси-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,36 (6H, d, J=6,0 Hz), 1,81-1,95 (2H, m), 2,99-2,73 (6H, m), 3,47-3,58 (4H, m), 4,75 (1H, t, J=5,0 Hz), 4,91-5,05 (2H m), 6,24 (1H, d, J=4,0 Hz), 7,31-7,43 (9H, m), 7,68-7,76 (3H, m)
(+)ESI-МС (m/z): 541 (M+H)+
(2) Гидрохлорид 4′-[2-[[(2R)-2-гидрокси-2-фенилэтил]амино]этил]-N-[(3-гидроксипропил)сульфонил]-3-(изопропилтио)-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,25 (6H, d, J=6,5 Hz), 1,85-1,99 (2H, m), 3,02-3,27 (6H, m), 3,49-3,58 (4H, m), 3,62-3,72 (1H, m), 4,76 (1H, br s), 4,95-5,04 (1H, m), 6,23 (1H, d, J=4 Hz), 7,31-7,42 (7H, m), 7,55-7,64 (2H, m), 7,70-7,74 (3H, m), 8,92 (1H, br s), 9,26 (1H, br s), 12,14 (1H, s)
(-)ESI-МС (m/z): 555 (M-H)-
(3) Гидрохлорид 3-(циклогексилокси)-4′-[2-[[(2R)-2-гидрокси-2-фенилэтил]амино]этил]-N-[(3-гидроксипропил)сульфонил]-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,34-2,01 (12H, m), 2,99-3,27 (6H, m), 3,46-3,59 (4H, m), 4,71-4,84 (2H, m), 4,94-5,04 (1H, m), 6,23 (1H, d, J=3,5 Hz), 7,32-7,43 (9H, m), 7,71-7,75 (3H, m)
(-)ESI-МС (m/z): 579 (M-H)-
(4) Дигидрохлорид 3-(циклогексилокси)-N-[(3-гидроксипропил)сульфонил]-4′-[2-[[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил]-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,35-2,02 (12H, m), 3,05-3,39 (6H, m), 3,48-3,60 (4H, m), 4,75-4,87 (1H, m), 5,27-5,35 (1H, m), 7,33-7,44 (4H, m), 7,71-7,75 (3H, m), 7,98 (1H, dd, J=5,5, 8,5 Hz), 8,49 (1H, d, J=8,5 Hz), 8,83-8,91 (2H, m), 9,30 (1H, br s), 9,41 (1H, br s), 11,18 (1H, s)
(-)ESI-МС (m/z): 580 (M-H)-
(5) Дигидрохлорид 3-(циклогексилокси)-4′-[2-[[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил]-N-[(2-метоксиэтил)сульфонил]-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,31-2,04 (10H, m), 3,04-3,50 (6H, m), 3,23 (3H, s), 3,72-3,84 (4H, m), 4,78-4,89 (1H, m), 5,27-5,37 (1H, m), 7,34-7,45 (4H, m), 7,68-7,79 (3H, m), 8,00 (1H, dd, J=5,5, 8,4 Hz), 8,51 (1H, d, J=8,4 Hz), 8,83-8,92 (2H, m), 9,33 (1H, br s), 9,45 (1H, br s), 11,19 (1H, s)
(-)ESI-МС (m/z): 580 (M-H)-
(6) Дигидрохлорид 3-(циклогексилокси)-N-[(2-гидроксиэтил)сульфонил]-4′-[2-[[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил]-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,30-2,01 (10H, m), 3,02-3,49 (6H, m), 3,67 (2H, t, J=6,0 Hz), 3,84 (2H, t, J=5,8 Hz), 4,75-4,89 (1H, m), 5,26-5,37 (1H, m), 7,32-7,45 (4H, m), 7,69-7,82 (3H, m), 7,97 (1H, d, J=5,4 Hz), 8,5 (1H, d, J=8,0 Hz), 8,82-8,93 (2H, m), 9,31 (1H, br s), 9,43 (1H, br s), 11,1 (1H, br s)
(-)ESI-МС (m/z): 566 (M-H)-
(7) Дигидрохлорид N-[(3-гидроксипропил)сульфонил]-4′-[2-[[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил-3-изопропокси-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,37 (6H, d, J=6 Hz), 1,81-1,96 (2H, m), 3,03-3,6 (8H, m), 4,91-5,03 (1H, m), 5,25-5,34 (1H, m), 7,32-7,44 (4H, m), 7,68-7,77 (3H, m), 7,96 (1H, dd, J=5,6, 8 Hz), 8,46 (1H, d, J=8 Hz), 8,8-8,89 (2H, m), 9,26 (1H, br s), 9,37 (1H, br s), 11,22 (1H, s)
(-)ESI-МС (m/z): 540 (M-H)-
(8) Гидрохлорид 3-(циклогексилокси)-N-[(2-гидроксиэтил)сульфонил]-4′-[2-[[(2R)-2-гидрокси-2-фенилэтил]амино]этил]-4-бифенилкарбоксамида
ЯМР (200 MHz, DMSO-d6, δ): 1,31-2,03 (10H, m), 3,00-3,29 (6H, m), 3,66 (2H, t, J=6 Hz), 3,79-3,87 (2H, m), 4,76-4,87 (1H, m), 4,95-5,11 (2H, m), 6,23 (1H, d, J=3,6 Hz), 7,31-7,44 (9H, m), 7,69-7,81 (3H, m)
(-)ESI-МС (m/z): 565 (M-H)-
Получение 2
Следующие соединения были получены способом, подобным способу примера 2.
(1) Метил 4′-[2-[(трет-бутоксикарбонил)[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил]-3-(циклогептилокси)-4-бифенилкарбоксилат
(+)ESI-МС (m/z): 589 (M+H)+
(2) Метил 4′-[3-[(трет-бутоксикарбонил)[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]пропил]-3-изопропокси-4-бифенилкарбоксилат
(+)ESI-МС (m/z): 549 (M+H)+, 571 (M+Na)+
Получение 3
К раствору метил 4′-[2-[(трет-бутоксикарбонил)[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил]-3-(циклогептилокси)-4-бифенилкарбоксилата (813 мг) в метаноле (8,1 мл) и тетрагидрофуране (2,4 мл) добавляли 1N раствор гидроксида натрия (4,14 мл), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакцию гасили путем добавления 1N раствора хлористоводородной кислоты (4,14 мл), и растворитель удаляли путем упаривания. Остаток подвергали хроматографии на силикагеле (элюент: смесь гексан/этилацетат) с получением 4′-[2-[(трет-бутоксикарбонил)[(2R)-2-гидрокси-2-(3-пиридил)этил]амино]этил]-3-(циклогептилокси)-4-бифенилкарбоновой кислоты (575 мг) в виде твердого вещества белого цвета.
(-)ESI-МС (m/z): 573 (M-H)-
Получение 4
К раствору 4-бром-2-циклопентилбензойной кислоты (4,05 г) в N,N-диметилформамиде (40 мл) добавляли N,N′-карбонилдиимидазол (2,68 г) при комнатной температуре, и смесь перемешивали в течение 4 часов. К смеси добавляли 3-(аминосульфонил)пропилацетат (3,0 г) и 1,8-диазабицикло[5.4.0] ундецен-7-ен (2,7 мл), и смесь перемешивали при 120°С в течение 20 часов. После охлаждения до комнатной температуры реакцию гасили путем добавления 1N раствора хлористоводородной кислоты (100 мл) и экстрагировали этилацетатом (100 мл, 50 мл). Объединенные экстракты промывали водой (100 мл × 2) и насыщенным раствором соли (100 мл) и сушили над сульфатом магния. Фильтрование с последующим упариванием привело к твердому веществу желтого цвета (6,77 г), которое подвергали хроматографии на силикагеле (элюент: смесь гексан/этилацетат) с получением 3-[[(4-бром-2-циклопентилбензоил)амино]сульфонил]пропилацетата (5,20 г) в виде твердого вещества белого цвета.
(-)ESI-МС (m/z): 430, 432 (M-H)-
Получение 5
Смесь 3-[[(4-бром-2-циклопентилбензоил)амино]сульфонил]пропилацетата (5,17 г), бис(пинаколато)диборона (3,34 г), [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II), комплекса с дихлорметаном (1:1, 977 мг), 1,1′-бис(дифенилфосфино)ферроцена (331 мг), ацетата калия (4,70 г) и 1,4-диоксана (52 мл) перемешивали при 95°С в течение 2 часов. После охлаждения до комнатной температуры реакцию гасили путем добавления 0,5N раствора хлористоводородной кислоты (100 мл) и экстрагировали этилацетатом (100 мл). Органический слой отделяли и промывали водой (100 мл) и 10% раствором хлорида натрия (100 мл). К органическому слою добавляли воду (100 мл), ацетат аммония (4,15 г) и периодат натрия (8,95 г). Смесь перемешивали при комнатной температуре в течение ночи. Нерастворимые твердые частицы отфильтровывали и промывали этилацетатом, и органический слой отделяли. Органический слой промывали 0,5N раствором хлористоводородной кислоты (100 мл) и насыщенным раствором соли (100 мл) и сушили над сульфатом магния. Фильтрование с последующим упариванием привело к твердому веществу коричневого цвета (6,62 г), которое подвергали хроматографии на силикагеле (элюент: смесь этилацетат/метанол) с получением [4-[[[[3-(ацетилокси)пропил]сульфонил]амино]карбонил]-3-циклопентилфенил]бороновой кислоты (3,34 г) в виде твердого вещества коричневого цвета.
(-)ESI-МС (m/z): 396 (M-H)-
Получение 6
[4-[[[[3-(Ацетилокси)пропил]сульфонил]амино]карбонил]-3-циклопентилфенил]бороновую кислоту (3,28 г) растворяли в 2,5N хлористом водороде в метаноле (20 мл), и смесь перемешивали при комнатной температуре в течение 17 часов. Растворитель удаляли упариванием с получением [3-циклопентил-4-[[[(3-гидроксипропил)сульфонил]амино]карбонил]фенил]бороновой кислоты (3,16 г) в виде твердого вещества коричневого цвета.
(-)ESI-МС (m/z): 354 (M-H)-
Получение 7
Смесь 2-бромэтанола (7,0 г) и тиоцианата калия (5,4 г) в метаноле (40 мл) кипятили с обратным холодильником в течение 7 часов. После удаления осадка фильтрованием фильтрат упаривали при пониженном давлении. Остаток суспендировали в смеси хлороформ/метанол (5/1). Осадок отфильтровывали. Фильтрат упаривали при пониженном давлении с получением тиоцианата (4,4 г). К смеси тиоцианата в смеси пиридин (4,8 мл)/дихлорметан (20 мл) добавляли уксусный ангидрид (5,3 мл) в дихлорметане (5 мл) при 5°С. Смесь перемешивали при комнатной температуре в течение 6 часов. Осадок отфильтровывали. Фильтрат промывали водой, сушили над сульфатом натрия и упаривали при пониженном давлении с получением 2-тиоцианатоэтилацетата (5,6 г).
ЯМР (200 MHz, DMSO-d6, δ): 2,06 (3H, s), 3,36 (2H, t, J=5,8 Hz), 4,32 (2H, t, J=5,8 Hz)
Получение 8
Раствор 2-тиоцианатоэтилацетата (5,6 г) в воде (20 мл) барботировали газообразным хлором в течение 20 минут при охлаждении льдом с перемешиванием с последующим экстрагированием дихлорметаном. После того как экстракт был высушен над сульфатом натрия растворитель упаривали при пониженном давлении с получением сульфонилхлорида (6,0 г, бесцветное масло). Сульфонилхлорид растворяли в дихлорметане (60 мл), и раствор барботировали газообразным аммиаком в течение 1 часа при охлаждении льдом. Осадок отфильтровывали, и фильтрат промывали водой, сушили над сульфатом натрия и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (смесь хлороформ/метанол = от 92/8 до 90/10) с получением 2-(аминосульфонил)этилацетата (385 мг).
ЯМР (200 MHz, CDCl3, δ): 2,11 (3H, s), 3,47 (2H, t, J=6,0 Hz), 4,54 (2H, t, J=6,0 Hz), 5,10 (2H, br s)
(-)ESI-МС (m/z): 166 (M-H)-
Получение 9
Смесь [(2-бромэтокси)метил]бензола (6,0 г) и сульфата натрия (3,9 г) в воде (12 мл) и этаноле (36 мл) кипятили с обратным холодильником в течение ночи. Смесь подкисляли с помощью концентрированн