Твердые солевые формы замещенного пирролом 2-индолинона
Иллюстрации
Показать всеИзобретение относится к новым солевым формам основания, где основание представляет собой (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидро-индол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты и где солевая форма выбрана из группы, состоящей из цитратной и фосфатной солей, и к их сольватам и полиморфам. Изобретение также относится к полиморфу (Форма 1) фосфатной соли по п.2, к фармацевтической композиции, к способу модулирования каталитической активности протеинкиназ, к способу предупреждения или лечения, связанного с протеинкиназой расстройства в организме, к способу получения кристаллов фосфатной соли основания по п.1, к способу получения полиморфов фосфатной соли по п.2, к способу получения кристаллов цитратной соли основания по п.1, а также к применению фосфатной соли по п.2, цитратной соли по п.5. Технический результат - получение новых биологически активных соединений, модулирующих активность протеинкиназ. 9 н. и 8 з.п. ф-лы, 8 табл., 6 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердым солевым формам 3-пиррол-замещенного 2-индолинонового соединения (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты. Вышеупомянутые соединения модулируют активность протеинкиназ (РК). Соединения по данному изобретению, следовательно, полезны в лечении расстройств, связанных с аномальной активностью РК. Раскрыты фармацевтические композиции, содержащие соли этого соединения, и способы получения этих солевых форм. Настоящее изобретение также относится к полиморфам фосфатной солевой формы этого амида.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Нижеследующее предложено только в качестве вспомогательной информации и не считается предшествующим уровнем техники по отношению к настоящему изобретению.
Твердые вещества, включая фармацевтические препараты, часто имеют более чем одну кристаллическую форму, и это известно как полиморфизм. Полиморфизм имеет место, когда соединение кристаллизуется во множестве разных твердых фаз, которые отличаются кристаллической упаковкой. Многочисленные примеры приведены в стандартных источниках информации о свойствах фармацевтических препаратов в твердом состоянии (Byrn, S.R., Solid-State Chemistry of Drugs, New York, Academic Press (1982); Kuhnert-Brandstatter, M., Thermomicroscopy In The Analysis of Pharmaceuticals, New York, Pergamon Press (1971) и Haleblian, J.K. and McCrone, W. Pharmaceutical applications of polymorphism. J.Pharm. Sci., 58, 911 (1969)). Byrn утверждает, что обычно полиморфы имеют разные физические характеристики, включая растворимость и физическую и химическую стабильность.
Из-за различий в молекулярной упаковке полиморфы могут различаться по влиянию на высвобождение лекарственного средства, по стабильности твердого состояния и по изготовлению фармацевтического препарата. Относительная стабильность и взаимопревращения полиморфов особенно важны для выбора товарного лекарственного средства. Пригодность полиморфа может зависеть от показателя физической стабильности. Например, выбор товарного лекарственного средства может зависеть от доступности и выбора подходящего полиморфа, имеющего желательные характеристики, такие как превосходная физическая стабильность или возможность крупномасштабного производства. Характеристики твердой лекарственной формы не должны лимитироваться полиморфными превращениями в течение срока хранения продукта. Важно отметить, что надежного способа прогнозирования достойных внимания кристаллических структур данного лекарственного средства или прогнозирования существования полиморфов с желательными физическими свойствами не существует.
Протеинкиназы (РК) представляют собой ферменты, которые катализируют фосфорилирование гидроксигрупп на тирозиновых, сериновых и треониновых остатках белков. Последствия этой кажущейся простой активности поразительны, так как фактически все аспекты жизни клетки (например рост клетки, дифференцировка и пролиферация) так или иначе зависят от активности РК. Кроме того, аномальная активность РК связывалась с хозяином расстройств, варьирующих от относительно не опасных для жизни заболеваний, таких как псориаз, до крайне опасных заболеваний, таких как глиобластома (рак мозга).
Рецепторные тирозинкиназы (RTK), класс РК, являются отличными кандидатами для направленной на молекулярную мишень терапии, так как они играют ключевую роль в контролировании пролиферации и выживания клеток и часто аномально регулируются при целом ряде злокачественных опухолей. Механизмы аномальной регуляции включают сверхэкспрессию (Her2/neu при раке молочной железы, рецептора эпидермального фактора роста при немелкоклеточном раке легкого), активирующие мутации (KIT при желудочно-кишечных стромальных опухолях, fms-родственной тирозинкиназы 3/FIk2 (FLT3) при остром миелогенном лейкозе) и аутокринные петли активации (сосудистого эндотелиального фактора роста/рецептора сосудистого эндотелиального фактора роста (VEGF/VEGFR) при меланоме, тромбоцитарного фактора роста/рецептора тромбоцитарного фактора роста (PDGF/PDGFR) при саркоме).
Аберрантно регулируемые RTK были описаны при сравнимых видах рака человека и собаки. Например, аберрантная экспрессия онкогена Met происходит как при человеческой, так и при собачьей остеосаркоме. Интересно, что сравнимые активирующие мутации в подмембранном (JM) домене c-kit наблюдаются в 50-90% случаях человеческих желудочно-кишечных стромальных опухолей (GIST) и в 30-50% случаях запущенных собачьих МСТ (тучноклеточные опухоли). Несмотря на то, что мутации при GIST у человека состоят из делеций в JM домене, а мутации при МСТ у собаки состоят из внутренних тандемных дупликаций (ITD) в JM домене, и те и другие приводят к конститутивному фосфорилированию KIT в отсутствие связывания с лигандом. RTK и их лиганды, VEGF, PDGF и FGF (фактор роста фибробластов) опосредуют неоваскуляризацию, известную как ангиогенез, в солидных опухолях. Следовательно, посредством ингибирования RTK можно ингибировать разрастание новых кровеносных сосудов в опухоли.
Агенты антиангиогенеза, класс молекул, которые ингибируют разрастание кровеносных сосудов в опухоли, оказывают значительно меньше токсическое воздействие на организм по сравнению с общепринятыми противораковыми лекарственными средствами. В патенте США 6573293, включенном в данное описание посредством ссылки, раскрывается, в числе других соединений, (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты (далее «Соединение I»). Оно имеет следующую структуру:
Соединение I представляет собой небольшую молекулу, которая обладает способностью модулировать РК. Следовательно, это соединение полезно в лечении расстройств, связанных с аномальной РК активностью. Оно является ингибитором RTK, PDGFR, VEGFR, KIT и FLT3. Было показано, что Соединение I ингибирует фосфорилирование KIT, останавливает пролиферацию клеток и индуцирует остановку клеточного цикла и апоптоз в злокачественных линиях тучных клеток in vitro, экспрессирующих разные формы мутантного KIT. Соединение I и родственные молекулы эффективны в предклинических моделях против опухолевых ксенотрансплантатов из клеточных линий, имеющих происхождение от различных человеческих опухолей.
Соединение I полезно для лечения раковых заболеваний у животных-компаньонов, в основном у собак, и также полезно для лечения, среди прочего, рака у человека. Такие раковые заболевания включают, но не ограничиваются ими, лейкоз, рак мозга, немелкоклеточный рак легкого, плоскоклеточную карциному, астроцитому, саркому Капоши, глиобластому, рак легкого, рак мочевого пузыря, рак в области головы и шеи, мелкоклеточный рак легкого, глиому, колоректальный рак, рак мочеполовых органов и желудочно-кишечный стромальный рак. Соединение I также полезно для лечения заболеваний, связанных со сверхэкспрессией тучных клеток, включая, но не ограничиваясь ими, мастоцитоз у людей и тучноклеточные опухоли у собак.
Недавно было показано, что Соединение I клинически эффективно против целого ряда спонтанных злокачественных образований у собак. В этом исследовании 11 из 22 собачьих МСТ продемонстрировали стойкие объективные ответные реакции (частичные ответные реакции и полные ответные реакции) на лечение Соединением I, и 9 из этих МСТ имели ITD (внутренняя тандемная дупликация) в JM домене с-kit.
Соединение I легко кристаллизуется. Его растворимость составляет примерно 10 мкг/мл в фосфатном буфере с рН 6 при 25°С. При синтезе этого соединения на его последней стадии из раствора в осадок выпадали очень мелкие частицы. Последующее выделение этих мелких частиц фильтрованием было медленным и приводило к образованию твердого осадка на фильтре после фильтрации. Существует потребность в соли Соединения I, которая имеет физическую стабильность и желательные физические свойства.
Краткое изложение сущности изобретения
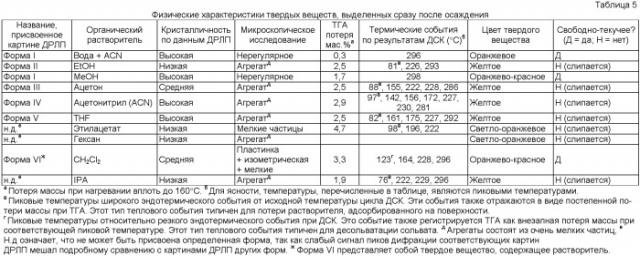
Данное изобретение относится к солевым формам Соединения I. Были синтезированы и здесь описаны пять разных солевых форм Соединения I (смотри Таблицу 1). Это гидрохлоридная, фумаратная, цитратная, фосфатная и аскорбатная соли Соединения I. Основываясь на результатах определения характеристик этих солей, фосфатная соль 1:1, фосфат Соединения I, была идентифицирована как солевая форма с превосходными характеристиками. Скрининг полиморфов выявил существование 10 полиморфов фосфата Соединения I, которые здесь названы как Формы I-Х.
В одном аспекте данного изобретения предложены две солевые формы Соединения I, где солевая форма выбрана из цитратной и фосфатной солей, и их сольваты и полиморфы. В одном воплощении выбрана фосфатная солевая форма с молекулярной формулой C22H25FN4O2·H3O4P. В другом воплощении выбрана фосфатная солевая форма с температурой плавления от примерно 285 до примерно 290°С. Фосфат Соединения I имеет структуру:
В другом воплощении выбрана цитратная соль, цитрат Соединения I, которая имеет молекулярную формулу C22H25FN4O2·C6H8O7. В еще одном воплощении выбрана цитратная солевая форма с температурой плавления от примерно 178 до примерно 183°С. Цитрат Соединения I имеет структуру:
Второй аспект данного изобретения составляет фармацевтическая композиция, содержащая фосфатную соль или цитратную соль Соединения I, или их сольваты, или полиморфы, и фармацевтически приемлемый носитель или эксципиент.
Третий аспект данного изобретения составляет способ модулирования каталитической активности протеинкиназ, включающий приведение указанной протеинкиназы в контакт с фосфатной или цитратной солями Соединения I, или их сольватами, или полиморфами. Протеинкиназа может быть выбрана из группы, состоящей из рецепторных тирозинкиназ, нерецепторных протеинтирозинкиназ и серин/треонин-протеинкиназ.
Четвертый аспект данного изобретения составляет способ предупреждения или лечения связанного с протеинкиназой расстройства в организме, включающий введение в указанный организм терапевтически эффективного количества фармацевтической композиции, содержащей фосфатную соль или цитратную соль Соединения I, или их сольваты, или полиморфы и фармацевтически приемлемый носитель или эксципиент. В одном воплощении организмом является человек. В другом воплощении организмом является животное-компаньон. В еще одном воплощении животным-компаньоном является кошка или собака. Связанное с протеинкиназой расстройство может быть выбрано из группы, состоящей из расстройства, связанного с рецепторной тирозинкиназой, расстройства, связанного с нерецепторной протеинтирозинкиназой, и расстройства, связанного с серин/треонин-протеинкиназой. Связанное с протеинкиназой расстройство может быть выбрано из группы, состоящей из расстройства, связанного с EGFR, расстройства, связанного с PDGFR, расстройства, связанного с IGFR, расстройства, связанного с c-kit, и расстройства, связанного с FLK. Такие расстройства включают, в качестве примера и не в качестве ограничения, лейкоз, рак мозга, немелкоклеточный рак легкого, плоскоклеточную карциному, астроцитому, саркому Капоши, глиобластому, рак легкого, рак мочевого пузыря, рак в области головы, рак в области шеи, меланому, рак яичника, рак предстательной железы, рак молочной железы, мелкоклеточный рак легкого, глиому, мастоцитоз, тучноклеточную опухоль, колоректальный рак, рак мочеполовой системы, желудочно-кишечный рак, диабет, аутоиммунное расстройство, гиперпролиферативное расстройство, рестеноз, фиброз, псориаз, болезнь фон Хеппеля-Линдау (von Heppel-Lindau), остеоартрит, ревматоидный артрит, ангиогенез, воспалительное расстройство, иммунологическое расстройство и сердечно-сосудистое расстройство.
Пятый аспект данного изобретения составляет способ получения кристаллов фосфатной соли основания (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты, включающий введение стехиометрического количества фосфорной кислоты в основание в растворе, содержащем растворитель или смесь растворителей, инициирование кристаллизации фосфатной соли в растворе, отделение кристаллов фосфатной соли от раствора растворителя и сушку кристаллов. Фосфорная кислота может быть введена в количестве, которое составляет 40% молярный избыток по отношению к основанию. Растворитель может содержать изопропанол. Стадия отделения кристаллов от раствора растворителя может включать добавление к раствору ацетонитрила и выпаривание раствора на роторном испарителе. Стадия отделения кристаллов от раствора растворителя также может включать фильтрование.
Шестой аспект данного изобретения составляет способ получения кристаллов цитратной соли основания (2-пирролидин-1-ил-этил)-амид 5-[5-фтор-2-оксо-1,2-дигидроиндол-(3Z)-илиденметил]-2,4-диметил-1Н-пиррол-3-карбоновой кислоты, включающий введение стехиометрического количества лимонной кислоты в основание в растворе, содержащем растворитель или смесь растворителей, инициирование кристаллизации цитратной соли в растворе, отделение кристаллов цитратной соли от раствора растворителя и сушку кристаллов. Может быть введена также лимонная кислота в количестве, которое составляет примерно 40% молярный избыток по отношению к основанию. Растворитель может содержать метанол. Стадия отделения кристаллов от раствора растворителя может включать добавление к раствору ацетонитрила и выпаривание раствора на роторном испарителе. Стадия отделения кристаллов от раствора растворителя может включать фильтрование.
В седьмом аспекте изобретения предложены полиморфы Формы I-Х (описанные здесь) фосфатной соли Соединения I. В одном воплощении предложена Форма I.
Восьмой аспект данного изобретения составляет фармацевтическую композицию, содержащую полиморф Формы I фосфата Соединения I и фармацевтически приемлемый носитель или эксципиент.
Девятый аспект данного изобретения составляет способ модулирования каталитической активности протеинкиназ, включающий приведение указанной протеинкиназы в контакт с полиморфом Формы I фосфата Соединения I.
Десятый аспект данного изобретения составляет способ предупреждения или лечения связанного с протеинкиназой расстройства в организме, включающий введение в указанный организм терапевтически эффективного количества полиморфа Формы I фосфата Соединения I. В одном воплощении организмом является человек или животное-компаньон. В другом воплощении животным-компаньоном является кошка или собака. Такие расстройства включают, в качестве примера и не в качестве ограничения, тучноклеточную опухоль и мастоцитоз.
Одиннадцатый аспект данного изобретения составляет способ получения полиморфов фосфата Соединения I, включающий введение фосфатной соли в раствор, содержащий растворитель или смесь растворителей, возможно добавление в раствор мостикового растворителя и отделение кристаллов полиморфа от раствора растворителя. Раствор может содержать воду плюс ацетонитрил. Раствор может содержать метанол. Мостиковым растворителем может быть метанол.
Двенадцатый аспект данного изобретения составляет применение фосфатных или цитратных солей Соединения I или полиморфа Формы I фосфатной соли в изготовлении лекарственного средства, полезного для лечения заболевания, опосредованного аномальной РК активностью.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
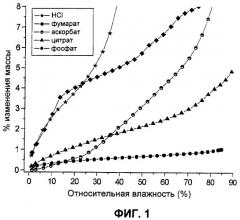
Фиг.1. Данные по влагопоглощению для солей Соединения I.
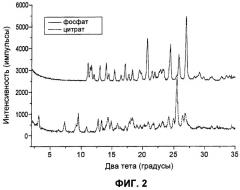
Фиг.2. Картины дифракции рентгеновских лучей на порошке цитрата Соединения I и фосфата Соединения I.
Фиг.3. Картины дифракции рентгеновских лучей на порошке десяти уникальных твердых веществ, полученных в результате скринингового исследования полиморфов (смотри Пример 5). Представлены Формы I-Х, как указано в Таблицах 5 и 6.
Фиг.4. Кривые ТГА (термогравиметрический анализ) твердых веществ из CH2Cl2 (Форма VI, сразу после осаждения), гексана (Форма VII, после стояния в течение ночи) и ацетонитрила (Форма VIII), после стояния в течение 3 суток).
Фиг.5. Результаты электрофореза на агарозном геле продуктов ПЦР из МСТ, оцененных в Примере 7. Дорожки 1-5 соответствуют пациентам 1-5 в Таблице 8; дорожки 6-14 соответствуют пациентам 6-14 в Таблице 8. Контроли состояли из продуктов ПЦР, генерированных из линии собачьих тучных клеток С2, содержащих ITD в 48 п.н. (дорожка 15) и из нормального собачьего мозжечка (дикий тип; дорожка 16).
Фиг.6. Снижение уровней МСТ фосфорилированной KIT и фосфорилированной регулируемой внеклеточным сигналом киназы (ERK)1/2 после разовой дозы фосфата Соединения I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения. Если не указано иное, следующие термины, использованные в данном описании и в формуле изобретения, имеют значения, рассматриваемые ниже.
Термин «С», когда он используется со ссылкой на температуру, означает стоградусную шкалу или температурную шкалу Цельсия.
Термин «каталитическая активность» относится к скорости фосфорилирования тирозина под влиянием, прямым или непрямым, RTK и/или СТК, или фосфорилирования серина и треонина под влиянием, прямым или непрямым, STK.
Термин «животное-компаньон» относится к домашним животным, составляющим компанию человеку, и включает, не ограничиваясь ими, кошками и собаками.
Термин «приведение в контакт» относится к сведению вместе соединения по настоящему изобретению и РК-мишени таким образом, что данное соединение может влиять на каталитическую активность РК либо прямо, т.е. взаимодействуя с самой киназой, либо опосредованно, т.е. через взаимодействие с другой молекулой, от которой зависит каталитическая активность киназы.
Термин «IC50» означает концентрацию тестируемого соединения, при которой достигается полумаксимальное ингибирование активности РК.
Термин «модуляция” или «модулирование» относится к изменению каталитической активности RTK, СТК и STK. В частности, модулирование относится к активации или ингибированию каталитической активности RTK, СТК и STK, предпочтительно к активации каталитической активности RTK, СТК и STK, в зависимости от концентрации соединения или соли, влиянию которых подвергаются RTK, СТК или STK, более предпочтительно к ингибированию каталитической активности RTK, СТК и STK.
Термин «РК» относится к рецепторной протеинтирозинкиназе (RTK), нерецепторной или «клеточной» тирозинкиназе (СТК) и к серин-треонинкиназам (STK).
Термин «полиморф» относится к твердой фазе вещества, которая проявляется в нескольких отличающихся формах вследствие разного расположения и/или конформации молекул в кристаллической решетке. Полиморфы обычно имеют разные химические и физические свойства.
Термин «фармацевтически приемлемый эксципиент» относится к любому веществу, отличающемуся от соединения по изобретению, добавленному в фармацевтическую композицию.
Термин «фармацевтическая композиция» относится к смеси одной или более солей по настоящему изобретению или к полиморфам таких солей, как описано здесь, с другими химическими компонентами, такими как физиологически/фармацевтически приемлемые носители и эксципиенты. Назначение фармацевтической композиции заключается в облегчении введения соединения в организм.
Термин «физиологически/фармацевтически приемлемый носитель» относится к носителю или разбавителю, который не вызывает значительного раздражения у организма и не аннулирует биологическую активность и свойства введенного соединения.
Термин «полиморф» также может быть определен как разные несольватированные кристаллические формы соединения. Этот термин также включает сольваты (т.е. формы, содержащие растворитель или воду), аморфные формы (т.е. некристаллические формы) и десольватированные сольваты (т.е. формы, которые могут быть получены только путем удаления растворителя из сольвата).
Термин «сольват» используется для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин «гидрат» используется, когда указанным растворителем является вода.
Термин «по существу не содержащий» по отношению к количеству определенного полиморфа в образце означает, что другие полиморфы присутствуют в количестве менее примерно 15 массовых процентов. В другом воплощении термин «по существу не содержащий» означает количество менее примерно 10 массовых процентов. В другом воплощении термин «по существу не содержащий» означает количество менее примерно 5 массовых процентов. В еще одном воплощении термин «по существу не содержащий» означает количество менее примерно 1 массового процента. Специалист в данной области поймет, что фраза «в количестве менее примерно 15 массовых процентов» означает, что интересующий полиморф присутствует в количестве более примерно 85 массовых процентов. Аналогично, фраза «менее примерно 10 массовых процентов» означает, что интересующий полиморф присутствует в количестве более примерно 90 массовых процентов и т.д.
Термин «терапевтически эффективное количество» относится к количеству вводимого соединения, которое будет предупреждать, частично снимать или облегчать один или более симптомов расстройства, которое лечат, или продлевать продолжительность жизни субъекта, которого лечат. В связи с лечением рака терапевтически эффективное количество относится к количеству, которое оказывает эффект:
(1) уменьшения размера опухоли;
(2) ингибирования (то есть замедления до некоторой степени или прекращения) метастазирования опухоли;
(3) ингибирования (то есть замедления до некоторой степени или прекращения) роста опухоли и/или
(4) облегчения до некоторой степени (или устранения) одного или более симптомов, ассоциированных с раком.
Для получения формы с лучшими физическими свойствами могут быть синтезированы разные солевые формы Соединения I. Соединение-основание может находиться в растворе. Раствором обычно является растворитель. В одном воплощении раствором является спирт. В другом воплощении растворителем может быть изопропанол, метанол, ацетонитрил или вода плюс ацетонитрил. Раствор также может содержать смесь растворителей.
Соли могут быть подвергнуты кристаллизации с использованием методики стехиометрического добавления/кристаллизации. В основание в растворе вводят стехиометрическое количество противоиона. В одном воплощении количество противоиона находится в соотношении 1:1 к основанию. В другом воплощении количество противоиона находится в молярном избытке от 0% до примерно 60% по отношению к основанию. В другом воплощении количество противоиона находится в молярном избытке от 10% до примерно 50% по отношению к основанию. В еще одном воплощении количество противоиона находится в молярном избытке примерно 40% по отношению к основанию. Противоионы могут включать гидрохлоридный, фумаратный, цитратный, фосфатный и аскорбатный ион. В одном воплощении противоионом является фосфатный ион. В другом воплощении противоионом является цитратный ион.
Затем инициируют кристаллизацию соли в растворе различными общепринятыми методами, включая охлаждение, выпаривание, обводнение и т.д., известные специалисту в данной области. Избыток растворителей может быть удален из образцов способами, известными специалисту в данной области. В одном воплощении растворители удаляют из раствора путем добавления ацетонитрила (ACN) и выпаривания раствора на роторном испарителе. Раствор можно выпаривать на роторном испарителе при температуре от примерно 40°С до примерно 60°С. В другом воплощении перед выпариванием на роторном испарителе в раствор могут быть добавлены дополнительные растворители (например, изопропанол и метилэтилкетон). Кристаллизация может быть проведена в темноте для предотвращения светоиндуцируемой изомеризации. В одном воплощении кристаллы удаляют фильтрованием. В другом воплощении фильтрация может быть осуществлена в окружающей лабораторной атмосфере.
Этими методами была осуществлена кристаллизация аскорбатной, цитратной, фумаратной, гидрохлоридной и фосфатной солей Соединения I. Конкретные примеры методов кристаллизации приведены ниже. Для определения чистоты полученного образца можно использовать ВЭЖХ (высокоэффективная жидкостная хроматография)-анализ. Физические свойства соединений могут быть определены известными специалисту тестами, включая определение температуры плавления, дифракцию рентгеновских лучей на порошке и динамическую гравиметрию влагопоглощения. Параметры для этих тестов описаны ниже.
Эти пять солевых форм описаны здесь (смотрите Таблицу 1). Эти соли Соединения I часто бывают гигроскопичными. Например, как можно видеть в Таблице 1, при влажности 80 процентов гидрохлоридная соль содержала примерно 20 процентов воды, фумаратная соль содержала примерно 9 процентов воды, и аскорбатная соль содержала примерно 6,5 процентов воды. Эта характеристика может затруднять использование соли в фармацевтическом препарате и может сокращать срок хранения препарата. Однако неожиданно было обнаружено, что две соли, фосфатная и цитратная, имеют низкое влагопоглощение и содержат примерно 1 процент и примерно 3,8 процента воды при влажности 80 процентов соответственно.
Основываясь на характеристиках этих солей, фосфатная соль 1:1, фосфат Соединения I, была идентифицирована как солевая форма с очень желательными характеристиками, включая хорошую кристалличность, низкое влагопоглощение, легкость кристаллизации, хорошую чистоту и отсутствие гидрата. Описано также десять полиморфов фосфата Соединения I, называемых здесь Формами I-Х. Цитратная соль также продемонстрировала желательные характеристики, такие как низкое влагопоглощение и хорошую кристалличность.
Полиморфы соединений по настоящему изобретению желательны, так как конкретный полиморф соединения может иметь лучшие физические и химические свойства, чем другие полиморфные формы того же самого соединения. Например, один полиморф может иметь повышенную растворимость в некоторых растворителях. Такая дополнительная растворимость может облегчать приготовление препарата или введение соединений по настоящему изобретению. Разные полиморфы также могут иметь разные механические свойства (например, разную прессуемость, уплотняемость, таблетируемость), которые могут влиять на эффективность таблетирования лекарственного средства и, таким образом, влиять на препарат отношению к другому полиморфу. Разные полиморфы также могут иметь разную физическую (превращение в твердом состоянии из метастабильного полиморфа в более стабильный полиморф) и химическую (реакционную способность) стабильность. В одном воплощении настоящего изобретения предусмотрен полиморф Форма I фосфата Соединения I, как описано здесь.
В воплощениях настоящего изобретения предусмотрены чистые отдельные полиморфы, а также смеси, содержащие два или более разных полиморфа. Чистый отдельный полиморф может по существу не содержать других полиморфов.
В некоторых воплощениях настоящего изобретения предусматриваются фармацевтические композиции, содержащие одну (один) или более солей Соединения I или полиморфов таких солей, как описано здесь, и фармацевтически приемлемый носитель или эксципиент.
Полиморфы были образованы из концентрированных растворов фосфата Соединения I. Концентрированные растворы могут иметь содержание фосфата Соединения I в пределах от 60 до 100 мг на мл раствора. В одном воплощении примерно 70 мг Соединения I может быть растворено в 1 мл фосфорной кислоты.
Кристаллы полиморфа могут быть осаждены из растворителя различными методами, включая, например, медленное выпаривание, охлаждение пересыщенного раствора, осаждение из антирастворителей и т.д., которые известны специалисту в данной области. В одном воплощении кристаллы полиморфа образуют добавлением раствора к антирастворителю. Антирастворитель может представлять собой воду плюс ацетонитрил (ACN), этанол, метанол, ацетон, ацетонитрил, THF, этилацетат, гексан, метиленхлорид (CH2Cl2), изопропиловый спирт (IPA), метилэтилкетон (МЕК) и диоксан. В одном воплощении может быть добавлен дополнительный растворитель (например, метанол). В другом воплощении образцы оставляют стоять в течение ночи, после чего кристаллы извлекают. В еще одном воплощении образцы оставляют стоять в течение трех суток, после чего кристаллы извлекают.
Кристаллы могут быть охарактеризованы с использованием стандартных методов, известных специалисту в данной области, включая ДРЛП (дифракция рентгеновских лучей на порошке), динамическую гравиметрию влагопоглощения, дифференциальную сканирующую калориметрию, термогравиметрический анализ и оптическую микроскопию. Эти методы описаны ниже.
Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения будут совершенно очевидными специалистам в данной области. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences. 19th Edition (Mack Publishing Company, 1995).
Выбор фармацевтически приемлемого эксципиента в значительной степени будет зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Примеры эксципиентов включают, без ограничений, карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Носители и эксципиенты для приготовления препаратов фармацевтически приемлемых композиций, содержащих Соединение I, общеизвестны в данной области и раскрыты, например, в патенте США №6573293, который во всей его полноте включен в данное описание. Способы введения для таких композиций также известны в данной области и также описаны, например, в патенте США №6573293. Аналогичные способы также могут быть использованы для приготовления и введения фармацевтически приемлемых композиций солей Соединения I или полиморфов таких солей по данному изобретению.
Подходящий препарат зависит от выбранного пути введения. Для введения инъекцией соединения по настоящему изобретению могут быть приготовлены в виде препаратов в водных растворах, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или буфер на основе физиологического раствора. Для трансмукозального введения в препарате используют пенетранты, соответствующие барьеру, через который необходимо проникать. Такие пенетранты известны в данной области. Для парентерального введения, например, посредством болюсной инъекции или непрерывной инфузии, препараты могут быть представлены в стандартных лекарственных формах, таких как, например, ампулы или в многодозовые контейнеры. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать вспомогательные технологические вещества, такие как суспендирующие, стабилизирующие или диспергирующие агенты.
Соединения по изобретению можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, внинтракраниальное, внутримышечное, интрасиновиальное и подкожное. Подходящие устройства для парентерального введения включают игольные (в том числе микроигольные) инъекторы, безыгольные инъекторы и оборудование для инфузии. Парентеральные препараты обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно доведенные до рН от 3 до 9), но для некоторых применений они могут быть более подходящим образом приготовлены в виде стерильного неводного раствора или в высушенной форме, которую используют совместно с подходящим разбавителем, таким как стерильная апирогенная вода. Дополнительно, суспензии соединений по настоящему изобретению могут быть приготовлены в липофильном носителе. Подходящие липофильные носители включают нелетучие жидкие масла, такие как кунжутное масло, синтетические эфиры жирных кислот, такие как этилолеат и триглицериды, или такие вещества, как липосомы.
Соединения по изобретению можно вводить перорально. Пероральное введение может включать проглатывание, так что соединение поступает в желудочно-кишечный тракт, и/или буккальное, лингвальное или сублингвальное введение, посредством которых соединение поступает в кровоток непосредственно из полости рта. Для перорального введения соединения могут быть приготовлены в виде препаратов путем объединения соединений по настоящему изобретению с фармацевтически приемлемыми носителями, общеизвестными в данной области.
Препараты, подходящие для перорального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (включая пастилки с жидким наполнителем); жевательные резинки; гели; быстрораспадающиеся лекарственные формы; пленки; овули; спреи и буккальные/мукоадгезивные пластыри.
Соединения по данному изобретению также можно вводить местно, (интра)дермально или трансдермально в кожу или слизистую оболочку. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки, импланты, губки, волокна, бандажи и микроэмульсии. Также можно использовать липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть введены усилители проницаемости (смотри, например, J Pharm Sci, 88 (10), 955-958 by Finnin and Morgan (октябрь 1999)). Другие способы местного введения включают доставку электропорацией, ионтофорезом, фонофорезом, сонофорезом и микроигольную или безыгольную (например, Powderject™, Bioject™ и т.д.) инъекцию.
Соединения по настоящему изобретению могут быть приготовлены в виде препаратов для ректального введения, таких как суппозитории или удерживающие клизмы, с использованием, например, традиционных суппозиторных основ, таких как масло какао или другие глицериды.
Соединения по настоящему изобретению также могут существовать в несольватированной и сольватированной формах.
Воплощения настоящего изобретения также предусматривают способ модулирования каталитической активности РК, включающий приведение указанной РК в контакт с одной или более чем одной солями Соединения I или полиморфами таких солей по настоящему изобретению. Такое «контактирование» может быть осуществлено «in vitro», т.е. в пробирке, чашке Петри или тому подобном. В пробирке в контактировании могут участвовать только соединение и интересующая РК или могут участвовать целые клетки. Можно также выдерживать или выращивать клетки в культуральных чашках и приводить их в контакт с соединением в этой среде. В данном случае способность конкретного соединения воздействовать на связанное с РК расстройство, т.е. IC50 соединения (определено ниже), может быть определена перед попыткой использования соединений in vivo с более сложными живыми организмами. Для клеток, находящихся вне организма, существуют множество методов приведения РК в контакт с соединениями, включая, без ограничений, прямую микроинъекцию в клетку и многочисленные методики с трансмембранными переносчиками, и их хорошо знают специалисты в данной области.
Воплощения настоящего изобретения предусматривают способ лечения или предупреждения связанного с протеинкиназой расстройства в организме (например, у животного-компаньона или человека), включающий введение в организм терапевтически эффективного количества фармацевтической композиции, содержащей одну или более солей Соединения) или полиморфов таких солей по настоящему изобретению и фармацевтически приемлемый носитель или эксципиент.
В одном воплощении настоящего изобретения связанное с протеинкиназой расстройство выбрано из группы, состоящей из расстрой