Состав, содержащий твердую дисперсию базедоксифен ацетата
Иллюстрации
Показать всеИзобретение относится к фармакологии. Твердая фармацевтическая дисперсия содержит базедоксифен ацетат, диспергированный в диспергирующем агенте, при этом указанный диспергирующий агент содержит поливинилпирролидон, полоксамер, полиэтиленгликоль или смесь, или сополимер указанных веществ. Изобретение относится также к составам, содержащим указанную дисперсию, способам получения твердой фармацевтической дисперсии, содержащей базедоксифен ацетат, и составам и лекарственной форме, содержащим твердую фармацевтическую дисперсию, содержащую базедоксифен ацетат для лечения заболевания или синдрома, связанного с дефицитом или избытком эстрогена, заболевания, или нарушения, связанного с пролиферацией или патологическим развитием эндометриальных тканей, снижения уровня холестерина, ингибирования потери костной ткани и лечения рака молочной железы. Изобретение относится также к способам лечения млекопитающих, имеющих заболевание или синдром, связанные с дефицитом или избытком эстрогена, или имеющих заболевание или расстройство, связанные с пролиферацией или патологическим развитием эндометриальных тканей, или снижения уровня холестерина у млекопитающего, ингибирования потери костной ткани у млекопитающего или лечения рака молочной железы у млекопитающего, лечения одного или нескольких вазомоторных нарушений у женщин, находящихся в постменапаузе, включающим введение терапевтически эффективного количества твердой фармацевтической дисперсии, а также к применению твердой фармацевтической дисперсии, содержащей базедоксифен ацетат, для получения лекарственного препарата для лечения заболевания или синдрома, связанного с дефицитом или избытком эстрогена, расстройства, связанного с пролиферацией или патологическим развитием эндометриальных тканей, для снижения холестерина, ингибирования потери костной ткани и лечения рака молочной железы. Изобретение обеспечивает повышение эффективности лечения. 14 н. и 24 з.п. ф-лы, 5 табл., 2 ил.
Реферат
Данное изобретение относится к твердым дисперсиям селективного модулятора эстрогенового рецептора - 1-[4-(2-азепан-1-ил-этокси)-бензил]-2-(4-гидрокси-фенил)-3-метил-1Н-индол-5-ол уксусной кислоты (базедоксифен ацетата) и составам, содержащим указанные дисперсии.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Базедоксифен ацетат (1-[4-(2-азепан-1-ил-этокси)-бензил]-2-(4-гидрокси-фенил)-3-метил-1Н-индол-5-ол уксусная кислота), имеющий химическую формулу, представленную ниже:
принадлежит к классу лекарств, обычно относящихся к селективным модуляторам эстрогенового рецептора (СМЭР). Как и свойственно селективным модуляторам эстрогеновых рецепторов, базедоксифен демонстрирует сродство к рецептору эстрогена (ЭР), но при этом проявляет тканеспецифичное эстрогенподобное действие. Например, базедоксифен ацетат оказывает незначительную (или не оказывает вовсе) стимуляцию маточного ответа в преклинических моделях маточной стимуляции. Однако базедоксифен ацетат действует как агонист эстрогена в отношении предотвращения потери костной ткани и уменьшения уровня холестерина в модельной системе овариэктомированных крыс с остеопенией. В линии клеток MCF-7 (линия клеток рака молочной железы человека) базедоксифен ацетат проявляет себя как антагонист эстрогена. Эти данные демонстрируют, что базедоксифен ацетат обладает эстрогенподобным действием на костные и липидные параметры сердечно-сосудистой системы и антиэстрогенным действием на маточную ткань и ткань молочной железы, и, таким образом, может быть использован в лечении ряда различных заболеваний или болезненных состояний, в которых участвует рецептор эстрогена.
Патенты США 5,998,402 и 6,479,535 описывают способ получения базедоксифен ацетата. Описание способа синтетического получения базедоксифен ацетата также представлено в непатентной литературе. См., например, Миллер с соавт. (Miller et al., J. Meet. Chem., 2001, 44, 1654-1657). Кроме того, описание биологической активности лекарства также представлено в непатентной литературе (например, Miller et al., J. Med. Chem., 2002, 27(2), 117-121). Рецептуры базедоксифен ацетата также представлены в патентной публикации США No.2002/0031548 А1.
Так как ведется постоянный поиск улучшенных лекарственных рецептур, обладающих, например, улучшенной биодоступностью, существует постоянная потребность в новых рецептурах существующих молекул лекарств. Описанные здесь твердые дисперсии базедоксифен ацетата и их составы помогают решить те или иные проблемы.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает твердую дисперсию, включающую базедоксифен ацетат, диспергированный в диспергирующем агенте.
Данное изобретение обеспечивает также состав, содержащий описанную здесь твердую дисперсию и фармацевтически приемлемый носитель.
Данное изобретение представляет собой лекарственную форму, содержащую описанную здесь твердую дисперсию.
Согласно некоторым способам реализации данное изобретение обеспечивает способ приготовления описанной здесь твердой дисперсии, включающий:
а) смешение базедоксифен ацетата и диспергирующего агента в растворе; и
б) удаление растворителя с образованием твердой дисперсии.
Согласно другим способам реализации данное изобретение представляет способ приготовления описанной здесь твердой дисперсии, включающий
а) смешение базедоксифен ацетата с расплавленным диспергирующим агентом с образованием жидкой смеси; и
б) затвердевание жидкой смеси с образованием твердой дисперсии.
Согласно другим способам реализации данное изобретение обеспечивает способ лечения млекопитающих, имеющих заболевания или расстройства, связанные с дефицитом эстрогена или избытком эстрогена, включающий введение млекопитающему терапевтически эффективного количества описанной здесь твердой дисперсии.
Согласно другим способам реализации данное изобретение обеспечивает способ снижения уровня холестерина у млекопитающего, включающий введение терапевтически эффективного количества описанной здесь твердой дисперсии.
Согласно другим способам реализации данное изобретение, кроме того, обеспечивает способ ингибирования потери костной ткани, включающий введение терапевтически эффективного количества описанной здесь твердой дисперсии.
Согласно еще одним способам реализации настоящее изобретение обеспечивает способ лечения рака молочной железы, включающий введение терапевтически эффективного количества описанной здесь твердой дисперсии.
Согласно другим способам реализации данное изобретение обеспечивает способ лечения женщины в постклимактерическом периоде с одним или более вазомоторными нарушениями путем введения терапевтически эффективного количества описанной здесь твердой дисперсии.
Настоящее изобретение, кроме того, обеспечивает твердую дисперсию для использования в терапии.
Настоящее изобретение также обеспечивает применение твердой дисперсии для приготовления лекарства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
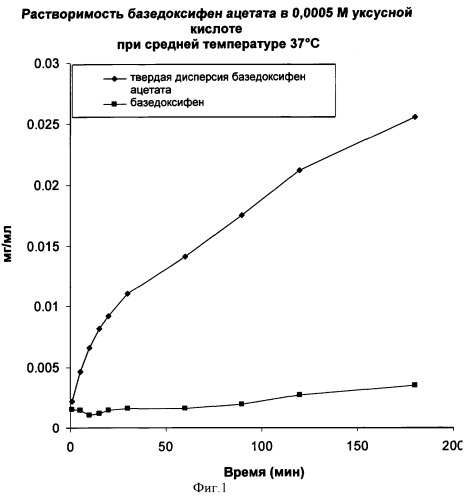
На Фигуре 1 представлен график скорости растворения базедоксифен ацетата в форме твердых кристаллов и в форме твердой дисперсии с ПВП согласно Примеру 3.
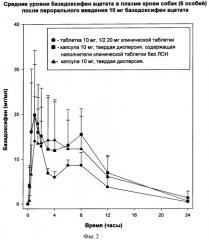
На Фигуре 2 представлен график сравнения биологической доступности базедоксифен ацетата у собак для смесей, содержащих дисперсные и недисперсные рецептуры, согласно Примеру 4.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение обеспечивает, в частности, твердые дисперсии базедоксифен ацетата (БКА) и составы, содержащие такие дисперсии, имеющие улучшенные параметры в отношении растворимости, биодоступности и подобных свойств. Твердые дисперсии согласно данному изобретению имеют повышенную растворимость и биодоступность по сравнению, например, с кристаллическим или микрокристаллическим БКА. Повышенная биодоступность, свойственная твердой дисперсии БКА, имеет многочисленные преимущества, включающие назначение более низких доз для введения, что, таким образом, позволяет уменьшить нежелательные побочные эффекты и снизить различие в достигаемых эффектах для разных пациентов.
Составы согласно данному изобретению содержат, например, БКА, диспергированный в диспрегирующем агенте. В некоторых способах реализации весовое соотношение БКА к диспрегирующему агенту варьирует от примерно 1:99 до примерно 99:1. В других - от примерно 1:99 до примерно 75:25 или же от примерно 1:99 до примерно 60:40. В других способах реализации весовое соотношение БКА к диспергирующему агенту составляет от примерно 1:99 до примерно 15:85; от примерно 1:99 до примерно 10:90 или от примерно 1:99 до примерно 5:95. В других способах реализации весовое соотношение БКА к диспергирующему агенту составляет примерно 5:95. В некоторых способах реализации весовое соотношение БКА к диспергирующему агенту составляет от примерно 25:75 до примерно 75:25; от примерно 40:60 до примерно 60:40 или примерно 1:1. В некоторых способах реализации весовое соотношение БКА к диспергирующему агенту составляет примерно 1:1.
Используемый здесь термин "диспрегирующий агент" относится к любому веществу или смеси веществ, которые действуют как диспергирующая среда для молекул/частиц базедоксифен ацетата. Диспергирующий агент обычно состоит из фармацевтически приемлемого вещества, которое не оказывает заметного влияния на фармацевтическое действие БКА. Применяемое здесь словосочетание "фармацевтически приемлемый" относится к тем веществам, которые включены в известные медицинские документы, подходят для использования в контакте с тканями человека и животных, т.е. не чрезмерно токсичны, не вызывают раздражения или аллергических реакций или других проблем или осложнений, соответствуют разумному соотношению риска и пользы. В некоторых способах реализации диспергирующий агент является твердым при комнатной тепературе (т.е. около 22°С). В других способах реализации диспергирующий агент плавится при температуре между примерно 30-100°С. В других способах реализации диспергирующий агент растворим в органическом растворителе.
Примеры диспергирующих агентов включают без ограничения полимеры, такие как целлюлозы (например, карбоксиметилцеллюлозы, метилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы); гиалуронаты; альгинаты; полисахариды, гетерополисахариды (пектины); полоксамеры, полоксамины; этиленвинилацетаты; полиэтиленгликоли; декстраны; поливинлпироллидоны; хитозаны; поливиниловые спирты; пропиленгликоли; поливинилацетаты; фосфатидилхолины (лецитины); миглиоли; полимолочная кислота; полигидроксимасляная кислоты; смесь из двух или более кислот, их сополимеры, их производные и тому подобное. Другие примеры диспергирующих агентов включают такие системы сополимеров, как полиэтилен гликоль-полимолочная кислота (ПЭГ-ПМК), полиэтилен гликоль-полигидроксимасляная кислота (ПЭГ-ПГМК), поливинилпирролидон-поливиниловый спирт (ПВП-ПВС) и производные сополимеры, такие как сополимеры производных N-винилпурина (или пиримидина) и N-винилпирролидон.
В некоторых способах реализации диспергирующий агент содержит поливинилпирролидон (ПВП) или его производные. ПВП является полиамидом, который формирует комплексы с большим количеством веществ и считается физиологически и химически инертными. Примеры подходящих ПВП включают поливинилпирролидоны, имеющие средний молекулярный вес примерно от 10000 до примерно 50000. В некоторых способах реализации поливинилпиролидон имеет средний молекулярный вес примерно от 10000 до примерно 20000. В других способах реализации поливинилпиролидон имеет молекулярный вес примерно от 15 000 до примерно 20000. Примером подходящего ПВП является ПВП К-17 (PLASDONE povidone, ISP Technologies, Ltd.). В некоторых способах реализации диспергирующий агент состоит в основном из ПВП или его производного.
В некоторых способах реализации диспергирующий агент содержит блок-сополимер этилена и пропиленгликоля, часто называемый Полоксамером. Одним из подходящих примеров Полоксамеров является Полоксамер 188 (LUTROL F 68, BASF), Полоксамер 407 (LUTROL F 127, BASF) и им подобные. В некоторых способах реализации диспергирующим агентом является Полоксамер 188.
В некоторых способах реализации диспрегирующий агент содержит полиэтиленгликоль (ПЭГ). К подходящим ПЭГ относятся: ПЭГ 200, 300, 400, 600, 1000, 1450, 3350, 4000, 6000, 8000, 10000, 20000, их смеси и им подобные. В некоторых способах реализации диспергирующим агентом является ПЭГ 1450.
Дисперсии БКА данного изобретения могут быть получены любым из многих способов, в результате которых получается, например, твердая дисперсия аморфного БКА. В приведенном способе БКА (в любой форме, например в кристаллической, аморфной и т.д.) и диспергирующий агент могут быть растворены в диспергирующем растворителе (вместе или по отдельности и затем объединены) в желаемых весовых соотношениях, и затем диспергирующий растворитель удаляют для получения желаемой твердой дисперсии. Диспергирующий растворитель может быть водным или органическим. Подходящие органические растворители включают спирты, эфиры, гидрокарбонаты, галогенированные гидрокарбонаты, нитрилы, их смеси и подобные вещества. В некоторых способах реализации органический растворитель является летучим растворителем, таким как метанол, этанол, изопропанол, диэтиловый эфир, пентан, гексан, бензен, дихлорметан, ацетонитрил, их смесями и подобными веществами. В некоторых способах реализации органическим растворителем является такой спирт как метанол, этанол, н-пропанол, их смеси и подобные вещества. В некоторых способах реализации органическим растворителем является этанол.
В другом примере БКА и диспергирующий агент могут быть смешаны в желаемом весовом соотношении, при этом один из них или оба агента (БКА и диспергирующий агент) находится (ятся) в жидком состоянии (например, в расплаве), и затем жидкая смесь затвердевает для образования желаемой твердой дисперсии. Согласно таким способам реализации БКА и диспергирующий агент могут быть смешаны, когда по крайней мере один из компонентов (БКА или диспергирующий агент) находится в расплавленном состоянии. Полученная в результате смесь затвердевает в результате охлаждения до температуры, достаточной для ее затвердевания. В некоторых способах реализации смесь охлаждают до 25°С или ниже. В некоторых способах реализации БКА смешивают с расплавленным диспергирующим агентом и полученную в результате смесь охлаждают до температуры ниже точки плавления смеси для образования твердой дисперсии. В других способах реализации диспергирующий агент нагревают до температуры между примерно 30 и 200°С, между примерно 30 и 150°С, или между примерно 30 и 100°С, которая является температурой, равной или выше точки плавления диспергирующего агента. В других способах реализации диспергирующий агент нагревают до температуры выше примерно 30, 40, 50, 60, 70, 80 или 90°С. Эти и другие способы являются стандартными техническими приемами, подходящими для приготовления дисперсии БКА данного изобретения.
В некоторых способах реализации твердые дисперсии согласно данному изобретению характеризуются равновесной растворимостью в 0.0005М уксусной кислоте при температуре от примерно 20 до примерно 26°С, которая является больше, чем температура для кристаллического или микрокристаллического базедоксифен ацетата. В других способах реализации твердые дисперсии данного изобретения характеризуются равновесной растворимостью в 0,0005М уксусной кислоте при температуре от примерно 20 до примерно 26°С, которая составляет, по крайней мере, примерно 8, 10, 12, 14, 16, или 19 мг/мл. Равновесная растворимость может быть измерена стандартными способами, описанными в Примере 2.
В некоторых примерах реализации твердые дисперсии согласно данному изобретению характеризуются тем, что дозированная лекарственная форма, содержащая примерно 10 мг суммарно базедоксифен ацетата в твердой дисперсии, характеризуется значением ППК0-24, большим, чем примерно 140, 150, 160 170 или 180 нг·час/мл, при пероральном введении млекопитающему. В других способах реализации твердые дисперсии данного изобретения характеризуются тем, что дозированная лекарственная форма, содержащая около 10 мг суммарно базедоксифен ацетата в твердой дисперсии, характеризуется следующими величинами:
a) ППК0-24 от примерно 140 до примерно 250 нг·час/мл;
b) Cmax примерно от 12 до 30 нг/мл;
c) tmax примерно от 1.0 до 3.5 час,
при пероральном введении млекопитающему. Способы измерения фармакокинетических параметров ППК0-24 (площадь под кривой в течение 24 часов), Cmax и tmax хорошо известны и описаны, например, в Примере 4.
Дозирование и рецептура:
Твердые дисперсии, описанные здесь, могут быть получены для введения пациенту любым способом из множества доступных способов. В некоторых способах реализации твердые дисперсии могут быть введены отдельно, т.е. без добавления наполнителей или других добавок. Например, твердые лекарственные формы (таблетки, капсулы и т.д.), содержащие более чем примерно 95%, 98%, или 99% (по весу) описанной здесь твердой дисперсии, могут быть введены пациенту непосредственно.
В некоторых способах реализации твердые дисперсии объединяют с одним или более фармацевтически приемлемым носителем (наполнителем) с тем, чтобы сформировать фармацевтический состав для введения пациенту. Этот состав может содержать любое количество твердой дисперсии. В некоторых способах реализации состав содержит примерно от 1 до 99% по весу твердой дисперсии. В других способах реализации состав содержит примерно от 1 до 50% по весу твердой дисперсии. В других способах реализации состав содержит примерно от 1 до 30% по весу твердой дисперсии. В других способах реализации состав содержит примерно от 1 до 20% по весу твердой дисперсии. В других же способах реализации состав содержит примерно от 1 до 10% по весу твердой дисперсии.
Рецептуры, содержащие представленные твердые дисперсии, могут быть введены нуждающемуся в них пациенту в виде суточных доз, содержащих от 0,1 до 1000 мг базедоксифена ацетата. Предпочтительный диапазон дозы составляет от 10 до примерно 600 мг/день, более предпочтительно от 10 до примерно 60 мг/день. Дозирование может быть или в виде однократной дозы, или в виде двух и более дробных доз в день. Такие дозы могут быть введены любым способом, который способствует введению соединения в кровяное русло, включая оральный способ, через имплантат, парентерально, вагинально, ректально и трансдермально.
Трансдермальное введение включает все способы введения через поверхность тела и внутренние проводящие пути, включая эпителиальные и слизистые ткани. Такое введение может быть в форме лосьона, крема, коллоида, пены, пластыря, суспензии и др.
Оральные рецептуры, содержащие твердые дисперсии согласно настоящему изобретению, могут включать любые традиционно используемые оральные формы, включая таблетки, капсулы, защечные формы, драже, пастилки, а также жидкости, суспензии для ротовой полости и подобные формы. Капсулы или таблетки, содержащие данную твердую дисперсию, могут быть объединены со смесями других активных компонентов или с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный или тапиоковый крахмал), сахарами, искусственными подсластителями, порошкообразной целлюлозой (такой как кристаллическая и микрокристаллическая), пудрами, желатинами, камедями и т.д.
Таблеточные рецептуры могут быть приготовлены способами обычного прессования, влажной или сухой грануляции с использованием фармацевтически приемлемых растворителей (наполнителей), связующих агентов, смазывающих веществ, дезинтегрантов, суспендирующих или стабилизирующих агентов, включая, без ограничения, стеарат магния, стеариновую кислоту, тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, кальций карбоксиметилцеллюлозы, поливинилпирролидон, желатин, альгиновую кислоту, аравийскую камедь, ксантановую камедь, цитрата натрия, сложные силикатов, карбонат кальция, глицин, декстрин, сахарозу, сорбитол, дикальциевый фосфат, сульфат кальция, лактозу, каолин, маннитол, хлорид натрия, тальк, сухие крахмалы, порошковый сахар. В случае использования рецептур для орального введения можно применять стандартные рецептуры или спансулы (spansules) с отложенным или замедленным высвобождением. Рецептуры суппозиториев могут быть приготовлены с использованием традиционных материалов, таких как кокосовое масло, с добавлением или без добавления восков для повышения точки плавления суппозиториев и глицерина. Также можно использовать водорастворимые основы для суппозиториев, например полиэтиленгликоли различного молекулярного веса.
Пленочные покрытия, используемые с рецептурами данного изобретения, хорошо известны и в общем случае состоят из полимера (обычно полимера целлюлозного типа), красителя и пластификатора. Дополнительные ингредиенты, такие как смачивающие агенты, сахара, ароматизаторы, масла и смазывающие вещества, могут быть включены в составы пленочных покрытий для придания им определенных свойств. Составы и рецептуры, кроме того, могут комбинироваться и обрабатываться как твердые, а затем помещаться в капсулы, такие как желатиновая капсула.
Наполнитель или разбавитель могут включать любую субстанцию, известную в данной области, которую используют для приготовления твердых оральных рецептур. Фармацевтически приемлемые наполнители могут быть выбраны из, например, лактозы, микрокристаллической целлюлозы, сахарозы, маннитола, фосфата кальция, карбоната кальция, порошковой целлюлозы, мальтодекстрина, сорбитола, крахмала, ксилитола и подобных веществ.
Данные рецептуры могут также включать дезинтегранты. Эти дезинтегранты, приемлемые для использования в данном изобретении, также могут быть выбраны из известных в данной области веществ, например прежелатинизированного крахмала или натрия крахмал гликолата. К другим приемлемым дезинтеграторам относятся: кроскармелоза натрия, кросповидон, крахмал, альгиновая кислота, альгинат натрия, глины (т.е. вигум (veegum) или ксантиновая камедь), целлюлозные хлопья, ионообменные смолы или шипучие системы, например системы с использованием пищевых кислот (таких как лимонная кислота, винная кислота, яблочная кислота, фумаровая кислота, молочная кислота, адипиновая кислота, аскорбиновая кислота, аспарагиновая кислота, эриторбовая кислота, глутаминовая кислота и янтарная кислота) и щелочных карбонатных компонентов (таких как бикарбонат натрия, карбонат кальция, карбонат магния, карбонат калия, карбонат аммония и т.п.). Доля дезинтегранта(ов), используемого здесь, может составлять примерно от 4% до примерно 40% от веса смеси, предпочтительно, примерно от 15% до примерно 35%, еще более предпочтительно, примерно от 20% до примерно 35%.
Некоторые компоненты могут иметь разнообразные функции в рецептурах данного изобретения, действуя, например, как наполнитель и как дезинтегрант, и их функция в определенной рецептуре может быть единственной, даже если их свойства приводят к множественной функциональности.
Фармацевтические рецептуры и системы наполнителей, представленные здесь, также могут содержать антиоксидант или смесь антиоксидантов, таких как аскорбиновая кислота. Могут использоваться и другие антиоксиданты, такие как аскорбат натрия, и аскорбилпальмитат, желательно в сочетании с аскорбиновой кислотой. Примерное содержание антиоксиданта(ов) может быть от 0.05% до 15%, от 0.5% до 15% и от 0.5% до 5% от общего веса. В некоторых способах реализации фармацевтические рецептуры не содержат антиоксидантов.
Фармацевтические составы базедоксифен ацетата могут включать стероидные эстрогены, такие как конъюгированные эстрогены, USP (Фармакопея США). Количество базедоксифен ацетата, используемое в рецептуре, может быть установлено, исходя из количества использованной твердой дисперсии, количества и типа стероидного эстрогена, используемого в рецептуре, а также с учетом конкретных терапевтических указаний. В общем случае базедоксифен ацетат может быть использован в количестве, достаточном для снижения влияния определенного эстрогена до желаемого уровня. Диапазон доз конъюгированных эстрогенов может составлять примерно от 0,3 мг до примерно 2,5 мг, примерно от 0,3 мг до примерно 1,25 мг, или примерно от 0,3 мг до примерно 0,625 мг. Примерное количество базедоксифен ацетата в сложных рецептурах составляет примерно от 10 мг до примерно 40 мг. Для стероидного эстрогена местранола суточная доза может составлять примерно от 1 мкг до примерно 150 мкг, а для этинил эстрадиола суточная доза может составлять примерно от 1 мкг до примерно 300 мкг. В некоторых случаях суточная доза составляет примерно от 2 мкг до примерно 150 мкг.
Примерная рецептура для орального применения содержит твердую дисперсию согласно настоящему изобретению и следующие наполнительные системы:
а) наполнитель и дезинтегрант, совместно составляющие примерно от 1% до 99% веса общей рецептуры, предпочтительно примерно от 20% до примерно 85%, из которых примерно от 4% до примерно 45% от общего веса рецептуры;
б) смазывающее вещество, составляющее примерно от 0,2% до 15% веса смеси, причем смазывающим веществом является стеарат магния или других металлов (например, стеарат кальция или цинка), эфиры жирных кислот (например, стеарил фумарат натрия), жирные кислоты (например, стеариновая кислота), жирные спирты, глицерил бегенат, минеральное масло, парафины, гидрогенезированные растительные масла, лейцин, полиэтилен гликоли, лаурил сульфаты металлов или хлорид натрия.
Указанное выше процентное содержание для наполнителя, дезинтегранта и смазывающих веществ представлено в расчете на массу конечного фармацевтического состава. Остальную часть конечного состава составляют твердая дисперсия и фармацевтически приемлемое покрытие поверхности, такое как глазировка или капсула, как описано здесь. В некоторых способах реализации данного изобретения твердая дисперсия составляет примерно от 1% до примерно 99%, примерно от 10 до примерно 95%, или примерно от 20% до примерно 90% от общего веса конечного состава; а покрытие или капсула составляет по весу примерно до 8% от рецептуры.
Многочисленные разнообразные дополнительные инертные наполнители, лекарственные формы, диспергирующие агенты и подобные компоненты, которые подходят для использования с твердыми дисперсиями данного изобретения, известны в данной области и описаны, например, в издании Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, которое полностью включено в данное описание по ссылке.
Способы
Как описано в патенте США No.5998402, базедоксифен ацетат и его соли являются селективными агонистами эстрогена, имеющими сродство к рецептору эстрогена. В отличие от других видов антагонистов эстрогена базедоксифен и его соли действуют как антиэстрогены в матке и могут снижать трофические влияния агонистов эстрогенов в тканях матки. Соответственно, твердые дисперсии данного изобретения и составы, содержащие их, могут найти применение в лечении болезненных состояний и синдромов, связанных с дефицитом эстрогенов или их избытком. Они также могут быть использованы в способах лечения заболеваний или нарушений, возникающих в результате пролиферации или аномального развития, действия или роста эндометриальной или эндометриально-подобной тканей.
Базедоксифен ацетат обладает способностью вести себя как агонист эстрогена, снижая холестерин и ингибируя потерю костной ткани. Соответственно, твердая дисперсия может использоваться для лечения многих расстройств, возникающих вследствие влияния эстрогена и избытка или недостатка эстрогенов, таких как остеопороз, гипертрофия простаты, мужское характерное облысение, вагинальная и кожная атрофия, акне, дисфункциональное маточное кровотечение, эндометриальные полипы, доброкачественные заболевания груди, маточные лейомиомы, аденомиоз, овариальный рак, бесплодие, рак груди, эндометриоз, эндометриальный рак, поликистозный синдром яичников, сердечно-сосудистые заболевания, контрацепция, болезнь Альцгеймера, когнитивные отклонения и другие нарушения центральной нервной системы (ЦНС), а также определенные виды рака, например меланома, рак простаты, раки толстой кишки, раки ЦНС и другие. Кроме того, твердые дисперсии могут применяться для контрацепции женщинами в пременопаузе, а также в гормонозамещающей терапии у женщин в постменопаузе (например, для лечения вазомоторных нарушений, таких как приступы жара), или в других случаях недостатка эстрогена, когда будет полезно его восполняющее введение. Составы данного изобретения также могут использоваться при болезненных состояниях, при которых желательна аменорея, таких как лейкемия, удаление эндометрия, хронические заболевания печени и почек, а также болезни и нарушениях свертываемости крови.
Твердые дисперсии данного изобретения также могут использоваться в способах ингибирования потери костной ткани. К потерям костной ткани часто приводит нарушение баланса между образованием новых костных тканей и ресорбцией старых, что ведет к общей потере костной массы у индивида. Такое истощение костной ткани возникает у ряда пациентов, в частности у женщин в постменопаузе, женщин, подвергнувшихся билатеральной овариэктомии, пациентов, получающих или получавших длительную терапию кортикостероидами, людей с гонадной дисгенезией и пациентов с синдромом Кушинга. Специальная потребность в замещении костной ткани, включая зубную и ротовую костные ткани, также может быть решена с использованием представленной твердой дисперсии у пациентов с переломами костей, дефектной структурой костей, а также теми, кому требуется хирургическое вмешательство, связанное с костной тканью и/или имплантация протезов. Кроме вышеописанных проблем твердая дисперсия может использоваться при лечении остеоартрита, гипокальцемии, гиперкальцемии, болезни Педжета, остеомаляции, остеогалистерезисе, множественной миеломе и других формах рака, оказывающих вредное воздействие на костную ткань.
Предполагается, что способы лечения заболеваний и синдромов, приведенные здесь, включают введение пациенту, нуждающемуся в данном лечении, терапевтически эффективного количества твердой дисперсии данного изобретения или состава, его содержащего. Здесь и далее термин «лечение» со ссылкой на болезнь обозначает предотвращение, подавление и/или улучшение состояния пацинета.
Здесь и далее термины «особь» или «пациент», используемые взаимозаменяемо, обозначают любых животных, включая млекопитающих, предпочтительно мышей, крыс, других грызунов, кроликов, собак, кошек, поросят, крупный рогатый скот, овец, лошадей, приматов и, что наиболее предпочтительно, людей.
Здесь и далее фраза «терапевтически эффективное количество» обозначает количество активного соединения или фармацевтического агента, которое вызывает биологический или медицинский ответ в ткани, системе, животном, особи или человеке, который может быть обнаружен исследователем, ветеринаром, медицинским врачом или другим клиницистом и включает один или несколько следующих пунктов:
(1) предотвращение заболевания; например предотвращение заболевания, состояния или нарушения у особей, которые могут быть предрасположены к заболеванию, состоянию или нарушению, но заболевание еще не началось, и у них не фиксируются патология или симптоматика данного заболевания;
(2) подавление заболевания; например подавление заболевания, состояния или нарушения у особей, находящихся в болезненном состоянии, у которых фиксируются патология или симптоматика заболевания, состояния или нарушения (т.е. остановка или замедление дальнейшего развития патологии и/или симптоматики); и
(3) улучшение состояния пациента; например улучшение состояния особей, находящихся в болезненном состоянии, у которых фиксируются патология или симптоматика заболевания, состояния или нарушения (т.е. реверсия патологии и/или симптоматики).
Данное изобретение будет описано более подробно с помощью примеров. Следующие примеры предложены в качестве иллюстраций и не ограничивают изобретение каким-либо образом. Специалисты в данной области легко увидят ряд некритичных параметров, в результате изменения или модификации которых могут быть получены одни и те же результаты.
ПРИМЕРЫ
Пример 1: Получение твердой дисперсии Базедоксифен Ацетата
Рецептуры твердой дисперсии базедоксифен ацетата получали согласно процедурам, описанным ниже. Согласно рентгеновской дифракции порошка установлено, что все дисперсии были аморфными (некристаллическими) и отличались от физической смеси БКА и диспергирующего реагента, которая, как показано, содержит кристаллическую форму БКА.
Пример 1.1: Твердая дисперсия базедоксифен ацетата с ПВП (1:1 в/в)
К раствору, содержащему 3,0004 г ПВП (поливинилпирролидона) К 17 (PLASDONE, Povidone USP, Polyvinylpyrrolidone, ISP Technologies Inc.) в 55 мл этанола (ЕМ Science), добавили 3,0894 г базедоксифен ацетата. Затем добавили еще 20 мл этанола, и полученную суспензию нагрели до 65°С в течение 5 минут до образования прозрачного коричневого раствора. Растворители выпарили при пониженном давлении при комнатной температуре до сухого состояния. Желтые хлопья собрали и растерли пестиком в ступке с образованием 5,6 г коричнево-кремового порошка.
Пример 1.2: Твердая дисперсия базедоксифен ацетата с ПВП (1:1 в/в)
К раствору, содержащему 2,1091 г ПВП К 17 (PLASDONE, Povidone USP, Polyvinylpyrrolidone, ISP Technologies Inc.) в 4 мл этанола (ЕМ Science), добавили 2,1028 г базедоксифен ацетата. Затем добавили еще 2 мл этанола до получения молочной суспензии. Затем добавили еще 44 мл этанола (всего 50 мл) и смесь нагрели до 65°С в течение 5 минут до образования желтого раствора. Растворители выпарили при пониженном давлении при комнатной температуре досуха с образованием желто-коричневого твердого вещества.
Пример 1.3: Твердая дисперсия базедоксифен ацетата с ПВП (1:1 в/в)
К раствору, содержащему 3,00519 г ПВП К 17 (PLASDONE, Povidone USP, Polyvinylpyrrolidone, ISP Technologies Inc.) в 15 мл этанола (ЕМ Science), добавили 3,00671 г базедоксифен ацетата при перемешивании. Затем добавили еще 60 мл этанола и смесь нагрели до 65°С в течение 5 минут до образования прозрачного желто-коричневого раствора. Растворители выпарили при пониженном давлением при комнатной температуре досуха. Желто-коричневую твердую массу растерли в ступке пестиком с образованием желто-кремового мелкого порошка.
Пример 1.4: Твердая дисперсия базедоксифен ацетата с ПВП (5% в/в активного компонента)
К раствору, содержащему 0,9509 г ПВП К17 (PLASDONE, Povidone USP, Polyvinylpyrrolidone, ISP Technologies Inc.) в 1 мл этанола (ЕМ Science), добавили 0,0499 г базедоксифен ацетата. К образовавшемуся бледно-желтому раствору добавили 0,5 мл этанола с образованием желтого вязкого раствора. Растворители выпарили при пониженном давлением при комнатной температуре досуха. Желтую твердую массу собрали и растерли в ступке пестиком.
Пример 1.5: Твердая дисперсия базедоксифен ацетата с Полоксамером 188 (5% в/в активного компонента)
К раствору, содержащему 0,9503 г Полоксамера 188 (BASF; полиоксипропилен-полиоксиэтилен сополимер) в 1,5 мл этанола и 0,5 мл деионизированной воды, добавили 0,0503 г базедоксифен ацетата до образования бесцветного раствора. Растворители выпарили при пониженном давлением при комнатной температуре досуха. Собрали твердую кремовую массу.
Пример 1.6: Твердая дисперсия базедоксифен ацетата с Полоксамером 188 (5% в/в активного компонента)
К Полоксамеру 188 (0,9540 g; BASF), расплавленному при 60°С, добавили 0,0502 г базедоксифен ацетата при перемешивании до образования прозрачной жидкости. Жидкость охладили до комнатной температуры.
Пример 1.7: Твердая дисперсия базедоксифен ацетата с Полоксамером 188 (5% в/в активного компонента)
К раствору, содержащему 0,9522 г ПЭГ 1450 (Union Carbide) в 1,5 мл этанола, подогретого до 40°С, добавили 0,0510 г базедоксифен ацетата до образования прозрачного раствора. Растворители выпарили при пониженном давлении до образования белого воскообразного вещества.
Пример 1.8: Твердая дисперсия базедокснфен ацетата с Полоксамером 188 (5% в/в активного компонента)
К 0,9448 г расплавленного ПЭГ 1450 при 70°С добавили 0,0504 г базедоксифен ацетата до образования прозрачного раствора. Жидкость охладили до комнатной температуры.
Пример 2: Равновесная растворимость твердых дисперсий базедоксифен ацетата.
Несколько миллиграмм каждой дисперсии из примеров 1.1 - 1.8 поместили в 2 мл 0,0005 М уксусной кислоты при комнатной температуре (примерно 20-26°С), отцентрифугировали при 50 об/мин в течение 18 часов и профильтровали через фильтр с диаметром пор 0,45 мкм (Nylon Acrodisc). После 10-кратного растворения с подвижной фазой 10 мкл поместили в колонку ВЭЖХ. ВЭЖХ выполнили в соответствии со следующими параметрами:
| Колонка: | Инертсил 5 ОДС-2 150×4,6 мм |
| Скорость потока: | 1,5 мл/мин |
| Детектор: | УФ, длина волны 220 нм |
| Температура: | температура окружающей среды |
| Подвижная фаза: | 320 мл ацетонитрила и 680 мл раствора, содержащего |
| 6,8 г одноосновного фосфата калия в 2 л воды, рН | |
| довели до 3,0 с помощью 85% фосфорной кислоты. |
Результаты представлены в Таблице II ниже. Твердая дисперсия базедоксифен ацетата с ПВП (5% в/в активного компонента) дала максимальную равновесную растворимость.
| Таблица II | |
| Пример дисперсии No. | Равновесная растворимость |
| 1.1 (этанол; ПВП; 1:1 в/в) | 13.9 мг/мл |
| 1.4 (этанол; ПВП; 5% в/в активного компонента) | 20.1 мг/мл |
| 1.5 (этанол; Полоксамер 188; 5% в/в активного компонента) | 2.9 мг/мл |
| 1.6 (расплав; Полоксамер 188; 5% в/в активного компонента) | 8.1 мг/мл |
| 1.7 (этанол ПЭГ 1450; 5% в/в активного компонента) | 2.3 мг/мл |
| 1.8 (расплав; ПЭГ 1450; 5% в/в активного компонента) | 5.3 мг/мл |
Пример 3: Скорость растворения базедоксифен ацетата по сравнению со скоростью растворения твердой дисперсии базедоксифен ацетата с ПВП (1:1 в/в)
Таблетки базедоксифен ацетата и твердой дисперсии базедоксифен ацетата (ПВП, 1:1 в/в, см. Пример 1) были получены прессованием 100 мг каждого вещества в аппарате Вудса при давлении в 6894,757 кПа в течение 1 минуты под прессом Карвера. Таблетированные образцы затем поместили в аппарат для растворения, при этом растворению подвергалась тол