N-замещенные производные тиогидразидов оксаминовых кислот, способ их получения и их использование
Иллюстрации
Показать всеИзобретение относится к N-замещенным производным тиогидразидов оксаминовых кислот общей формулы:
где R и R1, представляют собой Н, незамещенные или замещенные Het, фенил, Alk, при этом заместителями могут быть Alk, Hal, CF3, COOR3, SR3, либо R+R1=C2H4OC2H4; R2 представляет собой Н, Alk, OR3, Hal, где R3=Alk; Het представляет собой 5- или 6-членное кольцо, содержащее один или два гетероатома, выбранных из N, S. Изобретение также относится к способу получения указанных соединений. Технический результат - получение новых соединений, которые проявляют антибактериальную активность и могут быть использованы в качестве антибактериальных средств для подавления патогенных бактерий, в том числе и хламидий. 3 н. и 1 з.п. ф-лы.
Реферат
Изобретение относится к новым тиогидразидам оксаминовых кислот, а именно к новым N- замещенным производным тиогидразидов оксаминовых кислот, к способу их получения, а также к их использованию как антибактериальных средств для подавления патогенных бактерий.
Проблема антибиотикорезистентности является наиболее острой на данный момент, поскольку отмечено, что ко всем существующим классам антибактериальных препаратов у патогенных бактерий развивается устойчивость в той или иной степени {Сидоренко С.В. Механизмы антибиотикорезистентности / Антибактериальная терапия: Практическое руководство под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. - 2000. - М.: Фарммединфо. - 190 с.; Страчунский Л.С., Богданович Т.М. Состояние антибиотикорезистентности в России / Антибактериальная терапия: Практическое руководство под ред. Страчунского Л.С., Белоусова Ю.Б., Козлова С.Н. - 2000. - М, Фарммединфо. - 190 с.; Фурлетова Н.М., Карп В.П., Мирская М.А., Никитин А.П. Мониторинг спектра и чувствительности выделяемой микрофлоры в стационаре - МКО-10, 2002; Clatworthy A.E., Pierson E., Hung D.T. Targeting virulence: a new paradigm for antimicrobial therapy - Nature Chemical Biology - 2007. - V.3. - N9. - P.541-548).
Так, например, к группе β-лактамных антибиотиков на данный момент описано более 200 ферментов β-лактамаз, инактивирующих путем гидролиза одну из связей β-лактамного кольца. Согласно статистике, такие ферменты встречаются у 60-80% штаммов стафилококков, 30-40% - Escherihia coli, 20% у возбудителей тяжелых нозокомиальных инфекций Enterobacter spp., в результате чего существенно снизилась эффективность цефалоспоринов III и, в последнее время, IV поколений.
Практически у всех грамотрицательных бактерий с течением времени развивается еще один механизм устойчивости к данной группе препаратов: снижение проницаемости внешних структур, в результате мутаций, приводящих к полной или частичной утрате поринов, белков, участвующих в осуществлении динамической связи между бактериями и окружающей средой, в том числе поддерживают структурную целостность клетки, регулируют транспорт питательных веществ и бактерицидных агентов).
Аналогичная ситуация складывается с чувствительностью патогенов к аминогликозидам. Описано более 50 ферментов, инактивирующих данную группу антибиотиков.
Кроме того, используемые в клинической практике антибиотики в большинстве своем эффективно работают против острых инфекций, но не эффективны к хронической стадии инфекционного процесса. Это объясняется тем, что острая и хроническая инфекции - две разные формы взаимодействия патогена и организма хозяина, при которых реализуются две различные стратегии, заложенные в геноме патогена. В отличие от острой инфекции, хроническая инфекция это более сложная система взаимодействия, эволюционно выработанная адаптация, направленная на длительное выживание.
Таким образом, создание новых лекарственных препаратов для борьбы с хроническими инфекциями является актуальнейшей проблемой биологии и медицины.
Описанные выше проблемы заставили разработать подходы к синтезу новых антибактериальных средств для борьбы с патогенными бактериями.
В литературе описаны соединения, содержащие тиогидразидные фрагменты в своем составе, обладающие антибактериальными и антивирусными свойствами (К.Waisser, N.Houngbedji, Z.Odlerova, W.Thiel, R.Mayer. Pharmazie 45 (1990), H.2, 141; Antituberkulotika 45. Mitteilung: Antimykobakterielle Thiohydrazide, Waisser K., Odlerova Z., Houngbedji N., Thiel W., Mayer R. Zentralbl Mikrobiol. (1989), 144(5), 355). Практически не изучено биологическая активность тиогидразидов оксаминовых кислот.
Наиболее близкими к заявляемым соединениям являются тиогидразиды оксаминовых кислот общей формулы:
где R = циклогексил, фенил, дифенил, нафтил, которые исследовались в качестве противотуберкулезных средств (Antituberkulotika 45. Mitteilung: Antimykobakterielle Thiohydrazide, Waisser К., Odlerova Z., Houngbedji N., Thiel W., Mayer R. Zentralbl Mikrobiol. (1989), 144(5), 355). Однако производные тиогидразидов оксаминовых кислот, в том числе N-замещенные тиогидразиды оксаминовых кислот не изучались в качестве средств против патогенных бактерий, в том числе хламидий, вызывающих хронические инфекции.
Большую опасность для человека представляют хламидии, чрезвычайно успешно адаптированные к длительному сосуществованию с организмом хозяина и определяющие возможность развития хронических инфекций. Как известно патогенными для человека являются два основных вида хламидий: Ch.trachomatis и Ch.pneumoniae. Ch.trachomatis - самый распространенный возбудитель урогенитальных инфекций бактериальной природы. В нашей стране регистрируется ежегодно более 1,5 млн. новых случаев заболеваний, но это не отражает истинную картину заболеваемости, так как почти в 80% случаев инфекция протекает бессимптомно, а значит, не выявляется и не лечится, что и приводит к развитию хронического процесса. Хронические урогенитальные хламидиозы имеют очень серьезные последствия: женское и мужское бесплодие, патологии беременности, артрит, рак простаты и шейки матки.
Другим патогенным для человека видом хламидий является Ch.pneumoniae - возбудитель респираторного хламидиоза. С этим возбудителем связывают от 10 до 20% внебольничных пневмоний, а в период эпидемии показатели могут увеличиваться до 25%. Летальность при хламидийных пневмониях составляет почти 10%.
Задачей настоящего изобретения является изыскание новых соединений, возможность их использования в качестве антибактериальных средств против патогенных бактерий, в том числе и хламидий, и разработка способа их получения.
Поставленная задача достигается новыми N-замещенными производными тиогидразидов оксаминовых кислот общей формулы (I):
где R и R1, представляют собой Н, незамещенные или замещенные Het, Ar, Alk, при этом заместителями могут быть Alk, Hal, CF3, NR3R4, COOR3, CONR3R4, CONHNR3R4, COR3, NO2, CN, ОН, OR3, SH, SR3, либо R+R1=C2H4OC2H4,
R2 представляет собой Н, Alk, OR3, Hal, COOR3, CONH2, NO2 CN, OH, SR3, где R3,R4 = Alk
Het представляет собой 5- или 6-членное кольцо, содержащее один или два гетероатома, выбранных из О, N, S
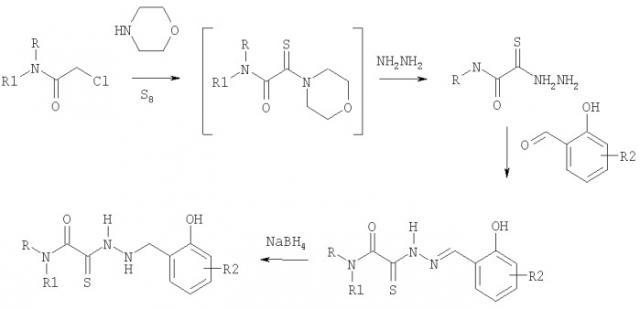
и способом их получения, заключающимся во взаимодействии соответствующих хлорацетамидов с раствором элементной серы в морфолине с последующим пропусканием полученного раствора монотиооксамида через слой сорбента и обработкой его гидразингидратом, взаимодействием образующихся при этом тиогидразидов оксаминовых кислот с производными салицилового альдегида с последующим восстановлением полученных гидразонов натрий боргидридом, в соответствии с нижеприведенной схемой:
При этом тиогидразиды оксаминовых кислот получают по методу, который отличается от описанного в литературе (Синтез тиогидразидов оксаминовых кислот и карбамоил-1,3,4-тиадиазолов, В.Н.Яровенко, А.В.Широков, О.Н.Крупинова, И.В.Заварзин, М.М.Краюшкин. ЖОрХ, (2003), 39(8), 1204) тем, что промежуточный монотиооксамид не выделяют и реакционную смесь, содержащую монотиооксамид, пропускают через слой сорбента и затем обрабатывают гидразингидратом. Для получения целевых продуктов образующиеся при этом тиогидразиды оксаминовых кислот подвергают взаимодействию с производными салицилового альдегида с последующим восстановлением полученных гидразонов натрийборгидридом.
Предложенный метод позволяет получать новые N- замещенные производные тиогидразидов оксаминовых кислот с хорошим выходом.
Соединения (I) проявляют антибактериальную активность и могут быть использованы в качестве антибактериальных средств для подавления патогенных бактерий, в том числе и хламидий.
Способ подавления патогенных бактерий заключается в воздействии на бактерии эффективным количеством соединения (I).
Полученные соединения хорошо растворимы в органических растворителях, что способствует их дальнейшему изучению и продвижению в качестве лекарственных препаратов.
Конкретные примеры выполнения группы изобретений.
Пример 1.
2-[2-(2-гидроксибензил)гидразино]-N-(2-метилфенил)-2-тиоксоацетамид (1)
N-хлорацетил-2-метиланилин (2).
К раствору 10,7 г (0,1 моль) 2-метиланилина в 100 мл ДМФА добавляем, при охлаждении, 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (2) 15,5 г, 85%. Т.пл. 124-126°С. ЯМР 1H DMSOd6 (δ, м.д., J, Гц): 1,74 (с, 3Н, СН3); 7,41 (м, 1H, аром); 7,21 (м, 1H, аром); 7,07 (м, 1Н, аром) 7,63 (м, 1H, аром); 4,20 (с, 2Н, CH2Cl); 10,57 (с, 1H, NH). Найдено (%) 58.86, Н 5.47, N 7.64. Вычислено (%): С 58.87, Н 5.49, N 7.63. Масс-спектр, m/z: 183.
2-[гидразино-(тиоксо)-ацетиламино]-2-метиланилин (3).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 5 мл (0,06 моль) морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 9,15 г (0,05 моль) хлорацетамида (2) в минимальном количестве ДМФА, при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-4 часа (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразингидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (3) 10,4 г, 60%. Т.пл. 154-155°С. ЯМР 1H DMSOd6 (δ, м.д., J, Гц): 1,74 (с, 3Н, СН3); 7,41 (м, 1Н, аром); 7,21 (м, 1H, аром); 7,07 (м, 1Н, аром); 7,63 (м, 1H, аром); 10,59 (с, 1Н, NH). Найдено: С 51.64, Н 5.28, N 20,10. Вычислено: С 51.66, Н 5.30, N 20.08. Масс-спектр, m/z: 209.
2-{2-[(2-гидроксифенил)метилиден]гидразино}-N-(2-метилфенил)-2-тиоксоацетамид (4)
К 209 мг (10 ммоль) тиогидразида оксаминовой кислоты (3) в 1-2 мл ДМФА добавили 140 мг (11 ммоль) салицилового альдегида в 1 мл ДМФА. Реакционную смесь оставили на сутки при комнатной температуре, затем добавили 3 мл метанола, выпавший осадок отфильтровали и промыли метанолом.
Выход гидразона (4) 156 мг, 50%. Т.пл. 215-217°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 2,50 (с, 3Н, СН3); 7,02 (м, 4Н, аром); 7,41 (м, 1H, аром); 7,21 (м, 1Н, аром); 7,07 (м, 1Н, аром); 7,63 (м, 1Н, аром); 10,59 (с, 1Н, NH). 11,92 (с, 1Н, NH т.амид). 12,76 (с, 1H, ОН, фен.). Найдено: С 61.33, Н 4.81, N 13.40. Вычислено: С 61.32, Н 4.82, N 13.41. Масс-спектр, m/z: 313.
2-[2-(2-гидроксибензил)гидразино]-N-(2-метилфенил)-2-тиоксоацетамид (1)
К 313 мг (1 ммоль) тиогидразона (4) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола или этанола.
Выход гидразида (1) 220 мг, 70%. Т.пл. 245-246°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 2,50 (с, 3Н, СН3); 4,35 (с, 1H, СН2); 6,45 (с, 1H, NH); 6,96 (м, 2Н, аром); 7,21 (м, 5Н, аром); 7,98 (м, 1H, аром); 9,92 (с 1H, ОН, фен.). Найдено (%): С 61.10, Н 5.11, N 13.40. Вычислено (%): С 60.93, Н 5.43, N 13.32. Масс-спектр, m/z: 315.
Пример 2.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (5)
N-хлорацетил-4-фторанилин (6).
К раствору 11,1 г (0,1 моль) 4-фторанилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (6) 80% Т.пл. 110-112°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 4,20 (с, 2Н, СН2С1). Найдено (%): С 51.21, Н 3.73, N 7.46. Вычислено (%): С 51.22, Н 3.76, N 7.47. Масс-спектр, m/z: 187.
2-[гидразино-(тиоксо)-ацетиламино]-4-фторанилин (7).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 9,37 г (0,05 моль) хлорацетамида (6) в минимальном количестве ДМФА, при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-10 часов (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразингидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (7) 6,4 г, 60%. Т.пл. 154-155°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 10,59 (с, 1H, NH). Найдено (%): С 51.64, Н 5.28, N 20,10. Вычислено (%): С 45.06, Н 3.78, N 19,71. Масс-спектр, m/z: 213.
2-{[1-(2-гидрокси3-этокси-фенил)-метилиден-гидразиноокситиоацетил]-амино}-4-фторанилин (8).
К 213 мг (10 ммоль) тиогидразида оксаминовой кислоты (7) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (8) 180 мг, 50%. Т.пл. 215-217°С. ЯМР 1H CDCl3 (δ, м.д., J, Гц): 1.5 (м, 3Н, СН3); 4,15 (м, 2Н, СН2); 6,88 (м, 2Н, аром); 7,07 (м, 3Н, аром) 7,65 (м, 2Н, аром); 8,57 (м, 1H, гидр.); 10,05 (с, 1H, ОН); 10,98 (с, 1Н, NH). 12,00 (с, 1H, NH т.амид). Найдено (%): С 56.41, Н 4.30, N 11.79. Вычислено (%): С 56.50, Н 4.46, N 11.63. Масс-спектр, m/z: 361.
2-[2-(3-этокси-2-гидроксибензип)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (5)
К 361 мг (1 ммоль) тиогидразона (8) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола или этанола.
Выход гидразида (5) 272 мг, 75%. Т.пл. 232-233°С. ЯМР 1H CDC13 (δ, м.д., J, Гц): 1.46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (с, 2Н, СН2), 6,85 (м, 4Н, аром); 7,08 (м, 1H, аром) 7,60 (м, 2Н, аром); 9,85 (с, 1H, ОН). Найдено (%): С 56.43, Н 4.62, N 11.78. Вычислено (%): С 56.19, Н 4.99, N 11.56. Масс-спектр, m/z: 363.
Пример 3.
2-[2-(3,5-дибром-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (9)
2-{2-[(3,5-дибром-2-гидроксифенил)метилиден]гидразино}-Н-(4-фторфенил)-2-тиоксоацетамид (10)
К 213 мг (10 ммоль) тиогидразида оксаминовой кислоты (7) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (10) 394 мг, 83%. Т.пл. 315-317°С. ЯМР 1Н CDCl3 7,22 (д, 2Н, аром); 7,08 (д, 2Н, аром) 7,21 (с, 1Н, аром); 7,07 (с, 1H, аром); 10,55 (с, 1H, NH); 11,70 (с, 1Н, NH т.амид); 13,78(с, 1Н, ОН, фен.). Найдено (%): С 37.72, Н 2.19, N 8.98. Вычислено (%): С 37.92, Н 2.12, N 8.84. Масс-спектр, m/z: 475.
2-[2-(3,5-дибром-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (9)
К 475 мг (1 ммоль) тиогидразона (10) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола, этанола или хлороформа.
Выход гидразида (9) 357 мг, 75%. Т.пл. 272-273°С. ЯМР 1H CDCl3 (δ, м.д., J, Гц): 4,36 (с, 2Н, СН2), 6,85 (м, 4Н, аром); 7,60 (м, 2Н, аром); 9,85 (с, 1H, ОН). Найдено (%): С 37.56, Н 2.73, N 8.62. Вычислено (%): С 37.76, Н 2.53, N 8.81. Масс-спектр, m/z: 477.
Пример 4.
2-[2-(5-бром-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (11)
2-{2-[(5-бром-2-гидроксифенил)метилиден]гидразино}-N-(4-фторфенил)-2-тиоксоацетамид (12)
К 213 мг (10 ммоль) тиогидразида оксаминовой кислоты (7) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (12) 277 мг, 70%. Т.пл. 235-237°С. ЯМР 1H CDCl3 7,22 (д, 2Н, аром); 7,08 (д, 2Н, аром) 7,21 (с, 1Н, аром); 7,07 (м, 2Н, аром); 10,55 (с, 1Н, NH); 11,70 (с, 1H, NH т.амид); 13,78 (с, 1H, ОН, фен.). Найдено (%): С 45.36, Н 2.89, N 10.77. Вычислено (%): С 45.47, Н 2.80, N 10.60. Масс-спектр, m/z: 396.
2-[2-(5-бром-2-гидроксибензил)гидразино]-N-(4-фторфенил)-2-тиоксоацетамид (11)
К 478 мг (1 ммоль) тиогидразона (12) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола, этанола или хлороформа.
Выход гидразида (11) 278 мг, 70%. Т.пл. 222- 223°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 4,36 (с, 2Н, СН2), 6,85 (м, 4Н, аром); 7,08 (м, 1H, аром) 7,60 (м, 2Н, аром); 9,85 (с, 1H, ОН). Найдено (%): С 56.43, Н 4.62, N 11.78. Вычислено (%): С 56.19, Н 4.99, N 11.56. Масс-спектр, m/z: 398.
Пример 5.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(3-фторфенил)-2-тиоксоацетамид (13)
N-хлорацетил-3-фторанилин (14).
К раствору 11,1 г (0,1 моль) 3-фторанилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (14) 80% Т.пл. 130-131°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (м, 3Н, аром); 7,07 (с, 1Н, аром); 4,20 (с, 2Н, CH2Cl). Найдено (%): С 51.21, Н 3.73, N 7.46. Вычислено (%): С 51.22, Н 3.76, N 7.47. Масс-спектр, m/z: 187.
2-[гидразино-(тиоксо)-ацетиламино]-3-фторанилин (15).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 9,37 г (0,05 моль) хлорацетамида (14) в минимальном количестве ДМФА, при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-10 часов (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразингидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (15) 6,4 г, 60%. Т.пл. 164-165°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 10,59 (с, 1H, NH). Найдено (%): С 51.64, Н 5.28, N 20,10. Вычислено (%): С 45.06, Н 3.78, N 19,71. Масс-спектр, m/z: 213.
2-{[1-(2-гидрокси3-этокси-фенил)-метилиден-гидразиноокситиоацетил]-амино}-3-фторанилин (16).
К 213 мг (10 ммоль) тиогидразида оксаминовой кислоты (15) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (16) 158 мг, 50%. Т.пл. 225-226°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.5 (м, 3Н, СН3); 4,15 (м, 2Н, СН2); 6,88 (м, 3Н, аром); 7,07 (м, 3Н, аром); 7,65 (с, 1Н, аром); 8,57 (м, 1H, гидр.); 10,05 (с, 1H, ОН); 10,98 (с, 1H, NH); 12,00 (с, 1H, NH т.амид). Найдено (%):С 56.41, Н 4.30, N 11.79. Вычислено (%): С 56.50, Н 4.46, N 11.63. Масс-спектр, m/z: 361.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(3-фторфенил)-2-тиоксоацетамид (13)
К 361 мг (1 ммоль) тиогидразона (16) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола или этанола.
Выход гидразида (13) 272 мг, 75%. Т.пл. 232- 233°С. ЯМР 1Н CDC13 (δ, м.д., J,Гц): 1.46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (с, 2Н, СН2), 6,85 (м, 4Н, аром); 7,08 (м, 1H, аром); 7,60 (м, 2Н, аром); 9,85 (с, 1H, ОН). Найдено (%): С 56.43, Н 4.62, N 11.78. Вычислено (%): С 56.19, Н 4.99, N 11.56. Масс-спектр, m/z: 363.
Пример 6.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(2-фторфенил)-2-тиоксоацетамид (17)
N-хлорацетил-2-фторанилин (18)
К раствору 11,1 г (0,1 моль) 2-фторанилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (18) 80% Т.пл. 130-132°С. ЯМР 1H DMSOd6 (δ, м.д., J, Гц): 7,21 (м, 2Н, аром); 7,07 (м, 2Н, аром); 4,20 (с, 2Н, СН2С1). Найдено (%): С 51.21, Н 3.73, N 7.46. Вычислено (%): С 51.22, Н 3.76, N 7.47. Масс-спектр, m/z: 187.
2-[гидразино-(тиоксо)-ацетиламино]-2-фторанилин (19).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 9,37 г (0,05 моль) хлорацетамида (18) в минимальном количестве ДМФА при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-10 часов (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразингидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (18) 6,4 г, 60%. Т.пл. 164-165°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 10,59 (с, 1H, NH). Найдено (%): С 51.64, Н 5.28, N 20,10. Вычислено (%): С 45.06, Н 3.78, N 19,71. Масс-спектр, m/z: 213.
2-{[1-(2-гидрокси3-этокси-фенил)-метилиден-гидразиноокситиоацетил]-амино}-2-фторанилин (19).
К 213 мг (10 ммоль) тиогидразида оксаминовой кислоты (18) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (19) 158 мг, 50%. Т.пл. 215-217°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.5 (м, 3Н, СН3); 4,15 (м, 2Н, СН2); 6,88 (м, 2Н, аром); 7,07 (м, 3Н, аром) 7,65 (м, 2Н, аром); 8,57 (м, 1H, гидр.); 10,05 (с, 1H, ОН); 10,98 (с, 1H, NH). 12,00 (с, 1H, NH т.амид). Найдено (%): С 56.41, Н 4.30, N 11.79. Вычислено (%): С 56.50, Н 4.46, N 11.63. Масс-спектр, m/z: 361.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-N-(2-фторфенил)-2-тиоксоацетамид (17)
К 361 мг (1 ммоль) тиогидразона (19) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола или этанола.
Выход гидразида (17) 272 мг, 75%. Т.пл. 232-233°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1,46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (с, 2Н, СН2); 6,85 (м, 4Н, аром); 7,08 (м, 1Н, аром); 7,60 (м, 2Н, аром); 9,85 (с, 1Н, ОН). Найдено (%): С 56.43, Н 4.62, N 11.78. Вычислено (%): С 56.19, Н 4.99, N 11.56. Масс-спектр, m/z: 363.
Пример 7.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-2-тиоксо-N-[2-(трифторметил)фенил]ацетамид (20)
N-хлорацетил-2-(трифторметил)-анилин (21).
К раствору 16,1 г (0,1 моль) 2-(трифторметил)-анилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (21) 19 г 80%. Т.пл. 115-116°С. ЯМР 1Н DMSOd6 (δ, м.д, J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 4,20 (с, 2Н, CH2Cl).
Найдено (%): С 45.38, Н 2.81, N 5.96. Вычислено (%): С 45.49, Н 2.97, N 5.89. Масс-спектр, m/z: 237.
2-[гидразино-(тиоксо)-ацетиламино]-2-(трифторметил)-анилин (22).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 11,85 г (0,05 моль) хлорацетамида (21) в минимальном количестве ДМФА при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-10 часов (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразин гидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (22) 6,4 г, 60%. Т.пл. 154-155°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 10,59 (с, 1H, NH). Найдено (%): С 41.16, Н 3.13, N 15.83. Вычислено (%): С 41.06, Н 3.06, N 15.96. Масс-спектр, m/z: 263.
2-{[1-(2-гидрокси3-этокси-фенил)-метилиден-гидразиноокситиоацетил]-амино}-2-(трифторметил)-анилин (23).
К 263 мг (10 ммоль) тиогидразида оксаминовой кислоты (13) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (23) 158 мг, 50%. Т.пл. 215-217°С. ЯМР 1H CDCl3 (δ, м.д., J, Гц): 1.5 (м, 3Н, СН3); 4,15 (м, 2Н, СН2); 6,88 (м, 2Н, аром); 7,07 (м, 3Н, аром); 7,65 (м, 2Н, аром); 8,57 (м, 1H, гидр.); 10,05 (с, 1H, ОН); 10,98 (с, 1Н, NH); 12,00 (с, 1H, NH т.амид). Найдено (%): С 52.43, Н 3.82, N 10.31. Вычислено (%): С 52.55, Н 3.92, N 10.21. Масс-спектр, m/z: 411.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-2-тиоксо-N-[2-(трифторметил)фенил]ацетамид (20)
К 411 мг (1 ммоль) тиогидразона (23) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола или этанола.
Выход гидразида (20) 272 мг, 75%. Т.пл. 232-233°С. ЯМР 1H CDCl3 (δ, м.д., J, Гц): 1.46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (c, 2Н, CH2),6,85 (4H, аром); 7,08 (м, 1Н, аром); 7,60 (м, 2Н, аром); 9,85 (c, 1H, OH). Найдено (%): С 52.29, Н 4.25, N 10.11. Вычислено (%): С 52.30, Н 4.39, N 10.16. Масс-спектр, m/z: 413. .
2-[2-(3,5-дибром-2-гидроксибензил)гидразино]-2-тиоксо-N-[2-(трифторметил)фенил]ацетамид (25)
2-{2-[(3,5-дибром-2-гидроксифенил)метилиден]гидразино}-2-тиоксо-N-[2-(трифторметил) фенил]ацетамид (23)
К 263 мг (10 ммоль) тиогидразида оксаминовой кислоты (13) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (25) 158 мг, 50%. Т.пл. 215-217°С.ЯМР 1H CDCl3 7,22 (д, 2Н, аром); 7,08 (д, 2Н, аром) 7,21 (с, 1Н, аром); 7,07 (с, 1Н, аром); 10,55 (с, 1Н, NH); 11,70 (с, 1H, NH т.амид); 13,78 (с, 1H, ОН, фен.). Найдено (%): С 36.69, Н 1.81, N 8.09. Вычислено (%): С 36.60, Н 1.92, N 8.00. Масс-спектр, m/z: 525.
2-[2-(3,5-дибром-2-гидроксибензил)гидразино]-2-тиоксо-H-[2-(трифторметил)фенил]ацетамид (25)
К 525 мг (1 ммоль) тиогидразона (25) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола, этанола или хлороформа.
Выход гидразида (24) 272 мг, 75%. Т.пл. 232-233°С. ЯМР 1Н CDCl3 (δ, м.д, J, Гц): 1.46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (с, 2Н, СН2); 6,85 (м, 4Н, аром); 7,08 (м, 1Н, аром); 7,60 (м, 2Н, аром); 9,85 (с, 1Н, ОН). Найдено (%): С 36.35, Н 2.21, N 7.84. Вычислено (%): С 36.46, Н 2.29, N 7.97. Масс-спектр, m/z: 527.
Пример 9.
2-[2-(5-бром-2-гидроксибензил)гидразино]-2-тиоксо-N-[2-(трифторметил)фенил]ацетамид (26)
2-{(2-[(5-бром-2-гидроксифенил)метилиден]гидразино}-2-тиоксо-N-[2-(трифториетил)фенил]ацетамид (27)
К 263 мг (10 ммоль) тиогидразида оксаминовой кислоты (13) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (27) 312 мг, 70%. Т.пл. 215-217°С. ЯМР 1Н CDCl3 7,22 (д, 2Н, аром); 7,08 (д, 2Н, аром); 7,21 (с, 1Н, аром); 7,07 (с, 1Н, аром); 10,55 (с, 1Н, NH); 11,70 (с, 1H, NH т.амид); 13,78 (с, 1Н, ОН, фен.). Найдено (%): С 43.16, Н 2.35, N 9.52. Вычислено (%): С 43.07, Н 2.48, N 9.42. Масс-спектр, m/z: 446.
2-[2-(5-бром-2-гидроксибензил)гидразжо]-2-тиоксо-N-[2-(трифторметил)фенил] ацетамид (26)
К 446 мг (1 ммоль) тиогидразона (26) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола, этанола или хлороформа.
Выход гидразида (26) 358 мг, 75%. Т.пл. 232-233°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (с, 2Н, СН2); 6,85 (м, 4Н, аром); 7,08 (м, 1Н, аром); 7,60 (м, 2Н, аром); 9,85 (с, 1H, ОН). Найдено (%): С 42.76, Н 2.86, N 9.42. Вычислено (%): С 42.87, Н 2.92, N 9.37. Масс-спектр, m/z: 448.
Пример 10.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-2-тиоксо-N-[3-(трифторметил)фенил]ацетамид (28)
N-хлорацетил-3-(трифторметил)-анилин (29).
К раствору 16,1 г (0,1 моль) 3-(трифторметил)-анилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (29) 19 г 80% Т.пл. 125-126°С. ЯМР 1H DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 4,20 (с, 2Н, CH2Cl).
Найдено (%): С 45.38, Н 2.81, N 5.96. Вычислено (%): С 45.49, Н 2.97, N 5.89. Масс-спектр, m/z: 237.
2-[гидразино-(тиоксо)-ацетиламино]-3-(трифторметил)-анилин (30).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 11,85 г (0,05 моль) хлорацетамида (21) в минимальном количестве ДМФА при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-10 часов (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразингидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (30) 6,4 г, 60%. Т.пл. 154-155°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 10,59 (с, 1H, NH). Найдено (%): С 41.16, Н 3.13, N 15.83. Вычислено (%): С 41.06, Н 3.06, N 15.96. Масс-спектр, m/z: 263.
2-{(2-[(3-этокси-2-гидроксифенил)метилиден]гидразино}-2-тиоксо-N-[3-(трифторметил)фенил]ацетамид (31)
К 263 мг (10 ммоль) тиогидразида оксаминовой кислоты (30) в 0,5 мл ДМФА добавили 11 ммоль салицилового альдегида в 1 мл метанола. Реакционную смесь оставили на сутки при комнатной температуре. Затем добавили 2 мл метанола и охладили до -5, осадок отфильтровали и промыли небольшим количеством ледяного метанола.
Выход гидразона (31) 158 мг, 50%. Т.пл. 215-217°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.5 (м, 3Н, СН3); 4,15 (м, 2Н, СН2); 6,88 (м, 2Н, аром); 7,07 (м, 3Н, аром) 7,65 (м, 2Н, аром); 8,57 (м, 1H, гидр.); 10,05 (с, 1Н, ОН); 10,98 (с, 1H, NH); 12,00 (с, 1H, NH т.амид). Найдено (%): С 52.43, Н 3.82, N 10.31. Вычислено (%): С 52.55, Н 3.92, N 10.21. Масс-спектр, m/z: 411.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-2-тиоксо-N-[3-(трифторметил)фенил]ацетамид (28)
К 411 мг (1 ммоль) тиогидразона (31) в 3 мл метанола при охлаждении льдом (0-5°С) добавили 55 мг (1,5 ммоль) боргидрида натрия, небольшими порциями. Реакционную смесь оставили на 2 часа при охлаждении, затем добавили 15 мл воды и нейтрализовали разбавленной соляной кислотой до нейтральной среды. Выпавший осадок отфильтровали и перекристаллизовали из изопропанола или этанола.
Выход гидразида (28) 272 мг, 75%. Т.пл. 232-233°С. ЯМР 1Н CDCl3 (δ, м.д., J, Гц): 1.46 (м, 3Н, СН3); 4,12 (м, 2Н, СН2); 4,36 (с, 2Н, СН2); 6,85 (м, 4Н, аром); 7,08 (м, 1H, аром); 7,60 (м, 2Н, аром); 9,85 (с, 1Н, ОН). Найдено (%): С 52.39, Н 4.25, N 10.11. Вычислено (%): С 52.30, Н 4.39, N 10.16. Масс-спектр, m/z: 413.
Пример 11.
2-[2-(3-этокси-2-гидроксибензил)гидразино]-2-тиоксо-N-[4-(трифторметил)фенил]ацетамид (32)
N-хлорацетил-4-(трифторметил)-анилин (33).
К раствору 16,1 г (0,1 моль) 4-(трифторметил)-анилина в 100 мл ДМФА добавляем при охлаждении 8,75 мл (0,11 моль) хлорацетилхлорида, следя за тем, чтобы температура не превышала 20°С. После окончания прибавления перемешиваем при комнатной температуре раствор еще 2 часа. Затем выливаем реакционную смесь в 600 мл холодной воды и отфильтровываем осадок. Промываем его на фильтре водой и сушим на воздухе.
Выход хлорацетамида (33) 19 г 80% Т.пл. 115-116°С. ЯМР 1Н DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 4,20 (с, 2Н, CH2Cl). Найдено (%): С 45.38, Н 2.81, N 5.96. Вычислено (%): С 45.49, Н 2.97, N 5.89. Масс-спектр, m/z: 237.
2-гидразино-2-тиоксо-N-[4-(трифторметил)фенил]ацетамид (34).
Готовим раствор 0,15 моль элементной серы в 50 мл ДМФА и добавляем 0,06 моль морфолина. Полученную смесь перемешиваем 20-30 минут и добавляем к ней раствор 11,85 г (0,05 моль) хлорацетамида (33) в минимальном количестве ДМФА при охлаждении, следя за тем, чтобы температура не превышала 15°С. Полученную смесь перемешиваем 3-10 часов (контроль по ТСХ). После окончания реакции реакционную смесь пропускаем через слой силикагеля, к полученному раствору добавляем 6 мл (0,12 моль) гидразингидрата и перемешиваем при комнатной температуре 2 часа. Затем выливаем в воду и подкисляем разбавленной соляной кислотой до рН 7. Отфильтровываем осадок и сушим его на воздухе.
Выход тиогидразида (34) 6,4 г, 60%. Т.пл. 154-155°С. ЯМР 1H DMSOd6 (δ, м.д., J, Гц): 7,21 (д, 2Н, аром); 7,07 (д, 2Н, аром); 10,59 (с, 1H, NH). Найдено (%