Индукция апоптоза в опухолевых клетках, экспрессирующих toll-подобный рецептор
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована для приготовления медикамента для лечения рака с экспрессией TLR3 у пациента. Для этого используют агонист TLR3 в сочетании с интерфероном типа I в низкой дозе. Изобретение позволяет воздействовать на опухоль за счет индуцирования апоптоза в экспрессирующей TLR3 раковой клетке. Эффективность воздействия обусловлена синергетическим эффектом между агонистом TLR3 и интерфероном. 2 н. и 16 з.п. ф-лы, 1 ил.
Реферат
Область изобретения
Изобретение относится к способам лечения видов рака и опухолевых клеток, экспрессирующих Toll-подобный рецептор (TLR), путем выбора TLR-экспрессирующей опухолевой клетки и контакта этой клетки с терапевтически эффективным количеством лиганда TLR. Изобретение, в частности, относится к способам лечения TLR3-экспрессирующих видов рака и опухолевых клеток при использовании агонистов TLR3.
Предшествующий уровень техники
Рак является одной из ведущих причин смерти в мире. Поэтому важно разработать новые способы лечения этой смертельной болезни. Многие существующие способы лечения рака воздействуют на быстро делящиеся клетки. Эти способы лечения имеют разрушительные побочные эффекты, потому что они воздействуют на все быстро делящиеся клетки, такие как клетки желудочно-кишечного тракта и волосяных фолликулов, а не только на раковые клетки. Таким образом, необходимы новые способы лечения, не имеющие таких разрушительных побочных эффектов. Настоящая заявка идентифицирует Toll-подобный рецептор 3 как терапевтическую мишень при лечении рака.
Белки Toll дрозофилы (Drosophila toll) управляют спинно-брюшинным паттерном эмбриона дрозофилы, и предполагается, что они представляют древний механизм иммунной защиты.
Были также идентифицированы человеческие гомологи Drosophila toll, называемые Toll-подобными рецепторами (TLRs). Выравнивание последовательностей Toll белков человека и дрозофилы показывает наличие гомологии по всей длине белковых цепей. Соответственно, предполагается, что TLR являются важным компонентом врожденного иммунитета у людей. Семейство Toll-подобных рецепторов человека состоит из десяти высоко консервативных белков рецепторов, TLR1-TLR10. Подобно белку Drosophila Toll TLR человека представляют собой трансмембранные белки типа 1 с внеклеточным доменом, состоящим из домена повтора, богатого лейцином (LRR), который распознает молекулярные паттерны, ассоциированные с патогеном (РАМР), и цитоплазматическим доменом, гомологичным цитоплазматическому домену рецептора интерлейкина-1 (IL-1) человека. Подобно сигнальным путям как для рецептора Drosophila Toll, так и для рецептора IL-1, Toll-подобные рецепторы человека передают сигнал через путь NF-κB.
Хотя TLR млекопитающих имеют много общих характеристик и механизмов передачи сигнала, их биологические функции очень различны. Это объясняется частично тем фактом, что с TLR в различных комбинациях ассоциированы четыре различных молекулы адаптера (MyD88, TIRAP, TRIF и TRAF) и они опосредуют различные пути передачи сигналов. Кроме того, различные лиганды к одному TLR могут избирательно активировать различные пути передачи сигнала. Кроме того, TLR дифференцированно экспрессируются в различных кроветворных и не-кроветворных клетках. Соответственно, ответ на лиганд TLR зависит не только от пути сигнала, активизированного TLR, но также и от природы клеток, в которых экспрессируется конкретный TLR.
Хотя лиганды для некоторых TLR еще не идентифицированы, уже сообщалось о ряде специфических лигандов TLR. Например, как Poly IC, так и Poly AU являются агонистами TLR3.
Полиинозиновая-полицитидиловая кислота (Poly IC) представляет собой высокомолекулярную синтетическую двухцепочечную РНК, гетерогенную по размеру. Poly IC является агонистом TLR3, но она также является мощным активатором PKR, убиквитарного фермента, участвующего в противовирусных реакциях и посттранскрипционном регулировании гена.
Полиадениловая-полиуридиловая кислота (Poly AU) представляет собой двухцепочечный комплекс синтетических полирибонуклеотидов. Poly AU является агонистом TLR3. Poly AU является модулятором как гуморальных, так и клеточных иммунных реакций, а также она является индуктором интерферона.
Хотя как Poly IC, так и Poly AU использовались в нескольких клинических испытаниях в качестве адъювантной терапии при различных видах рака, таких как рак груди, мочевого пузыря, почки и желудка, эти агенты не использовались ранее в новых способах, описанных в настоящем изобретении.
Как было указано ранее, в настоящем изобретении идентифицирован Toll-подобный рецептор 3 в качестве терапевтического агента для лечения рака. Приведенные ниже опубликованные исследования относятся к взаимосвязи TLR и апоптоза.
В работе Aliprantis et al. описаны эксперименты, изучающие влияние бактериальных липопротеинов (BLP) на индукцию апоптоза в клеточной линии моноцитов, экспрессирующих Toll-like рецептор 2 человека (hTLR2). См. Aliprantis et al., "Cell Activation and Apoptosis by Bacterial Lipoproteins Through Toll-like Receptor-2", Science, vol. 285, pp.736-739 (July 30, 1999).
Другая работа Aliprantis et al. относится к роли TLR2 в запуске активации каспазы 8 через вовлечение адаптера FADD. См. Aliprantis et al., "The apoptotic signaling pathway activated by Toll-like receptor-2", Embo J., vol. 19(13), pp.3325-3336 (2000).
Работа Sabroe et al. относится к роли TLR2 в выживании нейтрофилов. См. Sabroe et al., "Selective Roles for Toll-Like Receptor (TLR)2 and TLR4 in the Regulation of Neutrophil Activation and Life Span", J. Immunology, vol. 170, pp.5268-5275 (2003).
Работа Bannerman и Goldblum относится к исследованиям, характеризующим TLR4 и TLR2 как рецепторы бактериальных липополисахаридов (LPS). См. Bannerman and Goldblum, "Mechanisms of bacterial lipopolysaccharide-induced endothelial apoptosis". Am. J. Physiology Lung Cell Molecular Physiology, vol. 284, pp.L899-L914 (2003).
Работа Meyer et al. относится к изучению индукции апоптоза агонистом TLR7 в линиях клеток эпителия человека (HeLa S3), кератиноцитах (клетки НаСаТ и А431) и фибробластах мышей (клетки МсСоу). См. Meyer et al., "Induction of apoptosis by Toll-like Receptor-7 agonist in tissue cultures", British J. Dermatology, vol. 149 (supp.66), pp.9-13 (2003).
В работе Wen et al. предполагается, что диабет частично индуцируется комбинацией прямого распознавания вирус-подобного стимула панкреатическими островками через экспрессию природного иммунного рецептора, TLR3. Wen и соавторы также предполагают, что индукция апоптоза Poly IC, возможно, опосредована TLR3. См. Wen et al., "The Effect of Innate Immunity on Autoimmune Diabetes and the Expression of Toll-Like Receptors on Pancreatic Islets", J: Immunology, vol. 172, pp.3173-3180 (2004).
Наконец, работа Han et al. относится к индукции апоптоза в клетках 293, сверхэкспрессирующих белок TRIF. Работа Han et al. также относится к предложенной модели TRIF-индуцированных внутриклеточных сигнальных путей (ISRE/IFNβ, NF-κB и апоптоз), которые активируются TLR3. См. Han et al., "Mechanisms of the TRIF-induced Interferon-stimulated Response Element and NF-κВ Activation and Apoptosis Pathways", J. Biological Chemistry, vol. 279, no. 15, pp.15652-15661 (2004).
Краткое описание изобретения
Вариант осуществления изобретения обеспечивает способ лечения рака, содержащий:
а) выбор пациента, у которого наблюдается рак с экспрессией TLR, и b) введение такому пациенту терапевтически эффективного количества лиганда TLR. Предпочтительно, лиганд является агонистом или антагонистом.
Альтернативный вариант осуществления изобретения обеспечивает способ индуцирования апоптоза опухолевой клетки, содержащий: а) выбор опухолевой клетки, экспрессирующей TLR, и b) контактирование клетки с лигандом TLR в количестве, эффективном для индуцирования апоптоза в клетке. Предпочтительно, лиганд является агонистом или антагонистом.
Другой вариант осуществления изобретения обеспечивает способ лечения рака, содержащий: а) выбор пациента, у которого наблюдается рак с экспрессией TLR, и b) введение пациенту терапевтически эффективного количества лиганда TLR3. Предпочтительно, лиганд является агонистом или антагонистом. Более предпочтительно, агонист представляет собой Poly AU. Наиболее предпочтительно, агонист представляет собой Poly IC. Как вариант, антагонист представляет собой антитело или его фрагмент. Предпочтительно, рак, экспрессирующий TLR3, представляет собой рак толстой кишки. Наиболее предпочтительно, рак, экспрессирующий TLR3, представляет собой рак груди. Способ может дополнительно содержать введение пациенту химиотерапевтического агента или лечение рака. Способ может также дополнительно содержать введение пациенту низкой дозы интерферона типа I (IFN I) до введения лиганда TLR3.
Альтернативный вариант осуществления изобретения обеспечивает способ для индуцирования апоптоза опухолевой клетки, содержащий: а) выбор опухолевой клетки, экспрессирующей TLR3, и b) контактирование клетки с лигандом TLR3 в количестве, эффективном для индуцирования апоптоза в клетке. Предпочтительно, лиганд является агонистом или антагонистом. Более предпочтительно, агонист представляет собой Poly AU. Наиболее предпочтительно, агонист представляет собой Poly IC. Как вариант, антагонист представляет собой антитело или его фрагмент. Предпочтительно, опухолевая клетка, экспрессирующая TLR3, представляет собой клетку рака толстой кишки. Наиболее предпочтительно, опухолевая клетка, экспрессирующая TLR3, представляет собой клетку рака груди. Способ может дополнительно содержать контактирование клетки с химиотерапевтическим агентом или лечение рака. Способ может также дополнительно содержать контактирование клетки с низкой дозой интерферона типа I (IFN I) до введения лиганда TLR3.
Краткое описание чертежа
Вышеупомянутые и другие свойства настоящего изобретения будут более понятны из последующего подробного описания изобретения и краткого описания чертежа, который представляет собой ряд графиков, демонстрирующих влияние подавления TLR3 при помощи siPHK (малых интерферирующих РНК) на апоптоз клеток Саmа-1 после инкубации в течение 48 часов с Poly IC.
Подробное описание изобретения
Все процитированные публикации включены в настоящее описание в своей полноте посредством ссылки.
Определения
Термин "апоптоз" означает запрограммированную гибель клетки.
Термин "агонист" означает лиганд, способный связываться с рецептором и активировать его.
Термин "антагонист" означает лиганд, способный связываться с рецептором и блокировать или инактивировать его. Альтернативно, "антагонист" может связываться с агонистом и блокировать или инактивировать его, чтобы предотвратить его связывание с рецептором.
Термин "антитело" означает полный иммуноглобулин, то есть содержащий два фрагмента Fab, связанных с фрагментом Fc. Термин "антитело" включает поликлональные, моноклональные, химерные, приматизированные, гуманизированные и антитела человека.
Термин "антитело" включает любой из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, а также подклассы (изотипы) иммуноглобулинов, то есть IgG1, IgG2, IgG3, IgG4, IgA и IgA2.
Термин "фрагмент антитела" означает любой фрагмент или комбинацию фрагментов полного иммуноглобулина, таких как фрагменты Fab, Fc, F(ab)2 и Fv.
Термин "рак" описывает физиологическое состояние, которое обычно характеризуется неконтролируемым ростом клеток. К примерам рака относятся, без ограничения, карцинома, лимфома, бластома, саркома и лейкоз. К более специфическим примерам относятся плоскоклеточный рак, мелкоклеточный рак легкого, не-мелкоклеточный рак легкого, рак желудочно-кишечного пути, рак поджелудочной железы, глиобластома, цервикальный рак, рак яичников, рак печени, рак мочевого пузыря, гепатома, рак груди, рак толстой кишки, колоректальный рак, карцинома эндометрия, рак слюнной железы, рак почки, рак простаты, рак вульвы, рак щитовидной железы, карцинома печени и различные типы рака головы и шеи.
Термин "химиотерапевтический агент" означает химическое соединение, применимое в лечении рака.
Термин "лечение" подразумевает терапевтические, профилактические или суппрессивные меры воздействия на болезнь или нарушение, ведущие к любому клинически желательному или полезному эффекту, включая, без ограничения, облегчение одного или более симптомов, регрессию, замедление или прекращение прогрессии заболевания или нарушения.
Термин "siPHK" означает малую интерферирующую рибонуклеиновую кислоту.
Термин "TLR" означает Toll-подобный рецептор. TLR может представлять собой любой вид Toll-подобных рецепторов. Предпочтительно, термин относится к Toll-подобному рецептору человека (hTLR), такому как один из TLRs 1-10.
Термин "рак, экспрессирующий TLR" означает опухоль, содержащую клетки, экспрессирующие Toll-подобный рецептор.
Термин "опухолевая клетка, экспрессирующая TLR" означает опухолевую клетку, которая экспрессирует Toll-подобный рецептор.
Термины "экспрессировать", "экспрессирует", "экспрессия" и "экспрессирующий" означают транскрипцию и трансляцию нуклеиновой кислоты с образованием полипептида. В клетке это означает, что полипептид либо будет секретироваться, либо останется в цитоплазме, либо будет находиться, по меньшей мере, частично, в мембране клетки.
Термин "лиганд" означает любую молекулу, способную специфически связываться с другой молекулой, такой как рецептор. Термин "лиганд" включает как агонисты, так и антагонисты. "Лиганд" может быть, например, небольшой молекулой (органической молекулой), антителом или его фрагментом, siRNA, антисмысловой нуклеиновой кислотой, полипептидом, ДНК и РНК.
Термин "лиганд TLR" означает любую молекулу, способную специфически связываться с Toll-подобным рецептором, в частности с рецепторами человека TLRs 1-10. Термин "лиганд TLR" включает как агонисты, так и антагонисты TLRs. "Лиганд TLR" может, например, представлять собой небольшую молекулу (органическую молекулу), антитело или его фрагмент, siRNA, антисмысловую нуклеиновую кислоту, полипептид, ДНК и РНК.
Термин "соответствующий лиганд TLR" означает лиганд, связывающийся с конкретным TLR. Например, лиганд TLR1 является соответствующим лигандом TLR для TLR1. Аналогично, лиганд TLR2 является соответствующим лигандом TLR для TLR2. Этот же принцип применим к TLRs 3-10.
Термин "пациент" означает как человека, так и животных.
Термин "Poly IC" означает полиинозиновую-полицитидиловую кислоту.
Термин "Poly AU" означает полиадениловую-полиуридиловую кислоту.
Термин "терапевтически эффективное количество" означает количество композиции, такой как лиганд TLR, которое смягчает один или более параметров, характеризующих медицинские состояния, вызываемые или опосредуемые TLR, такие как рак.
Термины "эффективное количество" и "количество, эффективное для" означают количество фармацевтической композиции, такой как лиганд TLR, которое вызывает определенный эффект, такой как индукция апоптоза в клетке.
Термин "низкая доза" означает количество вещества, меньшее, чем количество, считающееся нормальным для достижения определенного эффекта, такого как терапевтический эффект.
Характеристика Toll-подобного рецептора (TLR)
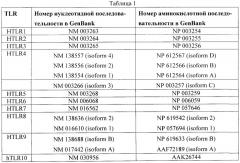
Семейство Toll-подобных рецепторов человека (hTLRs) состоит из десяти членов, hTLRs 1-10. Нуклеотидная последовательность полной открытой рамки считывания и соответствующая аминокислотная последовательность каждого из hTLRs 1-10 известны в данной области техники. Например, последовательности для hTLRs 1-10 описаны в РСТ-публикации WO 01/90151, хотя последовательности пронумерованы иначе, чем в общей номенклатуре. Нуклеотидную и аминокислотную последовательности для каждого из hTLRs 1-10 можно также найти в базе данных GenBank ®, как показано ниже в Таблице 1.
Специалист в данной области техники, зная последовательности нуклеиновой кислоты и аминокислоты любого TLR, способен получить любой белок TLR или его фрагмент, антитело к белку или фрагменту, нуклеиновую кислоту или ее фрагмент, зонд нуклеиновой кислоты, антисмысловую, siRNA, и т.д. при использовании стандартных способов молекулярной биологии. Эти молекулы можно использовать для отбора рака или опухолевой клетки, экспрессирующих TLR.
Были идентифицированы некоторые лиганды TLR, приведенные ниже в Таблице 2. Специалист в данной области техники может выделить или получить любой из указанных ниже лигандов. Альтернативно, лиганды могут быть приобретены из коммерческих источников.
| Таблица 2 | |
| TLR | Лиганды |
| TLR1 | Липопептиды микоплазмы (диацилированные липопротеины) (Sigma-Aldrich) |
| TLR2 | Липопептиды микоплазмы (диацилированные липопротеины) (Sigma-Aldrich), бактериальные липопептиды (Sigma-Aldrich) |
| TLR3 | Двухцепочечная РНК (dsRNA) (Invivogen), полидениловая-полиуридиловая кислота (Poly AU) (Invivogen), полиинозиновая-полицитидиловая кислота (Poly IC) (Invivogen) |
| TLR4 | LPS (липополисахарид) (Sigma-Aldrich) |
| TLR5 | Флагеллин (Calbiochem) |
| TLR6 | Бактериальные липопептиды (Sigma-Aldrich) |
| TLR7 | Имиквимод (Aldara®) (ЗМ Pharmaceuticals), R848 (ЗМ Pharmaceuticals) |
| TLR8 | R848 (ЗМ Pharmaceuticals) |
| TLR9 | CpG DNA (MWG Biotech) |
| TLR10 | He известны |
TLR функционируют как медиаторы иммунной реакции. Поэтому терапевтические применения для TLR существуют в областях онкологии, инфекционных заболеваний, аутоиммунитета, аллергии, астмы, хронической обструктивной болезни легких (ХОБЛ) и кардиологии.
Настоящее изобретение основано, частично, на открытии, что некоторые типы опухолевых клеток экспрессируют Toll-подобные рецепторы, и что связывание лиганда с этими TLR способствует появлению и повышению эффективности иммунных реакций, направленных на опухоль.
Выбор рака или опухолевой клетки, экспрессирующих TLR
Этап способа по изобретению включает выбор пациента, у которого наблюдается рак, экспрессирующий TLR, или выбор опухолевой клетки, экспрессирующей TLR.
Термин "выбор" означает идентификацию чего-то, представляющего интерес. В контексте настоящей заявки фраза "выбор пациента" означает идентификацию пациента, имеющего специфическую характеристику, такую как рак, экспрессирующий TLR. Фраза "выбор опухолевой клетки, экспрессирующей TLR" означает идентификацию опухолевой клетки, которая экспрессирует Toll-подобный рецептор.
Как известно в данной области техники, существует множество способов выбрать пациента, у которого наблюдается рак, экспрессирующий TLR, или выбрать опухолевую клетку, экспрессирующую TLR. Например, можно использовать антитело или фрагмент антитела для связывания и идентификации опухолевой клетки, экспрессирующей TLR. Предпочтительно, для связывания и идентификации опухолевой клетки, экспрессирующей TLR3, используют антитело к TLR3. Антитело или его фрагмент можно использовать in vivo в фармацевтической композиции или in vitro. Предпочтительно, пациенту проводят биопсию и отбирают опухолевые клетки in vitro. Также возможно увеличить экспрессию TLR перед биопсией, как потенциальное средство отбора пациентов, которые иначе не были бы включены в протокол лечения лигандом TLR. В случае TLR3, можно вводить низкую дозу интерферона типа 1 (I IFN) или самого лиганда TLR3 в течение нескольких дней перед биопсией или перед любой другой диагностической процедурой (аспирация через иглу или медицинское получение изображения). Альтернативно, для связывания и идентификации опухолевой клетки, экспрессирующей TLR, можно использовать любой из лигандов TLR, указанных в Таблице 2 настоящей заявки, или других малых молекул. Предпочтительно, для связывания и идентификации клетки, экспрессирующей TLR3, используют лиганд TLR3. В этом случае также этап выбора предпочтительно проводить in vitro. Кроме того, опухолевые клетки можно лизировать, чтобы определить, есть ли в клетках повышенные уровни конкретного белка TLR (Вестерн-блоттингом) или РНК конкретного TLR (Нозерн-блоттингом).
Процесс выбора может включать использование детектируемых меток. Например, для обнаружения описанных выше антител, фрагментов антител, малых молекул, ДНК, РНК и других лигандов их может быть необходимо пометить. Обнаружение можно проводить визуально или при помощи устройства. Обнаруживаемые метки, обычно используемые в данной области техники, включают, например, радиоактивные метки, флуоресцентные метки и ферментативные метки, хотя можно использовать любую обнаруживаемую метку.
В дополнение к идентификации опухолевой клетки, экспрессирующей TLR, на этапе выбора, вероятно, будет идентифицировано, какой именно Toll-подобный рецептор (TLRs 1-10) экспрессирует конкретная опухолевая клетка. Это объясняется тем фактом, что многие антитела, фрагменты антител, ДНК, РНК, малые молекулы или другие лиганды, используемые для отбора опухолевой клетки, экспрессирующей TLR, специфически связываются с отдельными TLR из TLRs 1-10.
Этап выбора пациента, у которого наблюдается рак, экспрессирующий TLR, или выбора опухолевой клетки, экспрессирующей TLR, может также быть осуществлен косвенным способом. Например, экспрессия специфического TLR при раке может быть связана с определенным подтипом рака с определенной этиологией. Любой маркер этой определенной этиологии, такой как вирус, может указывать на экспрессию данного TLR и может быть маркером, обусловливающим выбор используемого соответствующего лиганда TLR.
Введение пациентам лигандов TLR
Другой этап способа по изобретению включает введение пациенту терапевтически эффективного количества лиганда TLR. Этот этап включает введение лиганда TLR в фармацевтической композиции. Например, фармацевтическая композиция может быть представлена в форме таблетки, так чтобы лиганд абсорбировался в кровоток. Затем по системе кровообращения лиганд TLR может быть доставлен к раку, экспрессирующему TLR, таким образом обеспечивая контакт лиганда и рака. Этот этап контакта позволяет лиганду связаться с Toll-подобным(и) рецептором(ами) рака и вызвать ингибирование роста и апоптоз раковых клеток. Как вариант, фармацевтическую композицию можно вводить локально или топически, как при лечении меланомы.
Как указано выше, на этапе выбора вероятна идентификация конкретного TLR, экспрессируемого раком. Предпочтительно, этап введения включает введение соответствующего лиганда пациенту, у которого наблюдается рак, экспрессирующий Toll-подобный рецептор. Например, если рак экспрессирует TLR1, то пациенту предпочтительно вводить эффективное количество лиганда TLR1. Аналогично, если рак экспрессирует TLR2, то пациенту предпочтительно вводить эффективное количество лиганда TLR2. Тот же принцип применим к TLRs 3-10.
Предпочтительно, способ по изобретению включает введение пациенту, у которого наблюдается TLR3-экспрессирующй рак, эффективного количества лиганда TLR3. Предпочтительно, лиганд TLR3 является агонистом. Более предпочтительно, лиганд TLR3 представляет собой Poly AU. Наиболее предпочтительно, лиганд TLR3 представляет собой Poly IC. Предпочтительно, рак представляет собой рак толстой кишки или рак груди.
Предпочтительно, способ по изобретению дополнительно включает введение пациенту химиотерапевтического агента или лечение рака.
Предпочтительно, способ по изобретению дополнительно включает введение пациенту низкой дозы I IFN или лиганда TLR3. Например, низкая доза I IFN находится в пределах 1-3 ME, предпочтительно - 2 ME. Более предпочтительно, низкая доза I IFN составляет менее 1 ME.
Контакт опухолевых клеток, экспрессирующих TLR, с лигандами TLR
Как вариант, этап способа по настоящему изобретению включает контакт опухолевой клетки, экспрессирующей TLR, с эффективным количеством лиганда TLR. In vivo этап контакта представляет собой введение пациенту лиганда TLR в фармацевтической композиции. In vitro этап контакта представляет собой приведение опухолевой клетки, экспрессирующей TLR, и лиганда TLR в непосредственную физическую близость, таким образом, что лиганд и клетка могут контактировать друг с другом. Этот этап контакта позволяет лиганду связаться с Toll-подобным рецептором и вызвать ингибирование роста и апоптоз опухолевой клетки.
Как указано выше, на этапе выбора вероятна идентификация конкретного TLR, экспрессируемого опухолевой клеткой. Предпочтительно, этап контакта включает контакт клетки, экспрессирующей Toll-подобный рецептор, с соответствующим лигандом. Например, если рак экспрессирует TLR1, то пациенту предпочтительно вводить эффективное количество лиганда TLR1. Аналогично, если рак экспрессирует TLR2, то пациенту предпочтительно вводить эффективное количество лиганда TLR2. Тот же принцип применим к TLRs 3-10.
Предпочтительно, способ по изобретению включает контакт опухолевой клетки, экспрессирующей TLR3, с эффективным количеством лиганда TLR3. Предпочтительно, лиганд TLR3 является агонистом. Более предпочтительно, лиганд TLR3 представляет собой Poly AU. Наиболее предпочтительно, лиганд TLR3 представляет собой Poly IC. Предпочтительно, рак представляет собой рак толстой кишки или рак груди.
Предпочтительно, способ по изобретению дополнительно включает контакт клетки с химиотерапевтическим агентом или лечение рака.
Предпочтительно, способ по изобретению дополнительно включает контакт клетки с низкой дозой I IFN или лиганда TLR3. Например, низкая доза I IFN находится в пределах 1-3 ME, предпочтительно - 2 ME. Более предпочтительно, низкая доза I IFN составляет менее 1 ME.
Полипептиды
В способе по настоящему изобретению полипептиды, такие как антитело, фрагмент антитела или липопептид, могут использоваться на этапе выбора, для отбора рака или клетки, экспрессирующих TLR, на этапе введения, для доставки лиганда TLR пациенту, или на этапе контакта, для индукции ингибирования роста и апоптоза клетки, экспрессирующей TLR. Кроме того, полипептиды TLR или их фрагменты могут быть получены для идентификации или получения лигандов, таких как антитело, которые будут связываться с TLR.
В настоящем описании термин "полипептид" или "пептид" означает фрагмент или сегмент, например, полипептида, содержащего, по меньшей мере, 8, предпочтительно - по меньшей мере, 12, более предпочтительно - по меньшей мере, 20 и наиболее предпочтительно - по меньшей мере, 30 или более последовательных аминокислотных остатков, достигающих числом и включающих общее число остатков в полном белке. Термин "полипептид" также охватывает делеции, вставки, модификации, замены, аналоги, варианты и гликозилированные или негликозилированные полипептиды.
Замены включают как консервативные, так и неконсервативные замены.
Модификации аминокислотных остатков могут включать, без ограничения, алифатические эфиры или амиды карбокси-концов или остатков, содержащих карбоксильные боковые цепи, O-ацил-производные остатков, содержащих гидроксильные группы, и N-ацил-производные амино-концевой аминокислоты или остатков, содержащих аминогруппу, например, лизина или аргинина.
Аналоги представляют собой полипептиды, содержащие модификации, такие как включение неприродных аминокислотных остатков, или фосфорилированных аминокислотных остатков, таких как остатки фосфотирозина, фосфосерина или фосфотреонина. Другие возможные модификации включают сульфонирование, биотинилирование или добавление других фрагментов, особенно тех, молекулярные формы которых аналогичны форме фосфатных групп.
Методы синтеза полипептидов описаны, например, в Merrifield, J. Amer. Chem. Soc. 85:2149 (1963); Merrifield, Science 232:341 (1986); и Atherton et al., Solid Phase Peptide Synthesis: A Practical Approach, 1989, IRL Press, Oxford.
Аналоги полипептидов можно получать химическим синтезом или при использовании сайт-направленного мутагенеза [Gillman et al. Gene 8:81 (1979); Roberts et al. Nature, 328:731 (1987) или hmis (Ed.), 1990, PCR Protocols: A Guide to Methods and Applications, Academic Press, New York, NY] или метода полимеразной цепной реакции [PCR; Saiki et al. Science 239:487 (1988)], как описано, например, в Daugherty et al. [Nucleic Acids Res. 79:2471 (1991)] для модификации нуклеиновых кислот, кодирующих полные рецепторы. Также применимо добавление меток-эпитопов для очистки или детекции рекомбинантных продуктов.
Нуклеиновые кислоты
Нуклеиновые кислоты могут использоваться для выбора пациента, у которого наблюдается рак, экспрессирующий TLR, или для выбора TLR-экспрессирующей опухолевой клетки. Для выбора пациента предпочтительно проводить биопсию опухоли пациента.
Затем клетки опухоли можно анализировать in vitro на наличие экспрессии нуклеиновых кислот TLR.
Как указано в Таблице 1 настоящей заявки, последовательности нуклеиновых кислот и аминокислот каждого из hTLRs 1-10 известны в данной области техники. Специалист в данной области техники может использовать известные последовательности или их фрагменты для организации гибридизационного анализа, чтобы определить, экспрессирует ли конкретная опухолевая клетка нуклеиновые кислоты TLR. Например, используя известную последовательность конкретного TLR, специалист в данной области техники может провести Нозерн-блот-анализ, чтобы определить, экспрессирует ли опухолевая клетка этот конкретный TLR.
Кроме того, нуклеиновые кислоты, кодирующие конкретные TLR, или их фрагменты можно использовать для получения полипептидов TLR. Полипептиды TLR затем можно использовать для получения антител к специфическим TLR.
В настоящем описании "фрагмент нуклеиновой кислоты" определяется как нуклеотидная последовательность, содержащая, по меньшей мере, 17, обычно, по меньшей мере, 25, предпочтительно - по меньшей мере, 35, более предпочтительно - по меньшей мере, 45 и наиболее предпочтительно - по меньшей мере, 55 или более последовательных нуклеотидов.
Общие методы манипуляций с нуклеиновыми кислотами и их экспрессии описаны, например, в Sambrook, et al. Molecular Cloning: A Laboratory Manual (2d ed.), 1989, Vols. 1-3, Cold Spring Harbor Laboratory.
Получение антитела
В способе по настоящему изобретению антитела и их фрагменты, специфичные к TLR, можно использовать либо на этапе выбора, для отбора TLR-экспрессирующей клетки, на этапе введения, для доставки лиганда TLR пациенту, или на этапе контакта, для индукции ингибирования роста и апоптоза TLR-экспрессирующей клетки.
Можно получать антигенные (т.е. иммуногенные) фрагменты отдельного TLR. Вне зависимости от того, связывают ли они лиганды TLR, такие фрагменты, как и полные рецепторы, применимы в качестве антигенов для получения антител, которые могут связываться с полными рецепторами. Более короткие фрагменты могут быть последовательно соединены или присоединены к носителю. Поскольку в данной области техники известно, что эпитопы, в общем, содержат, по меньшей мере, около 5, предпочтительно - по меньшей мере, 8 аминокислотных остатков [Ohno et al., Proc. Natl. Acad. Sci. USA 82:2945 (1985)], то фрагменты, используемые для получения антител, в общем, будут, по меньшей мере, такого размера. Предпочтительно, они содержат даже более остатков, как описано выше. Является ли определенный фрагмент иммуногенным, можно легко определить рутинным экспериментом.
Хотя при использовании полных TLRs в качестве антигенов для стимуляции продукции антител в иммунологически компетентном хозяине это обычно не является необходимым, более маленьким антигенным фрагментам предпочтительно предварительно придать большую иммуногенность путем сшивки или последовательного соединения, или присоединения к иммуногенной молекуле-носителю (т.е. к макромолекуле, имеющей свойство независимого возбуждения иммунологического ответа в животном-хозяине). Сшивание или присоединение к молекуле-носителю могут быть необходимы, потому что небольшие полипептидные фрагменты иногда действуют как гаптены (молекулы, способные специфически связываться с антителом, но не способные вызывать продукцию антител, т.е. не являющиеся иммуногенными). Конъюгирование таких фрагментов с иммуногенной молекулой-носителем делает эти фрагменты более иммуногенными посредством эффекта, известного как "эффект носителя".
К подходящим молекулам-носителям относятся, например, белки и природные или синтетические полимерные соединения, такие как полипептиды, полисахариды, липополисахариды и т.д. Особенно предпочтительными являются белковые молекулы-носители, включая, без ограничения, гемоцианин лимфы улитки и белки сыворотки млекопитающих, такие как гамма-глобулин человека или быка, сывороточный альбумин человека, быка или кролика, или метилированные или другие производные таких белков. Специалисту в данной области техники будут также очевидны другие белковые носители. Предпочтительно, но необязательно, белковый носитель является чужеродным для животного-хозяина, в котором будут получать антитела к фрагментам.
Ковалентное присоединение к молекуле-носителю может быть осуществлено при использовании известных в данной области техники методов, выбор которых обусловлен природой используемой молекулы-носителя. Если иммуногенной молекулой-носителем является белок, то фрагменты по изобретению могут быть присоединены, например, при использовании водорастворимых карбодиимидов, таких как дициклогексилкарбодиимид или глутаровый альдегид.
Агенты присоединения, подобные указанным, можно также использовать для сшивки фрагментов друг с другом без использования отдельной молекулы-носителя. Такая сшивка в агрегаты может также повысить иммуногенность. Иммуногенность можно также повысить при использовании известных адъювантов, по отдельности или в комбинации с присоединением или агрегированием.
К подходящим адъювантам для вакцинации животных относятся, без ограничения, Адъювант 65 (содержащий арахисовое масло, маннид моноолеат и моностеарат алюминия); полный или неполный адъювант Фрейнда; минеральные гели, такие как гидроксид алюминия, фосфат алюминия или квасцы; поверхностно-активные вещества, такие как гексадециламин, октадециламин, лизолецитин, диметилдиоктадециламмония бромид, N,N-диоктадецил-N',N'-бис(2-гидроксиметил) пропандиамин, метоксигексадецилглицерин и плурониковые полиолы; полианионы, такие как пиран, декстран сульфат, poly IC, полиакриловая кислота и карбопол; пепиды, такие как мурамил дипептид, диметилглицин и туфтсин; и масляные эмульсии. Полипептиды также можно вводить после включения в липосомы или другие микроносители.
Информация, касающаяся адъювантов и различных аспектов иммунологических исследований, приведена, например, в серии Р. Tijssen, Practice and Theory of Enzyme Immunoassays, 3rd Edition, 1987, Elsevier, New York. К другим полезным ссылкам, описывающим методы получения поликлональных антисывороток, относятся Microbiology, 1969, Hoeber Medical Division, Harper and Row; Landsteiner, Specificity of Serological Reactions, 1962, Dover Publications, New York, и Williams, et al. Methods in Immunology and Immunochemistry, Vol.1, 1967, Academic Press, New York.
Сыворотку, полученную от животных, иммунизированных при использовании стандартных методов, можно использовать непосредственно, или от сыворотки можно отделить фракцию IgG при использовании стандартных методов, таких как плазмафорез или адсорбционная хроматография с адсорбентами, специфическими к IgG, такими как иммобилизованный Протеин А. Альтернативно, можно получить моноклональные антитела.
Гибридомы, продуцирующие моноклональные антитела против TLR или их антигенных фрагментов, получают хорошо известными методами. Обычно процесс включает слияние клеточной линии, придающей бессмертие, с В-лимфоцитом, продуцирующим требуемое антитело. Альтернативно, для получения перевиваемых (бессмертных) клеточных линий, продуцирующих антитело, можно использовать методы, не требующие слияния, например, вирус-индуцированную трансформацию [Casali et al., Science 234:476 (1986)]. Клеточные линии, придающие бессмертие, обычно представляют собой трансформированные клетки млекопитающих, особенно миеломные клетки, полученные от грызуна, быка или человека. Наиболее часто используют клеточные линии миеломы мышей или крыс, ввиду удобства и доступности.
Способы получения лимфоцитов, продуцирующих антитело, от млекопитающих, которым введены антигены, хорошо известны. В общем, если используют клетки, полученные от человека, то используют лимфоциты периферической крови (PBL), а для клеток, полученных из других млекопитающих, используют клетки селезенки или лимфатического узла. Животному-хозяину вводят повторяющиеся дозы очищенного антигена (клетки человека сенсибилизируют in vitro), и оставляют животное до появления клеток, продуцирующих требуемое антитело, затем их собирают для слияния с клеточной линией, придающей бессмертие. Методы слияния также хорошо известны в данной области техники, и в общем, включают смешивание клеток с агентом слияния, таким как полиэтиленгликоль.
Гибридомы отбирают стандартными методами, такими как селекция HAT (гипоксантин-аминоптерин-тимидин). Гибридомы, секретирующие требуемое антитело, отбирают при использовании стандартных методов иммунологического анализа, таких как Вестерн-блоттинг, ELISA (твердофазный иммуноферментный анализ), РИА (радиоиммунологический анализ), или подобные. Антитела выделяют из среды при использовании стандартных методов очистки белков [Tijssen, Practice and Theory of Enzyme Immunoassays (Elsevier, Amsterdam, 1985)].
Руководство по применению упомянутых методов можно найти в различных источниках [Kohler et al., Hybridoma Techniques (Cold Spring Harbor Laboratory, New York, 1980); Tijssen, Practice and Theory of Enzyme Immunoassays (Elsevier, Amsterdam, 1985); Camp-bell, Monoclonal Antibody Technology (Elsevier, Amsterdam, 1984); Hurrell, Monoclonal Hybridoma Antibodies: Techniques and Applications (CRC Press, Boca Raton, FL, 1982)]. Моноклональные антитела можно также получить при использовании хорошо известных систем фаговых библиотек. См., например, Huse, et al., Science 246:1275 (1989); Ward, et al., Nature, 341:544 (1989).
Полученные таким образом антитела, поликлональные или моноклональные, можно использовать, например, в иммобил