Препарат для применения аспартата для регулирования уровней глюкозы в крови
Иллюстрации
Показать всеПредложено применение белковых и/или пептидных фракций с содержанием аспартата по меньшей мере, 10,8 мас.% (или с содержанием аспартата 12,0-40 мас.% в расчете на общую массу белковой фракции) для изготовления питательной композиции для регулирования уровня глюкозы в плазме и/или повышения чувствительности к инсулину у млекопитающих после приема пищи, содержащей глюкозу (варианты) и соответствующие питательные композиции. Показано, что высокие количества аспартата, особенно при относительном отсутствии эквивалентов глутамата, повышают поглощение глюкозы в периферийных клетках и улучшают реакцию печени на поглощение диетической глюкозы. Это оказывает благоприятный эффект на уровни глюкозы в крови субъекта, страдающего гипергликемией и/или резистентностью к инсулину. Причем питательная композиция содержит белок, предпочтительно, выделенный из сои или молока, который дополнительно обогащен аспартатом при массовом соотношении эквивалентов аспартата и эквивалентов глутамата (asp:glu) от 0,41:1 до 5:1. 4 н. и 23 з.п. ф-лы, 2 ил, 3 табл.
Реферат
Область изобретения
Настоящее изобретение относится к препарату для применения специфических белковых и/или пептидных фракций с высоким содержанием аспартата для регулирования концентрации глюкозы в плазме и повышения чувствительности к инсулину у млекопитающих.
Предпосылки изобретения
Гипергликемия представляет собой метаболическое состояние организма, при котором уровни глюкозы в крови повышаются по сравнению с нормальными концентрациями в крови, составляющими около 3,9-6,1 ммоль/л (70-110 мг на 100 мл). Во время голодания или после потребления больших количеств глюкозы эти нормальные показатели, как правило, выходят за пределы этого диапазона, но организм млекопитающего имеет некоторые механизмы для поддержания гомеостаза глюкозы.
Субъектов, страдающих от аномально высоких уровней глюкозы после потребления источника глюкозы, определяют как страдающих от "высокого глюкозного ответа после приема пищи" или как "нетолерантных к глюкозе". Пониженная толерантность к глюкозе может привести к повышенным уровням глюкозы после голодания, и ее часто связывают с нарушением глюкозного обмена. Наглядные примеры можно найти у субъектов, которые, как было диагностировано, страдают от так называемого метаболического синдрома, или синдрома X, ожирения и некоторых типов диабета, таких как тип I, тип II и диабет беременных. Также субъекты, находящиеся под сильным эмоциональным стрессом, и пациенты, перенесшие тяжелую травму, хирургическую операцию или страдающие от острого заболевания, например пациенты отделения интенсивной терапии (ICU) в больнице, демонстрируют пониженную способность контролировать свой уровень глюкозы в крови до уровня ниже 6,1 ммоль/л, что, возможно, является результатом действия стрессовых гормонов, таких как кортизол. Помимо этих групп, также субъекты с некоторыми типами наследственного нарушения метаболизма, например субъекты, страдающие пропионовой ацидемией, изовалериановой ацидемией, метилмалоновой ацидемией, дефицитом оксокислотного кофермента А тиолазы или недостаточной активностью других тиолаз, и субъекты, имеющие недоразвитую метаболическую систему, такие как дети младшего возраста, часто испытывают периоды с возникающим после приема пищи высоким уровнем глюкозы в крови.
Высокий глюкозный ответ после приема пищи может привести к различным негативным эффектам на здоровье и функции организма, особенно когда это происходит в течение продолжительного времени или когда это связано с повышенным уровнем глюкозы после голодания. Примерами таких негативных эффектов являются сердечно-сосудистые проблемы как микро-, так и макрососудистого уровня, проблемы ухудшения зрения, почечные проблемы, неврологические проблемы, такие как невропатия и ухудшение когнитивной функции, повышенная чувствительность к инфекциям, таким как инфекции, вызываемые дрожжами, метаболические проблемы и более тяжелые эффекты, такие как полиурия и чувство чрезмерной жажды и голода.
Инсулин играет критическую роль в функционировании организма и, в частности, в метаболизме глюкозы в организме. В отличие от глюкагона, инсулин повышает поглощение глюкозы периферийными клетками, такими как клетки скелетных мышц и жировая ткань, и клетки печени, поджелудочной железы и сердечной мышцы, и он снижает печеночный глюконеогенез. Инсулин выделяется поджелудочной железой после потребления пищи, в частности, пищи, которая содержит источник глюкозы или белка. Выделение инсулина может снижаться при сильном повреждении поджелудочной железы, например при диабете типа I или панкреатите. По прошествии некоторого времени это может привести к серьезным проблемам со здоровьем, особенно когда возникающее после приема пищи пониженное выделение инсулина имеет место в сочетании с пониженной чувствительностью к инсулину. Инсулин, который выделяется в таких случаях, не приводит к повышенному поглощению глюкозы клетками, в частности периферийными клетками в организме, такими как клетки мышц. Это также называется "резистентность к инсулину".
Помимо диабетиков существует много других групп субъектов, которые страдают от резистентности к инсулину, таких как многие страдающие ожирением субъекты и субъекты, которые страдают метаболическим синдромом. Также после тяжелых травм или хирургических операций и в острых стадиях некоторых заболеваний, таких как рак и СПИД, часто наблюдается общая резистентность к инсулину. Резистентность к инсулину приводит к тяжелым проблемам здоровья, особенно при длительном сроке, и повышает риск заболеваемости и смертности у таких пациентов.
Несмотря на высокие системные уровни глюкозы при гипергликемии, некоторые ткани могут все же страдать от низких уровней внутриклеточной глюкозы. Для поддержания внутриклеточного энергетического гомеостаза в таких условиях в качестве энергетического источника должны использоваться липиды или белки. В случаях, когда поглощаются недостаточные количества липидов или белков, или в ситуации, когда запасы липидов в организме неправильно метаболизируются, происходит катаболизм мышечной (нежировой) массы организма. При нарушении энергетического питания могут возникнуть тяжелые осложнения, особенно при прогрессировании потери мышечной массы организма. Поэтому существует потребность в пищевом продукте, который повышает чувствительность к инсулину у энергетически неправильно питающихся субъектов, таких как те пациенты, которые страдают тяжелыми заболеваниями, субъектов, страдающих сильным ожирением и/или особенно у неправильно питающихся диабетических пациентов.
Новорожденные, в частности недоношенные дети, часто страдают от недоразвитой метаболической системы, которая нуждается в течение короткого времени в адаптации к новому режиму питания. В течение первых нескольких дней и даже недель в их организме происходят изменения, например, относящиеся к экспрессии ферментов, объему органов, например печени, поджелудочной железы, кишки и почек и содержимого кишки. Когда практика питания не приспособлена к их метаболическим возможностям, могут возникать расстройства и заболевания, такие как аномально высокие или низкие уровни глюкозы в крови.
В западных странах в последние десятилетия наблюдается существенное распространение случаев ожирения и диабета, и даже дети подвержены этим заболеваниям или расстройствам.
Из предшествующего уровня техники известны многие подходы к поиску пищевых продуктов, которые препятствуют тому, чтобы уровни глюкозы в плазме становились слишком низкими, но которые, в то же время, снижают глюкозный ответ после приема пищи и/или которые снижают резистентность к инсулину.
Были разработаны пищевые продукты, которые снижают гипергликемический ответ после их потребления. Например, глюкозный ответ после приема пищи, как это заявлено, сглаживается при включении источника медленно перевариваемого углевода, или скорость переваривания снижается путем включения клетчатки. Также источник глюкозы можно заменить другим ингредиентом, который высвобождает альтернативные углеводы, такие как фруктоза, которая не приводит к непосредственному повышению уровней глюкозы в крови после потребления. Пример этого описан в WO-A-03/105882. Однако эти альтернативные углеводы часто не соответствуют уникальным метаболическим и физиологическим свойствам глюкозы, подозревают, что особенно фруктоза обладает нежелательными побочными эффектами, особенно при высоких дозах, например, вызывает диарею, гиперурекемию, временно создавая запасы энергии в печени и вызывая воспалительный ответ.
Другой подход, известный из уровня техники, включает адаптирование белковой композиции для повышения высвобождения инсулина. В частности, обогащение аргинином, но также для этих целей предлагались лейцин, глицин или фенилаланин. Однако проблема резистентности к инсулину не решается при таком подходе. Высвобождение еще большего количества инсулина провоцирует и так уже сильно нагруженную поджелудочную железу и, таким образом, не является высокоэффективным подходом. Кроме того, считают, что превалирование высоких уровней инсулина в плазме в течение более длительных периодов времени повышает риск ожирения и развития резистентности к инсулину в более старшем возрасте. Это особенно важно для пациентов, которые страдают от проблем с поджелудочной железой и некоторых специфических проблем с печенью, например, как при диабете типа I, панкреатите, циррозе и гепатите.
Большинство коммерчески доступных полноценных питательных продуктов для диабетиков содержат белковую фракцию на основе казеина или сои. Лучшие глюкозные ответы после приема пищи особенно относят к продуктам на основе сои. Недостатком продуктов, в которых белковая фракция преимущественно образована из сои, является то, что вкус сои не очень приятный, а также то, что соя обеспечивает неоптимальный профиль аминокислот для удовлетворения всем требованиям, касающимся, например, количества незаменимых аминокислот, для субъектов, которые страдают гипергликемией, особенно в случае неправильно питающихся пациентов, страдающих от низкой мышечной массы тела и нуждающихся в сильном анаболизме в течение длительного периода времени.
Патент США № 6706697 раскрывает диабетическую и предназначенную для снижения веса композицию в форме порошка для получения напитка, содержащего около 15 мас.% фруктозы и 10 мас.% инулина, где белковая фракция напитка представляет собой органолептически более приемлемую комбинацию около 44 мас.% выделенного соевого белка и 20 мас.% изолята молочного белка. Изолят молочного белка определен как содержащий высушенный распылением растворимый казеин и белки сыворотки, выделенной из свежего сепарированного молока, где комбинацию казеина и белков сыворотки получают путем одновременного отделения всех белков, присутствующих в молоке, получая смесь казеина и сыворотки 80:20, обеспечивающую около 8 мас.% эквивалентов аспартата. К сожалению, использование высоких количеств фруктозы, как это предложено в патенте США № 6706697, может привести к указанным выше нежелательным побочным эффектам.
US 2004/0043013 раскрывает композицию средств для метаболической разобщающей терапии, включающую один или несколько членов, по меньшей мере, 4 групп веществ. Примеры 3-5 раскрывают препараты, полезные для достижения потери веса, лечения гиперлипидемии и ингибирования диабета типа II соответственно. Эти препараты состоят в основном из L-аспарагиновой кислоты в сочетании с креатином, пируватом и аргинином соответственно. Эти препараты не обеспечивают никаких незаменимых аминокислот и не включают никакого источника глюкозных эквивалентов. Более того, US 2004/0043013 раскрывает потребление больших количеств аминокислот, имеющее недостатки, связанные с указанным выше. Креатин может оказывать вредный эффект на некоторые ферменты путей транс-сульфурирования, относительно дорогой пируват легко разлагается в жидкой композиции и поэтому не является привлекательным ингредиентом для использования в питании, а аргинин сильно стимулирует высвобождения инсулина, создавая связанные с этим проблемы нагрузки на поджелудочную железу и повышения риска развития резистентности к инсулину.
Учитывая множество указанных выше проблем здоровья и низкий процент успеха решений, которые были раскрыты в предшествующем уровне техники, существует потребность в пищевых препаратах или диетическом режиме, которые могут быть вполне приемлемыми, благодаря их привлекательным органолептическим свойствам, которые соответствуют нормальному образу жизни, практике питания/питья, отсутствию дополнительной нагрузки на поджелудочную железу, возможно даже облегчая задачу поджелудочной железы, не имеют никаких нежелательных побочных эффектов и нормализуют уровни глюкозы в крови, особенно после приема пищи, и повышают чувствительность к инсулину.
Краткое описание изобретения
Было обнаружено, что высокие количества эквивалентов аспартата, особенно при относительном отсутствии эквивалентов глутамата, повышают поглощение глюкозы периферийными клетками и улучшают реакцию печени на потребление диетической глюкозы. В результате глюкозный ответ после приема пищи снижается, так же как и резистентность к инсулину в организме млекопитающего, и, таким образом, можно эффективно предотвращать и лечить диабетические состояния.
В соответствии с настоящим изобретением способность млекопитающих поглощать глюкозу из крови можно выгодным образом повысить с использованием полноценного пищевого продукта, обогащенного эквивалентами аспартата, или добавки, обогащенной эквивалентами аспартата, которую дают одновременно с или даже за несколько минут, вплоть до часа, до приема пищи, содержащей глюкозу. В любом случае обогащенный аспартатом питательный продукт или фармацевтический препарат оказывают благоприятный эффект на уровни глюкозы в крови субъектов, страдающих гипергликемией, в частности гипергликемией и/или резистентностью к инсулину, которые возникают после приема пищи и после хирургического вмешательства. Как показано в примере 7, обогащенные аспартатом пищевые продукты и пищевые продукты с высоким отношением аспартата к глутамату приводят к более быстрому выравниванию уровней глюкозы в крови после приема пищи, содержащей глюкозу.
Хотя использование аспартат- и глутаматсодержащих источников, например, таких как соя, для предотвращения некоторых указанных выше вторичных расстройств, связанных с гипергликемией и резистентностью к инсулину, известно из уровня техники, этот эффект никогда не относили к отдельным аминокислотам, не говоря уже об аспартате и его соотношении с глутаматом.
При использовании настоящего изобретения питательную композицию можно давать пациентам, страдающим гипергликемией, в частности гипергликемией, возникающей после приема пищи и после хирургического вмешательства, и/или страдающим резистентностью к инсулину, при этом такая композиция является обогащенной аспартатом, и/или массовое отношение аспартата к глутамату в ней является высоким, и где профиль (незаменимых) аминокислот можно адаптировать для соответствия требованиям в зависимости от состояния пациента, и которая обладает приемлемыми органолептическими свойствами.
В настоящее время обнаружено, что продукт, такой как описан в Патенте США № 6706697, содержащий эквиваленты аспартата в количестве максимум 10,4 мас.%, может быть еще более обогащен для достижения оптимального успеха в лечении и профилактики диабетических состояний.
Следовательно, используя эти знания, например, возможно сочетание высокого содержания аспартата в сое с другими обогащенными аспартатом белками, дипептидами и/или аспартатными солями для еще большего усиления поглощения глюкозы и, в то же время, для оптимизации органолептических свойств продукта и профиля содержания аминокислот у пациента. Также представляется возможным выбрать белок из источника, отличного от сои, для разработки продукта для контроля глюкозного ответа после приема пищи, где высокое содержание аспартата и, предпочтительно, также высокое отношение аспартата к глутамату, служат критерием выбора.
Таким образом, целью настоящего изобретения является обеспечение пищевой или фармацевтической композиции для регулирования концентрации глюкозы в плазме и/или повышения чувствительности к инсулину у млекопитающих, где пищевая или фармацевтическая композиция содержит белковую фракцию, включающую, по меньшей мере, 10,8 мас.% эквивалентов аспартата, где, по меньшей мере, часть обеспечивается источником аспартата, содержащим, по меньшей мере, 12,0 мас.%, предпочтительно, по меньшей мере, 12,3 мас.% эквивалентов аспартата. Предпочтительно, белковая фракция, кроме того, включает эквиваленты глутамата в массовом соотношении эквивалентов аспартата и эквивалентов глутамата (asp:glu) в пределах от 0,41:1 до 5:1.
Такой источник аспартата, содержащий, по меньшей мере, 12,0 мас.% может представлять собой интактный белок, белковый изолят, концентрат или гидролизат, и/или эквиваленты свободного аспартата. Когда источник аспартата, содержащий, по меньшей мере, 12,0 мас.% представляет собой белок, белковый изолят, концентрат гидролизата, предпочтительно, чтобы он присутствовал в количестве 5-100 мас.%, более предпочтительно 8-70 мас.%, даже более предпочтительно 10-60 мас.% в расчете на белковую фракцию. Когда присутствует более одного белка, содержащего, по меньшей мере, 12,0 мас.% аспартата, указанные выше цифры относятся к сумме этих белков. В случае когда источник аспартата образован из эквивалентов свободного аспартата, они предпочтительно присутствуют в количестве 0,2-9 мас.%, более предпочтительно 0,5-6 мас.%.
Таким образом, следующей целью настоящего изобретения является обеспечение питательной композиции, содержащей белковую фракцию, включающую, по меньшей мере, 10,8 мас.% эквивалентов аспартата, в расчете на массу белковой фракции. Более предпочтительно, белковая фракция, кроме того, включает эквиваленты глутамата, где массовое соотношение эквивалентов аспартата и эквивалентов глутамата составляет 0,41:1-5:1, более предпочтительно менее 2:1. Предпочтительно чтобы белковая фракция включала первый и второй источники эквивалентов аспартата, где указанный первый источник представляет собой интактный белок, белковый изолят, концентрат или гидролизат, и где второй источник отличается от первого источника. Это может быть, например, другой белок или полученное из белка вещество или эквиваленты свободного аспартата.
Еще одной целью настоящего изобретения является обеспечение питательной или фармацевтической композиции для регулирования концентрации глюкозы в плазме и/или повышения чувствительности к инсулину у млекопитающих, где питательная или фармацевтическая композиция включает, по меньшей мере, белковую фракцию, имеющую высокое массовое отношение эквивалентов аспартата к эквивалентам глутамата в пределах 0,41:1-5:1, предпочтительно в пределах 0,58:1-2:1.
Предпочтительно, питательную или фармацевтическую композицию, включающую эквиваленты аспартата, вводят одновременно или максимально за 60 минут до приема пищи, содержащей эквиваленты глюкозы.
И еще одной целью настоящего изобретения является обеспечение способа регулирования концентрации глюкозы в плазме и/или повышения чувствительности к инсулину у млекопитающих, нуждающихся в этом, особенно для лечения и профилактики диабета и гипергликемии, в частности гипергликемии, возникающей после приема пищи и после хирургического вмешательства, и/или резистентности к инсулину, при этом такой способ включает введение питательной или фармацевтической композици по настоящему изобретению указанному млекопитающему.
Подробное описание изобретения
Аспартат, глутамат
Аминокислоты - аспарагиновая кислота, аспарагин и глутаминовая кислота и глутамин, считаются незаменимыми аминокислотами для млекопитающих, поскольку организм млекопитающих обладает метаболической способностью синтезировать эти аминокислоты, когда это необходимо. Физиологически активный изомер представляет собой L-форму, и эндогенные аминокислоты обычно находятся в равновесии с их кето-аналогом оксалоацетатом (для аспартата) и альфа-кетоглутаратом (для глутамата). Аспарагин и глутамин могут гидролизоваться в организме до, соответственно, аспартата и глутамата в условиях высвобождения группы аммиака через взаимодействие с ферментами аспарагиназой и глутамазой соответственно. Аспартат и глутамат иногда рассматривают как нейротоксины.
В процессе применения стандартных методов анализа для определения содержания аминокислот аспарагин и глутамин легко гидролизуются, именно поэтому часто в аминокислотных композициях белков не указывают никакого отдельного количества аспарагина, но вместо этого указывают количество, представляющее собой сумму аспарагина и аспартата. То же относится и к глутамину.
Как это используется в настоящем документе, "эквиваленты аспартата" определены как компоненты, которые способны к высвобождению L-аспартата в организме, либо непосредственно, либо после расщепления, поглощения и метаболического преобразования печенью в ситуациях, в которых эквивалент был введен перорально или энтерально, например, путем питания через трубку. Примеры эквивалентов аспартата представляют собой белки или пептиды, которые содержат L-аспарагиновую кислоту и/или L-аспарагин, свободные аминокислоты, либо синтезированные, либо экстрагированные из природных веществ, солевые формы свободных аминокислот, например соли с ионами металлов, таких как натрий, калий, цинк, кальций, магний, или с другими соединениями, такими как другие аминокислоты, карнитин, таурин, или соединениями четвертичного аммония, такими как холин или бетаин, этерифицированные формы аминокислот, такие как соединения, которые содержат ацильную группу, связанную с одной из карбоновокислотных групп, или сложные эфиры, полученные из органических молекул, таких как пирувиновая кислота, и производные свободных аминокислот, где алкильная или ацильная группа была присоединена к первичному атому азота. Таким образом, эквиваленты аспартата включают любое соединение, имеющее формулу R1-NH-CH(COR2)-[СН2]n-CO-OR3 или R1-NH-CH(COR2)-[СН2]n-CO-NHR3, где n=1, R1 представляет собой Н, (замещенный) алкил или ацил (включая С-пептидил), R2 представляет собой ОН, OR3, NHR3 или N-пептидил, R3 представляет собой Н, (замещенный) алкил или ацил, а также анионные и катионные соли и цвиттерионы. То же относится и к эквивалентам глутамата, за исключением того, что n=2. Пептиды предпочтительно получают путем гидролиза интактного белка. Кето-аналог, оксалоацетат, и его производные представляют собой менее подходящие формы для включения в пищевой продукт из-за технологических проблем (обрабатываемость) и проблем стабильности, которые могут возникнуть.
Дозы указаны в граммах L-аспарагиновой кислоты. Эквивалентные дозы альтернативных компонентов можно рассчитать, используя те же молярные количества с поправкой на молекулярную массу альтернативного компонента. При расчетах остатки в пептидах и белках корректируют на недостаток молекулы воды в аминокислотной цепи. Все эквиваленты составляют общую массу в их полной, т.е. гидролизованной форме, включая молекулу воды.
"Эквиваленты глутамата" определяют таким же образом, как и эквиваленты аспартата. Они включают белки или пептиды, которые включают L-глутаминовую кислоту и/или L-глутамин, свободный глутамат и глутаминовую аминокислоты, либо синтезированные, либо экстрагированные из природных веществ, соли свободных аминокислот и т.д. N-ацетилглутамин и N-ацетилглутамат также являются подходящими формами. Повсеместно в настоящем описании и формуле изобретения дозы указаны в граммах L-глутамина, эквиваленты скорректированы на недостаток молекулы воды в случае пептидных и белковых составляющих.
Количества эквивалентов аспартата и глутамата рассчитывают в расчете на общую питательную или фармацевтическую композицию. В случае когда композиция состоит из разных частей, количества этих эквивалентов в разных частях складывают.
Повсеместно, как это предполагается в настоящем документе, "эквиваленты свободного аспартата" или "эквиваленты свободного глутамата" включают аспартат, аспарагин, глутамат и глутамин, их формы свободной кислоты, а также их анионные формы и соли, такие как соли щелочных металлов, соли щелочноземельных металлов, аммониевые соли, замещенные аммониевые соли и цвиттерионные виды; кислоты независимо указаны при помощи их кислотного наименования или их анионных наименований, например аспарагиновая кислота или аспартат и глутаминовая кислота или глутамат соответственно. Эквиваленты свободного аспартата и эквиваленты свободного глутамата также включают дипептиды содержащие, по меньшей мере, одну молекулу аспартата и глутамата соответственно. Дипептиды служат в качестве источника аспартата и глутамата и не должны обладать независимым биологическим действием в пределах концентраций, где их используют.
Однако предпочтительно использовать L-аспарагиновую кислоту или ее производные вместо L-аспарагина или его производных для предотвращения образования нежелательных побочных продуктов в процессе обработки, в частности, когда эквиваленты аспартата включают в свободной форме, т.е. не в виде олиго- или полипептида. Подходящие формы L-аспарагиновой кислоты представляют собой соли с металлами, такими как натрий, калий, кальций, цинк и магний, или с аминокислотами, такими как L-лизин и L-гистидин.
Количество солей аспартата не должно превышать 9 мас.%, предпочтительно менее 6 мас.% питательного препарата, в частности, количество каждой отдельной соли аспартата не должно превышать 4,8 мас.% в случае, когда белковую фракцию вводят пациенту в жидкой форме, во избежание электролитного дисбаланса. Например, количество калия обычно должно составлять менее 400, предпочтительно 50-250 и наиболее предпочтительно 100-180 мг на 100 мл. Количество магния обычно должно составлять менее 200 мг, предпочтительно 10-120 и более предпочтительно 12-80 мг на 100 мл. Также дипептиды, включающие одну или несколько групп аспарагиновой кислоты, являются подходящими, хотя и не предпочтительными вариантами воплощения изобретения. В этот случае также альтернативный источник представляет собой растительные экстракты, такие как экстракты из сахарного тростника, особенно те, которые обогащены аспартатом и бетаином, или экстракты из картофеля. Путем, по меньшей мере, частичного гидролиза фракция аспартата становится более быстро доступной для пациента.
Учитывая его важную роль в борьбе с указанными выше расстройствами, количество эквивалентов аспартата можно еще больше увеличить, но белковая фракция должна содержать не более 95 мас.%. Белковая фракция предпочтительно включает, по меньшей мере, 10,8 мас.% аспартата, предпочтительно 11,0-70 мас.%, более предпочтительно 11,5-50 мас.%, даже более предпочтительно 11,8-45 мас.%, еще более предпочтительно 12,0-40 мас.% и наиболее предпочтительно 12,5-36 мас.%, в частности 12,8-30 мас.%, более конкретно менее 25 мас.% эквивалентов аспартата в расчете на массу белковой фракции. Белковая фракция, содержащая более 13,0 мас.% или даже более 14,0 мас.% эквивалентов аспартата, является особенно предпочтительной.
Белковая фракция по настоящему изобретению предпочтительно включает фракцию аспартата, которая быстро расщепляется и абсорбируется, и поэтому является доступной в организме. Это достигается путем включения, по меньшей мере, части эквивалентов аспартата в форме, которая быстро проходит через желудок и не требует высокой активности пищеварительных ферментов, таких как пепсин, трипсин и химотрипсин. В одном варианте воплощения изобретения, таким образом, предпочтительно, чтобы, по меньшей мере, часть, предпочтительно, по меньшей мере, 0,2 мас.%, более предпочтительно, по меньшей мере, 0,5 мас.%, даже более предпочтительно, по меньшей мере, 0,7 мас.% и наиболее предпочтительно, по меньшей мере, 1,0 мас.%, в частности, по меньшей мере, 1,5 мас.% эквивалентов аспартата представляло собой синтетические или выделенные аминокислоты и/или их соли или сложные эфиры, и/или дипептиды, содержащие, по меньшей мере, одну молекулу эквивалентов аспартата.
Кроме того, белковая фракция по настоящему изобретению предпочтительно включает 0,2-30 мас.% эквивалентов глутамата, предпочтительно в количестве 2,0-25,0 мас.%, более предпочтительно 4,0-22,0 мас.%, даже более предпочтительно 5,0-22,0 мас.% и наиболее предпочтительно 8,0-21,0 мас.%, в частности 10,0-20,5 мас.% в расчете на массу белковой фракции. Иногда предпочтительной является белковая фракция, содержащая 12,0-18 мас.% эквивалентов.
Относительно высокое массовое отношение эквивалентов аспартата (asp) к эквивалентам глутамата (glu) обеспечивает выгодный эффект по настоящему изобретению. Особенно в продуктах для детей младшего возраста и грудных младенцев массовое отношение эквивалентов аспартата к эквивалентам глутамата играет важную роль. Поэтому белковая фракция имеет массовое соотношение asp:glu в пределах между 0,41:1 и 5:1, предпочтительно в пределах между 0,45:1 и 4:1, более предпочтительно в пределах между 0,50:1 и 3:1, в частности, в пределах между 0,53:1 и 2:1. В другом варианте воплощения изобретения, особенно в тех случаях, когда продукт состоит преимущественно из белков сои, предпочтительно составляющих более 50 мас.%, более предпочтительно более 60 мас.%, наиболее предпочтительно более 70 мас.% от массы белковой фракции, предпочтительным является еще более высокое массовое отношение asp:glu. В этом случае белковая фракция, предпочтительно, имеет массовое отношение эквивалентов аспартата к эквивалентам глутамата, которое предпочтительно находится в пределах от 0:58:1 до 2:1, предпочтительно в пределах 0,59:1-1,8:1, более предпочтительно 0,60:1-1,6:1, еще более предпочтительно 0,62:1-1,4:1 и наиболее предпочтительно в пределах 0,70:1-1,2:1.
Очевидно, что лучшие результаты получают при более высокой степени соответствия критериям, установленным для продукта по настоящему изобретению. Это особенно касается общей композиции аминокислот и включения источника эквивалентов аспартата, который является более быстро доступным для потребителя продукта по сравнению с фракцией глюкозы.
Белковая фракция; аминокислотный профиль
"Белковая фракция", как этот термин используется повсеместно в настоящем описании и формуле изобретения, означает сумму всех белков, пептидов и аминокислот в продукте, и под белком также подразумевается белковый изолят, концентрат и/или гидролизат. Белковая фракция является эффективной, когда она соответствует следующим критериям:
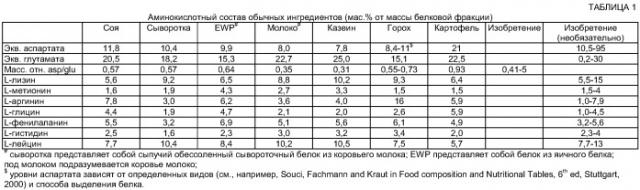
Помимо условий, касающихся количества эквивалентов аспартата и глутамата, количества незаменимых аминокислот в белковой фракции, таких как метионин, аминокислоты с разветвленной цепью: валин, лейцин и изолейцин, и, кроме того, лизин, тирозин, фенилаланин, гистидин, треонин и триптофан, которые будут доступны для организма млекопитающего после расщепления белковой фракции, должны обеспечивать достаточные количества для обеспечения анаболизма и правильного функционирования организма.
В частности, было обнаружено, что количества L-метионина и L-лизина, а также L-лейцина являются критическими. За исключением случаев, когда пациент страдает от роста опухоли, количество L-метионина предпочтительно составляет 1,5-4 мас.% и более предпочтительно 1,7-3,3 мас.% от массы белковой фракции. Тогда сумма количества L-метионина и L-цистеина в белковой фракции предпочтительно, более 2,7 мас.%, более предпочтительно более 2,9 мас.% и наиболее предпочтительно 3,5-8 мас.% от массы белковой фракции. В случае когда пациент, страдающий общей резистентностью к инсулину и/или гипергликемией, также страдает от роста опухоли, предпочтительно, чтобы к белковой фракции не добавляли L-метионин.
Пациенты, страдающие пропионовой ацидемией, не переносят высокие количества изолейцина, валина, метионина и треонина в пищевом рационе, которые катаболизируют до пропионовой кислоты. С продуктом по настоящему изобретению переносимое количество может быть увеличено. Поэтому общее количество этих аминокислот в белковой фракции выше 10, предпочтительно 12-30, более предпочтительно 16-26 мас.% от массы белковой фракции. Тот же критерий используют для продуктов, используемых субъектами, которые страдают метилмалоновой ацидемией.
Количество L-лизина предпочтительно составляет 5,5-15, более предпочтительно 6,6-12 и наиболее предпочтительно 7,1-11 мас.% от массы белковой фракции. Однако если его не вводят субъектам, страдающим глутаровой ацидемией, количество лизина должно быть ниже 7 мас.%, предпочтительно 5,5-6,9 мас.% от массы белковой фракции. В этом случае уровни триптофана должны быть ниже 1,7, предпочтительно 1,3-1,6 мас.% от массы белковой фракции.
В целях избежания большого высвобождения инсулина после введения, концентрации аргинина, глицина и фенилаланина в белковой фракции должны быть относительно низкими.
Количество аргинина предпочтительно составляет менее 7,9 мас.%, более предпочтительно менее 7,8 мас.%, еще более предпочтительно менее 7,0 мас.% и наиболее предпочтительно менее 6,0 мас.% от массы белковой фракции. Соотношение L-аргинина и L-лизина в продукте обычно должно составлять 0,4:1-1,43:1, предпочтительно 0,5:1-1,40:1, и особенно в продуктах, предназначенных для введения детям младшего возраста, это соотношение предпочтительно составляет 1:1-1,40:1. Отношение эквивалентов аспартата к L-аргинину в продукте предпочтительно должно быть выше 1,4, более предпочтительно 1,5-5, наиболее предпочтительно 1,6-3,0 для достижения максимального эффекта и сбалансированного аминокислотного профиля.
Количество L-глицина предпочтительно составляет более 3,5, предпочтительно в пределах от 3,6 до 4,5 мас.% и более предпочтительно менее 4,2 мас.% от массы белковой фракции. Массовое соотношение Asp/Gly предпочтительно находится в пределах 2,8:1-100:1, а массовое соотношение Asp/Phe - в пределах 2,4:1-100:1. В частности, количество L-серина должно превышать количество L-глицина, по меньшей мере, в 1,5 раза. Предпочтительно, соотношение L-серин/L-глицин составляет более чем 2,0:1, более предпочтительно, по меньшей мере, 2,3:1. Это достигается путем добавления белков, которые включают большое количество L-серина по сравнению с L-глицином, и/или путем добавления синтетического L-серина или дипептидов, которые включают L-серин.
Количество L-фенилаланина предпочтительно ниже 5,6 мас.% и более предпочтительно ниже 5,3 мас.% от массы белковой фракции. Аспартам также является неподходящим источником аспартата из-за его чрезмерной сладкости.
Количество лейцина в белковой фракции продуктов в соответствии с настоящим изобретением составляет 7,7-13 мас.%. Для субъектов, страдающих изовалериановой ацидемией, желательны уровни лейцина ниже 10 мас.%, предпочтительно ниже 9,0 мас.%. Для субъектов с недоразвитыми и/или нарушенными метаболическими функциями, таких как дети младшего возраста, недоношенные дети и субъекты с тяжелыми нарушениями функции печени, массовое содержание аспартата относительно лейцина предпочтительно находится в пределах 0,85:1-1,5:1, более предпочтительно 0,88:1-1,4:1, еще более предпочтительно 0,9:1-1,1:1 и наиболее предпочтительно в пределах 0,95:1-1,04:1. Для поддержания баланса количества аспартата и лейцина рекомендуется включать часть лейцина в виде альфа-кето-изокапроата. Этот компонент представляет собой отличный противоион для компонентов, таких как аминокислоты или орнитин или бетаин, в том, что касается эффективности и вкуса.
Особенно предпочтительно использование белковой фракции, обеспечивающей необходимый уровень эквивалентов аспартата по настоящему изобретению для получения продукта для лечения метаболических расстройств, где белковая фракция дополнительно включает одно из следующих: а) 7,7-19 мас.% от суммы всех аминокислот с разветвленной цепью; b) 7,7-9,0 мас.% лейцина и 3,6-4,5 мас.% глицина; с) 16-26 мас.% от суммы изолейцина, метионина, валина и треонина; и d) 5,5-6,9 мас.% лизина и 1,3-1,6 мас.% триптофана, где цифровые значения указаны в расчете на массу белковой фракции.
Количество L-гистидина предпочтительно составляет 2,3-4 и более предпочтительно 2,5-3,2 мас.% от массы белковой фракции. Количество аланина в белковой фракции обычно должно составлять 4,8-8, предпочтительно 5,1-7,5 и более предпочтительно 5,3-7,0 мас.%.
Выгодно, когда в продукт включают органические молекулы, содержащие гуанидиногруппу. Однако рекомендуется не включать свободный аргинин или его эквиваленты, такие как соли или небольшие пептиды, которые включают L-аргинин. Вместо этого можно включить небольшие количества гуанидиноацетата или 3-гуанидинопропионата, например, в количествах ниже 2 г на суточную дозу и предпочтительно в количествах 0,1-1 г на суточную дозу. В жидком продукте 3-гуанидинопропионат является отличным источником, и его концентрация обычно составляет 0,005-0,05 мас.%. Поэтому предпочтительно не включать никакого или только такое относительно низкое количество креатина, чтобы массовое соотношение креатин/эквиваленты аспартата в белковой фракции составляло менее 0,2:1, предпочтительно даже менее 0,1:1, более предпо