Производные гемина или их фармацевтически приемлемые соли, способ получения, композиция и применение
Иллюстрации
Показать всеИзобретение относится к новым производным гемина общей формулы I, где R1=R2 и представляют собой β-аланилгистамин, или γ-гутамилгистамин, или β-аланилгистидин, или R1 представляет собой ОН и R2 представляет собой γ-глутамилгистамин; Y- представляет собой Cl-; Me представляет собой Fеn+, где n=2, 3; и где карбоксильная группа гемина может быть модифицирована метиловым или другим C1-8 эфиром; их фармацевтически приемлемым солям; способу их получения и фармацевтическим композициям. Производные гемина общей формулы I могут быть использованы в качестве искусственных нуклеаз, средства, обладающего пероксидазной активностью, катализаторов окисления метиллинолеата и дезинфицирующей, антисептической композиции, обладающей вирулицидным действием. 7 н. и 2 з.п. ф-лы, 1 ил., 7 табл.
Реферат
Изобретение относится к области биоорганической химии, а именно к новым производным гемина, представляющим собой соединения общей формулы I:
где R1=R2 и представляют собой β-аланилгистамин, или γ-глутамилгистамин, или β-аланилгистидин,
или R1 представляет собой ОН и R2 представляет собой γ-глутамилгистамин;
Y- представляет собой Сl-; Me представляет собой Fen+, где n=2, 3; и где карбоксильная группа гемина может быть модифицирована метиловым или другим С1-8 эфиром, или их фармацевтически приемлемым солям, обладающим вирулицидным действием;
к способу синтеза этих соединений; композиции и применению, в том числе биомедицинскому, новых и известных производных гемина формулы I в качестве катализаторов окисления природных органических субстратов и потенциальных вирулицидных средств.
Известны производные гемина (геминпептиды), в частности моно-HemLeuHisOMe, обладающие пероксидазной активностью в реакции окисления NADH пероксидами (Н2О2, ТБГ) [Евстигнеева Р.П., Желтухина Г.А., Рожкова Е.А.// Кинетика и катализ, Т.40, №2, 1999, с.256-260]. Для некоторых аминокислотных и пептидных производных гемина общей формулы I, а именно при R1=-OH, R2=-ArgOMe, или R2=-LeuHisOMe, или R2=ArgArgTrpHisArgLeuLysGlu(OMe)OH, или R2=-ArgTrpHisArgLeuLysGlu(OMe)OH, или R2=-TrpHisArgLeuLysGlu(OMe)OH, установлена нуклеазная (нуклеолитическая) активность, проявляющаяся в способности разрушать плазмидную ДНК [Желтухина Г.А., Небольсин В.Е., Лобанова Т.Н.// Патент РФ №2250906; Желтухина Г.А., Лобанова Т.Н., Небольсин В.Е., Галлямов М.О., Драницына С.М., Костанян И.А. // Биоорган. химия. 2006. Т.32, №2, с.198-210].
Отдельные аминокислотные и пептидные производные гемина общей формулы I, а именно при R1=-OH, R2=-ArgArgTrpHisArgLeuLysGlu(OMe)OH или R2=-LeuHisOMe, а также при R1=R2=-ArgOMe, способны ингибировать протеиназу ВИЧ и оказывать вследствие этого противовирусное анти-ВИЧ действие [Евстигнеева Р.П., Желтухина Г.А., Зарубина Т.В., Небольсин В.Е., Носик Д.Н., Носик Н.Н. // Патент РФ №2238950]. Однако не была известна вирулицидная активность известных аминокислотных и пептидных производных гемина, за исключением монозамещенных геминпептидов общей формулы I с R1=-OH, содержащих в качестве заместителя R2=-ArgTrpHisArgLeuLysGlu(OMe)OH или -TrpHisArgLeuLysGlu(OMe)OH [Патент РФ 2296131]. Последние обладают вирулицидной активностью, в частности, против вирусов герпеса, но они сравнительно малодоступны из-за сложности строения и недостаточно эффективны, проявляя вирулицидное действие лишь спустя 1-2 часа.
Поэтому существует необходимость в синтезе низкомолекулярных, более простых производных гемина общей формулы I, например его дизамещенных аминокислотных производных.
Синтезы и физико-химические константы известных аминокислотных производных гемина общей формулы I, упоминаемых в данном изобретении, а именно соединений общей формулы I, где R1=R2=-SerOMe и R1=R2=-LysOMe, приведены соответственно в источниках [Небольсин В.Е., Желтухина Г.А., Лобанова Т.Н.// Патент РФ №2280649, Лившиц А.Б., Тульчинский В.М., Васильев А.Е. // Ж. орган. химия. 1977, т. ХIII, стр.436-442].
Однако вирулицидная активность для этих соединений не была установлена.
Композиции для предотвращения вирусных инфекций, включающие конъюгаты гемина с аминокислотами, пептидами и пептидомиметиками, неизвестны.
Задачей настоящего изобретения явилось создание новых доступных водорастворимых производных гемина общей формулы (I) и их фармацевтически приемлемых солей, за исключением известных производных геминпептидов, где R1=OH, R2=-ArgTrpHisArgLeuLysGlu(OMe)OH, или R2=-TrpHisArgLeuLysGlu(OMe)OH, обладающих одновременно вирулицидным действием и нуклеазной активностью, простого способа получения производных гемина общей формулы I с незащищенными карбоксильными группами, композиций для использования в качестве дезинфектантов, антисептиков, в том числе фармацевтических, на основе этих производных гемина и применение их в качестве вирулицидных агентов и средств предотвращения вирусных инфекций.
Поставленная задача в части новых соединений решается новыми производными гемина или их фармацевтически приемлемыми солями, представляющими собой соединения общей формулы I:
где R1=R2 и представляют собой -β-аланилгистамин, или -γ-глутамилгистамин, или -β-аланилгистидин,
или R1 представляет собой ОН и R2 представляет собой -γ-глутамилгистамин;
Y- представляет собой Сl-; Me представляет собой Fеn+, где n=2, 3; и где карбоксильная группа гемина может быть модифицирована метиловым или другим C1-C8 эфиром.
При этом предлагаемые производные гемина, описываемые общей формулой I, обладают вирулицидным действием, представляют собой искусственную нуклеазу, обладают пероксидазной активностью, являются катализаторами окисления природных органических субстратов.
Далее настоящее изобретение относится к фармацевтической композиции, обладающей вирулицидной активностью; дезинфицирующей, антисептической композиции, содержащим эффективное количество соединения общей формулы I или его фармацевтически приемлемой соли, а также, если требуется, носитель, в том числе фармацевтически приемлемый.
Еще одним объектом данного изобретения является новый способ получения конъюгатов гемина, описываемых общей формулой I, путем взаимодействия активированного по карбоксильной/ым группе/ам производного гемина с незащищенным по карбоксильной группе аминокомпонентом в присутствии четвертичного аммониевого основания в органическом растворителе с использованием катализатора межфазного переноса.
Новые предпочтительные соединения общей формулы I представлены ниже:
Далее перечислены известные предпочтительные соединения общей формулы I:
В соответствии с настоящим изобретением новые дизамещенные производные гемина, соответствующие общей формуле I, а именно II, III и IV, получают путем взаимодействия свободной по аминогруппе аминокомпоненты, включающей незащищенную по карбоксильной группе аминокислоту, с бис→N-оксисукцинимидным эфиром гемина, а соединение (V) синтезируют в растворе путем ацилирования аминогруппы соответствующей аминокомпоненты N-окси-5-норборнен-2,3-дикарбоксиимидным (ONb) эфиром гемина.
Одной из задач настоящего изобретения явилась разработка эффективного способа получения соединений общей формулы I, а именно конъюгатов гидрофобного гемина с гидрофильными незащищенными цвиттер-ионными аминокомпонентами, в частности новых соединений (II-V). Данная задача решена путем проведения реакции в присутствии четвертичного аммониевого основания - катализатора межфазного переноса, причем в качестве четвертичного аммониевого основания использован бензилтриметиламмония гидроксид (Triton В).
В отличие от ранее использованных способов синтеза известных соединений общей формулы I в соответствии с настоящим изобретением успешное проведение реакции взаимодействия бис-N-оксисукцинимидного эфира гемина, растворимого лишь в органических растворителях, с пептидомиметиком, например H-γ-GluHA, или пептидами, или аминокислотами цвиттер-ионного строения, которые растворимы исключительно в водной среде, было достигнуто в присутствии Triton В (бензилтриметиламмония гидроксида). Добавление последнего к этим аминокомпонентам позволило гомогенизировать реакционную смесь, способствуя растворению γ-GluHA, карнозина и аминокислот в среде органического растворителя (диметилформамида), депротонировать аминогруппы аминокомпонентов. В результате целевые продукты (III-V) были получены с высокими выходами (60-76%). Преимуществами способа, кроме того, явились минимальная длительность процесса и минимально простая необходимая очистка, например флэш-хроматографией. Дополнительное преимущество процесса заключается в его упрощении в сравнении с возможным альтернативным способом синтеза производных гемина, подобных IV-VI, путем получения, а затем омыления производных гемина, модифицированных остатками эфиров аминокислот и пептидов по карбоксильной группе. В последнем случае синтез включает дополнительную стадию (омыление), может сопровождаться рацемизацией и побочной реакцией образования Fe-O-Fe мостиков между остатками гемина.
Производные гемина (II-V) могут быть получены в виде фармацевтически приемлемых солей, например ацетатов, хлоридов, сульфатов, лактатов и т.д., путем варьирования природы кислоты при выделении производного гемина или превращены в таковые с применением ионообменной хроматографии.
Синтез производных гемина отражен в примерах 1-7.
Список сокращений:
DCC - N,N'-дициклогексилкарбодиимид,
DMF - N,N'-диметилформамид,
DMSO - диметилсульфоксид,
НА - гистамин,
Неm - остаток гемина,
iPrOH - изопропанол,
LOOH - липидная гидроперекись,
NADH - никотинамид адениндинуклеотид (восстановленный),
ОМе - метиловый эфир,
ONb - N-окси-5-норборнен-2,3-дикарбоксиимидный эфир,
ГП - производные гемина,
ПНЖК - полиненасыщенные жирные кислоты,
МЛ - метиловый эфир линолевой кислоты,
ТБГ - трет-бутилгидроперекись,
ТСХ - хроматография в тонком слое,
ЦВА - циклическая вольтамперометрия,
ЦПЭ - цитопатический эффект,
ЭА - этилацетат.
ПРИМЕРЫ СИНТЕЗА СОЕДИНЕНИЙ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В синтезе используют производные β-AlaHA и γ-GluHA, полученные по методикам, описанным ранее [Рожкова Е.А., Огрель С.А., Григорьев Д.Н., Небольсин В.Е., Желтухина Г.А., Евстигнеева Р.П.// Биоорганическая химия. 1996 г. Т.22. №10-11. С.838-847. Кромова Т.А., Желтухина Г.А., Небольсин В.Е., Ковалева В.Л., Кржечковская В.В., Евстигнеева Р.П.// Хим. Фарм. журнал. 2005. Т.39. №3. С.12-15.]. Все растворители безводные, за исключением тех, которые применяют для экстракции из водных растворов.
Индивидуальность полученных соединений проверяют методом ТСХ на пластинах Kieselgel 60 F254 (Merck, Германия) в системах: хлороформ - метанол - 25% водный аммиак 5:3:0.5 (1), iPrOH - ЭА - 25% водный NН3 3:1:1 (2), хлороформ - метанол 9:1 (3).
Хроматограммы проявляют хлор-толидиновым реактивом, нингидрином, по свечению в УФ-свете; имидазолсодержащие производные - реактивом Паули. Масс-спектры высокого разрешения получают на времяпролетном масс-спектрометре "ULTRAFLEX ("BRUKER", Германия) методом матриксной лазерно-десорбционной ионизации (TOF MALDI); в качестве матрицы используют 2,5- дигидроксибензойную кислоту. ИК-спектры регистрируют на приборе: "Magna 750" ("Nicolet", США). Электронные спектры снимают на спектрофотометре "Jasco" UV/VS 7800 (Япония).
Притязания подтверждены следующими примерами.
Пример 1. 6,7-бис-(N-β-аланилгистаминил)-протогемин IX (II)
К 0.1 г (0.40 ммоль) N-β-аланилгистамина×2 НСl в 4 мл DMF при перемешивании прибавляют 0.11 мл (0.80 ммоль) Еt3N при 0°С в течение 15 мин. К полученному раствору добавляют раствор 0.17 г (0. 20 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX, полученного ранее, в 6 мл DMF. Реакционную смесь перемешивают 2.5 ч при комнатной температуре. Контроль за протеканием реакции осуществляют методом ТСХ в условиях (1). Растворитель удаляют в вакууме. Для отделения примесей аминокомпонента и введения противоиона Сl- сухой остаток растворяют в 15 мл н-бутанола и встряхивают с 0.5 N раствором соляной кислоты, промывают водой, насыщенной NaCl, до нейтральной реакции. Растворитель удаляют в вакууме. Для удаления солей остаток растворяют в безводном DMF, осадок NaCl отфильтровывают. Растворитель удаляют в вакууме. Целевое вещество (II) переосаждают из метанола диэтиловым эфиром. Твердый остаток сушат в вакууме над безводным CaCl2. Выход 0.14 г (71%). Rf 0.72 (1), 0.62 (2). Электронный спектр, λmах, нм, вода, (ε·10-3): 408.6 (51.30), 532.0 (1.61), 564.1 (1.20). ИК-спектр Фурье, ν, см-1, KBr: 3423 (NH), 1645 (амид I), 1536 (амид II). Масс-спектр, m/z: [M]+ 944.3.
Пример 2. 6,7-бис-(N-γ-глутамилгистаминил)-протогемин IX (III)
К 0.1 г N-γ- глутамилгистамина (0.42 ммоль) прибавляют 3 мл DMF, затем добавляют по каплям 0.43 мл (0.84 ммоль) 35% раствора Triton В в МеОН до полного растворения γ-GluHA. К полученному раствору прибавляют раствор 0.18 г (0.21 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX в 6 мл DMF. Реакционную смесь перемешивают 1.5 ч при комнатной температуре. Контроль за протеканием реакции осуществляют методом ТСХ в условиях (1). Раствор концентрируют в вакууме до 2 мл, продукт осаждают диэтиловым эфиром. Осадок очищают флэш-хроматографией на силикагеле Kieselgel 60 F254 (Merck, Германия), целевой продукт элюируют смесью хлороформ-метанол-25% водный аммиак (5:3:2). Растворитель удаляют в вакууме. Для введения противоиона Cl- раствор соединения (III) в 20 мл смеси хлороформ-метанол (8:4) встряхивают с 0.5 N раствором соляной кислоты, промывают водой. Водные слои объединяют и экстрагируют н-бутанолом, органический слой промывают водой, насыщенным раствором NaCl до нейтральной реакции. Органический растворитель удаляют в вакууме. Для удаления солей остаток растворяют в DMF, осадок NaCl отфильтровывают. Растворитель отгоняют в вакууме. Остаток сушат в вакууме над безводным CaCl2. Выход 0.175 г (76%). Rf 0.54 (1). Электронный спектр, λmax, нм, вода, (ε·10-3): 408.4 (54.36), 535.8 (4.05), 570.2 (2.88). ИК-спектр Фурье, ν, см-1, KBr: 3247 (NH), 1647 (COO- амид I), 1541 (амид II). Масс-спектр, m/z: [М]+ 1060.6.
Пример 3. 6-7-моно-(N-γ-глутамилгистаминил)-протогемин IX (V)
К 0.074 г N-γ- глутамилгистамина (0.31 ммоль) прибавляют 2 мл DMF, затем по каплям прибавляют 0.31 мл (0.62 ммоль) 35% раствора Triton В в МеОН до полного растворения γ-GluHA. К раствору полученного аминокомпонента добавляют раствор 15 мл (0.31 ммоль) 6(7)-моно-N-гидрокси-5-норборнен-2,3-дикарбоксиимидного эфира протогемина (IX) в DMF. Реакционную смесь перемешивают 1 ч при комнатной температуре. Контроль за протеканием реакции осуществляют методом ТСХ в условиях (2), (3). Наблюдается выпадение осадка. Реакционную смесь центрифугируют (15 мин при 2900 об/мин). Супернатант отделяют от осадка декантированием и отбрасывают. К остатку прибавляют порциями DMF и центрифугируют в тех же условиях, супернатант отделяют декантацией. Процедуру повторяют несколько раз до полного отделения осадка от гемина. Для введения противоиона Сl- раствор соединения (IV) в 12 мл смеси хлороформ-метанол (8:4) встряхивают с 0.5 N раствором соляной кислоты, промывают водой до нейтральной реакции. Растворитель удаляют в вакууме. Остаток сушат в вакууме над безводным CaCl2. Выход 0.23 г (68%). Rf 0.82(1). Электронный спектр, λmax, нм, хлороформ-метанол (7:3), (ε·10-3): 402.00 (47.9), 500.60 (2.17), 629.20 (0.84). ИК-спектр Фурье, ν, см-1, KBr: 1717(СООН), 1638(амид I), 1540(амид II). Масс-спектр, m/z: [М]+ 837.6.
Пример 4. 6,7-бис-(N-β-аланилгистидин)-протогемин IX (IV)
Исходя из 0,1 г (0,442 ммол) β-аланилгистидина (карнозина) по методике, описанной в примере 2 для соединения (III), получают 0,270 г (71%) соединения (IV). Rf 0,4(1). Масс-спектр, m/z: [М]+ 824,4.
Таким образом, предлагаемые производные гемина (II -V) получены с высокими выходами, в индивидуальном состоянии и охарактеризованы электронной и ИК-спектроскопией, масс-спектрометрией, ТСХ.
Исследование активности производных гемина в реакциях окисления органических субстратов и вирулицидного действия описано далее в примерах 5-9.
Пример 5. Исследование нуклеазной активности геминпептидов
Исследование нуклеазной активности производных гемина (II, III, V-IX) проводят по типичной методике [Maniatis Т., Fritish В., Sambrook J. Molecular Cloning (A Laboratory Manual) Cold Spring Harbor; N.-Y.: Cold Spring Harbor Laboratory Press, 1982] с применением ДНК-плазмиды pGem-Т, состоящей из 3700 пар оснований, выделенной из клеток E.coli JS-5, с помощью набора "Wizard Plus SV Minipreps DNA Purification System" (Promega, США). Производные гемина в концентрации 10-4÷10-5М инкубируют с 0.05 мг/мл плазмидной ДНК в течение 1 ч при 37°С в 10 мкл реакционной смеси. Продукты расщепления анализируют с помощью электрофореза в 1% агарозном геле в ТАЕ-буфере (0.04 М Трис-ацетат, рН 8.0, 0.02М ЭДТА) при напряжении 10 В/см. Продукты реакции визуализируют путем окрашивания их флуоресцентным красителем бромистым этидием. Полосы ДНК детектируют с помощью источника УФ-света длинноволновой области с λ 300 нм и фотографируют с использованием цифровой камеры фирмы «Canon».
Активность соединений исследуют при кислых и нейтральных значениях рН в следующих буферных растворах:
буфер I: 50 мМ AcONH4 (рН 4.5), 5 мМ MnCl2;
буфер II: 10 мМ Трис-HCl (рН 7.5), 10 мМ MnCl2.
Производные гемина прибавляют к реакционной смеси в воде или в виде раствора в смеси воды и DMSO, причем концентрация DMSO в конечной пробе составляет ≤10%.
Результаты исследования нуклеазной активности новых и известных производных гемина, соответствующих общей формуле I, приведены в табл.1.
| Таблица 1Нуклеазная активность производных гемина, соответствующих общей формуле I, в отношении плазмидной ДНК pGem-T | ||
| № соединения (10-4 М) | Буфер I рН4.4 | Буфер II рН7.5 |
| II | + | + |
| III | - | - |
| V | - | - |
| VI | + | + |
| VII | - | - |
| VIII | + | + |
| IX | + | + |
| + расщепление ДНК- отсутствие расщепления ДНК |
Таким образом, введение в реакционную смесь производных гемина может вызывать исчезновение полос (расщепление) ДНК, в зависимости от условий рН и структуры заместителя в молекуле гемина.
Проведено исследование каталитической активности производных гемина, соответствующих общей формуле (I), в реакциях окисления природных органических субстратов.
Пример 6. Исследование пероксидазной активности производных гемина в реакции окисления никотинамидадениндинуклеотида (NADH)
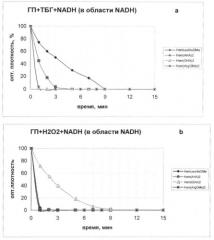
Пероксидазную активность производных гемина, соответствующих общей формуле I, оценивают по скорости окисления восстановленного пиридиннуклеотида (NADH), определяемой спектрофотометрически по снижению интенсивности полосы поглощения при λmax 339.0 нм [Евстигнеева Р.П., Желтухина Г.А., Рожкова Е.А.// Кинетика и катализ, Т.40, №2, 1999, с.256-260].
Реакцию окисления NADH гидроперекисями (трет-бутилгидроперекись - ТБГ, Н2О2) осуществляют следующим образом: в спектрофотометрическую кювету объемом 1 мл помещают 20 мМ калий-натрий фосфатного буфера (рН 7.4), содержащего 10-4М NADH, 9·10-3M ТБГ или Н2О2, при 25°С. Пероксидазную реакцию запускают добавлением раствора производного гемина, конечная концентрация которого в кювете составляет 25·10-6М.
Семейство спектральных кривых регистрируют в интервале от 200 до 600 нм последовательно через равные промежутки времени (1÷15 мин).
Спад поглощения при λmах 339.0 нм соответствовал окислению восстановленного пиридиннуклеотида.
Из данных, представленных на чертеже, следует, что новые и известные соединения, соответствующие общей формуле I, обладают пероксидазной активностью.
При катализе реакции окисления NADH в присутствии ТБГ (см. чертеж, a) Hem-(ArgOMe)2 (VI) и Hem-(γ-GluHA)2 (III) быстро (за 1 мин) и эффективно (почти на 100%) катализируют окисление NADH.
В присутствии Неm-(β-АlаНА)2 (II) и Hem-(LeuHisOMe) (X) эта реакция протекает медленнее.
В реакции окисления NADH перекисью водорода Hem-(ArgOMe)2 (VI), Hem-LeuHisOMe (X) и Hem-(β-AlaHA)2 (II) проявляют высокую активность, в то время как Hem-(γ-GluHA)2 (III) окисляет NADH с меньшей скоростью.
Таким образом, заявляемые соединения, соответствующие общей формуле I, эффективно, но с разной скоростью катализируют окисление NADH пероксидами, проявляя пероксидазную активность.
Пример 7. Исследование каталитической активности производных гемина в реакции окисления метиллинолеата (МЛ)
Эффективность производных гемина как инициаторов и катализаторов окисления метиллинолеата (МЛ) зависит от двух факторов: от скорости генерации активных радикалов при взаимодействии производных гемина с МЛ или с продуктом окисления МЛ - липидной гидроперекисью (LOOH) и продолжительности каталитического действия производных гемина, которая обусловлена главным образом способностью каталитически активной формы производных гемина к регенерации.
В качестве тестирующей системы используют цепное окисление 5 mМ метиллинолеата (МЛ) в 50 mM мицеллярном растворе неионогенного ПАВ Тритон 100-Х в 50 mM Na-фосфатном буфере при рН 7.4 и 37°С.
Скорость окисления МЛ определяют по скорости поглощения кислорода, при этом концентрацию кислорода в тестирующей системе определяют с помощью кислородного биологического монитора YCI-5300 (Yellow Springs Instruments, США) с электродом Кларка в качестве сенсора. Скорость окисления МЛ находят исходя из наклона кинетических кривых в зависимости от изменения концентрации кислорода от времени [Roginsky V.A., Stegmann H.B.// Free Rad. Biol. Med. 1994. V.17. P.93-103].
Метиллинолеат (МЛ) вводят в измерительную ячейку после 10-минутного термостатирования и стабилизации системы. Катализатор окисления МЛ из ряда заявляемых производных гемина вводят после 3-5 мин периода неингибированного окисления без открытия рабочей ячейки и без прекращения мониторинга.
В качестве основных параметров, характеризующих каталитическую активность производных гемина, используют эффективную константу скорости генерации активных радикалов kin и константу скорости первого порядка, характеризующую скорость снижения во времени генерирующей способности kD, а также коэффициент регенерации (f), который характеризует устойчивость к деградации и суммарную эффективность катализатора.
Полученные результаты представлены в табл.2.
| Таблица 2Кинетические параметры, характеризующие каталитическую активность производных гемина при окислении МЛ | |||
| № соединения | kin, М-1 сек- | f, коэф. регенерации | KD, сек-1 |
| (II) | 800 | 24 | 0.019 |
| (III) | 80 | >7.5 | 0.006 |
| (VI) | 110 | 25 | ~0.0033 |
| (VII) | 240 | >25 | 0.0019 |
| (VIII) | 540 | >27 | 0.013 |
| (IX) | 360 | 12 | ~0.015 |
| (X) | 900 | 20-25 | 0.018 |
| (XI) | 35±9 | 1.9 | 0.014 |
| (XII) | 375±25 | 9-10 | 0.018 |
Из таблицы следует, что производные гемина по изобретению, соответствующие общей формуле I, могут катализировать окислительное расщепление органических субстратов, в том числе компонентов вируса, таких как ПНЖК, ДНК, NADH и др., представляя свидетельство их вирулицидного действия. Кроме того, данная каталитическая активность может представлять самостоятельную ценность для потенциального индустриального использования синтетических производных гемина общей формулы I в качестве катализаторов окисления в химии и биотехнологии.
Пример 8. Тестирование вирулицидной активности производных гемина
Для выявления вирулицидной активности исследуют влияние производных гемина общей формулы I на модели безоболочечного РНК-содержащего вируса, высокорезистентного к физико-химическим воздействиям (вирус полиомиелита), и ДНК-содержащего крупного вируса, имеющего оболочку (вирус герпеса простого). Вирус полиомиелита, тип 1, вакцинный штамм, получали из НИИ полиомиелита и вирусных энцефалитов им. М.П.Чумакова РАМН. Вирус герпеса простого, тип 1, получали из коллекции вирусов ГУ НИИ вирусологии им. Д.И.Ивановского РАМН.
Используют перевиваемую культуру клеток почки зеленых мартышек VERO, культивируемую в среде Игла с 10% сыворотки эмбриона коров. Жизнеспособность клеток определяют окраской 0.4%-ным раствором трипанового синего (Sigma, США).
Инфицирование чувствительных культур клеток проводят путем инкубации при 34°С с вируссодержащей средой (вирус полиомиелита) и 37°С (вирус герпеса простого) до развития цитопатического эффекта (ЦПЭ) со 100% гибелью клеток. Учет результатов проводят микроскопически. Репродукцию вирусов в клетках оценивают по вирус-индуцированному ЦПЭ. Водорастворимые геминпептиды растворяют в стерильной дистиллированной воде, а гидрофобные - в ее смеси с DMSO (5%).
Результаты экспериментов по изучению вирулицидных свойств производных гемина общей формулы I приведены в табл.3 и 4.
| Таблица 3Исследование вирулицидных свойств производных гемина в отношении вируса герпеса простого и полиомиелита | ||||||||
| соединение | Степень ингибирования вируса | |||||||
| Вирус полиомиелита, исх. титр 5,5 log10 | Вирус герпеса простого, исх. титр 4,5 log10 | |||||||
| 10-4 М | 10-5 M | 10-4 М | 10-5 M | |||||
| 30 мин | 60 мин | 30 мин | 60 мин | 30 мин | 60 мин | 30 мин | 60 мин | |
| (IX) | 4,0 | 4,5 | 4,0 | 3,8 | - | - | - | - |
| (XI) | 3,5 | 4,0 | 3,0 | 3,75 | 2,25 | 2,75 | 2,0 | 2,5 |
| (VI) | 3,5 | 4,5 | 3,5 | 4,5 | 3,0 | 3,0 | 2,5 | 2,5 |
| - не исследовали |
Вирулицидные свойства соединений (табл.3) исследовали при обработке поверхности (линолеум). Способ обработки - протирание избытком раствора вещества.
| Таблица 4Результаты исследования вирулицидных свойств производных гемина в отношении вируса полиомиелита (в суспензионном тесте) | ||||
| соединение | Степень ингибирования вируса полиомиелита, исх. титр 6,0 log10 | |||
| 10-4 М | 10-5 М | |||
| 30 мин | 60 мин | 30 мин | 60 мин | |
| (П) | 2,6 | 2,7 | 2,4 | 2,6 |
| (III) | 3,25 | 3,5 | 3,0 | 3,25 |
| (V) | 3,0 | 3,75 | 2,75 | 3,0 |
| (VI) | 2,6 | 4,6 | 2,6 | 3,6 |
| (VII) | 3,2 | 3,2 | 3,0 | 3,0 |
| (VIII) | 2,1 | 4,5 | 3,0 | 2,6 |
| (IX) | 3,0 | 3,6 | 2,1 | 2,7 |
| (XI) | 3,5 | 4,2 | 3,0 | 4,0 |
Результаты исследования вирулицидных свойств производных гемина в отношении вируса герпеса простого при различном времени воздействия представлены в табл.5. В качестве тест-объекта используют линолеум. Способ обработки - протирание с избытком раствора исследуемого соединения.
| Таблица 5Вирулицидные свойства производных гемина в отношении вируса герпеса простого, тип 1 | ||||
| Шифр | Степень ингибирования вируса, log10 ТЦИД50 | |||
| 10-4 М | 10-5 М | |||
| 30 минут | 60 минут | 30 минут | 60 минут | |
| VII | 4,5 | 4,5 | 3,0 | 2,6 |
| VIII | 3,0 | 3,6 | 2,1 | 2,7 |
| XI | 2,6 | 2,75 | 2,0 | 2,5 |
| III | 2,6 | 2,7 | 2,4 | 2,6 |
Исходный титр вируса - 4,5 log10 ТЦИД50, время экспозиции 30 и 60 минут. Способ исследования - протирание вирусной пленки на поверхности избытком раствора вещества.
В табл.6 приведены испытания на вирулицидную активность в отношении вируса герпеса производного гемина формулы I, где R1=R2=β-аланилгистидин (соединение IV).
| Таблица 6Вирулицидная активность соединения IV в отношении вируса герпеса (ВПГ-1) | |||||
| Соединение № | ИНФЕКЦИОННЫЙ ТИТР ВИРУСА (log10) | ||||
| КОНЦЕНТРАЦИЯ ПРЕПАРАТА | |||||
| 10-4 M | 10-5 M | Снижение титра на log10 | |||
| 30 минут | 60 минут | 30 минут | 60 минут | ||
| IV | 5,0 | 3,0 | 5,0 | 4,0 | 2,0; 1,0 |
| вирус | 5,0 |
Исходный титр вируса - 5,0 log10 ТЦИД50, время экспозиции в 30 и 60 минут.
Способ исследования - в суспензии вируса.
Представленные результаты указывают на способность исследуемых соединений ингибировать инфекционную способность вируса герпеса. Степень ингибирования была различной. Отмечается как временная, так и дозовая зависимость степени подавления вируса. Наиболее выраженное антигерпесное вирулицидное действие наблюдалось для соединения VII при концентрации 10-4 М и времени воздействия 30 минут. При уменьшении конечной концентрации в 10 раз (до 10-5М) ингибирующий эффект снижался.
Пример 9. Проведено изучение вирулицидного действия соединений, соответствующих общей формуле I в суспензии, на интактные вирусные частицы гриппа A/Aichi/2/68 (H3N2)
Методика изучения вирулицидного действия соединений, соответствующих общей формуле I в суспензии, на интактные вирусные частицы гриппа A/Aichi/2/68 (H3N2)
Вируссодержащую жидкость с титром 4,0 для вируса гриппа соединяли 1:1 с учетом разведения препаратов вирусным материалом в 2 раза, инкубировали при комнатной температуре в присутствии и в отсутствие испытуемых соединений. Экспозицию с препаратами вируса гриппа проводили в течение 30 и 60 минут.
Вируссодержащий материал инкубировали в присутствии соединения IV в исследуемой концентрации и определяли величину снижения инфекционного титра вируса по сравнению с контролем - вирусом, инкубируемым в тех же условиях, но без испытуемого соединения.
Инфекционный титр вирусов определяли путем заражения культур клеток.
Перед инфицированием клетки дважды промывали средой без сыворотки для снижения неспецифической реакции. Инфицирование проводили 10-кратными разведениями проб вирусов с соединением IV и без него на соответствующей среде с добавлением трипсина (ТРСК treated, Sigma) в случае исследования вируса гриппа. Адсорбцию вирусов проводили в течение 40-60 минут при 37°С. Несорбировавшийся вирус удаляли 3-кратной промывкой средой без сыворотки. Контроли вирусов и клеток культивировали в соответствующей клеткам среде. Далее планшеты инкубировали в термостате в течение 48-72 часов при 37°С.
Учет результатов проводили по определению гемагглютинирующей активности вируса гриппа в надосадочной жидкости в реакции гемагглютинации с человеческими эритроцитами 0(1) группы.
Инфекционный титр вируса герпеса ВПГ-1 определяли в реакции иммуноферментного анализа, используя коммерческие тест-системы и ПЦР фирмы «Амплисенс». Результаты испытаний приведены в таблице 7.
| Таблица 7Вирулицидная активность заявляемых соединений общей формулы I в отношении вируса гриппа A/Aichi/2/68 (H3N2) | |||||
| Соединение, № | ИНФЕКЦИОННЫЙ ТИТР ВИРУСА (log10) | ||||
| КОНЦЕНТРАЦИЯ ПРЕПАРАТА | |||||
| 10-4 M | 10-5 M | Снижение титра на log10 | |||
| 30 минут | 60 минут | 30 минут | 60 минут | ||
| IV | 4,0 | 2,0 | 4,0 | 2,5 | 2,0; 1,5 |
| вирус | 4,0 |
Исходный титр вируса - 4,0log10 TЦИД50, время экспозиции 30 и 60 минут. Способ исследования - в суспензии вируса.
Проведенные испытания на примере соединения IV показали, что заявляемые соединения общей формулы I проявляют вирулицидную активность также в отношении вируса гриппа, и при этом показали, что соединение IV обладает высокой активностью в отношении вируса герпеса (ВПГ-1) и в отношении вируса гриппа A/Aichi/2/68 (H3N2).
Проведенные исследования свидетельствуют, что производные гемина по изобретению, соответствующие общей формуле I, обладают выраженными вирулицидными свойствами в отношении РНК- и ДНК-содержащих вирусов (полиомиелит, герпес, грипп), обладающих различной степенью устойчивости к воздействию физико-химических факторов.
Пример 10. Композиции настоящего изобретения могут быть использованы в виде дезинфицирующих, антисептических и фармацевтических препаратов (например, в твердой, полутвердой или жидкой формах), содержащих предлагаемые в настоящем изобретении соединения в качестве активных ингредиентов в смеси с органическим или неорганическим носителем или наполнителем, приемлемым для внутримышечного, внутривенного, интраназального, перорального, сублингвального, ингаляционного и интраректального введения. Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными, фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, суппозиториев, эмульсий, суспензий, спреев, ингаляторов, капель, мазей и любых других лекарственных форм. В качестве носителей могут быть использованы вода, глюкоза, лактоза, аравийская камедь, желатин, крахмал, триксилит магния, тальк, кукурузный крахмал, мочевина, полиэтиленгликоль и другие носители, пригодные для изготовления твердых, мягких или жидких препаратов. При этом в качестве добавок могут быть использованы стабилизаторы, загустители, красители и отдушки.
Активное действующее соединение общей формулы I вводят в композицию в количестве, достаточном для получения нужного вирулицидного эффекта.
При изготовлении разовой лекарственной формы количество активного ингредиента, используемого в комбинации с носителем, может варьировать в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства.
Так, например, при использовании соединений настоящего изобретения в виде растворов для инъекций содержание действующего начала в них составляет 0.001-1%. В качестве разбавителя вещества могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы. При использовании соединения общей формулы (I) в виде таблеток и суппозиториев количество вещества составляет 1,0-100,0 мг на единичную дозированную форму. Для таблеток и суппозиториев в качестве фармацевтического наполнителя используют любую фармацевтически пригодную основу.
Ниже приведены примеры лекарственных форм.
А. Желатиновые капсулы
Состав вводимого в капсулу порошка:
| Соединение, соответствующее общей формуле (I) | 1-50 мг |
| Оксид магния | 50 мг |
| Крахмал | 100-200 мг |
Указанные выше ингредиенты смешивают и смесь вводят в твердые желатиновые капсулы в количестве 151- 285 мг.
Б. Таблетированная форма
Таблетированную форму получают, используя приведенные ниже ингредиенты:
| Соединение, соответствующее общей формуле (I) | 1-50 мг |
| Крахмал картофельный | 100 мг |
| Поливинилпирролидон | 10мг |
| Магния стеарат | 2 мг |
| Лактоза | 48-82 мг |
| Аэросил | 5 мг |
Компоненты смешивают и прессуют для образования таблеток весом 200 мг каждая.
В. Аэрозольная форма
Состав аэрозольной смеси, рассчитанной на 10 приемов:
| Соединение, соответствующее общей формуле (I) | 10-100 мг |
| Магния сульфата | 150 мг |
| Лактоза | 110-140 мг |
Соединение смешивают с наполнителями и помещают в специальное устройство для распыления.
Г. Суппозитории
В качестве суппозиторной основы могут быть использованы:
основы, нерастворимые в воде, - масло какао;
основы, растворимые в воде или смешиваемые с водой, - желатино-глицериновые или полиэтиленоксидные;
комбинированные основы - мыльно-глицериновые.
Пример состава суппозитория:
| Соединение, соответствующее общей формуле (I) | 1-50 мг |
| Масло какао | количество, необходимое для получения суппозитория |
При необходимости возможно изготовление ректальных, вагинальных и уретральных суппозиториев с соответствующими наполнителями.
Д. Мази
В качестве мазевой основы могут быть использованы:
углеводородные мазевые основы - вазелин белый и желтый (Vaselinum album, Vaselinum flavum), вазелиновое масло (Oleum Vaselini), мазь белая и жидкая (Unguentum album, Unguentum flavum), а в качестве добавок для придания более плотной консистенции - твердый парафин и воск;
абсорбтивные мазевые основы - гидрофильный вазелин (Vaselinum hydrophylicum), ланолин (Lanolinum), кольдкрем (Unguentum leniens);
мазевые основы, смываемые водой, - гидрофильная мазь (Unguentum hydrophylum); водорастворимые мазевые основы - полиэтиленгликолевая мазь (Unguentum Glycolis Polyaethyleni), бентонитовые основы и другие.
Пример состава мази:
| Соединение соответствующее общей формуле (I) | 0,01 г-0,1 г |
| Вазелин | 10 г |
Мази изготавливают по соответствующей технологии.
Е. Раствор для инъекций
В качестве растворителя при приготовлении раствора для инъекций могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина. Форма выпуска - ампулы, флаконы, шприц-тюбики.
Состав раствора для инъекций:
| Соединение, соответствующее общей формуле (I) | 1-50 мг |
| Вода дистиллированная | 1 -2 мл |