Способ лечения заболеваний предстательной железы, основанный на местной доставке активных веществ
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к урологии, и может быть использовано для лечения у субъекта заболеваний, связанных с предстательной железой. Способ и набор обеспечивают максимальный терапевтический эффект со значительным уменьшением токсичности. Проводят необязательное введение субъекту начальной бустерной дозы одного или более активных веществ и/или пролекарств и местное введение в предстательную железу фармацевтической композиции с контролируемым высвобождением, включающей одно или более активных веществ в биоразлагаемом керамическом носителе. Биоразлагаемый гидратирующийся керамический материал может быть выбран из группы, состоящей из негидратированного или гидратированного сульфата кальция, фосфата кальция, карбоната кальция, фторида кальция, силиката кальция, сульфата магния, фосфата магния, карбоната магния, фторида магния, силиката магния, сульфата бария, фосфата бария, карбоната бария, фторида бария, силиката бария или их смесей. В частном варианте осуществления биоразлагаемый гидратирующийся керамический материал является негидратированным или гидратированным сульфатом кальция. Также используется набор, представляющий собой начальную бустерную дозу одного или более активных веществ и/или пролекарств и второй компонент, представляющий собой фармацевтическою композицию с контролируемым высвобождением, включающую одно или более активных веществ в биоразлагаемом керамическом носителе и их применение. 3 н. и 51 з.п. ф-лы, 7 табл., 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу лечения заболеваний, связанных с предстательной железой, с помощью i) необязательного введения субъекту начальной импульсной/бустерной дозы одного или более активных веществ и ii) введения локально в предстательную железу фармацевтической композиции с контролируемым высвобождением, включающей одно или более активных веществ в биоразлагаемом носителе. Носитель может быть представлен биоразлагаемым керамическим материалом и/или биоразлагаемым полимером. Соответственно, носитель является биологически совместимым. Способ подходит для лечения, например, рака предстательной железы, доброкачественной гиперплазии предстательной железы или острого и хронического простатита.
Уровень техники изобретения
Рак предстательной железы является самой распространенной причиной некожного рака у мужчин и является ведущим смертельным злокачественным образованием с повышающейся заболеваемостью во всем мире. Смертность от рака предстательной железы непрерывно снижается приблизительно на 4% ежегодно с 1994, в то время как заболеваемость повышается чуть менее чем на 2% ежегодно. Рак предстательной железы продолжает иметь самую высокую заболеваемость и второй наивысший показатель смертности среди любых раковых заболеваний у мужчин в США. В 2004 в США было отмечено более 230000 новых случаев рака предстательной железы, и 29000 мужчин умерли от заболевания. В целом, рак является второй ведущей причиной смерти мужчин, и рассмотренный в отдельности рак предстательной железы находится среди 10 основных причин смерти мужчин в США. В связи с тем, что заболеваемость раком предстательной железы повышается с возрастом, ожидается, что старение популяции приведет в будущем к повышению смертности от рака предстательной железы. Кроме того, улучшенные методы диагностики приводят к более ранней постановке диагноза, и в настоящее время многие мужчины получают лечение, оставаясь в то же время физически и сексуально активными.
Применяемые в настоящее время методы лечения рака предстательной железы, включающие терапевтическую или хирургическую кастрацию, оказывают существенное влияние на многие аспекты качества жизни. Терапия нестероидными пероральными антиандрогенами, включая флутамид (EulexinТМ, Schering; Eulecin; Flutacan; Flutamid), бикалутамид (CasodexТМ, AstraZeneca) и нилутамид (AnandronТМ, Aventis), демонстрирует эффективность при нескольких стадиях рака предстательной железы и представляет собой терапевтическую стратегию, альтернативную кастрации. Данные о выживаемости мужчин с предварительно нелеченным, локально запущенным заболеванием свидетельствуют о том, что монотерапия антиандрогенами обеспечивает благоприятное влияние на выживаемость, которое существенно не отличается от кастрации. К сожалению, системное гормональное лечение также вызывает обширные побочные эффекты. Эти данные стимулировали изучение и исследование альтернативных способов лечения и терапевтических агентов, с помощью которых могут быть улучшены существующие в настоящее время схемы лечения, например с помощью локального направленного воздействия, а также режимов, сфокусированных на задержку развития устойчивости к андрогенам и влияние на инвазию рака предстательной железы. Один из способов, обеспечивающих успешный результат антиандрогенной терапии, то есть высокую эффективность и низкую вероятность развития серьезных побочных эффектов, состоит в обеспечении локального специфического направленного воздействия терапевтического вещества на участок опухоли и таким образом в уменьшении системных эффектов.
Доброкачественная гиперплазия предстательной железы (BPH) может быть гистологически обнаружена у более 50% мужчин в возрасте 60 лет и приблизительно у 90% мужчин в возрасте 85 лет. Симптомы наблюдаются у четверти этих мужчин. С увеличением в настоящее время популяции пожилых людей также увеличивается число случаев BPH. Согласно рекомендациям Американской Ассоциации Урологов по лечению BPH, трансуретральная резекция предстательной железы (TURP) является самым распространенным способом хирургического лечения симптоматической BPH. Однако для пациентов результат не всегда является удовлетворительным, так как для TURP требуется госпитализация и существует риск различных осложнений. Медикаментозное лечение, включая альфа-1-блокаторы, является другим возможным выбором для лечения BPH, но в отдаленном периоде может развиваться толерантность. Для лечения BPH была предложена минимально инвазивная терапия, находящаяся между медикаментозным лечением и радикальным хирургическим лечением, но существующие в настоящее время способы требуют новейшей техники и дорогостоящих устройств.
Зависимость между воспалением предстательной железы и раком предстательной железы все в большей степени попадает в центр внимания клинических и фундаментальных научных исследований в урологии. В обзорах эпидемиологических и клинических исследований предполагается связь между хроническим воспалением предстательной железы и развитием рака предстательной железы. Доказательство биологического правдоподобия этой связи охватывает диапазон от воспалительных моделей онкогенеза предстательной железы in vivo до повышения воспалительных медиаторов и маркеров окислительного стресса в сыворотке, моче и опухолях пациентов с раком предстательной железы. Несмотря на то что причинную роль воспаления на раке предстательной железы еще предстоит установить, к возможным механизмам относятся образование реактивных частиц кислорода, индукция циклооксигеназы-2 и высвобождение паракринных факторов, которые могут привести к индукции или пролиферации рака. Воспаление предстательной железы, особенно при сопутствующей бактериальной инфекции, сочетается с повышением уровней PSA в сыворотке. Предстательная железа расположена кпереди от прямой кишки. Выше предстательной железы находится мочевой пузырь, а ниже мочеполовая диафрагма. Семенные пузырьки образуют семявыбрасывающие протоки и входят в железу в заднебоковом направлении и выходят в уретру приблизительно в средней части железы. Железа покрыта фиброзной капсулой и имеет эластичную консистенцию. Функцией предстательной железы является секреция молочно-белой субстанции семенной жидкости. До периода полового созревания эта функция отсутствует и железа является очень маленькой. В отличие от многих органов рост предстательной железы продолжается на протяжении всей жизни человека, часто приводя к доброкачественной гиперплазии предстательной железы.
Патология и патофизиология рака предстательной железы
Гистопатология высокодифференцированной интраэпителиальной неоплазии предстательной железы характеризуется архитектурно доброкачественными ацинусами предстательной железы, выстланными клетками, которые похожи на злокачественные. Предстательные железы с карциномой имеют большее число этих фокусов, чем железы без карциномы. Предстательные железы с распространенной высокодифференцированной интраэпителиальной неоплазией предстательной железы также имеют более мультифокальные карциномы. На момент постановки диагноза большинство пациентов имеют локальное раковое поражение предстательной железы без распространения или метастазов.
К пациентам с локально прогрессирующими неметастатическими заболеваниями относятся те, у которых имеется патологический процесс, пенетрирующий капсулу предстательной железы или имеющий инвазию в семенной пузырек при пальцевом ректальном исследовании. Заболеваемость локально прогрессирующим заболеванием варьирует от популяции к популяции и включает пациентов, которые либо не затронуты скрининговыми исследованиями, либо имеют необычно агрессивное течение болезни с быстрым развитием заболевания между интервалами скрининга.
Андрогены играют важную роль в дифференцировке и росте репродуктивного тракта мужчины, половом созревании и развитии вторичных мужских половых признаков, инициировании и регуляции сперматогенеза и сексуального поведения мужчины. Стероидные андрогены увеличивают мышечную массу, массу костной ткани и силу; стимулируют мужское облысение и изменяют профили липидов в сыворотке и распределение жира. Тестостерон, синтезируемый и секретируемый яичками, и его более активный 5-редуцированный метаболит, дигидротестостерон (DHT), являются основными биологически активными эндогенными андрогенами. Тестостерон и дигидротестостерон оказывают тканеспецифичные биологические воздействия. Например, тестостерон выполняет функции стимулирования развития мышечной массы, полового развития и сперматогенеза, тогда как дигидротестостерон играет ключевую роль в росте волос на лице и теле, образовании угрей и увеличении предстательной железы. Воздействия как тестостерона, так и дигидротестостерона опосредуются внутриклеточным андрогеновым рецептором (AR), членом суперсемейства нуклеарных рецепторов, активируемых лигандами факторов транскрипции. После связывания тестостерона или дигидротестостерона андрогеновый рецептор подвергается конформационному изменению, связывается со специфичными последовательностями ДНК, которые называют андроген-респонсивными элементами, образует комплексы с нуклеарными корегуляторными факторами и модулирует транскрипцию генов-мишеней.
Андрогены важны в развитии и лечении рака предстательной железы. Прекращение воздействия тестостерона с помощью хирургической или медикаментозной кастрации является общеизвестным способом лечения рака предстательной железы и эффективно у 75-80% пациентов с метастатическим раком предстательной железы. У животных тестостерон и дигидротестостерон индуцировали раковые опухоли предстательной железы, но связь между андрогенами и развитием рака у человека менее ясна.
Варианты лечения
Сегодня варианты лечения ранней стадии рака предстательной железы могут быть сгруппированы в четыре обширные категории:
- наблюдение ("выжидательный подход"),
- хирургическое лечение (радикальная простатэктомия),
- лучевая терапия (дистанционная лучевая терапия, брахитерапия или оба метода),
- гормональная терапия.
Подвергаться обследованию без проведения лечения могут главным образом пожилые пациенты и те, кто имеет сопутствующую патологию. Хирургическое лечение (радикальная простатэктомия) и лучевая терапия (дистанционная лучевая терапия, брахитерапия или оба метода) являются наиболее широко признанными вариантами лечения пациентов, нуждающихся во вмешательстве.
Радикальная простатэктомия является стандартом, с которым сравнивают другие способы местного лечения. Эта процедура была усовершенствована, что привело в результате к высоким показателям эффективности лечения при сниженной заболеваемости у должным образом отобранных пациентов. Сокращение заболеваемости не привело к снижению контроля за заболеванием.
Дистанционная лучевая терапия предусматривает ежедневное лечение в течение 7-8 недель. Она также была тщательно изучена для ранней стадии рака предстательной железы и подобно радикальной простатэктомии претерпела технологическую революцию, с результатами, демонстрирующими выживаемость, сопоставимую хирургическому лечению, но с отличным профилем побочных эффектов. Брахитерапия, которая предусматривает помещение радиоактивных источников непосредственно в заинтересованную область предстательной железы, применяется во многих центрах. В качестве способа лечения ранней стадии рака предстательной железы в настоящее время она обеспечивает практически безрецидивную выживаемость, сопоставимую с таковой при радикальной простатэктомии и дистанционной лучевой терапии. Преимуществом брахитерапии является повышение дозы в раковой опухоли без повышения дозы в окружающей здоровой ткани. Все эти способы местного лечения были усовершенствованы, что привело в результате к сопоставимым показателям эффективности лечения; однако все они имеют различные профили побочных эффектов.
Гормональная терапия, несмотря на ее эффективность при назначении в качестве вспомогательного метода лечения у некоторых пациентов с ранней стадией заболевания, может применяться в отдельности и как альтернатива наблюдению. Простата является гормонально чувствительным органом, и это наблюдение стало основанием для воздействий на рак простаты, которые как уменьшают уровень тестостерона сыворотки, так и блокируют эффекты этого гормона.
Гормоны применяли в комбинации с простатэктомией с ограниченным успехом. Однако гормоны улучшают результаты выживания в комбинации с лучевой терапией, вероятно вследствие их отличающихся механизмов действия. Гормональная терапия может независимо разрушать рак предстательной железы и сенсибилизировать опухоль к радиации. Полезный эффект гормональной терапии в дополнение к дистанционной лучевой терапии при промежуточной стадии и локально распространенном заболевании был продемонстрирован во многих рандомизированных исследованиях. По-видимому, у выбранных пациентов с ранней стадией заболевания, которые имеют один или более отрицательных прогностических факторов (высокодифференцированное заболевание, высокий уровень PSA (простатспецифический антиген), или и тот и другой), имеет место специфическое улучшение, и если это будет подтверждено в результирующих исследованиях, вероятно в будущем гормональная терапия будет применяться намного больше у больных с ранней стадией заболевания.
Наиболее часто применяемыми в настоящее время пероральными гормональными терапевтическими средствами являются бикалутамид (Casodex) и флутамид (Eulexin, Eulecin, Flutacan, Flutamid). Спектр побочных эффектов бикалутамида и флутамида включает диарею, гипертрофию молочных желез, тошноту, импотенцию, снижение либидо, боль в животе, метеоризм, усталость, астению, остеопороз, потливость, приливы, потерю либидо или эректильной функции, повышение массы тела, гинекомастию и токсическое воздействие на печень и, как результат, снижение качества жизни. Эти побочные эффекты связаны с наибольшей величиной дозы и концентрацией в плазме/ткани и таким образом зависят от высокого содержания активного лекарственного средства в большом круге кровообращения и различных тканях за пределами ткани предстательной железы. И важно то, что ни один из этих побочных эффектов не связан или не опосредован локальным воздействием лекарственного средства на ткань предстательной железы. Таким образом, целесообразно сфокусироваться на новых терапевтических способах лечения, которые нацелены на улучшение профиля локальной концентрации/количества в зависимости от времени и повышение активности противоракового агента в ткани предстательной железы. Подобная концепция действует с тех пор, как были получены сообщения о том, что пероральная терапия флутамидом оказывает воздействие посредством подавления связывания внутрипростатического дигидротестостерона (активного метаболита тестостерона) с внутриклеточным андрогенным рецептором (AR).
Кроме того, было разработано множество других способов лечения заболеваний предстательной железы. Некоторые основаны на внутримышечном или подкожном введении композиций с замедленной доставкой лекарственного средства, содержащих активное вещество (таких как агонисты гонадотропин-рилизинг гормона (GnRH) и антагонисты GnRH). Также были описаны инъекции активных веществ в предстательную железу (например, антибиотиков) и в патологический очаг. Эти способы имеют недостатки в обеспечении как пролонгированного системного воздействия, так и в необходимости повторных инъекций через значительные промежутки времени.
Соответственно, существует потребность в разработке новых способов лечения заболеваний, связанных с предстательной железой, которые приведут к более эффективному лечению и одновременно позволят уменьшить необходимость в хирургическом лечении и лучевой терапии и свести к минимуму побочные эффекты, связанные с применением гормонов. В этих целях авторы данного изобретения разработали способ, который включает локальную инъекцию в пределах пораженной ткани предстательной железы композиции с контролируемым высвобождением одного или более активных веществ.
Подобный сайт-специфичный способ доставки лекарственного средства имеет множество преимуществ по сравнению с методами системного фармакологического лечения млекопитающих при локализованных заболеваниях. Например, частота развития многих серьезных побочных эффектов будет значительно ниже, и лекарственное средство будет доставляться в патологический участок, то есть участок воздействия, с более высокой, менее переменной и более предсказуемой локальной доступностью лекарственного средства и эффектом. Суточная доза, получаемая с композицией с сайт-специфичной доставкой, значительно ниже, чем при системной пероральной терапии. Следовательно, эта сайт-специфичная доставка лекарственного средства приведет к уменьшению дозозависимых побочных эффектов, поскольку системная концентрация активного лекарственного средства(средств) и его активного метаболита(ов) будет ниже, особенно в сравнении с соответствующей пероральной лекарственной терапией. Маловероятно, что активное лекарственное средство в низкой системной концентрации будет каким-либо образом взаимодействовать с другими лекарственными средствами, то есть не предполагается ни взаимодействие между лекарственными средствами, ни любые взаимодействия лекарственного средства и продуктов питания.
Подробное описание изобретения
Способ лечения
Настоящее изобретение относится к способу лечения у субъекта заболеваний, связанных с предстательной железой, где способ включает i) необязательное введение пациенту импульсной/бустерной дозы одного или более активных веществ и ii) локальное введение в предстательную железу фармацевтической композиции с контролируемым высвобождением, включающей одно или более активных веществ в биоразлагаемом керамическом носителе.
Как правило, субъектом, получающим лечение, является млекопитающее, предпочтительно человек. Авторы данного изобретения обнаружили, что подходящим и эффективным способом может быть лечение, включающее начальную импульсную или бустерную дозу одного или более активных веществ с последующим контролируемым высвобождением, обеспечиваемым локально вводимой композицией, включающей одинаковые или различные активные вещества. Бустерная доза обеспечивает должную начальную концентрацию специфического активного вещества в участке воздействия. Метод начального бустерного введения гарантирует, что наименьший необходимый уровень лекарственного средства в предстательной железе достигается немедленно или в течение 3 часов, и что оптимальное стационарное соотношение концентрация-эффект устанавливается сразу или в течение 3 часов (предотвращая недостаточное лекарственное воздействие с начала периода лечения). Бустерная доза также способствует ослаблению возрастания уровня PSA (простат-специфический антиген) в плазме, вызванного местным введением композиции с медленным высвобождением, и она помогает избежать развития толерантности. После бустерного введения вводимая местно композиция с контролируемым высвобождением обеспечивает пролонгированную доставку активн(ых)ого веществ(а) в патологически измененную ткань предстательной железы в пределах интервала местной терапевтической концентрации в ткани предстательной железы для каждого активного вещества. Другими словами, бустерная доза обеспечивает немедленное начало противоракового воздействия, тогда как композиция с контролируемым высвобождением обеспечивает продолжительное воздействие с достаточной местной концентрацией активн(ых)ого веществ(а).
В зависимости от заболевания и состояния субъекта, которому проводится лечение, бустерная доза и композиция с контролируемым высвобождением могут вводиться одновременно, в основном одновременно или последовательно. Как здесь было описано, могут иметь место ситуации, при которых бустерная доза обеспечивается композицией с контролируемым высвобождением. Соответственно, введение i) и ii) могут быть разделены по времени, предпочтительно на менее чем 24 часа.
Несмотря на это, в специфичном аспекте шаг введения бустерной дозы является необязательным и в некоторых случаях может быть исключен в зависимости от заболевания и, например, какого-либо предварительного лечения. Подобная ситуация может встречаться, например, в тех случаях, когда пациент уже получает лечение, так что стационарные концентрации уже достигнуты, и задача состоит в том, чтобы изменить проводимое лечение на местное лечение с контролируемым высвобождением в ткани предстательной железы, как здесь было описано.
Важным признаком настоящего изобретения является введение фармацевтической композиции с контролируемым высвобождением в ткань предстательной железы и характеристики такой композиции. Особенно подходящей композицией является композиция, которую легко вводить в ткань предстательной железы без хирургического вмешательства, например с помощью инъекции или минимально инвазивного хирургического вмешательства, и которая остается в ткани предстательной железы в течение длительного периода времени, высвобождая активное вещество местно в патологически измененную ткань предстательной железы. В этих целях настоящие изобретатели разработали подходящую композицию с контролируемым высвобождением (см. WO 2005/039537). Вкратце, подобная композиция с контролируемым высвобождением основана на биоразлагаемой керамической матрице. Композицию можно вводить в жидкой форме (дисперсии, суспензии или в виде пасты), которая может оставаться жидкой или которая может затвердевать с формированием твердого и биоразлагаемого имплантата in vivo. В альтернативном варианте ее можно вводить в виде предварительно затвердевшего вещества.
Инъецируемая композиция с контролируемым высвобождением разработана для высыхания (затвердевания) в течение интервала времени от 5 до 20 минут, чтобы после этого твердый имплантат был устойчив к движениям окружающей ткани и протеканию через ткань мочи. Процесс затвердевания прежде всего регулируется с помощью количества воды, содержащейся в композиции и в окружающей ткани после введения, а также с помощью времени, необходимого для затвердевания композиции. Реакция происходит с водой (жидкостями), которая является частью процесса затвердевания, как вне, так и внутри организма (in vivo).
Согласно способу изобретения керамический материал может также быть имплантирован в виде твердых, предварительно затвердевших частиц различной формы, например цилиндрической, сферической, палочковидной и т.д., которые достаточно малы, чтобы проходить через канюли, ширококанальные иглы, трубки или катетеры. Можно проникнуть в множество участков предстательной железы и наполнить ее большим количеством частиц композиций с медленным высвобождением. Независимо от того, представлен ли имплантат в виде жидкости, дисперсии или суспензии, или твердой частицы, имплантированная затвердевшая композиция сохраняется в патологически измененной ткани до завершения биологического распада.
Способ по изобретению предназначен для лечения заболеваний, связанных с предстательной железой, включая рак предстательной железы, доброкачественную гиперплазию предстательной железы или острый или хронический простатит. Способ включает введение необязательно бустерной дозы и композиции с контролируемым высвобождением; во всяком случае, последнюю вводят в ткань предстательной железы или в окружающее ее пространство через трансуретральный, трансректальный или чрезпромежностный доступ. Осуществление инъекции композиции с контролируемым высвобождением возможно через клинически применяемые стандартные шприцы, иглы, системы трубок и канюли. Композиция с контролируемым высвобождением может также быть имплантирована в ткань предстательной железы в тех участках предстательной железы, в которых присутствуют раковые клетки или иначе патологически измененная ткань. Это введение можно осуществлять через уретру с помощью обычной цистоскопии или с помощью контроля рукой через прямую кишку при помощи ультразвуковой визуализации; магнитно-резонансной визуализации; рентгенографической трансмиссионной визуализации; визуализации с помощью компьютерной томографии; визуализации на основе изотопов, включая позитронную эмиссионную томографию или гамма-камеру/SPECT; систем позиционирования на основе магнитных или радиоволн и т.д; или через брюшную полость.
Если применяется бустерная доза, ее можно вводить с помощью любого подходящего способа введения, такого как, например, пероральный, трансдермальный, легочный, назальный, сублингвальный, ректальный или любой парентеральный путь введения, или ее можно вводить местно в ткань предстательной железы. Пероральное введение бустерной дозы может осуществляться с уже известными композициями, которые эффективны для специфического лечения. Местное введение бустерной дозы может производиться из композиции с контролируемым высвобождением, имплантированной с помощью способов, подобных тем, что используются для композиции с замедленным высвобождением. Введение бустерной дозы и введение с контролируемым высвобождением могут происходить из одной и той же местно имплантированной композиции. В целом принимается, что имплантаты, содержащие лекарственное вещество или комбинацию нескольких соединений для длительного высвобождения, могут иметь некоторую фракцию дозы, доступную для быстро высвобождаемой части лекарственного вещества или комбинации нескольких соединений на поверхности имплантата. В некоторых случаях такого количества может быть достаточно, чтобы предоставить местную бустерную дозу и, соответственно, в подобных ситуациях нет необходимости в отдельной бустерной дозе. Также возможно создать специальный быстро высвобождаемый наружный слой имплантата, состоящий из лекарственного вещества или комбинации нескольких соединений, с помощью нанесения, например, методом распыления.
Вследствие собственных свойств керамического материала, содержащегося в композиции, композиция является рентгеноконтрастной и доступна для визуализации с помощью стандартных клинических способов рентгеноскопии. Таким образом, расположение композиции с контролируемым высвобождением, основанной на биоразлагаемом керамическом материале, может легко контролироваться во время инъекции и во время периода лечения с помощью, например, ультразвуковой визуализации; магнитно-резонансной визуализации; рентгенографической трансмиссионной визуализации; визуализации с помощью компьютерной томографии; визуализации на основе изотопов, включая позитронную эмиссионную томографию или гамма-камеру/SPECT; систем позиционирования на основе магнитных или радиоволн. Соответственно, можно гарантировать, что композиция с контролируемым высвобождением преимущественно достигает участков патологически измененной ткани, а не здоровых участков ткани предстательной железы. В предпочтительном варианте осуществления способ изобретения включает подобный мониторинг.
Рентгеноконтрастные свойства композиции с контролируемым высвобождением могут также применяться для повышения точности лучевой терапии, таким образом, предоставляя возможность комбинировать адъювантную/неоадъювантную местную гормональную и антигормональную терапию с высокоточной дистанционной лучевой терапией с брахиусилением или без него.
Мониторинг совместно с упомянутыми выше способами может также применяться во время периода лечения. Предпочтительная композиция с контролируемым высвобождением для применения в способе согласно изобретению высвобождает активное вещество прежде всего посредством эрозии и/или диффузии, то есть в таком случае скорость разложения фармацевтической композиции с контролируемым высвобождением является способом in vivo мониторинга скорости высвобождения одного или более активных веществ. Как правило, рекомендуется, чтобы подобный мониторинг, если таковой проводится, осуществлялся с заданными интервалами после инъекции, например приблизительно каждый 1 месяц, приблизительно каждые 2 месяца или приблизительно каждые 3 месяца после первой инъекции в ткань предстательной железы фармацевтической композиции с контролируемым высвобождением.
Как упомянуто выше, фармацевтическая композиция с контролируемым высвобождением является видимой in vivo у субъектов, которые получают лечение, для мониторинга регулировки дозы. Следовательно, доза композиции с контролируемым высвобождением может быть корригирована с помощью дополнительной дозы, а различия между субъектами по разложению лекарственной формы и высвобождению активного вещества можно контролировать и рассчитывать с более высокой точностью, в отличие от стандартизированного протокола. Кроме того, во время лечения размер предстательной железы, а также условия внутри предстательной железы могут изменяться, например, в отношении pH. Подобные изменения могут также обуславливать коррекцию дозы или требуемого высвобождения активного вещества.
В случае, если мониторинг обнаруживает более быстрое разложение, чем ожидалось, или он показывает значительное разложение фармацевтической композиции с контролируемым высвобождением, субъект, получающий лечение, будет обычно нуждаться в дополнительном введении одной или более дополнительных доз одного или более активных веществ. Эта доза может быть в виде импульсной/бустерной дозы активного вещества и/или в виде последующей инъекции в форме фармацевтической композиции с контролируемым высвобождением.
Фармацевтическая композиция с контролируемым высвобождением может быть разработана для высвобождения активного вещества в течение заданного периода времени. Как правило, период высвобождения составляет приблизительно от 1 недели до приблизительно 6 месяцев (такой как, например, приблизительно 1 неделя, приблизительно 2 недели, приблизительно 3 недели, приблизительно 1 месяц, приблизительно 2 месяца, приблизительно 3 месяца и предпочтительно приблизительно 6 месяцев или дольше после инъекции первой введенной фармацевтической композиции с контролируемым высвобождением) и, соответственно, в любом случае может быть необходимо повторять введение композиции с контролируемым высвобождением через регулярные интервалы (то есть если период высвобождения составляет приблизительно 1 месяц, новое введение можно произвести через период от приблизительно 3 недель до приблизительно 1 месяца после первого введения, тогда как, если период высвобождения составляет приблизительно 6 месяцев, новое введение можно производить через период от приблизительно 5 до приблизительно 6 месяцев после первого введения). В некоторых случаях может также оказаться необходимым добавление бустерной дозы, в зависимости от поставленного врачом диагноза и выбранного лечения.
Другой или альтернативный способ мониторинга эффекта лечения состоит в определении PSA (простатспецифический антиген) в плазме (общепринятый биомаркер рака предстательной железы и доброкачественной гиперплазии предстательной железы), то есть в обычной практике в ведении и последующем врачебном наблюдении пациентов с раком предстательной железы применяются сходные диагностические системы. Эффективное местное лечение будет уменьшать уровень PSA плазмы, таким образом уменьшая риск метастазирования в ткани. Воздействие эффективного местного лечения также будет снижать уровни в плазме и/или в тканях любых других биомаркеров заболеваний, связанных с предстательной железой. Соответственно, в одном варианте осуществления изобретения способ дополнительно включает шаг in vivo мониторинга скорости высвобождения одного или более активных веществ с помощью мониторинга уровней одного или более активных веществ в плазме.
В предпочтительном варианте осуществления активное вещество в шаге i) и ii) является 2-гидроксифлутамидом или предоставляет 2-гидроксифлутамид. 2-гидроксифлутамид является активным метаболитом флутамида, то есть введение флутамида может обеспечить эффективную терапевтическую концентрацию 2-гидроксифлутамида, по меньшей мере после перорального, трансдермального, легочного, носового, сублингвального, ректального, подкожного или внутримышечного введения.
В другом частном варианте осуществления активное вещество в шаге i) является флутамидом, а активное вещество во шаге ii) является 2-гидроксифлутамидом. В другом предпочтительном варианте осуществления активное вещество в шаге i) и ii) является бикалутамидом.
Для активных веществ флутамида или 2-гидроксифлутамида бустерная доза для обычного пациента, страдающего раком предстательной железы, в шаге i) находится в диапазоне от приблизительно 100 мг до приблизительно 2000 мг, например предпочтительно от приблизительно 500 мг до приблизительно 1000 мг в сутки для перорального приема, и в диапазоне приблизительно от 1 мг приблизительно до 100 мг, например предпочтительно от приблизительно 5 мг до приблизительно 50 мг в сутки для местного введения в предстательную железу. Фармацевтическая композиция с контролируемым высвобождением в шаге ii) предоставляет количество активного вещества в диапазоне от приблизительно 0,1 мг до приблизительно 100 мг в сутки в течение периода по меньшей мере в 1 месяц, 3 месяцев, 6 месяцев или дольше.
Для активного вещества бикалутамида бустерная доза для обычного пациента, страдающего раком предстательной железы, в шаге i) находится в диапазоне от приблизительно 10 мг до приблизительно 1000 мг, например предпочтительно от приблизительно 25 мг до приблизительно 500 мг в сутки для перорального приема, и в диапазоне от приблизительно 1 мг до приблизительно 50 мг, например предпочтительно от приблизительно 5 мг до приблизительно 50 мг в сутки для местного введения в предстательную железу. С фармацевтической композицией с контролируемым высвобождением в шаге ii) вводится количество активного вещества в диапазоне от приблизительно 0,1 мг до приблизительно 100 мг в сутки в течение периода по меньшей мере в 1 месяц, 3 месяцев, 6 месяцев или дольше.
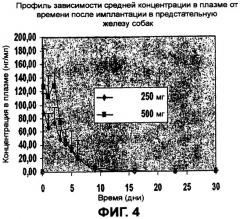
После перорального приема 250 мг флутамида и/или 2-гидроксифлутамида 3 раза в день стационарная концентрация активного метаболита в плазме, сыворотке или крови находится предпочтительно в диапазоне от приблизительно 500 до приблизительно 2000 нг/мл в плазме, сыворотке или крови. В способе по изобретению концентрация 2-гидроксифлутамида или бикалутамида в плазме снижена по меньшей мере до 25%, например по меньшей мере до 10% или по меньшей мере до 5% или менее от значений, достигаемых после перорального приема стандартной композиции флутамида в суточной дозе, которая обеспечивает эквивалентный терапевтический эффект.
При применении бикалутамида с аналогом гонадорелина при паллиативном лечении обычная доза составляет 50 мг ежедневно, тогда как суточная доза 150 мг может применяться в виде монотерапии. Стандартная композиция бикалутамида представлена, например, таким коммерчески доступным таблетированным продуктом, как Casodex® (см., например, Martindale The Complete Drug Reference, 34th Edition, Pharmaceutical Press, 2005). Стандартная композиция флутамида представлена, например, таким коммерчески доступным таблетированным или капсулированным продуктом, как, например, Eulecin®, Flutacan®, Flutamid®, Eulexin® и т.д (см., например, Martindale The Complete Drug Reference, 34th Edition, Pharmaceutical Press, 2005). Суточная доза, обычно применяемая для достижения адекватного терапевтического эффекта, составляет 250 мг 3 раза в день, то есть суммарная суточная доза составляет 750 мг. Эта доза должна быть эффективной для достижения эффективной концентрации активного вещества в патологически измененной ткани предстательной железы.
Задачей способа согласно изобретению, включающего применение флутамида, 2-гидроксифлутамида и/или бикалутамида, является достижение местной концентрации 2-гидроксифлутамида в ткани предстательной железы в диап